2.3.4 氧化还原反应的应用 课件(共31页) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3.4 氧化还原反应的应用 课件(共31页) 2023-2024学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 24.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 00:25:22 | ||
图片预览











文档简介
(共31张PPT)
第4课时 氧化还原反应的应用
第2章 第3节
1.以H2O2为例,学会根据元素化合价预测并设计实验探究物质的氧化性或还原
性(重点)。
2.了解氧化还原反应在物质转化和能量转化中的应用,能从元素价态变化的视
角说明物质的转化路径,学会氯气的实验室制法(难点)。
学习目标
新课导入
相关负责人说,池水变浑变绿是藻类生长造成的。该泳池在一直使用NaClO抑制藻类生长的情况下,这次事件中工作人员又误加入了H2O2消毒剂。
为什么加入H2O2后池水变绿了?
巴西奥运会室外游泳池事件
在研究物质性质中的应用
1.研究物质氧化性或还原性的思路
预测
验证
根据物质所含元素化合价可升高,可能具有还原性
根据物质所含元素化合价可降低,可能具有氧化性
物质具有还原性,可选择具有氧化性的试剂
物质具有氧化性,可选择具有还原性的试剂
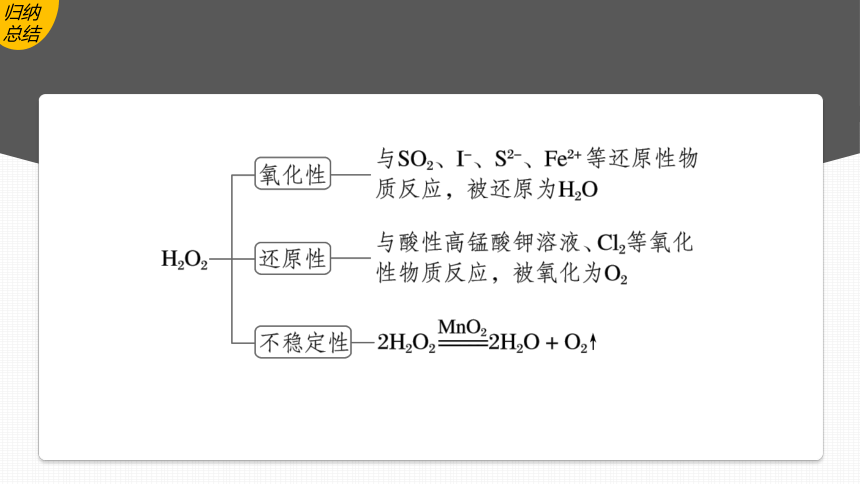
2.以过氧化氢(H2O2)为例探究物质的氧化性或还原性
H2O2
-1
0
-2
还原性
氧化性
如何验证
酸性高锰
酸钾溶液
KI溶液
淀粉溶液
溶液紫色褪去,产生无色无味的气体,该气体能使带火星的木条复燃
溶液变蓝色
?
结论:H2O2表现还原性,被氧化为氧气
结论:H2O2表现氧化性,被还原为H2O
(1)证明过氧化氢具有氧化性或还原性的依据是什么?
思考
提示 证明H2O2具有氧化性的依据是能将具有强还原性的KI氧化为使淀粉溶液变蓝的I2;
证明H2O2具有还原性的依据是能使具有强氧化性的酸性KMnO4溶液紫色褪去。
(2)为什么称H2O2为“绿色氧化剂”?医疗上常用3%的H2O2溶液作为消毒杀菌剂,利用了H2O2的什么性质?
提示 H2O2为“绿色氧化剂”的原因为H2O2的还原产物为H2O,对环境或体系不造成污染;H2O2杀死细菌病毒,利用了H2O2的强氧化性。
3.影响物质氧化性或还原性的因素
(1)物质氧化性或还原性的强弱由物质得失电子的能力决定。
(2)环境条件也会影响物质氧化性或还原性的强弱。如酸性越强,KMnO4的氧化性越强。
应用体验
1.判断正误
(1)预测物质可能有氧化性或还原性,可以根据物质所含元素价态来判断
(2)FeCl2中Fe元素价态为+2价,为中间价态,因此预测Fe2+既有氧化性又有还原性
(3)HBr中Br元素价态为最低价态,因此HBr只能失电子,只有还原性
(4)H2O2中H元素价态为+1价,因此预测H2O2和还原性物质反应时,其还原产物为H2
(5)物质的氧化性或还原性是由其本身性质决定,与溶液酸碱性无关
×
√
×
×
√
应用体验
.
2.针对以下A~D四个涉及H2O2的反应填空。
A.Na2O2+2HCl===H2O2+2NaCl
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2 2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_____(填字母,下同),H2O2仅体现还原性的反应是_____,H2O2既体现氧化性又体现还原性的反应是_____,H2O2既不做氧化剂又不做还原剂的反应是_____。
D
B
C
A
应用体验
.
(2)请用双线桥标出C反应中电子转移的方向和数目:___________________。
反应中氧化剂是_____,被氧化的元素是________。
H2O2
O(或氧)
归纳总结
在物质转化和能量转化中的应用
二
思考:金属在自然界主要以游离态还是化合态形式存在?
Au 单质
Ag 单质
黄铜矿CuFeS2
赤铁矿Fe2O3
铝土矿Al(OH)3
分析如何得到金属单质?
1.利用氧化还原反应实现物质的转化
(1)冶炼金属
①金属冶炼的本质
金属阳离子得电子被还原生成金属单质
Mn++ne-===M
②金属冶炼方法
热还原法:
以C、CO等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质。
Fe2O3+3CO ==== 2Fe + 3CO2
高温
(高炉炼铁)
金属置换法:
以活泼金属为还原剂,将目标金属从其盐溶液中还原出来。
CuSO4+Fe===FeSO4+Cu
②金属冶炼方法
电解法:
热分解法:
利用外加电源提供电子,使金属元素的化合价降低,从而获得金属单质。
2Al2O3 (熔融) ==== 4Al + 3O2 ↑
电解
冰晶石
在加热条件下,物质自身发生氧化还原反应,将金属还原出来。
2HgO ==== 2Hg + O2 ↑
加热
归纳总结
金属的冶炼方法
金属活泼性与冶炼方法的关系如下:
特别提醒 ①冶炼Mg时只能电解熔融MgCl2不能电解MgO,原因是MgO的熔点高,熔化时消耗更多能量,增加生产成本。
②冶炼Al时只能电解熔融Al2O3不能电解熔融AlCl3,原因是AlCl3在熔融态时不导电。
(2)实验室制取氯气
①制备原理
0
+4 -1
+2
化合价升高,氧化反应
化合价降低,还原反应
氧化剂
还原剂
思考1
含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
不能。一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸具有挥发性。
MnO2+ 4HCl(浓) ==== MnCl2 + Cl2 ↑ + 2H2O
②仪器装置
分液漏斗
圆底烧瓶
NaOH溶液
除去Cl2中少量的HCl气体
干燥氯气(或除去Cl2中的水蒸气)
向上排空气法
如何检验收集到的氯气已集满?
a.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸变蓝,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸先变红后褪色,则证明已集满。
实验室用氢氧化钠溶液吸收尾气的原理是什么,氯气表现什么性质?
反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O,氯气既表现氧化性又表现还原性。
(1)为防止Cl2污染,能否用澄清石灰水处理过量的Cl2
思考2
提示 吸收Cl2时不宜用澄清石灰水代替NaOH溶液,因为Ca(OH)2微溶于水,溶解的量少,不能保证Cl2全部被吸收。
(2)在实验室中也可以利用高锰酸钾与浓盐酸在常温下反应制取氯气,请预测反应产物,写出该反应的化学方程式。
提示 16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O。
2.利用氧化还原反应获取能量
煤的燃烧
天然气的燃烧
火力发电厂
燃料电池电车
利用氧化还原反应获取热能
利用氧化还原反应获取电能
利用氧化还原反应获取光能
镁条燃烧
应用体验
1.判断正误
(1)在浓盐酸和二氧化锰制氯气的反应中,HCl只做还原剂
(2)实验室在制取O2和Cl2的反应中,均用到MnO2,两反应中MnO2作用相同
(3)金属冶炼的本质是金属阳离子得电子被氧化的过程
(4)可以通过热还原法用H2还原MgO生成Mg
(5)“湿法炼铜”的本质是铁从铜盐的溶液中置换出铜
(6)燃烧释放能量的过程一定发生了氧化还原反应
×
×
×
√
×
√
应用体验
.
2.实验室可以用高锰酸钾(固体)和浓盐酸直接混合快速制备氯气,已知该反应的化学方程式如下:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请在上述化学方程式中用双线桥标出电子转移的方向和数目。
答案
应用体验
.
(2)可以采用下列______装置来快速制备氯气(填字母)。
BC
(3)该反应中氧化剂是________(填化学式),HCl发生_____(填“氧化”或“还原”)反应。
KMnO4
氧化
(4)若产生标准状况下氯气1.12 L,则消耗HCl的物质的量为_____mol。
0.16
A.还原性 B.氧化性 C.漂白性 D.制备O2
1
2
3
自我测试
√
2.下表中金属在工业上的冶炼方法错误的是
1
2
3
自我测试
Al和Na是活泼的金属,冶炼方法分别是电解熔融的Al2O3和NaCl。
选项 A B C D
金属 Ca、Mg Sn、Pb Al、Na Hg、Ag
冶炼方法 电解法 热还原法 热还原法 热分解法
√
3.(2023·淄博实验中学高一检测)某学习小组用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图,请回答:
1
2
3
自我测试
(1)A中盛放浓盐酸的仪器名称是_________。
(2)A中反应的化学方程式:_______________________________________。
分液漏斗
1
2
3
自我测试
(3)饱和食盐水的作用是_______________。
除去Cl2中的HCl
(4)按照上述装置,D中现象:_____________。
布条颜色变浅
1
2
3
自我测试
(5)指出该套装置存在的两处缺陷:_______________________________、_____________________。
(6)E中反应的离子方程式:__________
____________________。
(7)取少量E中溶液与洁厕灵(主要成分是盐酸)混合产生有毒气体,原因是_____________________________(请用离子方程式表示)。
装置B、C之间没有气体干燥装置
C中的导管“短进长出”
Cl2+2OH-===Cl-+ClO-+H2O
ClO-+Cl-+2H+===H2O+Cl2↑
第4课时 氧化还原反应的应用
第2章 第3节
1.以H2O2为例,学会根据元素化合价预测并设计实验探究物质的氧化性或还原
性(重点)。
2.了解氧化还原反应在物质转化和能量转化中的应用,能从元素价态变化的视
角说明物质的转化路径,学会氯气的实验室制法(难点)。
学习目标
新课导入
相关负责人说,池水变浑变绿是藻类生长造成的。该泳池在一直使用NaClO抑制藻类生长的情况下,这次事件中工作人员又误加入了H2O2消毒剂。
为什么加入H2O2后池水变绿了?
巴西奥运会室外游泳池事件
在研究物质性质中的应用
1.研究物质氧化性或还原性的思路
预测
验证
根据物质所含元素化合价可升高,可能具有还原性
根据物质所含元素化合价可降低,可能具有氧化性
物质具有还原性,可选择具有氧化性的试剂
物质具有氧化性,可选择具有还原性的试剂
2.以过氧化氢(H2O2)为例探究物质的氧化性或还原性
H2O2
-1
0
-2
还原性
氧化性
如何验证
酸性高锰
酸钾溶液
KI溶液
淀粉溶液
溶液紫色褪去,产生无色无味的气体,该气体能使带火星的木条复燃
溶液变蓝色
?
结论:H2O2表现还原性,被氧化为氧气
结论:H2O2表现氧化性,被还原为H2O
(1)证明过氧化氢具有氧化性或还原性的依据是什么?
思考
提示 证明H2O2具有氧化性的依据是能将具有强还原性的KI氧化为使淀粉溶液变蓝的I2;
证明H2O2具有还原性的依据是能使具有强氧化性的酸性KMnO4溶液紫色褪去。
(2)为什么称H2O2为“绿色氧化剂”?医疗上常用3%的H2O2溶液作为消毒杀菌剂,利用了H2O2的什么性质?
提示 H2O2为“绿色氧化剂”的原因为H2O2的还原产物为H2O,对环境或体系不造成污染;H2O2杀死细菌病毒,利用了H2O2的强氧化性。
3.影响物质氧化性或还原性的因素
(1)物质氧化性或还原性的强弱由物质得失电子的能力决定。
(2)环境条件也会影响物质氧化性或还原性的强弱。如酸性越强,KMnO4的氧化性越强。
应用体验
1.判断正误
(1)预测物质可能有氧化性或还原性,可以根据物质所含元素价态来判断
(2)FeCl2中Fe元素价态为+2价,为中间价态,因此预测Fe2+既有氧化性又有还原性
(3)HBr中Br元素价态为最低价态,因此HBr只能失电子,只有还原性
(4)H2O2中H元素价态为+1价,因此预测H2O2和还原性物质反应时,其还原产物为H2
(5)物质的氧化性或还原性是由其本身性质决定,与溶液酸碱性无关
×
√
×
×
√
应用体验
.
2.针对以下A~D四个涉及H2O2的反应填空。
A.Na2O2+2HCl===H2O2+2NaCl
B.Ag2O+H2O2===2Ag+O2↑+H2O
C.2H2O2 2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_____(填字母,下同),H2O2仅体现还原性的反应是_____,H2O2既体现氧化性又体现还原性的反应是_____,H2O2既不做氧化剂又不做还原剂的反应是_____。
D
B
C
A
应用体验
.
(2)请用双线桥标出C反应中电子转移的方向和数目:___________________。
反应中氧化剂是_____,被氧化的元素是________。
H2O2
O(或氧)
归纳总结
在物质转化和能量转化中的应用
二
思考:金属在自然界主要以游离态还是化合态形式存在?
Au 单质
Ag 单质
黄铜矿CuFeS2
赤铁矿Fe2O3
铝土矿Al(OH)3
分析如何得到金属单质?
1.利用氧化还原反应实现物质的转化
(1)冶炼金属
①金属冶炼的本质
金属阳离子得电子被还原生成金属单质
Mn++ne-===M
②金属冶炼方法
热还原法:
以C、CO等物质作为还原剂,在加热条件下将金属氧化物还原为金属单质。
Fe2O3+3CO ==== 2Fe + 3CO2
高温
(高炉炼铁)
金属置换法:
以活泼金属为还原剂,将目标金属从其盐溶液中还原出来。
CuSO4+Fe===FeSO4+Cu
②金属冶炼方法
电解法:
热分解法:
利用外加电源提供电子,使金属元素的化合价降低,从而获得金属单质。
2Al2O3 (熔融) ==== 4Al + 3O2 ↑
电解
冰晶石
在加热条件下,物质自身发生氧化还原反应,将金属还原出来。
2HgO ==== 2Hg + O2 ↑
加热
归纳总结
金属的冶炼方法
金属活泼性与冶炼方法的关系如下:
特别提醒 ①冶炼Mg时只能电解熔融MgCl2不能电解MgO,原因是MgO的熔点高,熔化时消耗更多能量,增加生产成本。
②冶炼Al时只能电解熔融Al2O3不能电解熔融AlCl3,原因是AlCl3在熔融态时不导电。
(2)实验室制取氯气
①制备原理
0
+4 -1
+2
化合价升高,氧化反应
化合价降低,还原反应
氧化剂
还原剂
思考1
含有146 g HCl的浓盐酸与足量的MnO2反应,能生成71 g Cl2吗?
不能。一是随着反应的进行,盐酸浓度变小,Cl-的还原性减弱,MnO2不能再氧化HCl,此反应不再进行;二是浓盐酸具有挥发性。
MnO2+ 4HCl(浓) ==== MnCl2 + Cl2 ↑ + 2H2O
②仪器装置
分液漏斗
圆底烧瓶
NaOH溶液
除去Cl2中少量的HCl气体
干燥氯气(或除去Cl2中的水蒸气)
向上排空气法
如何检验收集到的氯气已集满?
a.将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸变蓝,则证明已集满。
b.将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸先变红后褪色,则证明已集满。
实验室用氢氧化钠溶液吸收尾气的原理是什么,氯气表现什么性质?
反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O,氯气既表现氧化性又表现还原性。
(1)为防止Cl2污染,能否用澄清石灰水处理过量的Cl2
思考2
提示 吸收Cl2时不宜用澄清石灰水代替NaOH溶液,因为Ca(OH)2微溶于水,溶解的量少,不能保证Cl2全部被吸收。
(2)在实验室中也可以利用高锰酸钾与浓盐酸在常温下反应制取氯气,请预测反应产物,写出该反应的化学方程式。
提示 16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O。
2.利用氧化还原反应获取能量
煤的燃烧
天然气的燃烧
火力发电厂
燃料电池电车
利用氧化还原反应获取热能
利用氧化还原反应获取电能
利用氧化还原反应获取光能
镁条燃烧
应用体验
1.判断正误
(1)在浓盐酸和二氧化锰制氯气的反应中,HCl只做还原剂
(2)实验室在制取O2和Cl2的反应中,均用到MnO2,两反应中MnO2作用相同
(3)金属冶炼的本质是金属阳离子得电子被氧化的过程
(4)可以通过热还原法用H2还原MgO生成Mg
(5)“湿法炼铜”的本质是铁从铜盐的溶液中置换出铜
(6)燃烧释放能量的过程一定发生了氧化还原反应
×
×
×
√
×
√
应用体验
.
2.实验室可以用高锰酸钾(固体)和浓盐酸直接混合快速制备氯气,已知该反应的化学方程式如下:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请在上述化学方程式中用双线桥标出电子转移的方向和数目。
答案
应用体验
.
(2)可以采用下列______装置来快速制备氯气(填字母)。
BC
(3)该反应中氧化剂是________(填化学式),HCl发生_____(填“氧化”或“还原”)反应。
KMnO4
氧化
(4)若产生标准状况下氯气1.12 L,则消耗HCl的物质的量为_____mol。
0.16
A.还原性 B.氧化性 C.漂白性 D.制备O2
1
2
3
自我测试
√
2.下表中金属在工业上的冶炼方法错误的是
1
2
3
自我测试
Al和Na是活泼的金属,冶炼方法分别是电解熔融的Al2O3和NaCl。
选项 A B C D
金属 Ca、Mg Sn、Pb Al、Na Hg、Ag
冶炼方法 电解法 热还原法 热还原法 热分解法
√
3.(2023·淄博实验中学高一检测)某学习小组用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图,请回答:
1
2
3
自我测试
(1)A中盛放浓盐酸的仪器名称是_________。
(2)A中反应的化学方程式:_______________________________________。
分液漏斗
1
2
3
自我测试
(3)饱和食盐水的作用是_______________。
除去Cl2中的HCl
(4)按照上述装置,D中现象:_____________。
布条颜色变浅
1
2
3
自我测试
(5)指出该套装置存在的两处缺陷:_______________________________、_____________________。
(6)E中反应的离子方程式:__________
____________________。
(7)取少量E中溶液与洁厕灵(主要成分是盐酸)混合产生有毒气体,原因是_____________________________(请用离子方程式表示)。
装置B、C之间没有气体干燥装置
C中的导管“短进长出”
Cl2+2OH-===Cl-+ClO-+H2O
ClO-+Cl-+2H+===H2O+Cl2↑
