第2章 元素与物质世界章末复习 复习课件(共36页) 2023-2024学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第2章 元素与物质世界章末复习 复习课件(共36页) 2023-2024学年高一化学鲁科版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 00:00:00 | ||
图片预览










文档简介
(共36张PPT)
章末复习
第2章
1.能依据物质类别和不同分类标准列举某类物质的典型代表物。
2.能用离子方程式正确表示典型物质的化学反应(重点)。
3.能从物质类别和元素价态变化的视角说明物质的转化路径。
4.能从化合价变化的角度理解氧化还原反应中氧化剂和还原剂所发生的变化(难点)。
学习目标
元素与物质的分类
一
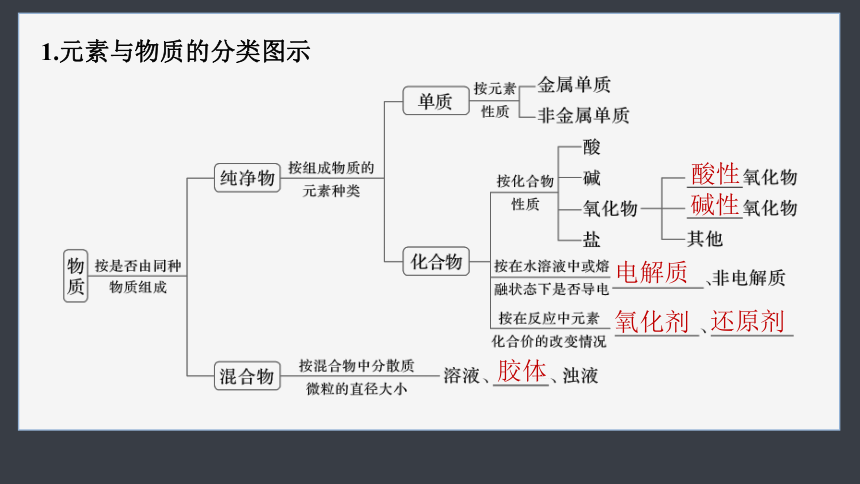
1.元素与物质的分类图示
酸性
碱性
电解质
氧化剂
还原剂
胶体
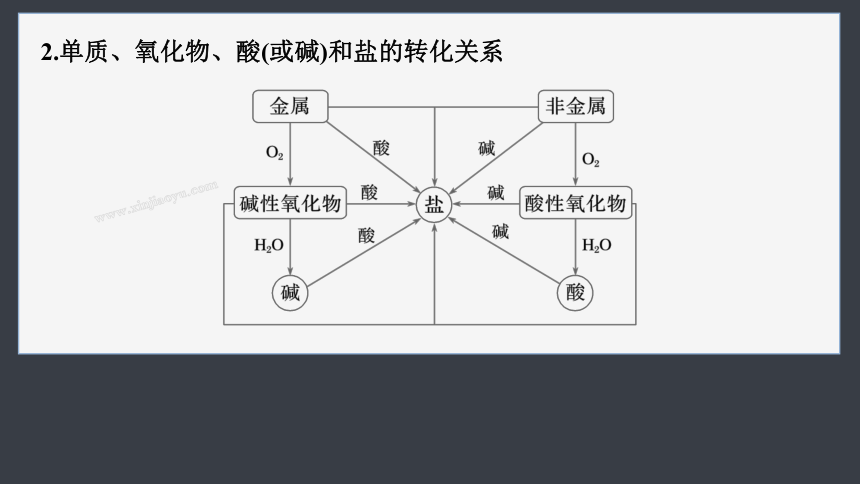
2.单质、氧化物、酸(或碱)和盐的转化关系
3.胶体
(1)胶体是一种分散系,其分散质粒子的直径为1~100 nm。
(2)用丁达尔效应来区分胶体和溶液。
(3)分离提纯胶体常用渗析操作。
(4)制备Fe(OH)3胶体的方法是向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色。
(5)使胶体聚沉的方法是加热、加入电解质溶液或加入带相反电荷胶体粒子的胶体。
应用体验
1.(2022·安徽池州市第一中学高一检测)下列关于物质的分类正确的是
酸 盐 纯净物 电解质
A HClO 小苏打 KAl(SO4)2·12H2O NH4Cl溶液
B CO2 NaHSO4 漂白粉 Mg
C HNO3 烧碱 生铁 熔融的氯化钠
D H2SiO3 纯碱 冰水 AgCl
√
NH4Cl溶液是混合物,既不是电解质也不是非电解质,故A错误;
CO2是酸性氧化物;漂白粉是主要成分为次氯酸钙和氯化钙的混合物;Mg是金属单质,既不是电解质也不是非电解质,故B错误;
烧碱是氢氧化钠,属于碱;生铁是铁碳合金,属于混合物,故C错误;
H2SiO3是弱酸;纯碱是碳酸钠,属于盐;冰水中只含水分子,属于纯净物;AgCl属于强电解质,故D正确。
应用体验
.
2.下列说法正确的是
A.纳米铜颗粒(粒子直径为50~100 nm)是一种胶体
B.向NaOH溶液中滴加饱和FeCl3溶液可制取Fe(OH)3胶体
C.直径在80 nm左右的病毒颗粒是由蛋白质构成的,在空气中不能形成
气溶胶
D.将含0.1 mol FeCl3的饱和溶液逐滴滴入到沸水中充分反应,得到的
Fe(OH)3胶体微粒一定小于0.1 mol
√
胶体是混合物,而纳米铜仅由一种元素组成,属于单质,不是胶体,故A错误;
向NaOH溶液中滴加饱和FeCl3溶液,生成Fe(OH)3沉淀,得不到Fe(OH)3胶体,故B错误;
胶体分散质微粒的直径在1~100 nm之间,病毒蛋白质分子直径为80 nm左右,在空气中能形成气溶胶,故C错误;
一个氢氧化铁胶粒是多个氢氧化铁的聚集体,则得到的Fe(OH)3胶体微粒一定小于0.1 mol,故D正确。
返回
电解质的电离 离子反应
二
1.电解质与离子反应
2.离子方程式的书写和正误判断
(1)书写抓住“两易”,即易溶、易电离的物质(包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、难电离的物质(包括弱酸、弱碱、水等)、难溶物、单质、气体、氧化物等用化学式表示。
(2)正误判断注意“六看”
一看是否符合客观事实;
二看是否符合拆写原则;
三看是否遵守质量守恒定律;
四看是否遵守电荷守恒;
五看是否漏掉离子反应;
六看是否符合阴、阳离子的个数配比。
3.常见离子能否大量共存的判断方法
(1)由于发生复分解反应:有气体、沉淀、弱电解质生成,离子不能大量共存。
(2)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
(3)审题时应注意题中给出的附加条件
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃性气体的溶液等。
②有色离子不能存在于无色溶液中。注意题目要求“能大量共存”还是“不能大量共存”。
应用体验
1.常考易错的8个离子方程式书写再落实
(1)过氧化钠溶于水:
__________________________________。
(2)用NaOH吸收Cl2:
_____________________________。
(3)Ba(OH)2溶液与H2SO4溶液混合:
________________________________________。
(4)用MnO2与浓盐酸共热制Cl2:
________________________________________。
2Na2O2+2H2O===4Na++4OH-+O2↑
Cl2+2OH-===Cl-+ClO-+H2O
应用体验
.
(5)CuSO4溶液与过量Ba(OH)2溶液反应:
____________________________________________。
(6)向NaHCO3溶液中加入过量澄清石灰水:
__________________________________。
(7)小苏打与NaOH溶液混合:
_________________________。
(8)FeSO4溶液中加入用H2SO4酸化的H2O2溶液:
_________________________________。
2Fe2++2H++H2O2===2Fe3++2H2O
应用体验
.
2.(2023·重庆高一检测)粗盐中常含有杂质MgCl2、CaCl2和Na2SO4,为将杂质除尽,设计如下步骤:
√
盐酸和氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,加稀盐酸调节pH,可除去氯化钠溶液中的NaOH、Na2CO3等杂质,故B正确;
加碳酸钠的目的是除去CaCl2和BaCl2,所以试剂①不可能是Na2CO3,故C错误;
应用体验
.
√
返回
氧化还原反应
三
1.认识氧化还原反应
(1)氧化还原反应的特征是元素化合价的升降。
(2)氧化还原反应的本质是电子转移(电子得失或共用电子对的偏移)。
(3)有单质参加的化合反应、有单质生成的分解反应、置换反应是氧化还原反应,复分解反应不是氧化还原反应。
2.氧化还原反应中基本概念之间的关系
3.基本规律
(1)守恒律:得失电子守恒。
(2)强弱律:氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物。
(3)价态律:元素最高价只有氧化性,最低价只有还原性,中间价态既有氧化性又有还原性。
(4)转化律:同种元素不同价态之间只靠近不交叉。
(5)优先律:氧化性强或还原性强的优先发生反应。
4.氧化还原反应的应用
(1)研究物质的性质:如H2O2的氧化性和还原性。
(2)冶炼金属
方法:电解法、热还原法、热分
解法、金属置换法。
(3)制备物质:如实验室制氯气。
(4)获取能量:热量、电能等。
应用体验
1.(2023·南京高一质检)下列表示氧化还原反应中电子转移的方向和数目正确的是
A. B.
C. D.
√
钠和氯气反应生成氯化钠,钠失电子、氯气得电子,电子转移的方向
和数目表示为 ,故A错误;
氧化铜和碳反应生成铜和二氧化碳,氧化铜中铜元素得电子生成铜,
碳失电子生成二氧化碳,电子转移的方向和数目表示为
,故B错误;
氯酸钾加热分解为氯化钾和氧气,氯元素化合价由+5降低为-1、氧元素化合价由-2升高为0,电子转移的方向和数目表示为
,故C错误;
硫化氢和浓硫酸反应生成硫、二氧化硫和水,硫化氢中S元素化合价由-2升高为0、硫酸中S元素化合价由+6降低为+4,电子转移的方向和数目均正确,故D正确。
应用体验
.
2.(2022·吉林松原高一阶段练习)我国神州系列火箭使用的一种燃料是偏二甲肼(C2H8N2),其中N为-2价,反应的化学方程式为C2H8N2+2N2O4===3N2+2X+4H2O,下列有关叙述不正确的是
A.标准状况下,生成X和H2O的体积比为1∶2
B.标准状况下,6 g C2H8N2完全反应产生6.72 L N2
C.X的化学式为CO2
D.N2既是还原产物,又是氧化产物
√
根据原子守恒可知偏二甲肼燃烧的化学方程式为C2H8N2+2N2O4===
3N2+2CO2+4H2O,则X的化学式为CO2,C正确;
6 g C2H8N2的物质的量为0.1 mol,根据化学方程式可知完全反应产生0.3 mol N2,0.3 mol N2在标准状况下的体积为0.3 mol×22.4 L·mol-1=6.72 L,B正确;
在标准状况下,H2O为液态,无法比较CO2和H2O的体积,A错误;
C2H8N2中N元素为-2价,N2O4中N元素为+4价,产物N2中N元素为0价,N元素化合价既降低又升高,因此N2既是还原产物,又是氧化产物,D正确。
应用体验
.
3.氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为____,有较强的_____(填“氧化”或“还原”)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式:______________________________。
+1
氧化
Cl2+2OH-===Cl-+ClO-+H2O
NaClO中Na元素是+1价,O元素是-2价,由正、负化合价的代数和为零可知Cl元素的化合价为+1价;次氯酸钠具有强氧化性,有杀菌消毒的作用;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。
应用体验
.
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_________________________。
应用体验
.
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身被还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_____。
2∶5
ClO2可将废水中的Mn2+转化为MnO2而除去,本身被还原为Cl-,反应中ClO2为氧化剂,Cl元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2∶5。
应用体验
.
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化过程中,化合价保持不变的元素有___________。该图示的总反应的化学方程式为___________________________。
Cu、H、Cl
返回
章末复习
第2章
1.能依据物质类别和不同分类标准列举某类物质的典型代表物。
2.能用离子方程式正确表示典型物质的化学反应(重点)。
3.能从物质类别和元素价态变化的视角说明物质的转化路径。
4.能从化合价变化的角度理解氧化还原反应中氧化剂和还原剂所发生的变化(难点)。
学习目标
元素与物质的分类
一
1.元素与物质的分类图示
酸性
碱性
电解质
氧化剂
还原剂
胶体
2.单质、氧化物、酸(或碱)和盐的转化关系
3.胶体
(1)胶体是一种分散系,其分散质粒子的直径为1~100 nm。
(2)用丁达尔效应来区分胶体和溶液。
(3)分离提纯胶体常用渗析操作。
(4)制备Fe(OH)3胶体的方法是向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色。
(5)使胶体聚沉的方法是加热、加入电解质溶液或加入带相反电荷胶体粒子的胶体。
应用体验
1.(2022·安徽池州市第一中学高一检测)下列关于物质的分类正确的是
酸 盐 纯净物 电解质
A HClO 小苏打 KAl(SO4)2·12H2O NH4Cl溶液
B CO2 NaHSO4 漂白粉 Mg
C HNO3 烧碱 生铁 熔融的氯化钠
D H2SiO3 纯碱 冰水 AgCl
√
NH4Cl溶液是混合物,既不是电解质也不是非电解质,故A错误;
CO2是酸性氧化物;漂白粉是主要成分为次氯酸钙和氯化钙的混合物;Mg是金属单质,既不是电解质也不是非电解质,故B错误;
烧碱是氢氧化钠,属于碱;生铁是铁碳合金,属于混合物,故C错误;
H2SiO3是弱酸;纯碱是碳酸钠,属于盐;冰水中只含水分子,属于纯净物;AgCl属于强电解质,故D正确。
应用体验
.
2.下列说法正确的是
A.纳米铜颗粒(粒子直径为50~100 nm)是一种胶体
B.向NaOH溶液中滴加饱和FeCl3溶液可制取Fe(OH)3胶体
C.直径在80 nm左右的病毒颗粒是由蛋白质构成的,在空气中不能形成
气溶胶
D.将含0.1 mol FeCl3的饱和溶液逐滴滴入到沸水中充分反应,得到的
Fe(OH)3胶体微粒一定小于0.1 mol
√
胶体是混合物,而纳米铜仅由一种元素组成,属于单质,不是胶体,故A错误;
向NaOH溶液中滴加饱和FeCl3溶液,生成Fe(OH)3沉淀,得不到Fe(OH)3胶体,故B错误;
胶体分散质微粒的直径在1~100 nm之间,病毒蛋白质分子直径为80 nm左右,在空气中能形成气溶胶,故C错误;
一个氢氧化铁胶粒是多个氢氧化铁的聚集体,则得到的Fe(OH)3胶体微粒一定小于0.1 mol,故D正确。
返回
电解质的电离 离子反应
二
1.电解质与离子反应
2.离子方程式的书写和正误判断
(1)书写抓住“两易”,即易溶、易电离的物质(包括强酸、强碱、大多数可溶性盐)以实际参加反应的离子符号表示,非电解质、难电离的物质(包括弱酸、弱碱、水等)、难溶物、单质、气体、氧化物等用化学式表示。
(2)正误判断注意“六看”
一看是否符合客观事实;
二看是否符合拆写原则;
三看是否遵守质量守恒定律;
四看是否遵守电荷守恒;
五看是否漏掉离子反应;
六看是否符合阴、阳离子的个数配比。
3.常见离子能否大量共存的判断方法
(1)由于发生复分解反应:有气体、沉淀、弱电解质生成,离子不能大量共存。
(2)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
(3)审题时应注意题中给出的附加条件
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃性气体的溶液等。
②有色离子不能存在于无色溶液中。注意题目要求“能大量共存”还是“不能大量共存”。
应用体验
1.常考易错的8个离子方程式书写再落实
(1)过氧化钠溶于水:
__________________________________。
(2)用NaOH吸收Cl2:
_____________________________。
(3)Ba(OH)2溶液与H2SO4溶液混合:
________________________________________。
(4)用MnO2与浓盐酸共热制Cl2:
________________________________________。
2Na2O2+2H2O===4Na++4OH-+O2↑
Cl2+2OH-===Cl-+ClO-+H2O
应用体验
.
(5)CuSO4溶液与过量Ba(OH)2溶液反应:
____________________________________________。
(6)向NaHCO3溶液中加入过量澄清石灰水:
__________________________________。
(7)小苏打与NaOH溶液混合:
_________________________。
(8)FeSO4溶液中加入用H2SO4酸化的H2O2溶液:
_________________________________。
2Fe2++2H++H2O2===2Fe3++2H2O
应用体验
.
2.(2023·重庆高一检测)粗盐中常含有杂质MgCl2、CaCl2和Na2SO4,为将杂质除尽,设计如下步骤:
√
盐酸和氢氧化钠反应生成氯化钠和水,盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,加稀盐酸调节pH,可除去氯化钠溶液中的NaOH、Na2CO3等杂质,故B正确;
加碳酸钠的目的是除去CaCl2和BaCl2,所以试剂①不可能是Na2CO3,故C错误;
应用体验
.
√
返回
氧化还原反应
三
1.认识氧化还原反应
(1)氧化还原反应的特征是元素化合价的升降。
(2)氧化还原反应的本质是电子转移(电子得失或共用电子对的偏移)。
(3)有单质参加的化合反应、有单质生成的分解反应、置换反应是氧化还原反应,复分解反应不是氧化还原反应。
2.氧化还原反应中基本概念之间的关系
3.基本规律
(1)守恒律:得失电子守恒。
(2)强弱律:氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物。
(3)价态律:元素最高价只有氧化性,最低价只有还原性,中间价态既有氧化性又有还原性。
(4)转化律:同种元素不同价态之间只靠近不交叉。
(5)优先律:氧化性强或还原性强的优先发生反应。
4.氧化还原反应的应用
(1)研究物质的性质:如H2O2的氧化性和还原性。
(2)冶炼金属
方法:电解法、热还原法、热分
解法、金属置换法。
(3)制备物质:如实验室制氯气。
(4)获取能量:热量、电能等。
应用体验
1.(2023·南京高一质检)下列表示氧化还原反应中电子转移的方向和数目正确的是
A. B.
C. D.
√
钠和氯气反应生成氯化钠,钠失电子、氯气得电子,电子转移的方向
和数目表示为 ,故A错误;
氧化铜和碳反应生成铜和二氧化碳,氧化铜中铜元素得电子生成铜,
碳失电子生成二氧化碳,电子转移的方向和数目表示为
,故B错误;
氯酸钾加热分解为氯化钾和氧气,氯元素化合价由+5降低为-1、氧元素化合价由-2升高为0,电子转移的方向和数目表示为
,故C错误;
硫化氢和浓硫酸反应生成硫、二氧化硫和水,硫化氢中S元素化合价由-2升高为0、硫酸中S元素化合价由+6降低为+4,电子转移的方向和数目均正确,故D正确。
应用体验
.
2.(2022·吉林松原高一阶段练习)我国神州系列火箭使用的一种燃料是偏二甲肼(C2H8N2),其中N为-2价,反应的化学方程式为C2H8N2+2N2O4===3N2+2X+4H2O,下列有关叙述不正确的是
A.标准状况下,生成X和H2O的体积比为1∶2
B.标准状况下,6 g C2H8N2完全反应产生6.72 L N2
C.X的化学式为CO2
D.N2既是还原产物,又是氧化产物
√
根据原子守恒可知偏二甲肼燃烧的化学方程式为C2H8N2+2N2O4===
3N2+2CO2+4H2O,则X的化学式为CO2,C正确;
6 g C2H8N2的物质的量为0.1 mol,根据化学方程式可知完全反应产生0.3 mol N2,0.3 mol N2在标准状况下的体积为0.3 mol×22.4 L·mol-1=6.72 L,B正确;
在标准状况下,H2O为液态,无法比较CO2和H2O的体积,A错误;
C2H8N2中N元素为-2价,N2O4中N元素为+4价,产物N2中N元素为0价,N元素化合价既降低又升高,因此N2既是还原产物,又是氧化产物,D正确。
应用体验
.
3.氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)NaClO中Cl的化合价为____,有较强的_____(填“氧化”或“还原”)性,所以是常用的消毒剂和漂白剂,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式:______________________________。
+1
氧化
Cl2+2OH-===Cl-+ClO-+H2O
NaClO中Na元素是+1价,O元素是-2价,由正、负化合价的代数和为零可知Cl元素的化合价为+1价;次氯酸钠具有强氧化性,有杀菌消毒的作用;氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O。
应用体验
.
(2)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为_________________________。
应用体验
.
②ClO2可将废水中的Mn2+转化为MnO2而除去,本身被还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为_____。
2∶5
ClO2可将废水中的Mn2+转化为MnO2而除去,本身被还原为Cl-,反应中ClO2为氧化剂,Cl元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2∶5。
应用体验
.
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应可以回收S,其物质转化如图所示。在图示的转化过程中,化合价保持不变的元素有___________。该图示的总反应的化学方程式为___________________________。
Cu、H、Cl
返回
