2.3 化学反应的速率 同步测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.3 化学反应的速率 同步测试题(含解析) 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 542.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 12:16:41 | ||
图片预览




文档简介
2.3 化学反应的速率 同步测试题
一、单选题
1.已知反应2A(g) 2B(g)+C(g)△H<0,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为( )
A.减小容器容积 B.增大容器容积
C.减小B的浓度 D.降温
2.一定量盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②KNO3溶液 ③水 ④CH3COONa固体
A.①③ B.②④ C.②③ D.③④
3.在通过实验测量化学反应速率时,不可以利用的相关性质为( )
A.气体的体积和体系的压强 B.颜色的深浅
C.物质的浓度(或质量) D.元素的化合价
4.为探究铁与稀硫酸的反应速率(以表示)向反应混合液中加入某些物质,下列判断正确的是( )
A.加入铁固体,加快
B.在常温下将题中稀硫酸改为浓硫酸,加快
C.加入溶液,减小
D.加入溶液,不变
5.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A. B.
C. D.
6.O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
T℃ t/min pH 3.0 4.0 5.0 6.0
20 301 231 169 58
30 158 108 48 15
50 31 26 15 7
据表中的递变规律,推测O3分别在条件①40℃、pH=3.0,②10℃、pH=5.0,③30℃、pH=7.0下,分解速率依次增大的顺序为( )
A.①②③ B.③②① C.②①③ D.③①②
7.下列有关化学反应速率的说法正确的是( )
A.4 mol L 1 s 1的反应速率一定比1 mol L 1 s 1的反应速率大
B.对于任何化学反应来说,反应速率越快,反应现象就越明显
C.100mL 0.5 mol L 1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
D.升温能使反应物活化分子百分数增大,从而加快化学反应速率
8.某温度时,在容器中发生两种物质之间的转化反应,物质的量随时间变化曲线如图所示,判断下列说法正确的是( )
A.时反应达到平衡
B.时逆反应速率大于正反应速率
C.该反应的化学方程式为
D.反应开始至时A的平均反应速率为
9.已知某反应的各物质浓度数据如下:
aA(g)+ bB(g) 2C(g)
起始(mol/L) 3.0 1.0 0
2 s末浓度(mol/L) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
10.合成气转变为甲醇的反应为:CO(g)+2H2(g) CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
A.其他条件不变,增大CO浓度可以增加体系中活化分子百分数
B.0~5min,反应放出的热量为27.24kJ
C.反应到5min时,生成0.6molCH3OH
D.第5min时,H2的反应速率为0.06mol·L-1min-1
11.反应2SO2+O2 2SO3,经过一段时间后,O2的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4mol/(L s),则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
12.某有机物M是一种环境污染物,我国学者研究出的一种高效处理M的原理示意图如图所示。下列说法错误的是( )
A.上述处理过程中没有涉及能量转化
B.催化剂能加快处理过程中的反应速率
C.适当增加 用量有利于使M处理得更充分
D.催化剂表面存在化学键的断裂和形成过程
13.向体积均为1L的两恒容密闭容器中分别充入2molX和1molY发生反应:2X(g)+Y(g)Z(g) △H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A.△H>0 B.气体的总物质的量:na<nc
C.平衡时容器的压强:p甲<p乙 D.反应速率:va正<vb逆
14.工业制备硫酸过程中存在如下反应:2SO2+O2 2SO3,下列关于该反应的说法正确的是( )
A.增大O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.一定条件下SO2能100%转化为SO3
15.对于反应 ,下列说法正确的是
A.上述反应
B.及时液化分离出氨气,正反应速率增大
C.增大压强,活化分子百分数增多,反应速率加快
D.若反应放出92.4 kJ热量,则过程中有被氧化
16.已知反应C+CO2 2CO的正反应为吸收热量。当温度升高时,其正反应、逆反应的速率变化情况为( )
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
二、综合题
17.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L min).求:
(1)此时A的浓度c(A)= mol/L,反应开始前容器中的A,B的物质的量:n(A)=n(B)= mol;
(2)B的平均反应速率v(B)= mol/(L min);
(3)x的值为 .
18.氮的氧化物在生产、生活中有广泛应用。
(1)Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
(常温下平衡常数为K1)
(常温下平衡常数为K2)
则 ;常温下平衡常数K= (用K1、K2来表示)
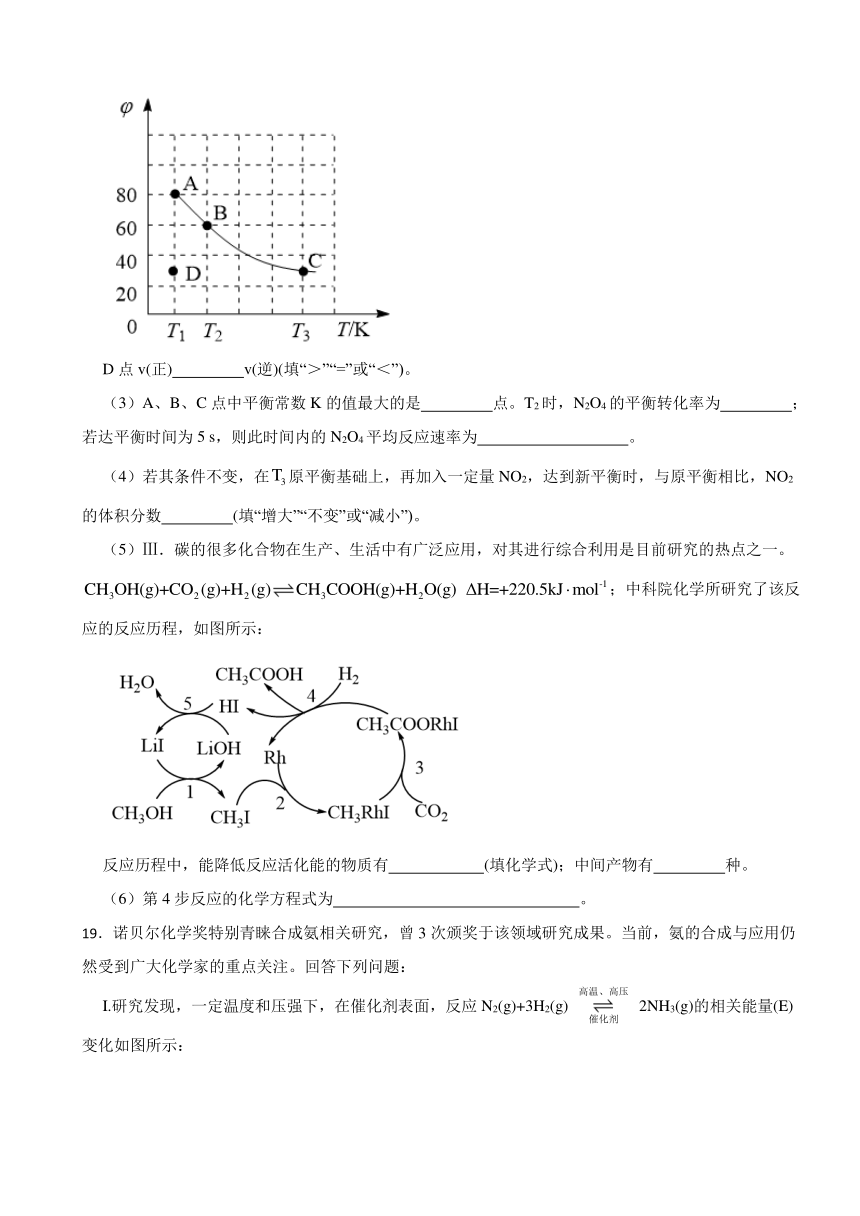
(2)Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应,平衡体系中N2O4的体积分数()随温度的变化如图所示:
D点v(正) v(逆)(填“>”“=”或“<”)。
(3)A、B、C点中平衡常数K的值最大的是 点。T2时,N2O4的平衡转化率为 ;若达平衡时间为5 s,则此时间内的N2O4平均反应速率为 。
(4)若其条件不变,在原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数 (填“增大”“不变”或“减小”)。
(5)Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。;中科院化学所研究了该反应的反应历程,如图所示:
反应历程中,能降低反应活化能的物质有 (填化学式);中间产物有 种。
(6)第4步反应的化学方程式为 。
19.诺贝尔化学奖特别青睐合成氨相关研究,曾3次颁奖于该领域研究成果。当前,氨的合成与应用仍然受到广大化学家的重点关注。回答下列问题:
I.研究发现,一定温度和压强下,在催化剂表面,反应N2(g)+3H2(g) 2NH3(g)的相关能量(E)变化如图所示:
(1)每生成2molNH3时 (填放出”或“吸收”) kJ的能量。
(2)在恒容密闭容器中发生上述反应,能说明该反应达到平衡状态的是 。
a.容器内混合气体的质量不再变化
b.c(N2):c(H2):c(NH3)=1:3:2
c.容器内NH3的浓度不再变化
d.容器内混合气体的物质的量不再变化
(3)一定温度下,在体积为2L的密团容器中,充入1molN2和3molH2模拟工业合成氨的反应。10min时,测得容器中气体的总物质的量是起始时的0.8倍,用NH3的浓度变化表示的化学反应速率为 。
(4)II.某氨-空气燃料电池的工作原理是氨气与氧生成一种常见的无毒气体和水,其装置如图所示:
溶液c最好选择 (填“酸性”、“碱性”或“中性”)溶液。
(5)正极的电极反应式为 。
20.在容积为2.0 L的恒容密闭容器中,通入一定量的N2O4,发生反应:N2O4 (g)2NO2(g)△H>0。100℃时,各物质的物质的量浓度随时间变化如下图所示。
(1)60s内,v(NO2)= 。
(2)a点时,v正 v逆(填“>”、“<”或“=”),此时容器内压强与起始时压强之比为 。
(3)下列叙述中,能说明该反应达到化学平衡状态的是____(填字母序号)。
A.2v(N2O4)=v(NO2)
B.单位时间内消耗a mol N2O4,同时生成2a mol NO2
C.容器内的压强不再变化
D.容器内气体平均摩尔质量不再变化
E.容器内混合气体的密度不再变化
(4)欲提高N2O4的平衡转化率,理论上可以采取的措施为____。
A.减小压强 B.加入催化剂
C.降低温度 D.再充入一定量的N2O4
(5)100℃时,该反应的化学平衡常数数值为 。该温度下,在容器中按初始浓度c(N2O4)=0.10mol/L、c(NO2)=0.20mol/L投料,反应向 方向进行(填“正反应”或“逆反应”)。
21.汽车尾气中CO、NO2在定条件下可发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g)。一定温度下,向2 L恒容密闭容器中充入一定量的CO和NO2,反应经10 min达到平衡状态。CO的物质的量随时间的变化曲线如图1所示:
(1)0 ~ 10 min内,用CO的浓度变化表示的平均反应速率为 mol/(L·min)。
(2)A点时v正( NO2) (填“>”、“<”或“=”)v逆(NO2)。
(3)下列不能说明该反应一定达到化学平衡状态的是____(填字母)。
A.单位时间内,每消耗4molCO2的同时生成1molN2
B.容器内混合气体的平均相对分子质量不再变化
C.容器内混合气体的密度保持不变
D.c(CO) :c(NO2) :c( CO2):c(N2)=4:2:4:1
(4)在图2中画出0~ 15 min内,CO2的物质的量浓度随时间变化的曲线图。
(5)下列设备工作时,将化学能主要转化为热能的是____(填字母)。
A.燃气灶 B.锌锰电池
C.风力发电 D.太阳能热水器
答案解析部分
1.【答案】A
【解析】【解答】解:A、减小容器体积,可以增大化学反应速率,且平衡左移,故符合题意,故A正确;
B、增大容器容积,减小化学反应速率,故不符合题意,故B错误;
C、减小B的浓度,平衡右移,A的浓度减小,不符合题意,故C错误;
D、降温化学反应速率减低,故D错误,
故选A.
【分析】对于反应2A(g) 2B(g)+C(g),△H<0来说,增大正反应速率,可增大A的浓度、升高温度或加入催化剂或加压,要使c(A)增大,可以让反应向你反应进行,以此解答.
2.【答案】D
【解析】【解答】①加入NaOH固体,与盐酸反应,酸减少生成氢气减少,故不符合;
②加KNO3溶液,铁与H+、NO3-反应不生成氢气,则生成氢气的总量减少,故不符合;
③加水,氢离子浓度减小,所以与铁反应的速率减慢,同时氢离子的物质的量不变,则不影响生成氢气的总量,故符合;
④加入CH3COONa固体,与盐酸反应生成醋酸,溶液中已电离出的氢离子浓度减小,但物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故符合;
综上③④,符合题意;
故答案为:D。
【分析】减小反应物的浓度可以减慢反应的速率,并且不会改变反应物的物质的量,所以不会改变氢气的量;
加入醋酸钠,会结合盐酸生成醋酸,使得氢离子的浓度减小,所以反应的速率会减慢,但是氢离子的物质的量不变,所以生产的氢气总量不变。
3.【答案】D
【解析】【解答】化学反应速率的快慢,可以用单位时间内物质的浓度变化来表示,颜色变化也可以衡量有色物质消耗或生成的快慢,化合价与反应速率无关。
故答案为:D
【分析】反应速率,可用一段时间内气体体系的压强、颜色的深浅、量的变化进行表示;元素的化合价是由于电子的得失或偏移造成的,不用于表示反应速率。
4.【答案】C
【解析】【解答】A.铁是固体,改变固体的量不会改变反应速率,因此加入铁固体,不变,A不符合题意;
B.在常温下将题中稀硫酸改为浓硫酸,常温下铁在浓硫酸中钝化,不能产生氢气,B不符合题意;
C.加入溶液,相当于稀释,反应物浓度减小,减小,C符合题意;
D.加入溶液,铁置换出铜,构成原电池,加快,D不符合题意;
故答案为:C。
【分析】A、改变固体的量不会改变反应速率;
B、常温下铁在浓硫酸中钝化,阻止铁与硫酸反应;
D、加入溶液,铁置换出铜,构成原电池,加快反应速率。
5.【答案】B
【解析】【解答】在相同的条件下,同一个化学反应中,用不同的物质表示数值不同。要比较反应速率,转化为同一种物质表示。用不同的物质表示的化学反应速率其数值之比等于化学计量数之比;有 。所有用其他物质表示的反应速率转化为用B表示;
A. ,有 ,用B表示的速率 ;
B. ;
C. ,有 ,用B表示的速率 ;
D.,单位为mol·L-1·min-1,与其他选项的单位不同,需要转化单位,将D表示的速率转化为用单位mol·L-1·s-1表示的速率, ,再转化为用B表示, ,有 用B表示的速率 ;
综上反应速率最快的为B项;
本题
故答案为:B。
【分析】此题中除了要转化为用相同的物质表示化学反应速率,还要注意单位。
6.【答案】C
【解析】【解答】由表格数据可知,相同温度下,pH越大,反应所需时间越短,说明pH越大,反应速率越大;在pH相同时,温度越高,反应时间越短,说明温度越高,反应速率越快。结合变化的趋势可知,温度对反应速率的影响大于pH对反应速率的影响。
③中温度高,pH大,因此反应速率最大;①中温度高于②,因此①的反应速率大于②,因此反应速率大小关系为③>①>②,C符合题意;
故答案为:C
【分析】此题是对反应速率影响因素的考查,结合表格数据分析不同条件下反应速率的大小。
7.【答案】D
【解析】【解答】A.4 mol L 1 s 1的反应速率不一定比1 mol L 1 s 1的反应速率大,如果是同种物质则前者大于后者,如果是不同物质,有可能后者的速率大于后者,故A不符合题意;
B.对于任何化学反应来说,反应速率越快,反应现象不一定越明显,比如酸碱中和反应,故B不符合题意;
C.100mL 0.5 mol L 1的盐酸跟锌片反应,加入适量的氯化钠溶液,由于溶液中含有水,因此氢离子浓度降低,反应速率减慢,故C不符合题意;
D.升温,原来不是活化分子吸收能量变成了活化分子,分子总数不变,因此活化分子百分数增大,碰撞几率增大,因此加快化学反应速率,故D符合题意。
故答案为:D。
【分析】A.化学反应速率比较应该指明同一种物质;
B.反应速率越快,反应现象不一定就越明显;
C.加入适量的氯化钠溶液,氢离子浓度减小。
8.【答案】C
【解析】【解答】A.4min时A、B物质的量相等,后来还在改变,反应未达到平衡,故A不符合题意;
B.8min时反应达到平衡,逆反应速率等于正反应速率,故B不符合题意;
C.根据分析可知该反应的化学方程式为,故C符合题意;
D.反应开始至4min时,A物质的量变化=0.8mol-0.4mol=0.4mol,A的平均反应速率为,故D不符合题意;
故答案为C。
【分析】A.依据变者不变即平衡分析;
B.平衡时逆反应速率等于正反应速率;
C.依据化学计量系数之比等于物质的变化量之比,可逆反应进行不到底分析;
D.依据计算。
9.【答案】B
【解析】【解答】
aA(g)+ bB(g) 2C(g)
起始(mol/L) 3.0 1.0 0
反应(mol/L) 1.8 06 0.8
平衡(mol/L) 1.2 0.4 0.8
浓度变化量之比等于化学计量数之比,所以a:b:c=1.2:0.4:0.8=3:1:2,
故答案为:B。
【分析】根据浓度变化量之比等于化学计量数之比计算解答。
10.【答案】B
【解析】【解答】A.其他条件不变,增大CO浓度,增大单位体积内活化分子的数目,但分子总数也增大,故体系中活化分子百分数未改变,A说法不符合题意;
B.0~5min,反应放出的热量= ×90.8kJ·mol-1=27.24kJ,B说法符合题意;
C.反应到5min时,反应0.6mol氢气,生成0.3molCH3OH,C说法不符合题意;
D.只能计算一段时间内的平均速率,不能计算瞬时速率,第5min时,H2的反应速率不能确定,D说法不符合题意;
故答案为:B。
【分析】A.增大浓度可以增大单位体积内的活化分子数;
B.根据物质的量与焓变计算;
C.根据方程式的系数计算;
D.瞬时速率无法计算。
11.【答案】D
【解析】【解答】解:△t= = =10s,
故选D.
【分析】根据v= ,化学反应速率之比等化学计量数之比进行计算.
12.【答案】A
【解析】【解答】A.上述处理过程涉及化学能转化为热能,选项A符合题意;
B.催化剂能加快反应速率,选项B不符合题意;
C. 用量增大,有利于M的转化,选项C不符合题意;
D.催化剂表面发生反应,存在化学键的断裂和形成过程,选项D不符合题意。
故答案为:A。
【分析】根据图示可以知道M和氧气在催化剂的表面发生了反应,生成了水和二氧化碳,其中涉及到键的断裂和键的生成,因此有能量的变化,催化剂可以加快反应速率降低反应所需要的的活化能,增加氧气的含量可以使M充分的反应。
13.【答案】B
【解析】【解答】A.随反应进行,气体物质的量减少,开始反应时,甲容器内压强增大,可知温度升高,所以△H<0,故A不符合题意;
B.a、c两点压强相等,a点温度大于c,可知气体的总物质的量:na<nc,故B符合题意;
C.由图像可知,a、b为平衡点,平衡时容器的压强:p甲>p乙,故C不符合题意;
D.a、b点达到平衡,a点温度较高、压强较大,所以va正>vb逆,故D不符合题意;
故答案为:B。
【分析】A.该反应前后气体分子数减小,恒容条件下,结合PV=nRT进行分析。
B.a、c两点压强相等,a点温度大于c,结合PV=nRT进行分析。
C.a、b为平衡点,据此分析。
D.a、b点达到平衡,结合反应速率的影响因素进行分析。
14.【答案】A
【解析】【解答】解;A.增加O2的浓度,单位体积活化分子数目增多,则反应速率增大,故A正确;
B.降低温度,活化分子百分数减小,反应速率减小,故B错误;
C.使用催化剂,反应速率增大,故C错误;
D.可逆反应反应物不可能完全转化,故D错误.
故选A.
【分析】该反应为可逆反应,反应物不可能完全转化,一般来说,增大浓度、升高温度或加入催化剂,可增大反应速率,以此解答该题.
15.【答案】D
【解析】【解答】A.上述反应中4摩尔气体生成2摩尔气体,所以是,A不符合题意;
B.及时液化分离出氨气,正反应速率不变,逆反应速率减小,B不符合题意;
C.增大压强,单位体积内活化分子数增多,反应速率加快,C不符合题意;
D.若反应放出92.4 kJ热量,则过程中有被氧化,D符合题意;
故答案为:D。
【分析】A.该反应是气体体积减小的反应,ΔS<0;
B.分离出液氨,正反应速率不变,逆反应速率减小;
C.增大压强,单位体积内活化分子数增多。
16.【答案】A
【解析】【解答】化学反应无论是吸热反应还是放热反应,温度升高,活化分子的百分含量增大,有效碰撞的次数增大,化学反应速率都增大。
故答案为:A。
【分析】温度升高,化学反应的速率就会升高,无论该反应是吸热反应还是放热反应。
17.【答案】(1)0.75;3
(2)0.05
(3)2
【解析】【解答】解:(1)5min后,n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g) xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
设初始时A、B的物质的量均为n,则(n﹣1.5):(n﹣0.5)═3:5,即n=3.
c(A)═ ═0.75mol/L.故答案为:0.75;3; (2)v(B)═ ═0.05mol/(L min),故答案为:0.05;(3)n(C)═0.1mol/(L min)×5min×2L═1mol,
n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g) xC(g)+2D(g),n(C):n(D)═1:1,
因为生成C和D的物质的量之比等化学计量数之比,所以n═2,故答案为:2.
【分析】(1)根据化学方程和物质的量浓度的计算式思考;(2)根据评价反应速率公式计算;(3)根据化学方程式计算.
18.【答案】(1)-112;
(2)<
(3)C;0.25;0.1 mol/(L·s)
(4)减小
(5)LiI和Rh;5
(6)CH3COORhI+H2=Rh+HI+CH3COOH
【解析】【解答】(1)①
②,
根据盖斯定律②-①×2,整理可得△H=-112 kJ/mol;的化学平衡常数K1=;反应的化学平衡常数K2= ,则在常温下该反应的化学平衡常数K=;
(2)根据图示可知D点N2O4的含量低于该温度下化学平衡状态时的N2O4的含量,则化学反应向生成N2O4的逆反应方向进行,因此反应速率:v(正)<v(逆);
(3)根据图像可知:升高温度,N2O4的平衡含量降低,说明升高温度,化学平衡正向移动,根据平衡移动原理:升高温度化学平衡向吸热反应方向移动,因此该反应的正反应为吸热反应,所以A、B、C点中平衡常数K的值最大的是C点;
在T2时,假设反应的N2O4的物质的量为x ,反应产生的NO2的物质的量为2x,平衡时N2O4的物质的量为(4-x) mol,N2O4平衡含量是60%,则,解得x=1 mol,所以N2O4的平衡转化率为;
若达平衡时间为5 s,则此时间内的N2O4平均反应速率v(N2O4)=;
(4)若其条件不变,在T3原平衡基础上,再加入一定量NO2,必然会导致反应体系的压强增大,增大压强,化学平衡向气体体积减小的逆反应方向移动,因此达到新平衡时,与原平衡相比,NO2的体积分数减小;
(5)在反应历程中,能降低反应活化能的物质是反应的催化剂,催化剂参加化学反应,改变了化学反应途径,只是在前边的化学反应中是反应物,在后边的反应中又是生成的物质。对反应图示进行分析发现:能降低反应活化能的物质有LiI和Rh;
根据图示可知反应过程的中间产物有CH3I、LiOH、CH3RhI、CH3COORhI、HI,共5种物质;
(6)根据图示可知:第4步反应的反应物是CH3COORhI、H2,生成物是Rh、HI\CH3COOH,故该步反应的化学方程式为:CH3COORhI+H2=Rh+HI+CH3COOH。
【分析】(1)根据盖斯定律和化学平衡常数的关系;
(2)根据物质含量低于该温度下化学平衡状态时的含量分析;
(3)根据图像,利用平衡移动原理判断;利用“三段式”法计算;
(4)依据化学平衡移动原理分析;
(5)催化剂参加化学反应,改变了化学反应途径,只是在前边的化学反应中是反应物,在后边的反应中又是生成的物质;根据中间体反应前和反应后均没有,只在过程中出现;
(6)根据图示反应物和生成物书写。
19.【答案】(1)放出;92
(2)cd
(3)
(4)碱性
(5)
【解析】【解答】I.(1)由图知,破坏1molN2(g)和3molH2(g)的化学键时共需吸收能量2254kJ ,形成2molNH3(g)的化学键时放出2346kJ的能量,则 Q =2346-2254=92,反应每生成2molNH3时放出92kJ的能量;(2)在恒容密闭容器中发生 反应:a.容器内混合气体的质量始终不变,故气体总质量不再变化,不能说明该反应达到平衡状态,a不正确; b.各成分的平衡浓度与起始浓度有关,c(N2):c(H2):c(NH3)=1:3:2不一定显示平衡状态,b不正确;c.容器内NH3的浓度不再变化,符合平衡特征,能说明该反应达到平衡状态,c正确;d.反应过程中混合气体的物质的量会随着反应而变,故其不再改变的时候,说明已达到化学平衡状态,d正确;故答案为cd;(3)已知,一定温度下,在体积为2L的密团容器中,充入1molN2和3molH2模拟工业合成氨的反应。10min时,测得容器中气体的总物质的量是起始时的0.8倍,则
, ,解得x=0.4 , ;II. (4)溶液c最好选择碱性溶液,由题意知,氨气燃料电池负极是氨气,正极是氧气,用惰性电极,选用碱性电解质溶液的原因是,氨气极易溶于水,溶液呈碱性,氨气不会和电解质发生反应,且导电能力强;(5)正极是氧气得电子被还原的反应,故电极反应式为 。
【分析】I.(1)破坏反应物化学键时吸收能量,形成生成物的化学键时放出能量,则 放出的能量大于吸收的能量时,为放热反应;(2)按平衡状态的特征判断正误:①对同一个物质而言正反应速率和逆反应速率相等,如υ正= υ逆,②各成分的含量、也可以是物质的量或浓度保持定值,不再改变,③选定的某个物理量,一开始会随着反应的发生而变化,而当这个量不再改变的时候,就达到化学平衡状态;(3)用三段式结合已知条件计算;II. 燃料电池中,通入燃料的一极为负极,还原剂失去电子发生氧化反应,电子沿着导线流向正极,通入助燃物的一极为正极,正极上发生还原反应,内电路中阴离子移向负极、阳离子移向正极,据此分析;
20.【答案】(1)0.002mol/(L·s)
(2)>;4:3
(3)C;D
(4)A
(5)0.36;逆反应
【解析】【解答】(1)根据图示可知:在60 s内,NO2的浓度升高0.12 mol/L,则v(NO2)=。
(2)反应从正向建立平衡,到a点时,反应尚未到达平衡状态,所以v正>v逆;
根据图像,设达到a点时两物质的浓度均为x mol/L,列出三段式:
2(0.10-x)=x,解得x=1/15。在容积为2.0 L的恒容密闭容器中,压强比等于浓度之比,所以容器内压强:起始时压强=。
(3)A.速率并未说明是正反应速率等于逆反应速率,故A不正确;
B.单位时间内消耗,同时生成,都是正反应速率,不能说明该反应达到化学平衡状态,故B不正确;
C.该反应是气体体积增大的反应,压强增大,当压强不变了说明该反应达到化学平衡状态,故C正确;
D. ,气体质量始终不变,气体物质的量变大,平均分子质量在变化,当容器内气体平均摩尔质量不再变化说明达到平衡,故D正确;
E.该反应气体的质量不变,则容器内气体的密度始终没有变化,不能说明该反应达到化学平衡状态,故E不正确;
故答案为:CD。
(4)A.该反应的正反应是气体体积增大的反应,在其他条件不变时减小压强,化学平衡向气体体积增大的正反应方向移动,导致N2O4的平衡转化率升高,A正确;
B.在其它条件不变时,加入催化剂,能够降低反应的活化能,使反应速率加快,但由于对正、逆反应速率影响相同,因此不能使化学平衡发生移动,不能提高N2O4的平衡转化率,B不正确;
C.该反应的正反应是吸热反应,在其它条件不变时,降低温度,化学平衡向放热的逆反应方向移动,导致N2O4的平衡转化率降低,C不正确;
D.再充入一定量的N2O4,相当于体系压强增大,平衡向气体分子数减小的逆反应方向移动,N2O4的平衡转化率下降,D不正确;
故答案为:A。
(5)根据图象可知:反应在100℃,反应达到平衡时c(NO2)=0.12 mol/L,c(N2O4)=0.040 mol/L,则该时刻的化学平衡常数K==;100℃时,在容器中按初始浓度c(N2O4)=0.10 mol/L、c(NO2)=0.20 mol/L投料,此时的浓度商Qc==>0.36,则化学反应向逆反应方向进行。
【分析】(1)利用υ=Δc/Δt计算;
(2)利用“三段式”法计算;
(3依据化学平衡的特征“等”和“定”进行分析判断;
(4)根据影响化学平衡移动的因素分析;
(5)通过计算比较Qc与K的大小判断。
21.【答案】(1)0.015
(2)=
(3)C;D
(4)
(5)A
【解析】【解答】(1)由图像可知,0-10min内一氧化碳的物质的量变化量为0.3mol,则v(CO)=。
(2)由图可知,A点处于平衡状态,则v正(NO2)= v逆(NO2)。
(3)A项单位时间内每消耗4molCO2的同时生成1molN2,生成1molN2的同时生成4molCO2,v正(CO2)= v逆(CO2),反应达到平衡状态,A正确;B项反应体系中各物质均为气体,气体的总质量不变,随着反应进行气体物质的量减小,则气体的平均相对分子质量增大,容器内混合气体的平均相对分子质量不再变化,说明达到平衡状态,B正确;C项反应为恒容密闭容器中进行,气体的密度始终保持不变,不能说明反应达到平衡,C不正确;D项可逆反应达到平衡时,各组分的浓度不变,但浓度之比不一定等于化学计量数之比,c(CO) :c(NO2) :c( CO2):c(N2)=4:2:4:1的状态不一定是平衡状态,与反应物的起始量和转化率有关,D不正确。
(4)由,可知Δn(CO2)=Δn(CO)=0.6mol-0.3mol=0.3mol,10min内Δc(CO2)=,10min时反应达到平衡状态,即平衡时c(CO2)=0.15mol/L,0-15min内CO2的物质的量浓度随时间变化的曲线图为。
(5)A项燃烧是放热反应,将化学能转化为热能,A正确;B项锌锰电池是把化学能转化为电能,B不正确;C项风力发电是将风能转化为电能,C不正确;D项太阳能热水器是将太阳能转化为热能,D不正确。
【分析】(1)结合公式计算;
(2)反应达到平衡时,正逆反应速率相等;
(3)化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
(4)二氧化碳的物质的量变化量等于一氧化碳的物质的量变化量,即增长速率相等;
(5)A、燃烧属于化学能转化为热能;
B、电池属于化学能转化为电能;
C、风力发电属于风能转化为电能;
D、太阳能热水器属于太阳能转化为热能。
一、单选题
1.已知反应2A(g) 2B(g)+C(g)△H<0,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为( )
A.减小容器容积 B.增大容器容积
C.减小B的浓度 D.降温
2.一定量盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
①NaOH固体 ②KNO3溶液 ③水 ④CH3COONa固体
A.①③ B.②④ C.②③ D.③④
3.在通过实验测量化学反应速率时,不可以利用的相关性质为( )
A.气体的体积和体系的压强 B.颜色的深浅
C.物质的浓度(或质量) D.元素的化合价
4.为探究铁与稀硫酸的反应速率(以表示)向反应混合液中加入某些物质,下列判断正确的是( )
A.加入铁固体,加快
B.在常温下将题中稀硫酸改为浓硫酸,加快
C.加入溶液,减小
D.加入溶液,不变
5.在2A+B 3C+4D反应中,表示该反应速率最快的是( )
A. B.
C. D.
6.O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
T℃ t/min pH 3.0 4.0 5.0 6.0
20 301 231 169 58
30 158 108 48 15
50 31 26 15 7
据表中的递变规律,推测O3分别在条件①40℃、pH=3.0,②10℃、pH=5.0,③30℃、pH=7.0下,分解速率依次增大的顺序为( )
A.①②③ B.③②① C.②①③ D.③①②
7.下列有关化学反应速率的说法正确的是( )
A.4 mol L 1 s 1的反应速率一定比1 mol L 1 s 1的反应速率大
B.对于任何化学反应来说,反应速率越快,反应现象就越明显
C.100mL 0.5 mol L 1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
D.升温能使反应物活化分子百分数增大,从而加快化学反应速率
8.某温度时,在容器中发生两种物质之间的转化反应,物质的量随时间变化曲线如图所示,判断下列说法正确的是( )
A.时反应达到平衡
B.时逆反应速率大于正反应速率
C.该反应的化学方程式为
D.反应开始至时A的平均反应速率为
9.已知某反应的各物质浓度数据如下:
aA(g)+ bB(g) 2C(g)
起始(mol/L) 3.0 1.0 0
2 s末浓度(mol/L) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A.9∶3∶4 B.3∶1∶2 C.2∶1∶3 D.3∶2∶1
10.合成气转变为甲醇的反应为:CO(g)+2H2(g) CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
A.其他条件不变,增大CO浓度可以增加体系中活化分子百分数
B.0~5min,反应放出的热量为27.24kJ
C.反应到5min时,生成0.6molCH3OH
D.第5min时,H2的反应速率为0.06mol·L-1min-1
11.反应2SO2+O2 2SO3,经过一段时间后,O2的浓度增加了4mol/L,在这段时间内用O2表示的反应速率为0.4mol/(L s),则这段时间为( )
A.0.1 s B.2.5 s C.5 s D.10 s
12.某有机物M是一种环境污染物,我国学者研究出的一种高效处理M的原理示意图如图所示。下列说法错误的是( )
A.上述处理过程中没有涉及能量转化
B.催化剂能加快处理过程中的反应速率
C.适当增加 用量有利于使M处理得更充分
D.催化剂表面存在化学键的断裂和形成过程
13.向体积均为1L的两恒容密闭容器中分别充入2molX和1molY发生反应:2X(g)+Y(g)Z(g) △H,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A.△H>0 B.气体的总物质的量:na<nc
C.平衡时容器的压强:p甲<p乙 D.反应速率:va正<vb逆
14.工业制备硫酸过程中存在如下反应:2SO2+O2 2SO3,下列关于该反应的说法正确的是( )
A.增大O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.一定条件下SO2能100%转化为SO3
15.对于反应 ,下列说法正确的是
A.上述反应
B.及时液化分离出氨气,正反应速率增大
C.增大压强,活化分子百分数增多,反应速率加快
D.若反应放出92.4 kJ热量,则过程中有被氧化
16.已知反应C+CO2 2CO的正反应为吸收热量。当温度升高时,其正反应、逆反应的速率变化情况为( )
A.同时增大 B.同时减小 C.增大,减小 D.减小,增大
二、综合题
17.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率为0.1mol/(L min).求:
(1)此时A的浓度c(A)= mol/L,反应开始前容器中的A,B的物质的量:n(A)=n(B)= mol;
(2)B的平均反应速率v(B)= mol/(L min);
(3)x的值为 .
18.氮的氧化物在生产、生活中有广泛应用。
(1)Ⅰ.已知汽车气缸中氮及其化合物发生如下反应:
(常温下平衡常数为K1)
(常温下平衡常数为K2)
则 ;常温下平衡常数K= (用K1、K2来表示)
(2)Ⅱ.四氧化二氮(N2O4)可作为运载火箭的推进剂,将4 mol N2O4放入2 L恒容密闭容器中发生反应,平衡体系中N2O4的体积分数()随温度的变化如图所示:
D点v(正) v(逆)(填“>”“=”或“<”)。
(3)A、B、C点中平衡常数K的值最大的是 点。T2时,N2O4的平衡转化率为 ;若达平衡时间为5 s,则此时间内的N2O4平均反应速率为 。
(4)若其条件不变,在原平衡基础上,再加入一定量NO2,达到新平衡时,与原平衡相比,NO2的体积分数 (填“增大”“不变”或“减小”)。
(5)Ⅲ.碳的很多化合物在生产、生活中有广泛应用,对其进行综合利用是目前研究的热点之一。;中科院化学所研究了该反应的反应历程,如图所示:
反应历程中,能降低反应活化能的物质有 (填化学式);中间产物有 种。
(6)第4步反应的化学方程式为 。
19.诺贝尔化学奖特别青睐合成氨相关研究,曾3次颁奖于该领域研究成果。当前,氨的合成与应用仍然受到广大化学家的重点关注。回答下列问题:
I.研究发现,一定温度和压强下,在催化剂表面,反应N2(g)+3H2(g) 2NH3(g)的相关能量(E)变化如图所示:
(1)每生成2molNH3时 (填放出”或“吸收”) kJ的能量。
(2)在恒容密闭容器中发生上述反应,能说明该反应达到平衡状态的是 。
a.容器内混合气体的质量不再变化
b.c(N2):c(H2):c(NH3)=1:3:2
c.容器内NH3的浓度不再变化
d.容器内混合气体的物质的量不再变化
(3)一定温度下,在体积为2L的密团容器中,充入1molN2和3molH2模拟工业合成氨的反应。10min时,测得容器中气体的总物质的量是起始时的0.8倍,用NH3的浓度变化表示的化学反应速率为 。
(4)II.某氨-空气燃料电池的工作原理是氨气与氧生成一种常见的无毒气体和水,其装置如图所示:
溶液c最好选择 (填“酸性”、“碱性”或“中性”)溶液。
(5)正极的电极反应式为 。
20.在容积为2.0 L的恒容密闭容器中,通入一定量的N2O4,发生反应:N2O4 (g)2NO2(g)△H>0。100℃时,各物质的物质的量浓度随时间变化如下图所示。
(1)60s内,v(NO2)= 。
(2)a点时,v正 v逆(填“>”、“<”或“=”),此时容器内压强与起始时压强之比为 。
(3)下列叙述中,能说明该反应达到化学平衡状态的是____(填字母序号)。
A.2v(N2O4)=v(NO2)
B.单位时间内消耗a mol N2O4,同时生成2a mol NO2
C.容器内的压强不再变化
D.容器内气体平均摩尔质量不再变化
E.容器内混合气体的密度不再变化
(4)欲提高N2O4的平衡转化率,理论上可以采取的措施为____。
A.减小压强 B.加入催化剂
C.降低温度 D.再充入一定量的N2O4
(5)100℃时,该反应的化学平衡常数数值为 。该温度下,在容器中按初始浓度c(N2O4)=0.10mol/L、c(NO2)=0.20mol/L投料,反应向 方向进行(填“正反应”或“逆反应”)。
21.汽车尾气中CO、NO2在定条件下可发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g)。一定温度下,向2 L恒容密闭容器中充入一定量的CO和NO2,反应经10 min达到平衡状态。CO的物质的量随时间的变化曲线如图1所示:
(1)0 ~ 10 min内,用CO的浓度变化表示的平均反应速率为 mol/(L·min)。
(2)A点时v正( NO2) (填“>”、“<”或“=”)v逆(NO2)。
(3)下列不能说明该反应一定达到化学平衡状态的是____(填字母)。
A.单位时间内,每消耗4molCO2的同时生成1molN2
B.容器内混合气体的平均相对分子质量不再变化
C.容器内混合气体的密度保持不变
D.c(CO) :c(NO2) :c( CO2):c(N2)=4:2:4:1
(4)在图2中画出0~ 15 min内,CO2的物质的量浓度随时间变化的曲线图。
(5)下列设备工作时,将化学能主要转化为热能的是____(填字母)。
A.燃气灶 B.锌锰电池
C.风力发电 D.太阳能热水器
答案解析部分
1.【答案】A
【解析】【解答】解:A、减小容器体积,可以增大化学反应速率,且平衡左移,故符合题意,故A正确;
B、增大容器容积,减小化学反应速率,故不符合题意,故B错误;
C、减小B的浓度,平衡右移,A的浓度减小,不符合题意,故C错误;
D、降温化学反应速率减低,故D错误,
故选A.
【分析】对于反应2A(g) 2B(g)+C(g),△H<0来说,增大正反应速率,可增大A的浓度、升高温度或加入催化剂或加压,要使c(A)增大,可以让反应向你反应进行,以此解答.
2.【答案】D
【解析】【解答】①加入NaOH固体,与盐酸反应,酸减少生成氢气减少,故不符合;
②加KNO3溶液,铁与H+、NO3-反应不生成氢气,则生成氢气的总量减少,故不符合;
③加水,氢离子浓度减小,所以与铁反应的速率减慢,同时氢离子的物质的量不变,则不影响生成氢气的总量,故符合;
④加入CH3COONa固体,与盐酸反应生成醋酸,溶液中已电离出的氢离子浓度减小,但物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故符合;
综上③④,符合题意;
故答案为:D。
【分析】减小反应物的浓度可以减慢反应的速率,并且不会改变反应物的物质的量,所以不会改变氢气的量;
加入醋酸钠,会结合盐酸生成醋酸,使得氢离子的浓度减小,所以反应的速率会减慢,但是氢离子的物质的量不变,所以生产的氢气总量不变。
3.【答案】D
【解析】【解答】化学反应速率的快慢,可以用单位时间内物质的浓度变化来表示,颜色变化也可以衡量有色物质消耗或生成的快慢,化合价与反应速率无关。
故答案为:D
【分析】反应速率,可用一段时间内气体体系的压强、颜色的深浅、量的变化进行表示;元素的化合价是由于电子的得失或偏移造成的,不用于表示反应速率。
4.【答案】C
【解析】【解答】A.铁是固体,改变固体的量不会改变反应速率,因此加入铁固体,不变,A不符合题意;
B.在常温下将题中稀硫酸改为浓硫酸,常温下铁在浓硫酸中钝化,不能产生氢气,B不符合题意;
C.加入溶液,相当于稀释,反应物浓度减小,减小,C符合题意;
D.加入溶液,铁置换出铜,构成原电池,加快,D不符合题意;
故答案为:C。
【分析】A、改变固体的量不会改变反应速率;
B、常温下铁在浓硫酸中钝化,阻止铁与硫酸反应;
D、加入溶液,铁置换出铜,构成原电池,加快反应速率。
5.【答案】B
【解析】【解答】在相同的条件下,同一个化学反应中,用不同的物质表示数值不同。要比较反应速率,转化为同一种物质表示。用不同的物质表示的化学反应速率其数值之比等于化学计量数之比;有 。所有用其他物质表示的反应速率转化为用B表示;
A. ,有 ,用B表示的速率 ;
B. ;
C. ,有 ,用B表示的速率 ;
D.,单位为mol·L-1·min-1,与其他选项的单位不同,需要转化单位,将D表示的速率转化为用单位mol·L-1·s-1表示的速率, ,再转化为用B表示, ,有 用B表示的速率 ;
综上反应速率最快的为B项;
本题
故答案为:B。
【分析】此题中除了要转化为用相同的物质表示化学反应速率,还要注意单位。
6.【答案】C
【解析】【解答】由表格数据可知,相同温度下,pH越大,反应所需时间越短,说明pH越大,反应速率越大;在pH相同时,温度越高,反应时间越短,说明温度越高,反应速率越快。结合变化的趋势可知,温度对反应速率的影响大于pH对反应速率的影响。
③中温度高,pH大,因此反应速率最大;①中温度高于②,因此①的反应速率大于②,因此反应速率大小关系为③>①>②,C符合题意;
故答案为:C
【分析】此题是对反应速率影响因素的考查,结合表格数据分析不同条件下反应速率的大小。
7.【答案】D
【解析】【解答】A.4 mol L 1 s 1的反应速率不一定比1 mol L 1 s 1的反应速率大,如果是同种物质则前者大于后者,如果是不同物质,有可能后者的速率大于后者,故A不符合题意;
B.对于任何化学反应来说,反应速率越快,反应现象不一定越明显,比如酸碱中和反应,故B不符合题意;
C.100mL 0.5 mol L 1的盐酸跟锌片反应,加入适量的氯化钠溶液,由于溶液中含有水,因此氢离子浓度降低,反应速率减慢,故C不符合题意;
D.升温,原来不是活化分子吸收能量变成了活化分子,分子总数不变,因此活化分子百分数增大,碰撞几率增大,因此加快化学反应速率,故D符合题意。
故答案为:D。
【分析】A.化学反应速率比较应该指明同一种物质;
B.反应速率越快,反应现象不一定就越明显;
C.加入适量的氯化钠溶液,氢离子浓度减小。
8.【答案】C
【解析】【解答】A.4min时A、B物质的量相等,后来还在改变,反应未达到平衡,故A不符合题意;
B.8min时反应达到平衡,逆反应速率等于正反应速率,故B不符合题意;
C.根据分析可知该反应的化学方程式为,故C符合题意;
D.反应开始至4min时,A物质的量变化=0.8mol-0.4mol=0.4mol,A的平均反应速率为,故D不符合题意;
故答案为C。
【分析】A.依据变者不变即平衡分析;
B.平衡时逆反应速率等于正反应速率;
C.依据化学计量系数之比等于物质的变化量之比,可逆反应进行不到底分析;
D.依据计算。
9.【答案】B
【解析】【解答】
aA(g)+ bB(g) 2C(g)
起始(mol/L) 3.0 1.0 0
反应(mol/L) 1.8 06 0.8
平衡(mol/L) 1.2 0.4 0.8
浓度变化量之比等于化学计量数之比,所以a:b:c=1.2:0.4:0.8=3:1:2,
故答案为:B。
【分析】根据浓度变化量之比等于化学计量数之比计算解答。
10.【答案】B
【解析】【解答】A.其他条件不变,增大CO浓度,增大单位体积内活化分子的数目,但分子总数也增大,故体系中活化分子百分数未改变,A说法不符合题意;
B.0~5min,反应放出的热量= ×90.8kJ·mol-1=27.24kJ,B说法符合题意;
C.反应到5min时,反应0.6mol氢气,生成0.3molCH3OH,C说法不符合题意;
D.只能计算一段时间内的平均速率,不能计算瞬时速率,第5min时,H2的反应速率不能确定,D说法不符合题意;
故答案为:B。
【分析】A.增大浓度可以增大单位体积内的活化分子数;
B.根据物质的量与焓变计算;
C.根据方程式的系数计算;
D.瞬时速率无法计算。
11.【答案】D
【解析】【解答】解:△t= = =10s,
故选D.
【分析】根据v= ,化学反应速率之比等化学计量数之比进行计算.
12.【答案】A
【解析】【解答】A.上述处理过程涉及化学能转化为热能,选项A符合题意;
B.催化剂能加快反应速率,选项B不符合题意;
C. 用量增大,有利于M的转化,选项C不符合题意;
D.催化剂表面发生反应,存在化学键的断裂和形成过程,选项D不符合题意。
故答案为:A。
【分析】根据图示可以知道M和氧气在催化剂的表面发生了反应,生成了水和二氧化碳,其中涉及到键的断裂和键的生成,因此有能量的变化,催化剂可以加快反应速率降低反应所需要的的活化能,增加氧气的含量可以使M充分的反应。
13.【答案】B
【解析】【解答】A.随反应进行,气体物质的量减少,开始反应时,甲容器内压强增大,可知温度升高,所以△H<0,故A不符合题意;
B.a、c两点压强相等,a点温度大于c,可知气体的总物质的量:na<nc,故B符合题意;
C.由图像可知,a、b为平衡点,平衡时容器的压强:p甲>p乙,故C不符合题意;
D.a、b点达到平衡,a点温度较高、压强较大,所以va正>vb逆,故D不符合题意;
故答案为:B。
【分析】A.该反应前后气体分子数减小,恒容条件下,结合PV=nRT进行分析。
B.a、c两点压强相等,a点温度大于c,结合PV=nRT进行分析。
C.a、b为平衡点,据此分析。
D.a、b点达到平衡,结合反应速率的影响因素进行分析。
14.【答案】A
【解析】【解答】解;A.增加O2的浓度,单位体积活化分子数目增多,则反应速率增大,故A正确;
B.降低温度,活化分子百分数减小,反应速率减小,故B错误;
C.使用催化剂,反应速率增大,故C错误;
D.可逆反应反应物不可能完全转化,故D错误.
故选A.
【分析】该反应为可逆反应,反应物不可能完全转化,一般来说,增大浓度、升高温度或加入催化剂,可增大反应速率,以此解答该题.
15.【答案】D
【解析】【解答】A.上述反应中4摩尔气体生成2摩尔气体,所以是,A不符合题意;
B.及时液化分离出氨气,正反应速率不变,逆反应速率减小,B不符合题意;
C.增大压强,单位体积内活化分子数增多,反应速率加快,C不符合题意;
D.若反应放出92.4 kJ热量,则过程中有被氧化,D符合题意;
故答案为:D。
【分析】A.该反应是气体体积减小的反应,ΔS<0;
B.分离出液氨,正反应速率不变,逆反应速率减小;
C.增大压强,单位体积内活化分子数增多。
16.【答案】A
【解析】【解答】化学反应无论是吸热反应还是放热反应,温度升高,活化分子的百分含量增大,有效碰撞的次数增大,化学反应速率都增大。
故答案为:A。
【分析】温度升高,化学反应的速率就会升高,无论该反应是吸热反应还是放热反应。
17.【答案】(1)0.75;3
(2)0.05
(3)2
【解析】【解答】解:(1)5min后,n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g) xC(g)+2D(g),生成1molD要消耗1.5molA和0.5molB,
设初始时A、B的物质的量均为n,则(n﹣1.5):(n﹣0.5)═3:5,即n=3.
c(A)═ ═0.75mol/L.故答案为:0.75;3; (2)v(B)═ ═0.05mol/(L min),故答案为:0.05;(3)n(C)═0.1mol/(L min)×5min×2L═1mol,
n(D)=0.5mol/L×2L═1mol,
根据3A(g)+B(g) xC(g)+2D(g),n(C):n(D)═1:1,
因为生成C和D的物质的量之比等化学计量数之比,所以n═2,故答案为:2.
【分析】(1)根据化学方程和物质的量浓度的计算式思考;(2)根据评价反应速率公式计算;(3)根据化学方程式计算.
18.【答案】(1)-112;
(2)<
(3)C;0.25;0.1 mol/(L·s)
(4)减小
(5)LiI和Rh;5
(6)CH3COORhI+H2=Rh+HI+CH3COOH
【解析】【解答】(1)①
②,
根据盖斯定律②-①×2,整理可得△H=-112 kJ/mol;的化学平衡常数K1=;反应的化学平衡常数K2= ,则在常温下该反应的化学平衡常数K=;
(2)根据图示可知D点N2O4的含量低于该温度下化学平衡状态时的N2O4的含量,则化学反应向生成N2O4的逆反应方向进行,因此反应速率:v(正)<v(逆);
(3)根据图像可知:升高温度,N2O4的平衡含量降低,说明升高温度,化学平衡正向移动,根据平衡移动原理:升高温度化学平衡向吸热反应方向移动,因此该反应的正反应为吸热反应,所以A、B、C点中平衡常数K的值最大的是C点;
在T2时,假设反应的N2O4的物质的量为x ,反应产生的NO2的物质的量为2x,平衡时N2O4的物质的量为(4-x) mol,N2O4平衡含量是60%,则,解得x=1 mol,所以N2O4的平衡转化率为;
若达平衡时间为5 s,则此时间内的N2O4平均反应速率v(N2O4)=;
(4)若其条件不变,在T3原平衡基础上,再加入一定量NO2,必然会导致反应体系的压强增大,增大压强,化学平衡向气体体积减小的逆反应方向移动,因此达到新平衡时,与原平衡相比,NO2的体积分数减小;
(5)在反应历程中,能降低反应活化能的物质是反应的催化剂,催化剂参加化学反应,改变了化学反应途径,只是在前边的化学反应中是反应物,在后边的反应中又是生成的物质。对反应图示进行分析发现:能降低反应活化能的物质有LiI和Rh;
根据图示可知反应过程的中间产物有CH3I、LiOH、CH3RhI、CH3COORhI、HI,共5种物质;
(6)根据图示可知:第4步反应的反应物是CH3COORhI、H2,生成物是Rh、HI\CH3COOH,故该步反应的化学方程式为:CH3COORhI+H2=Rh+HI+CH3COOH。
【分析】(1)根据盖斯定律和化学平衡常数的关系;
(2)根据物质含量低于该温度下化学平衡状态时的含量分析;
(3)根据图像,利用平衡移动原理判断;利用“三段式”法计算;
(4)依据化学平衡移动原理分析;
(5)催化剂参加化学反应,改变了化学反应途径,只是在前边的化学反应中是反应物,在后边的反应中又是生成的物质;根据中间体反应前和反应后均没有,只在过程中出现;
(6)根据图示反应物和生成物书写。
19.【答案】(1)放出;92
(2)cd
(3)
(4)碱性
(5)
【解析】【解答】I.(1)由图知,破坏1molN2(g)和3molH2(g)的化学键时共需吸收能量2254kJ ,形成2molNH3(g)的化学键时放出2346kJ的能量,则 Q =2346-2254=92,反应每生成2molNH3时放出92kJ的能量;(2)在恒容密闭容器中发生 反应:a.容器内混合气体的质量始终不变,故气体总质量不再变化,不能说明该反应达到平衡状态,a不正确; b.各成分的平衡浓度与起始浓度有关,c(N2):c(H2):c(NH3)=1:3:2不一定显示平衡状态,b不正确;c.容器内NH3的浓度不再变化,符合平衡特征,能说明该反应达到平衡状态,c正确;d.反应过程中混合气体的物质的量会随着反应而变,故其不再改变的时候,说明已达到化学平衡状态,d正确;故答案为cd;(3)已知,一定温度下,在体积为2L的密团容器中,充入1molN2和3molH2模拟工业合成氨的反应。10min时,测得容器中气体的总物质的量是起始时的0.8倍,则
, ,解得x=0.4 , ;II. (4)溶液c最好选择碱性溶液,由题意知,氨气燃料电池负极是氨气,正极是氧气,用惰性电极,选用碱性电解质溶液的原因是,氨气极易溶于水,溶液呈碱性,氨气不会和电解质发生反应,且导电能力强;(5)正极是氧气得电子被还原的反应,故电极反应式为 。
【分析】I.(1)破坏反应物化学键时吸收能量,形成生成物的化学键时放出能量,则 放出的能量大于吸收的能量时,为放热反应;(2)按平衡状态的特征判断正误:①对同一个物质而言正反应速率和逆反应速率相等,如υ正= υ逆,②各成分的含量、也可以是物质的量或浓度保持定值,不再改变,③选定的某个物理量,一开始会随着反应的发生而变化,而当这个量不再改变的时候,就达到化学平衡状态;(3)用三段式结合已知条件计算;II. 燃料电池中,通入燃料的一极为负极,还原剂失去电子发生氧化反应,电子沿着导线流向正极,通入助燃物的一极为正极,正极上发生还原反应,内电路中阴离子移向负极、阳离子移向正极,据此分析;
20.【答案】(1)0.002mol/(L·s)
(2)>;4:3
(3)C;D
(4)A
(5)0.36;逆反应
【解析】【解答】(1)根据图示可知:在60 s内,NO2的浓度升高0.12 mol/L,则v(NO2)=。
(2)反应从正向建立平衡,到a点时,反应尚未到达平衡状态,所以v正>v逆;
根据图像,设达到a点时两物质的浓度均为x mol/L,列出三段式:
2(0.10-x)=x,解得x=1/15。在容积为2.0 L的恒容密闭容器中,压强比等于浓度之比,所以容器内压强:起始时压强=。
(3)A.速率并未说明是正反应速率等于逆反应速率,故A不正确;
B.单位时间内消耗,同时生成,都是正反应速率,不能说明该反应达到化学平衡状态,故B不正确;
C.该反应是气体体积增大的反应,压强增大,当压强不变了说明该反应达到化学平衡状态,故C正确;
D. ,气体质量始终不变,气体物质的量变大,平均分子质量在变化,当容器内气体平均摩尔质量不再变化说明达到平衡,故D正确;
E.该反应气体的质量不变,则容器内气体的密度始终没有变化,不能说明该反应达到化学平衡状态,故E不正确;
故答案为:CD。
(4)A.该反应的正反应是气体体积增大的反应,在其他条件不变时减小压强,化学平衡向气体体积增大的正反应方向移动,导致N2O4的平衡转化率升高,A正确;
B.在其它条件不变时,加入催化剂,能够降低反应的活化能,使反应速率加快,但由于对正、逆反应速率影响相同,因此不能使化学平衡发生移动,不能提高N2O4的平衡转化率,B不正确;
C.该反应的正反应是吸热反应,在其它条件不变时,降低温度,化学平衡向放热的逆反应方向移动,导致N2O4的平衡转化率降低,C不正确;
D.再充入一定量的N2O4,相当于体系压强增大,平衡向气体分子数减小的逆反应方向移动,N2O4的平衡转化率下降,D不正确;
故答案为:A。
(5)根据图象可知:反应在100℃,反应达到平衡时c(NO2)=0.12 mol/L,c(N2O4)=0.040 mol/L,则该时刻的化学平衡常数K==;100℃时,在容器中按初始浓度c(N2O4)=0.10 mol/L、c(NO2)=0.20 mol/L投料,此时的浓度商Qc==>0.36,则化学反应向逆反应方向进行。
【分析】(1)利用υ=Δc/Δt计算;
(2)利用“三段式”法计算;
(3依据化学平衡的特征“等”和“定”进行分析判断;
(4)根据影响化学平衡移动的因素分析;
(5)通过计算比较Qc与K的大小判断。
21.【答案】(1)0.015
(2)=
(3)C;D
(4)
(5)A
【解析】【解答】(1)由图像可知,0-10min内一氧化碳的物质的量变化量为0.3mol,则v(CO)=。
(2)由图可知,A点处于平衡状态,则v正(NO2)= v逆(NO2)。
(3)A项单位时间内每消耗4molCO2的同时生成1molN2,生成1molN2的同时生成4molCO2,v正(CO2)= v逆(CO2),反应达到平衡状态,A正确;B项反应体系中各物质均为气体,气体的总质量不变,随着反应进行气体物质的量减小,则气体的平均相对分子质量增大,容器内混合气体的平均相对分子质量不再变化,说明达到平衡状态,B正确;C项反应为恒容密闭容器中进行,气体的密度始终保持不变,不能说明反应达到平衡,C不正确;D项可逆反应达到平衡时,各组分的浓度不变,但浓度之比不一定等于化学计量数之比,c(CO) :c(NO2) :c( CO2):c(N2)=4:2:4:1的状态不一定是平衡状态,与反应物的起始量和转化率有关,D不正确。
(4)由,可知Δn(CO2)=Δn(CO)=0.6mol-0.3mol=0.3mol,10min内Δc(CO2)=,10min时反应达到平衡状态,即平衡时c(CO2)=0.15mol/L,0-15min内CO2的物质的量浓度随时间变化的曲线图为。
(5)A项燃烧是放热反应,将化学能转化为热能,A正确;B项锌锰电池是把化学能转化为电能,B不正确;C项风力发电是将风能转化为电能,C不正确;D项太阳能热水器是将太阳能转化为热能,D不正确。
【分析】(1)结合公式计算;
(2)反应达到平衡时,正逆反应速率相等;
(3)化学平衡判断:1、同种物质正逆反应速率相等,2、不同物质速率满足:同侧异,异侧同,成比例,3、各组分的浓度、物质的量、质量、质量分数不变,4、左右两边化学计量数不相等,总物质的量、总压强(恒容)、总体积(恒压)不变,5、平均相对分子质量、平均密度根据公式计算,6、体系温度、颜色不变;
(4)二氧化碳的物质的量变化量等于一氧化碳的物质的量变化量,即增长速率相等;
(5)A、燃烧属于化学能转化为热能;
B、电池属于化学能转化为电能;
C、风力发电属于风能转化为电能;
D、太阳能热水器属于太阳能转化为热能。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
