3.4 沉淀溶解平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.4 沉淀溶解平衡 同步练习题(含解析) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 496.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 14:02:20 | ||
图片预览



文档简介
3.4 沉淀溶解平衡同步练习题
一、选择题
1.下列说法正确的是
A.Mg(OH)2难溶于水,故其饱和溶液不能使酚酞变红
B.气态的非金属单质分子均为非极性分子
C.新制氯水放置一段时间后酸性增强
D.白磷和金属钠均可用适量煤油贮存
2.℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.t℃时,Ag2CrO4的Ksp=1×10﹣8 B.d点有Ag2CrO4沉淀生成
C.a点对应的Ksp等于b点对应的Ksp D.加入AgNO3可使溶液由b点变成c点
3.下列反应的离子方程式正确的是
A.NaHCO3溶液的水解:HCO+H2OH3O++CO
B.FeI2溶液中滴加少量氯水:2Fe2++Cl2=2Fe3++2Cl
C.向NH4HCO3溶液中加过量的NaOH溶液:NH+ OH NH3↑+H2O
D.向Mg(OH)2悬浊液中滴加NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH=2NH3·H2O+Mg2+
4.下列说法正确的是
A.在元素周期表中,每一周期都是从碱金属元素开始,以稀有气体元素结束
B.弱电解质电离平衡正向移动,则电离程度增大,溶液导电性增强
C.难溶电解质的越大,其溶解度不一定越大
D.向平衡体系中加入反应物,则正反应速率增大,平衡正向移动
5.化学与生活、生产密切相关,下列说法正确的是
A.酒精和84消毒液的消毒原理相同
B.硅橡胶具有无毒、无味、耐高温的性质,用作压力锅的密封圈
C.垃圾宜分类投放,废纸、塑料、废电池均为可回收垃圾,图标为
D.纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Hg2+等重金属离子,其原理相同
6.将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是
①20 mL 0.01 mol·L-1NH4Cl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1盐酸
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1AgNO3溶液
A.①②③④⑤ B.④①③②⑤ C.⑤④②①③ D.④③⑤②①
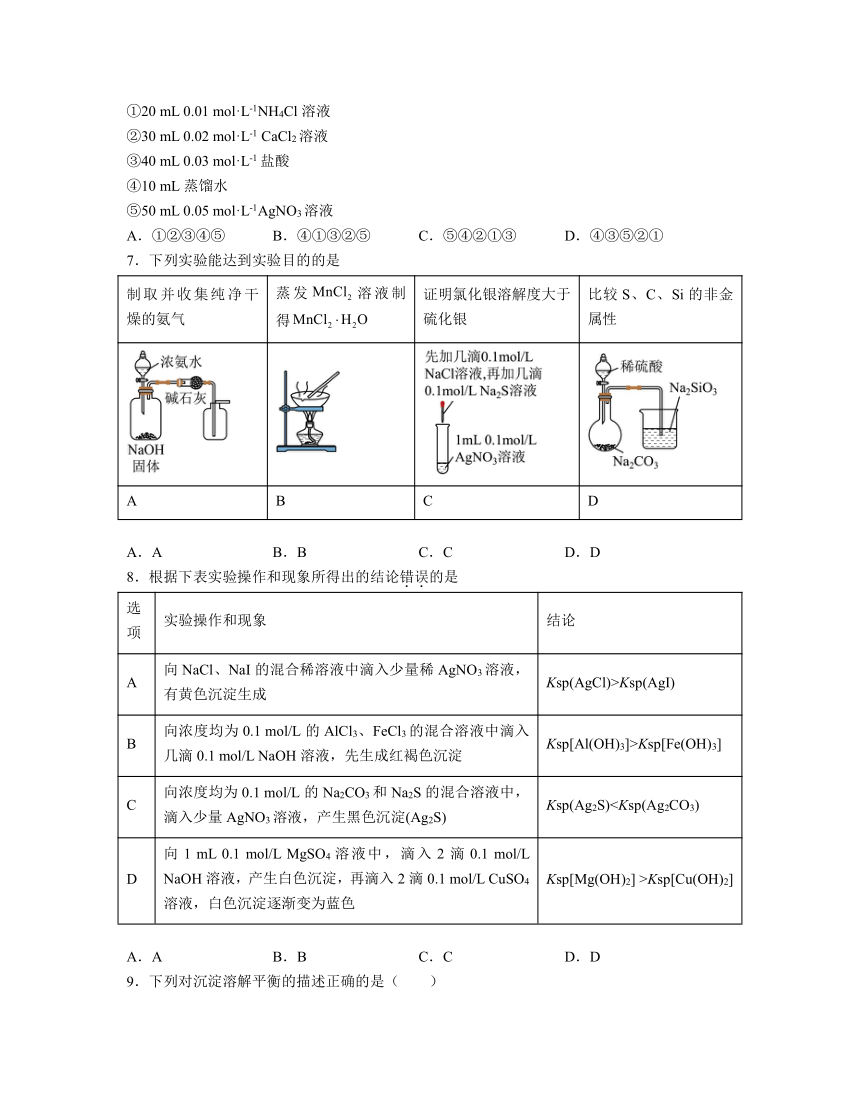
7.下列实验能达到实验目的的是
制取并收集纯净干燥的氨气 蒸发溶液制得 证明氯化银溶解度大于硫化银 比较S、C、Si的非金属性
A B C D
A.A B.B C.C D.D
8.根据下表实验操作和现象所得出的结论错误的是
选项 实验操作和现象 结论
A 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 Ksp(AgCl)>Ksp(AgI)
B 向浓度均为0.1 mol/L的AlCl3、FeCl3的混合溶液中滴入几滴0.1 mol/L NaOH溶液,先生成红褐色沉淀 Ksp[Al(OH)3]>Ksp[Fe(OH)3]
C 向浓度均为0.1 mol/L的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,产生黑色沉淀(Ag2S) Ksp(Ag2S)D 向1 mL 0.1 mol/L MgSO4溶液中,滴入2滴0.1 mol/L NaOH溶液,产生白色沉淀,再滴入2滴0.1 mol/L CuSO4溶液,白色沉淀逐渐变为蓝色 Ksp[Mg(OH)2] >Ksp[Cu(OH)2]
A.A B.B C.C D.D
9.下列对沉淀溶解平衡的描述正确的是( )
A.沉淀达到溶解平衡时,溶液中溶质离子浓度一定相等,且保持不变
B.升高温度,沉淀溶解平衡一定向溶解方向移动
C.室温下,AgCl在水中的溶解度大于在食盐水中的溶解度
D.向Na2SO4溶液中加入过量的BaCl2溶液,则SO沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO
10.下列有关说法正确的是
A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH)减小
B.相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强
C.向氨水中不断通入CO2,c(OH-)/c(NH3·H2O)不断增大
D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4)
11.下列实验操作、现象与结论均正确的是
选项 操作 现象 结论
A 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 溶液颜色变浅 FeCl3+2KSCNFe(SCN)3+3KCl平衡向逆反应方向移动
B 浓度均为0.10mol/L的Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 产生黑色沉淀 Ksp(Ag2S)>Ksp(Ag2CO3)
C 向装有X溶液的试管中滴入NaOH溶液,将干燥的红色石蒸试纸置于试管口 无明显现象 X溶液中无NH
D 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 变红,前者红色更深 结合质子的能力:CO>HCO
A.A B.B C.C D.D
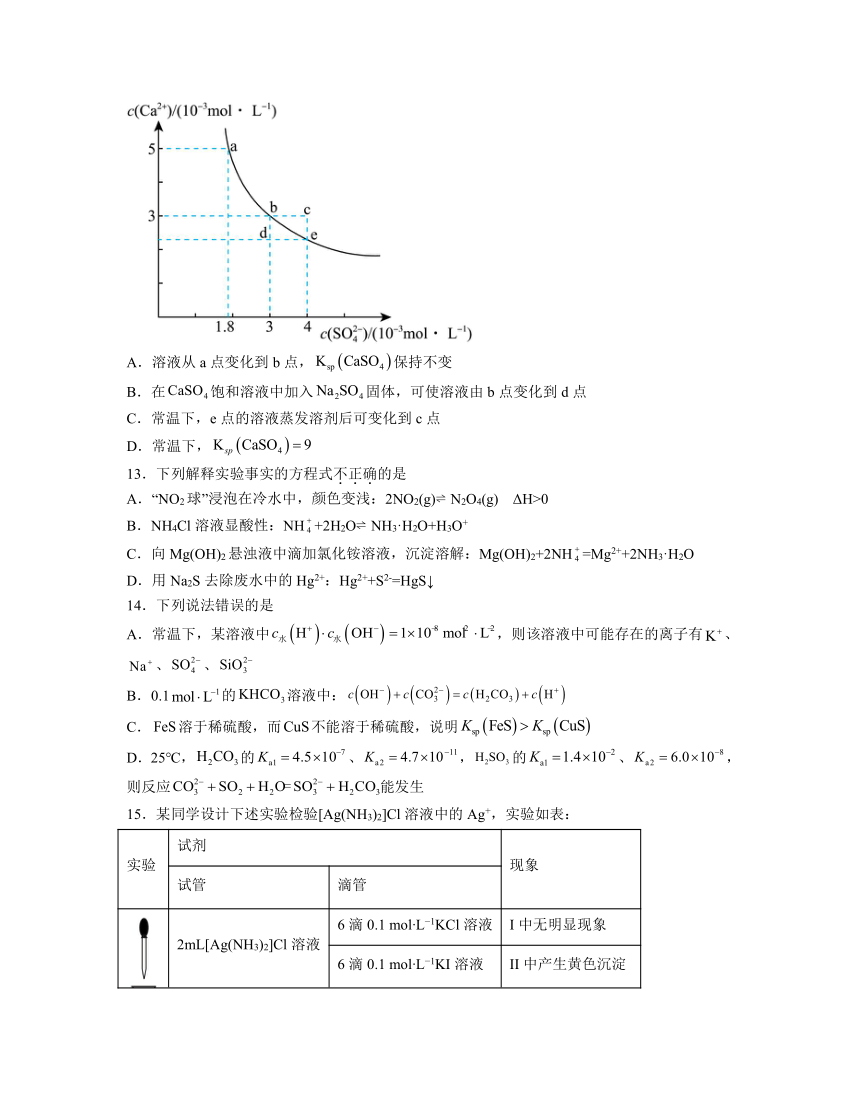
12.常温下,在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
A.溶液从a点变化到b点,保持不变
B.在饱和溶液中加入固体,可使溶液由b点变化到d点
C.常温下,e点的溶液蒸发溶剂后可变化到c点
D.常温下,
13.下列解释实验事实的方程式不正确的是
A.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) N2O4(g) ΔH>0
B.NH4Cl溶液显酸性:NH+2H2O NH3·H2O+H3O+
C.向Mg(OH)2悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2NH=Mg2++2NH3·H2O
D.用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
14.下列说法错误的是
A.常温下,某溶液中,则该溶液中可能存在的离子有、、、
B.0.1的溶液中:
C.溶于稀硫酸,而不能溶于稀硫酸,说明
D.25℃,的、,的、,则反应能发生
15.某同学设计下述实验检验[Ag(NH3)2]Cl溶液中的Ag+,实验如表:
实验 试剂 现象
试管 滴管
2mL[Ag(NH3)2]Cl溶液 6滴0.1 mol L 1KCl溶液 I中无明显现象
6滴0.1 mol L 1KI溶液 II中产生黄色沉淀
6滴0.1 mol L 1HCl溶液 III中产生白色沉淀
6滴饱和KCl溶液 IV中产生白色沉淀
下列说法不正确的是
A.I中的c(Ag+)较小,不足以与Cl-沉淀
B.II中存在平衡:AgI(s)Ag+(aq)+I-(aq)
C.III说明NH3与H+的结合能力小于与Ag+的结合能力
D.配离子与其它离子能否反应,其本质是平衡移动的问题
二、填空题
16.工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______,然后加入适量的_______,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)“再经过一些列操作可得纯净的胆矾晶体”,一系列操作是指_______、_______、_______。
(3)CuSO4 溶液显酸性的原因为_______(用离子方程式表示)。
(4)pH=6,CuSO4溶液中由水电离出的c(H+)是_______。
17.已知氢硫酸与碳酸的电离平衡常数分别为
H2S:
H2CO3:
请回答下列问题:
(1)室温下,0.1mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_________________,其原因是______________________________________________;
(2)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象:___________________________________________。
18.回答下列问题
(1)常温下,浓度均为0.1的五种钠盐溶液的如下表所示:
溶质
8.8 9.7 11.6 10.3 11.1
①上述几种钠盐的阴离子,结合氢离子能力最强的是____________(填离子符号)。
②根据表中数据判断,将浓度均为0.01的下列四种酸的溶液分别稀释至原体积的100倍,变化最大的是____________。
a. B. C. D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的如下表所示:
离子
7.6 5.2 10.1
,。
①用1501溶液吸收标准状况下的2.24L,所得溶液中各离子的浓度由大到小的顺序为____________。
②___________(填“>”“=”或“<”)。
③当向含有相同浓度的、、的溶液中滴加溶液时,_________(填离子符号)先沉淀。
④要使0.2溶液中沉淀完全,则应向溶液中加入溶液使溶液的不低于_________(保留1位小数)。
19.回答下列问题
(1)在化学分析中采用为指示剂,以标准溶液滴定溶液中的,利用与生成砖红色沉淀,指示到达滴定终点.当溶液中恰好完全沉淀(浓度等于)时,溶液中为_______________,此时溶液中等于_______________.[已知的分别为和]
(2)生成沉淀是利用反应,常温下,该反应平衡常数,的平衡常数,则_______________。
20.实验室测定水体中氯离子含量,实验过程如下:向水样中加入溶液作指示剂,用溶液滴定至终点。已知:为不溶于水的砖红色沉淀;常温下,。回答下列问题:
(1)滴定时,应使用___________(填“酸式”或“碱式”)滴定管。
(2)滴定达到终点的判断标志是___________。
(3)实验过程中测得数据如下表:
编号 1 2 3
(水样) 10.00 10.00 10.00
3.75 4.01 3.99
计算水样中氯离子的含量为___________(保留2位小数)。
(4)滴定结束后,溶液中的残余,则此时溶液中___________。
(5)下列情况会造成实验测定结果偏低的是___________。(填字母)
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
【参考答案】
一、选择题
1.C
解析:A.已知Ksp[Mg(OH)2]=5.6×10-12,Mg(OH)2难溶于水,溶液中存在Mg(OH)2(s)Mg2+(aq)+2OH-(aq),故其饱和溶液中c(OH-)=2=2=2mol/L,此时pH>10,故能使酚酞变红,A错误;
B.气态的非金属单质分子不一定为非极性分子,如O3为极性分子,B错误;
C.由Cl2+H2OHCl+HClO、2HClO2HCl+O2↑可知,新制氯水放置一段时间后酸性增强,C正确;
D.白磷溶于煤油中,需贮存在冷水中,而金属钠用适量煤油贮存,D错误;
故答案为:C。
2.C
解析:A.Ag2CrO4存在沉淀溶解平衡:Ag2CrO4(s)2Ag+(aq)+(aq),据图可知,Ksp=c2(Ag+) c()=(10﹣3mol/L)2×10﹣5mol/L=1×10﹣11,故A错误;
B.b为溶解平衡点,b在d的上方,则d点为Ag2CrO4的不饱和溶液,没有Ag2CrO4沉淀生成,故B错误;
C.Ksp只与温度有关,a点温度与b点相同,所以Ksp相等,故C正确;
D.Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag+(aq)+,加入AgNO3可使溶液中的c(Ag+)增大,平衡逆向移动,最终c(Ag+)增大、c()减小,所以不能由b点变成c点,故D错误;
答案选C。
3.D
解析:A.NaHCO3水解生成碳酸,离子方程式为HCO+H2OOH +H2CO3,A错误;
B.还原性:Fe2+C.NaOH溶液过量,铵根、碳酸氢根都能反应,离子方程式为NH+HCO+2OH NH3↑+H2O+ CO,C错误;
D.NH4Cl水解使溶液显酸性,加入Mg(OH)2悬浊液后使其沉淀溶解平衡正向移动,最终得到一水合氨和氯化镁,D正确;
综上所述答案为D。
4.C
解析:A.第一周期是从氢元素开始的,氢元素不是碱金属元素,选项A错误;
B.若加水稀释,则弱电解质电离平衡正向移动,电离程度增大,但离子浓度减小,溶液导电性减弱,选项B错误;
C.Ksp越大,但电解质的溶解度不一定越大,溶解度还取决于溶液的类型和浓度关系,以及物质的摩尔质量等因素,例如AgCl在水中和盐酸中的溶解度不同,但溶度积相同,选项C正确;
D.向平衡体系中加入反应物,若加入的反应物为固体或纯液体,则浓度不变,正反应速率不变,平衡不移动,选项D错误;
答案选C。
5.B
解析:A.医用酒精灭菌时,主要是破坏蛋白质形成蜷曲和螺旋的各种力,从而使蛋白质变性;而84消毒液的主要成分为次氯酸钠,次氯酸钠水解生成的次氯酸具有强氧化性,能与细菌发生氧化还原反应而杀死细菌,A错误;
B.硅橡胶具有无毒、无味、耐高温的性质,所以可以用作压力锅的密封圈,B正确;
C.垃圾宜分类投放,废纸、塑料均为可回收垃圾,废充电电池属于有害垃圾,C错误;
D.纳米Fe粉是和Pb2+、Cu2+、Hg2+发生置换反应从而治理污染,FeS是将Pb2+、Cu2+、Hg2+等重金属离子转化为比FeS更难溶的金属硫化物沉淀而治理污染,二者原理不同,D错误;
故答案为:B。
6.B
【分析】根据氯化银沉淀在溶液中的溶解平衡的移动进行判断溶解度的大小。同离子的浓度越大,对沉淀溶解平衡的抑制程度越大,相应沉淀的溶解度越小。
解析:氯化银的溶解平衡:根据此平衡的移动进行判断,①中氯离子的浓度为0.01 mol·L-1,②中氯离子浓度为0.04mol·L-1,③中氯离子浓度为0.03mol·L-1,⑤银离子的浓度为0.05 mol·L-1,根据氯离子或银离子的浓度越大对平衡的抑制程度越大,氯化银的溶解度越小,由此判断氯化银的溶解度由大到小顺序为:④①③②⑤。
故选答案B。
【点睛】注意对沉淀溶解平衡的影响的主要因素是同离子效应。
7.D
解析:A.氨气密度小于空气,收集氨气应用向下排空气法,A错误;
B.蒸发MnCl2溶液,Mn2+会水解为Mn(OH)2,B错误;
C.AgNO3过量,会生成两种沉淀,不能比较出硫化银和氯化银的溶解度,C错误;
D.此实验可说明酸性H2SO4>H2CO3>H2SiO3,故非金属性S>C>Si,D正确;
故选D。
8.A
解析:A.NaCl和NaI浓度未知,滴入少量稀AgNO3溶液,有黄色沉淀生成,可能是由于c(I-)大,所以不能证明Ksp(AgCl)>Ksp(AgI),故A错误;
B.Al3+、Fe3+浓度相同,滴入几滴NaOH溶液,先生成红褐色的Fe(OH)3沉淀,而且Al(OH)3和Fe(OH)3化学式形式相同,所以可以得出结论:Ksp[Al(OH)3]>Ksp[Fe(OH)3],故B正确;
C.、S2-浓度相同,滴入少量AgNO3溶液,产生黑色的Ag2S沉淀,且Ag2S和Ag2CO3化学式形式相同,所以可以得出结论:Ksp(Ag2S)D.向1 mL 0.1 mol/L MgSO4溶液中,滴入2滴0.1 mol/L NaOH溶液,产生白色沉淀Mg(OH)2,NaOH是少量的,再滴入2滴0.1 mol/L CuSO4溶液,Mg(OH)2白色沉淀逐渐变为更难溶的蓝色的Cu(OH)2沉淀,说明Ksp[Mg(OH)2] >Ksp[Cu(OH)2],故D正确;
故选A。
9.C
解析:A.沉淀达到溶解平衡时,溶液中溶质离子浓度保持不变,不一定相等,例如Ca(OH)2达到溶解平衡,钙离子和氢氧根离子浓度不相等,故A错误;
B.有些物质升高温度,溶解度减小,沉淀溶解平衡向逆反应方向移动,例如氢氧化钙饱和溶液升高温度,沉淀溶解平衡向逆反应反向移动,故B错误;
C.室温下,食盐水中含有大量的氯离子,根据同离子效应,氯化银的电离平衡被破坏,平衡向左移动,溶液中银离子浓度减小,降低了氯化银的溶解度,故氯化银在水中的溶解度大于在食盐水中的溶解度,故C正确;
D.硫酸钡达到沉淀溶解平衡为动态平衡,溶液中还含有硫酸根离子,故D错误;
故选C。
10.B
解析:A.在氨水中加入少量的水稀释促进一水合氨电离,但c(NH)减小,加入氯化铵固体后,虽抑制一水合氨的电离,但溶液中的c(NH)增大,A错误;
B.相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HA更多,物质的量浓度更大,即HB的酸性比HA的酸性强,B正确;
C.向氨水中不断通入CO2,消耗氢氧根离子,促进电离平衡向正向移动,c(NH)不断增大,所以c(OH-)/c(NH3·H2O)=不断减小,C错误;
D.两种溶液的溶度积常数表达式不同,无法比较溶度积常数大小,所以根据先后沉淀无法确定溶度积常数,D错误;
故选B。
11.D
解析:A.KCl对铁离子与SCN-的平衡无影响,则溶液颜色不变,故A错误;
B.产生的黑色沉淀为Ag2S,说明Ag2S的溶度积更小,即Ksp (Ag2S)C.检验气体的试纸需要湿润,干燥的红色石蕊试纸不能检验氨气,故C错误;
D.由现象可知,Na2CO3溶液的碱性强,可知结合质子的能力:CO>HCO,故D正确;
故选D。
12.A
【分析】由图可知a~b~e在曲线上,代表钙离子和硫酸根离子在不同浓度下的饱和溶液,曲线下方离子浓度不足,为的不饱和溶液,反之曲线上方代表的悬浊液.
解析:A.沉淀的溶度积只随温度的变化而变化,所以溶液从a点变化到b点温度不变,保持不变,A正确;
B.在饱和溶液中加入固体,硫酸根离子浓度增大,会有沉淀析出,钙离子浓度降低,可使溶液由b点变化到e点,B错误;
C.常温下,e点的溶液蒸发溶剂,会有沉淀析出,使得钙离子和硫酸根离子浓度保持不变,C错误;
D.由b点可知,,D错误;
故选:A。
13.A
解析:A.根据实验现象,降低温度,化学平衡正反应方向移动,使c(NO2)降低,因此混合气体颜色变浅,所以正反应是放热反应,A错误;
B.NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解作用,消耗水电离产生的OH-,使水的电离平衡正向移动,最终达到平衡时,溶液中c(H+)>c(OH-),水解存在平衡,水解方程式为:NH4++2H2ONH3·H2O+H3O+,B正确;
C.Mg(OH)2难溶于水,在溶液中存在沉淀溶解平衡,Mg(OH)2电离出的OH-与氯化铵电离出的NH4+反应生成氨水,氢氧化镁溶解,离子方程式为Mg(OH)2+2NH4+=Mg2++2NH3·H2O,C正确;
D.用Na2S去除废水中的Hg2+:二者反应产生黑色沉淀,离子方程式为Hg2++S2-= ↓,D正确;
故选A。
14.D
解析:A.由可知,,故存在促进水电离的离子,能促进水的电离使溶液呈碱性,且与其他三种离子可以大量共存,A正确;
B.由质子守恒得,B正确;
C.与在水溶液中都存在沉淀溶解平衡,电离出的与结合生成,能破坏的沉淀溶解平衡,但不能破坏的沉淀溶解平衡,说明,C正确;
D.根据电离常数的大小可以判断酸性强弱:,则题给反应应生成、,或、、或、,D错误;
答案选D。
15.C
解析:A.根据I和IV得到I中没有沉淀产生,说明I中的c(Ag+)较小,不足以与Cl-沉淀,故A正确;
B.II中产生黄色沉淀即生成AgI沉淀,AgI沉淀存在溶解平衡即:AgI(s)Ag+(aq)+I-(aq),故B正确;
C.根据I和III的现象,产生的沉淀说明[Ag(NH3)2]Cl和氢离子反应,有大量银离子生成,银离子和氯离子反应生成AgCl沉淀,说明III中NH3与H+的结合能力大于与Ag+的结合能力,故C错误;
D.根据I和II的现象,可以得出配离子与其它离子能否反应,其本质是平衡移动的问题,故D正确。
这是啥,答案为C。
二、填空题
16.(1) D 2Fe2++H2O2+2H+=2Fe3++2H2O AC
(2) 蒸发浓缩 冷却结晶 过滤、洗涤、干燥
(3)Cu2++2H2OCu(OH)2+2H+
(4)1×10-6mol·L-1
解析:(1)pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀,若直接将Fe2+转化为沉淀,则Cu2+也被沉淀,结合pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀可知应先将Fe2+氧化为Fe3+后在转化为沉淀除去,过氧化氢作氧化剂时还原产物为H2O,不引入新的杂质离子,因此先加H2O2将Fe2+氧化为Fe3+;反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;然后再消耗H+将pH调大使铁离子转化为Fe(OH)3,为不引入新的杂质离子,试剂选用CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,选AC;
(2)硫酸铜溶液获得胆矾晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(3)CuSO4溶液显酸性的原因是铜离子发生水解,反应的离子方程式为Cu2++2H2OCu(OH)2+2H+;
(4)CuSO4溶液中,水解时,部分铜离子结合水电离的氢氧根离子,氢离子全部来自水的电离,pH=6,c(H+)=10-6mol/L,由水电离出的c(H+)是1×10-6mol·L-1。
17. 硫化钠溶液 氢硫酸的K2小于碳酸的K2;硫化钠的水解程度更高,碱性更强 饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀生成。加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成
解析:(1)酸越弱,相应的盐越容易水解,溶液的碱性就越强。根据电离平衡常数可知,氢硫酸的K2小于碳酸的K2;硫化钠的水解程度更高,碱性更强;(2)饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀生成。加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成,故向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。
18.(1) C
(2) < 6.7
解析:(1)①上述几种钠盐的阴离子,pH越大,说明阴离子水解能力越强,结合氢离子能力越强,所以选;
②加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,酸的酸性越强,酸的pH变化越大,酸性最强的酸是,则pH变化最大的是,故选C;
(2)①150mL 1molL-1的NaOH的物质的量为0.15mol,标准状况下2.24LCO2的物质的量为0.1mol,二者反应所得溶液为等浓度的碳酸钠和碳酸氢钠的混合液,碳酸根的水解程度大于碳酸氢根的水解程度,则溶液中离子浓度大小关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②开始沉淀的pH是7.6,即c(OH-)=10-6.4,开始沉淀的pH是10.1,c(OH-)=10-3.9,则<;
③pH小的离子先沉淀,溶度积常数小的物质越先沉淀,所以铜离子先沉淀。
④要使0.2溶液中沉淀完全,当铜离子完全沉淀时铜离子浓度为1×10-5mol/L,则氢氧根离子浓度为mol/L,pOH=8-lg=8-0.7,则pH=14-pOH=6.7。
19.(1)
(2)
解析:(1)根据,可计算出当溶液中恰好完全沉淀时,溶液中,然后再根据,又可计算出此时溶液中。
(2)由题给方程式可知,平衡常数,则。
20.(1)酸式
(2)滴加最后一滴溶液时,生成砖红色沉淀,且半分钟不变色
(3)14.20
(4)
(5)CD
解析:(1)用0.0010mol·L-1AgNO3溶液做滴定液, AgNO3为强酸弱碱盐,水解使溶液呈酸性,必须盛放于酸式滴定管中;
(2)当Cl-恰好沉淀完全时,再滴加一滴硝酸银溶液,Ag+与生成Ag2CrO4砖红色沉淀,且30s内不变色;
(3)第1组硝酸银溶液体积的数据与第2组和第3组相比,误差较大,舍去第1组数据,用第2组和第3组数据的平均值计算。消耗的硝酸银溶液的体积的平均值为,,,水样中氯离子的含量为;
(4)当溶液中的残余c(Cl-)=1.8x10-5mol/L时,根据,则
,又依据,则解得;
(5)A.锥形瓶洗涤后不干燥对待测液物质的量无影响,对滴定结果结果无影响,A不符题意;
B.滴定前,未使用标准液润洗滴定管,标准液浓度变小,所消耗标准液体积偏大,结果偏大,B不符题意;
C.酸式滴定管滴定前仰视读数,滴定后俯视读数,导致读数偏小,结果偏低,C符合题意;
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡,有部分液体未放出,所耗标准液体积偏小,结果偏低,D符合题意;
选CD
一、选择题
1.下列说法正确的是
A.Mg(OH)2难溶于水,故其饱和溶液不能使酚酞变红
B.气态的非金属单质分子均为非极性分子
C.新制氯水放置一段时间后酸性增强
D.白磷和金属钠均可用适量煤油贮存
2.℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.t℃时,Ag2CrO4的Ksp=1×10﹣8 B.d点有Ag2CrO4沉淀生成
C.a点对应的Ksp等于b点对应的Ksp D.加入AgNO3可使溶液由b点变成c点
3.下列反应的离子方程式正确的是
A.NaHCO3溶液的水解:HCO+H2OH3O++CO
B.FeI2溶液中滴加少量氯水:2Fe2++Cl2=2Fe3++2Cl
C.向NH4HCO3溶液中加过量的NaOH溶液:NH+ OH NH3↑+H2O
D.向Mg(OH)2悬浊液中滴加NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH=2NH3·H2O+Mg2+
4.下列说法正确的是
A.在元素周期表中,每一周期都是从碱金属元素开始,以稀有气体元素结束
B.弱电解质电离平衡正向移动,则电离程度增大,溶液导电性增强
C.难溶电解质的越大,其溶解度不一定越大
D.向平衡体系中加入反应物,则正反应速率增大,平衡正向移动
5.化学与生活、生产密切相关,下列说法正确的是
A.酒精和84消毒液的消毒原理相同
B.硅橡胶具有无毒、无味、耐高温的性质,用作压力锅的密封圈
C.垃圾宜分类投放,废纸、塑料、废电池均为可回收垃圾,图标为
D.纳米铁粉和FeS都可以高效地去除被污染水体中的Pb2+、Cu2+、Hg2+等重金属离子,其原理相同
6.将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小排列的顺序是
①20 mL 0.01 mol·L-1NH4Cl溶液
②30 mL 0.02 mol·L-1 CaCl2溶液
③40 mL 0.03 mol·L-1盐酸
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1AgNO3溶液
A.①②③④⑤ B.④①③②⑤ C.⑤④②①③ D.④③⑤②①
7.下列实验能达到实验目的的是
制取并收集纯净干燥的氨气 蒸发溶液制得 证明氯化银溶解度大于硫化银 比较S、C、Si的非金属性
A B C D
A.A B.B C.C D.D
8.根据下表实验操作和现象所得出的结论错误的是
选项 实验操作和现象 结论
A 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 Ksp(AgCl)>Ksp(AgI)
B 向浓度均为0.1 mol/L的AlCl3、FeCl3的混合溶液中滴入几滴0.1 mol/L NaOH溶液,先生成红褐色沉淀 Ksp[Al(OH)3]>Ksp[Fe(OH)3]
C 向浓度均为0.1 mol/L的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,产生黑色沉淀(Ag2S) Ksp(Ag2S)
A.A B.B C.C D.D
9.下列对沉淀溶解平衡的描述正确的是( )
A.沉淀达到溶解平衡时,溶液中溶质离子浓度一定相等,且保持不变
B.升高温度,沉淀溶解平衡一定向溶解方向移动
C.室温下,AgCl在水中的溶解度大于在食盐水中的溶解度
D.向Na2SO4溶液中加入过量的BaCl2溶液,则SO沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含SO
10.下列有关说法正确的是
A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(NH)减小
B.相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强
C.向氨水中不断通入CO2,c(OH-)/c(NH3·H2O)不断增大
D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4)
11.下列实验操作、现象与结论均正确的是
选项 操作 现象 结论
A 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 溶液颜色变浅 FeCl3+2KSCNFe(SCN)3+3KCl平衡向逆反应方向移动
B 浓度均为0.10mol/L的Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 产生黑色沉淀 Ksp(Ag2S)>Ksp(Ag2CO3)
C 向装有X溶液的试管中滴入NaOH溶液,将干燥的红色石蒸试纸置于试管口 无明显现象 X溶液中无NH
D 常温下,向浓度、体积都相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 变红,前者红色更深 结合质子的能力:CO>HCO
A.A B.B C.C D.D
12.常温下,在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
A.溶液从a点变化到b点,保持不变
B.在饱和溶液中加入固体,可使溶液由b点变化到d点
C.常温下,e点的溶液蒸发溶剂后可变化到c点
D.常温下,
13.下列解释实验事实的方程式不正确的是
A.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) N2O4(g) ΔH>0
B.NH4Cl溶液显酸性:NH+2H2O NH3·H2O+H3O+
C.向Mg(OH)2悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2NH=Mg2++2NH3·H2O
D.用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓
14.下列说法错误的是
A.常温下,某溶液中,则该溶液中可能存在的离子有、、、
B.0.1的溶液中:
C.溶于稀硫酸,而不能溶于稀硫酸,说明
D.25℃,的、,的、,则反应能发生
15.某同学设计下述实验检验[Ag(NH3)2]Cl溶液中的Ag+,实验如表:
实验 试剂 现象
试管 滴管
2mL[Ag(NH3)2]Cl溶液 6滴0.1 mol L 1KCl溶液 I中无明显现象
6滴0.1 mol L 1KI溶液 II中产生黄色沉淀
6滴0.1 mol L 1HCl溶液 III中产生白色沉淀
6滴饱和KCl溶液 IV中产生白色沉淀
下列说法不正确的是
A.I中的c(Ag+)较小,不足以与Cl-沉淀
B.II中存在平衡:AgI(s)Ag+(aq)+I-(aq)
C.III说明NH3与H+的结合能力小于与Ag+的结合能力
D.配离子与其它离子能否反应,其本质是平衡移动的问题
二、填空题
16.工业制胆矾时,将粗制CuO粉末(含杂质FeO、Fe2O3)慢慢加入适量的稀H2SO4中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀。回答下列问题:
(1)为除去溶液中的Fe2+,可先加入_______,(从下面四个选项选择)将Fe2+氧化为Fe3+,反应的离子方程式为_______,然后加入适量的_______,(从下面四个选项选择)调整溶液的pH使Fe3+转化为Fe(OH)3沉淀。
A.CuO B.Cl2 C.Cu(OH)2 D.H2O2
(2)“再经过一些列操作可得纯净的胆矾晶体”,一系列操作是指_______、_______、_______。
(3)CuSO4 溶液显酸性的原因为_______(用离子方程式表示)。
(4)pH=6,CuSO4溶液中由水电离出的c(H+)是_______。
17.已知氢硫酸与碳酸的电离平衡常数分别为
H2S:
H2CO3:
请回答下列问题:
(1)室温下,0.1mol·L-1的硫化钠溶液和0.1mol·L-1的碳酸钠溶液,碱性更强的是_________________,其原因是______________________________________________;
(2)向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。用电离平衡原理解释上述现象:___________________________________________。
18.回答下列问题
(1)常温下,浓度均为0.1的五种钠盐溶液的如下表所示:
溶质
8.8 9.7 11.6 10.3 11.1
①上述几种钠盐的阴离子,结合氢离子能力最强的是____________(填离子符号)。
②根据表中数据判断,将浓度均为0.01的下列四种酸的溶液分别稀释至原体积的100倍,变化最大的是____________。
a. B. C. D.
(2)实验室中常用氢氧化钠溶液进行洗气和提纯。
已知:几种离子开始沉淀时溶液的如下表所示:
离子
7.6 5.2 10.1
,。
①用1501溶液吸收标准状况下的2.24L,所得溶液中各离子的浓度由大到小的顺序为____________。
②___________(填“>”“=”或“<”)。
③当向含有相同浓度的、、的溶液中滴加溶液时,_________(填离子符号)先沉淀。
④要使0.2溶液中沉淀完全,则应向溶液中加入溶液使溶液的不低于_________(保留1位小数)。
19.回答下列问题
(1)在化学分析中采用为指示剂,以标准溶液滴定溶液中的,利用与生成砖红色沉淀,指示到达滴定终点.当溶液中恰好完全沉淀(浓度等于)时,溶液中为_______________,此时溶液中等于_______________.[已知的分别为和]
(2)生成沉淀是利用反应,常温下,该反应平衡常数,的平衡常数,则_______________。
20.实验室测定水体中氯离子含量,实验过程如下:向水样中加入溶液作指示剂,用溶液滴定至终点。已知:为不溶于水的砖红色沉淀;常温下,。回答下列问题:
(1)滴定时,应使用___________(填“酸式”或“碱式”)滴定管。
(2)滴定达到终点的判断标志是___________。
(3)实验过程中测得数据如下表:
编号 1 2 3
(水样) 10.00 10.00 10.00
3.75 4.01 3.99
计算水样中氯离子的含量为___________(保留2位小数)。
(4)滴定结束后,溶液中的残余,则此时溶液中___________。
(5)下列情况会造成实验测定结果偏低的是___________。(填字母)
A.锥形瓶洗涤后未干燥
B.滴定前,未使用标准液润洗滴定管
C.滴定管滴定前仰视读数,滴定后俯视读数
D.滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡
【参考答案】
一、选择题
1.C
解析:A.已知Ksp[Mg(OH)2]=5.6×10-12,Mg(OH)2难溶于水,溶液中存在Mg(OH)2(s)Mg2+(aq)+2OH-(aq),故其饱和溶液中c(OH-)=2=2=2mol/L,此时pH>10,故能使酚酞变红,A错误;
B.气态的非金属单质分子不一定为非极性分子,如O3为极性分子,B错误;
C.由Cl2+H2OHCl+HClO、2HClO2HCl+O2↑可知,新制氯水放置一段时间后酸性增强,C正确;
D.白磷溶于煤油中,需贮存在冷水中,而金属钠用适量煤油贮存,D错误;
故答案为:C。
2.C
解析:A.Ag2CrO4存在沉淀溶解平衡:Ag2CrO4(s)2Ag+(aq)+(aq),据图可知,Ksp=c2(Ag+) c()=(10﹣3mol/L)2×10﹣5mol/L=1×10﹣11,故A错误;
B.b为溶解平衡点,b在d的上方,则d点为Ag2CrO4的不饱和溶液,没有Ag2CrO4沉淀生成,故B错误;
C.Ksp只与温度有关,a点温度与b点相同,所以Ksp相等,故C正确;
D.Ag2CrO4的沉淀溶解平衡为:Ag2CrO4(s)2Ag+(aq)+,加入AgNO3可使溶液中的c(Ag+)增大,平衡逆向移动,最终c(Ag+)增大、c()减小,所以不能由b点变成c点,故D错误;
答案选C。
3.D
解析:A.NaHCO3水解生成碳酸,离子方程式为HCO+H2OOH +H2CO3,A错误;
B.还原性:Fe2+C.NaOH溶液过量,铵根、碳酸氢根都能反应,离子方程式为NH+HCO+2OH NH3↑+H2O+ CO,C错误;
D.NH4Cl水解使溶液显酸性,加入Mg(OH)2悬浊液后使其沉淀溶解平衡正向移动,最终得到一水合氨和氯化镁,D正确;
综上所述答案为D。
4.C
解析:A.第一周期是从氢元素开始的,氢元素不是碱金属元素,选项A错误;
B.若加水稀释,则弱电解质电离平衡正向移动,电离程度增大,但离子浓度减小,溶液导电性减弱,选项B错误;
C.Ksp越大,但电解质的溶解度不一定越大,溶解度还取决于溶液的类型和浓度关系,以及物质的摩尔质量等因素,例如AgCl在水中和盐酸中的溶解度不同,但溶度积相同,选项C正确;
D.向平衡体系中加入反应物,若加入的反应物为固体或纯液体,则浓度不变,正反应速率不变,平衡不移动,选项D错误;
答案选C。
5.B
解析:A.医用酒精灭菌时,主要是破坏蛋白质形成蜷曲和螺旋的各种力,从而使蛋白质变性;而84消毒液的主要成分为次氯酸钠,次氯酸钠水解生成的次氯酸具有强氧化性,能与细菌发生氧化还原反应而杀死细菌,A错误;
B.硅橡胶具有无毒、无味、耐高温的性质,所以可以用作压力锅的密封圈,B正确;
C.垃圾宜分类投放,废纸、塑料均为可回收垃圾,废充电电池属于有害垃圾,C错误;
D.纳米Fe粉是和Pb2+、Cu2+、Hg2+发生置换反应从而治理污染,FeS是将Pb2+、Cu2+、Hg2+等重金属离子转化为比FeS更难溶的金属硫化物沉淀而治理污染,二者原理不同,D错误;
故答案为:B。
6.B
【分析】根据氯化银沉淀在溶液中的溶解平衡的移动进行判断溶解度的大小。同离子的浓度越大,对沉淀溶解平衡的抑制程度越大,相应沉淀的溶解度越小。
解析:氯化银的溶解平衡:根据此平衡的移动进行判断,①中氯离子的浓度为0.01 mol·L-1,②中氯离子浓度为0.04mol·L-1,③中氯离子浓度为0.03mol·L-1,⑤银离子的浓度为0.05 mol·L-1,根据氯离子或银离子的浓度越大对平衡的抑制程度越大,氯化银的溶解度越小,由此判断氯化银的溶解度由大到小顺序为:④①③②⑤。
故选答案B。
【点睛】注意对沉淀溶解平衡的影响的主要因素是同离子效应。
7.D
解析:A.氨气密度小于空气,收集氨气应用向下排空气法,A错误;
B.蒸发MnCl2溶液,Mn2+会水解为Mn(OH)2,B错误;
C.AgNO3过量,会生成两种沉淀,不能比较出硫化银和氯化银的溶解度,C错误;
D.此实验可说明酸性H2SO4>H2CO3>H2SiO3,故非金属性S>C>Si,D正确;
故选D。
8.A
解析:A.NaCl和NaI浓度未知,滴入少量稀AgNO3溶液,有黄色沉淀生成,可能是由于c(I-)大,所以不能证明Ksp(AgCl)>Ksp(AgI),故A错误;
B.Al3+、Fe3+浓度相同,滴入几滴NaOH溶液,先生成红褐色的Fe(OH)3沉淀,而且Al(OH)3和Fe(OH)3化学式形式相同,所以可以得出结论:Ksp[Al(OH)3]>Ksp[Fe(OH)3],故B正确;
C.、S2-浓度相同,滴入少量AgNO3溶液,产生黑色的Ag2S沉淀,且Ag2S和Ag2CO3化学式形式相同,所以可以得出结论:Ksp(Ag2S)
故选A。
9.C
解析:A.沉淀达到溶解平衡时,溶液中溶质离子浓度保持不变,不一定相等,例如Ca(OH)2达到溶解平衡,钙离子和氢氧根离子浓度不相等,故A错误;
B.有些物质升高温度,溶解度减小,沉淀溶解平衡向逆反应方向移动,例如氢氧化钙饱和溶液升高温度,沉淀溶解平衡向逆反应反向移动,故B错误;
C.室温下,食盐水中含有大量的氯离子,根据同离子效应,氯化银的电离平衡被破坏,平衡向左移动,溶液中银离子浓度减小,降低了氯化银的溶解度,故氯化银在水中的溶解度大于在食盐水中的溶解度,故C正确;
D.硫酸钡达到沉淀溶解平衡为动态平衡,溶液中还含有硫酸根离子,故D错误;
故选C。
10.B
解析:A.在氨水中加入少量的水稀释促进一水合氨电离,但c(NH)减小,加入氯化铵固体后,虽抑制一水合氨的电离,但溶液中的c(NH)增大,A错误;
B.相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HA更多,物质的量浓度更大,即HB的酸性比HA的酸性强,B正确;
C.向氨水中不断通入CO2,消耗氢氧根离子,促进电离平衡向正向移动,c(NH)不断增大,所以c(OH-)/c(NH3·H2O)=不断减小,C错误;
D.两种溶液的溶度积常数表达式不同,无法比较溶度积常数大小,所以根据先后沉淀无法确定溶度积常数,D错误;
故选B。
11.D
解析:A.KCl对铁离子与SCN-的平衡无影响,则溶液颜色不变,故A错误;
B.产生的黑色沉淀为Ag2S,说明Ag2S的溶度积更小,即Ksp (Ag2S)
D.由现象可知,Na2CO3溶液的碱性强,可知结合质子的能力:CO>HCO,故D正确;
故选D。
12.A
【分析】由图可知a~b~e在曲线上,代表钙离子和硫酸根离子在不同浓度下的饱和溶液,曲线下方离子浓度不足,为的不饱和溶液,反之曲线上方代表的悬浊液.
解析:A.沉淀的溶度积只随温度的变化而变化,所以溶液从a点变化到b点温度不变,保持不变,A正确;
B.在饱和溶液中加入固体,硫酸根离子浓度增大,会有沉淀析出,钙离子浓度降低,可使溶液由b点变化到e点,B错误;
C.常温下,e点的溶液蒸发溶剂,会有沉淀析出,使得钙离子和硫酸根离子浓度保持不变,C错误;
D.由b点可知,,D错误;
故选:A。
13.A
解析:A.根据实验现象,降低温度,化学平衡正反应方向移动,使c(NO2)降低,因此混合气体颜色变浅,所以正反应是放热反应,A错误;
B.NH4Cl是强酸弱碱盐,在溶液中NH4+发生水解作用,消耗水电离产生的OH-,使水的电离平衡正向移动,最终达到平衡时,溶液中c(H+)>c(OH-),水解存在平衡,水解方程式为:NH4++2H2ONH3·H2O+H3O+,B正确;
C.Mg(OH)2难溶于水,在溶液中存在沉淀溶解平衡,Mg(OH)2电离出的OH-与氯化铵电离出的NH4+反应生成氨水,氢氧化镁溶解,离子方程式为Mg(OH)2+2NH4+=Mg2++2NH3·H2O,C正确;
D.用Na2S去除废水中的Hg2+:二者反应产生黑色沉淀,离子方程式为Hg2++S2-= ↓,D正确;
故选A。
14.D
解析:A.由可知,,故存在促进水电离的离子,能促进水的电离使溶液呈碱性,且与其他三种离子可以大量共存,A正确;
B.由质子守恒得,B正确;
C.与在水溶液中都存在沉淀溶解平衡,电离出的与结合生成,能破坏的沉淀溶解平衡,但不能破坏的沉淀溶解平衡,说明,C正确;
D.根据电离常数的大小可以判断酸性强弱:,则题给反应应生成、,或、、或、,D错误;
答案选D。
15.C
解析:A.根据I和IV得到I中没有沉淀产生,说明I中的c(Ag+)较小,不足以与Cl-沉淀,故A正确;
B.II中产生黄色沉淀即生成AgI沉淀,AgI沉淀存在溶解平衡即:AgI(s)Ag+(aq)+I-(aq),故B正确;
C.根据I和III的现象,产生的沉淀说明[Ag(NH3)2]Cl和氢离子反应,有大量银离子生成,银离子和氯离子反应生成AgCl沉淀,说明III中NH3与H+的结合能力大于与Ag+的结合能力,故C错误;
D.根据I和II的现象,可以得出配离子与其它离子能否反应,其本质是平衡移动的问题,故D正确。
这是啥,答案为C。
二、填空题
16.(1) D 2Fe2++H2O2+2H+=2Fe3++2H2O AC
(2) 蒸发浓缩 冷却结晶 过滤、洗涤、干燥
(3)Cu2++2H2OCu(OH)2+2H+
(4)1×10-6mol·L-1
解析:(1)pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀,若直接将Fe2+转化为沉淀,则Cu2+也被沉淀,结合pH接近4时,Fe3+以Fe(OH)3的形式完全沉淀可知应先将Fe2+氧化为Fe3+后在转化为沉淀除去,过氧化氢作氧化剂时还原产物为H2O,不引入新的杂质离子,因此先加H2O2将Fe2+氧化为Fe3+;反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;然后再消耗H+将pH调大使铁离子转化为Fe(OH)3,为不引入新的杂质离子,试剂选用CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等,选AC;
(2)硫酸铜溶液获得胆矾晶体的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(3)CuSO4溶液显酸性的原因是铜离子发生水解,反应的离子方程式为Cu2++2H2OCu(OH)2+2H+;
(4)CuSO4溶液中,水解时,部分铜离子结合水电离的氢氧根离子,氢离子全部来自水的电离,pH=6,c(H+)=10-6mol/L,由水电离出的c(H+)是1×10-6mol·L-1。
17. 硫化钠溶液 氢硫酸的K2小于碳酸的K2;硫化钠的水解程度更高,碱性更强 饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀生成。加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成
解析:(1)酸越弱,相应的盐越容易水解,溶液的碱性就越强。根据电离平衡常数可知,氢硫酸的K2小于碳酸的K2;硫化钠的水解程度更高,碱性更强;(2)饱和H2S溶液中电离产生的S2-浓度很低,因此没有沉淀生成。加入氨水后,促进H2S的电离,S2-浓度增大,有沉淀生成,故向ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加—定量的氨水后,生成ZnS沉淀。
18.(1) C
(2) < 6.7
解析:(1)①上述几种钠盐的阴离子,pH越大,说明阴离子水解能力越强,结合氢离子能力越强,所以选;
②加水稀释促进弱酸电离,相同浓度的不同酸稀释相同的倍数,酸的酸性越强,酸的pH变化越大,酸性最强的酸是,则pH变化最大的是,故选C;
(2)①150mL 1molL-1的NaOH的物质的量为0.15mol,标准状况下2.24LCO2的物质的量为0.1mol,二者反应所得溶液为等浓度的碳酸钠和碳酸氢钠的混合液,碳酸根的水解程度大于碳酸氢根的水解程度,则溶液中离子浓度大小关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
②开始沉淀的pH是7.6,即c(OH-)=10-6.4,开始沉淀的pH是10.1,c(OH-)=10-3.9,则<;
③pH小的离子先沉淀,溶度积常数小的物质越先沉淀,所以铜离子先沉淀。
④要使0.2溶液中沉淀完全,当铜离子完全沉淀时铜离子浓度为1×10-5mol/L,则氢氧根离子浓度为mol/L,pOH=8-lg=8-0.7,则pH=14-pOH=6.7。
19.(1)
(2)
解析:(1)根据,可计算出当溶液中恰好完全沉淀时,溶液中,然后再根据,又可计算出此时溶液中。
(2)由题给方程式可知,平衡常数,则。
20.(1)酸式
(2)滴加最后一滴溶液时,生成砖红色沉淀,且半分钟不变色
(3)14.20
(4)
(5)CD
解析:(1)用0.0010mol·L-1AgNO3溶液做滴定液, AgNO3为强酸弱碱盐,水解使溶液呈酸性,必须盛放于酸式滴定管中;
(2)当Cl-恰好沉淀完全时,再滴加一滴硝酸银溶液,Ag+与生成Ag2CrO4砖红色沉淀,且30s内不变色;
(3)第1组硝酸银溶液体积的数据与第2组和第3组相比,误差较大,舍去第1组数据,用第2组和第3组数据的平均值计算。消耗的硝酸银溶液的体积的平均值为,,,水样中氯离子的含量为;
(4)当溶液中的残余c(Cl-)=1.8x10-5mol/L时,根据,则
,又依据,则解得;
(5)A.锥形瓶洗涤后不干燥对待测液物质的量无影响,对滴定结果结果无影响,A不符题意;
B.滴定前,未使用标准液润洗滴定管,标准液浓度变小,所消耗标准液体积偏大,结果偏大,B不符题意;
C.酸式滴定管滴定前仰视读数,滴定后俯视读数,导致读数偏小,结果偏低,C符合题意;
D.酸式滴定管滴定前尖嘴部分充满溶液,滴定结束时滴定管尖嘴有气泡,有部分液体未放出,所耗标准液体积偏小,结果偏低,D符合题意;
选CD
