3.3 第4课时 四大平衡常数的综合应用 复习课件(共42张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 3.3 第4课时 四大平衡常数的综合应用 复习课件(共42张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 14:11:22 | ||
图片预览










文档简介
(共42张PPT)
第3章 第3节
第4课时 四大平衡常数的综合
应用
1.比较掌握溶液中四大平衡的特点,能用平衡观分析电解质在溶液中的变化
(重点)。
2.能用四大常数定量分析电解质在溶液中的变化,掌握四大常数的关系及简单
计算(重、难点)。
学习目标
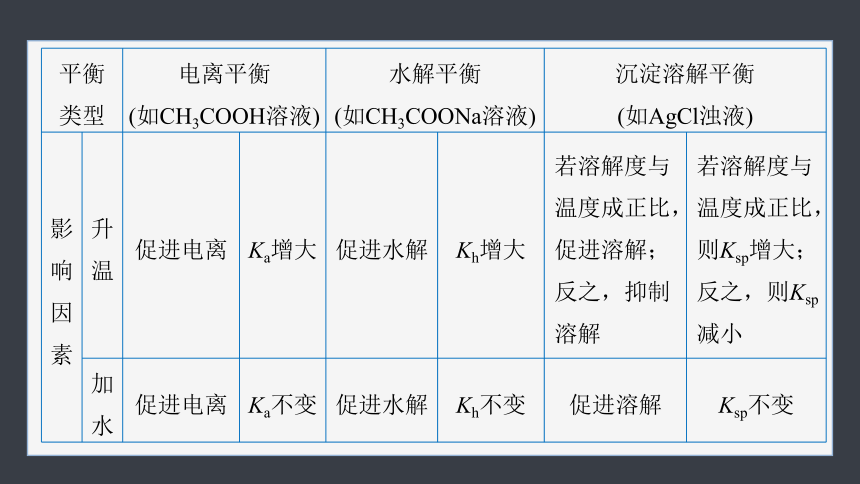
电离平衡、水解平衡、沉淀溶解平衡的比较
一
平衡 类型 电离平衡 (如CH3COOH溶液) 水解平衡 (如CH3COONa溶液) 沉淀溶解平衡 (如AgCl浊液)
影响因素 升温 促进电离 Ka增大 促进水解 Kh增大 若溶解度与温度成正比,促进溶解;反之,抑制溶解 若溶解度与温度成正比,则Ksp增大;反之,则Ksp减小
加水 促进电离 Ka不变 促进水解 Kh不变 促进溶解 Ksp不变
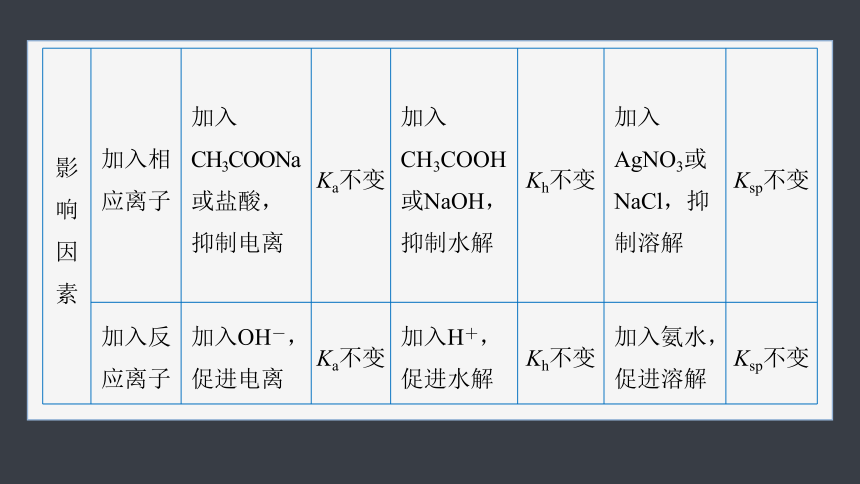
影响因素 加入相 应离子 加入CH3COONa或盐酸,抑制电离 Ka不变 加入CH3COOH或NaOH,抑制水解 Kh不变 加入AgNO3或NaCl,抑制溶解 Ksp不变
加入反 应离子 加入OH-,促进电离 Ka不变 加入H+,促进水解 Kh不变 加入氨水,促进溶解 Ksp不变
1.室温下,下列说法正确的是
对点训练
B.等物质的量浓度的HCOONa和NaF溶液,前者pH较大,则可发生反
应:HCOOH+NaF===HF+HCOONa
C.pH=9的CH3COONa溶液与pH=5的CH3COOH溶液,水的电离程度
相同
D.等浓度、等体积的NaOH溶液和二元弱酸H2A溶液混合后溶液呈酸性,
则混合液中:c(HA-)>c(A2-)>c(H2A)
√
等物质的量浓度的HCOONa和NaF溶液,前者pH较大,说明HCOO-的水解程度大于F-,酸性:HF>HCOOH,则反应HCOOH+NaF===HF+HCOONa不能发生,违背了强酸制弱酸的原理,B错误;
pH=9的CH3COONa溶液由水电离产生的氢离子浓度为10-5 mol·L-1,pH=5的CH3COOH溶液由水电离产生的氢离子浓度为10-9 mol·L-1,二者水的电离程度不相同,C错误;
两溶液混合后,溶液中的溶质为NaHA,溶液呈酸性,说明HA-的电离程度大于其水解程度,则混合液中:c(HA-)>c(A2-)>c(H2A),D正确。
2.(2022·淮安市期中)室温下,通过下列实验探究Na2SO3溶液的性质。
对点训练
实验 实验操作和现象
1 用pH试纸测定某Na2SO3溶液的pH,测得pH约为9
2 向Na2SO3溶液中滴加酸性KMnO4溶液,溶液紫红色褪去
3 将浓度均为0.01 mol·L-1的Na2SO3和Ba(OH)2溶液等体积混合,产生白色沉淀
4 向Na2SO3溶液中滴加稀盐酸,产生有刺激性气味的气体
下列有关说法正确的是
B.实验2说明Na2SO3溶液具有漂白性
C.依据实验3的现象得出Ksp(BaSO3)<2.5×10-5 mol2·L-2
D.实验4中生成的有刺激性气味的气体可能为Cl2
√
向亚硫酸钠溶液中滴加酸性高锰酸钾溶液,因发生氧化还原反应而使酸性高锰酸钾溶液褪色,说明亚硫酸钠溶液具有还原性,故B错误;
向亚硫酸钠溶液中加入稀盐酸有气泡产生,发生复分解反应生成二氧化硫气体,D错误。
已知:Ksp[Mg(OH)2]=5.6×10-12 mol3·L-3,Ksp(BaSO4)=1.1×10-10 mol2·
L-2,Ksp(BaCO3)=2.6×10-9 mol2·L-2。
对点训练
下列说法不正确的是
A.常温时,调节溶液的pH>12,可使滤液中c(Mg2+)<1×10-5mol·L-1
D.若步骤①加入BaCl2溶液后进行过滤,可以避免白色沉淀M的生成
√
流程中加入过量饱和碳酸钠溶液会将部分硫酸钡转化为碳酸钡沉淀,同时生成硫酸根离子,故步骤①加入BaCl2溶液后进行过滤,可以避免白色沉淀M的生成,D正确。
返回
四大常数的区别与联系
二
平衡常数 符号 适用体系 影响因素 表达式
水的离子 积常数 Kw 稀的电解质溶液及纯水 温度升高,Kw增大 Kw=c平(OH-)·c平(H+)
电离常数 酸Ka 弱酸溶液 升温,K 增大
碱Kb 弱碱溶液
1.四大平衡常数的比较
盐的水 解常数 Kh 某些 盐溶液 升温,Kh 增大
溶度积 常数 Ksp 难溶电解质溶液 升温,大多数Ksp增大
2.水溶液中几个平衡常数及它们之间的关系
(1)平衡常数都只与温度有关,温度不变,平衡常数不变。升高温度,Ka、Kb、Kw、Kh均增大。
(3)对二元酸的Ka1、Ka2与相应酸根离子的Kh1、Kh2的关系式为Ka1·Kh2=Kw,Ka2·Kh1=Kw。
1.Ka、Kw、Kh、Ksp分别表示电离常数、水的离子积常数、水解常数、溶度积常数,下列判断不正确的是
A.室温下Ka(HClO)的大
对点训练
C.已知25 ℃时,AgCl和砖红色沉淀Ag2CrO4的Ksp分别为1.8×10-10 mol2·
L-2和2.0×10-12 mol3·L-3,则用AgNO3标准溶液滴定Cl-时,可采
用K2CrO4作指示剂
D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大
√
室温下Ka(HClO)某温度下,一元弱酸HA的Ka越小,则A-和H+结合就越容易,则NaA越易水解,Kh越大,D正确。
2.25 ℃时,已知H2SO3的电离常数为Ka1=1.4×10-2 mol·L-1,Ka2=6.0×10-8 mol·L-1;H2CO3的电离常数为Ka1=4.5×10-7 mol·L-1,Ka2=4.7×10-11 mol·L-1,回答下列问题:
(1)可用Na2CO3溶液吸收CO2制备NaHCO3,该反应的离子方程式是_________________________, 水解常数为________________(结果保留2位有效数字,下同)。
对点训练
2.2×10-8 mol·L-1
对点训练
1.7×10-7 mol·L-1
3.沉淀转化需要满足一定条件。25 ℃时,几种难溶盐的溶度积常数(单位省略)如表:
对点训练
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
回答下列问题:
(1)一般来说,相同类型的难溶电解质相互转化时,溶度积小的沉淀转化为溶度积____的沉淀容易实现。向AgCl悬浊液中加入0.1 mol·L-1的KI溶液,充分振荡,可以观察到的现象是_____________。
更小
沉淀变为黄色
由表格可知AgI比AgCl的溶度积更小,所以白色的AgCl沉淀可以转化为黄色的AgI沉淀。
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
(2)AgBr转化为AgI的离子方程式为______________________________,此反应的平衡常数为_________(结果保留3位有效数字,下同)。
对点训练
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
AgBr(s)+I-(aq)===AgI(s)+Br-(aq)
6.29×103
(3)不同类型的难溶电解质,沉淀转化需要具体分析。25 ℃时,Ag2CrO4(s)+2Cl-(aq)===2AgCl(s)+ (aq)的平衡常数K=_______
___________,由此可见,溶度积小的Ag2CrO4也可以转化为溶度积较大的AgCl。
对点训练
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
6.39×
107 mol-1·L
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
1
2
3
自我测试
1.下列溶液或浊液中,关于离子浓度的说法正确的是
C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1的NaOH溶液等体积
混合后:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
D.常温下,Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=2.0×10-12 mol3·
L-3,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
√
4
1
2
3
自我测试
4
1
2
3
自我测试
0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1的NaOH溶液等体积混合后醋酸过量,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)和物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+)可知,溶液中c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),C正确;
4
1
2
3
自我测试
2.已知pH=6的含磷废水中的磷以磷酸及其盐的形式存在。某温度下,磷酸的pKa与溶液的pH的关系如图,下列叙述不正确的是
D.向废水中加入CaCl2生成Ca5(PO4)3OH沉淀除磷后,溶液pH将增大
√
4
1
2
3
自我测试
4
1
2
3
自我测试
4
1
2
3
自我测试
3.如图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
(1)当pH=8时,含硫废水中最主要的含硫微粒为_____。
HS-
4
1
2
3
自我测试
随着溶液碱性逐渐增强,H2S的电离程度越来越大,图中从左至右对应曲线中,逐渐减小的为H2S,先增大后减小的为HS-,最右侧逐渐增大的为S2-,当pH=8时,含硫废水中最主要的含硫微粒为HS-。
4
1
2
3
自我测试
(2)NaHS溶液呈_____(填“酸性”“碱性”或“中性”),NaHS水解的离子方程式为_______________________。
碱性
HS-+H2O H2S+OH-
4
1
2
3
自我测试
(3)由图判断,NaHS在常温下发生水解的平衡常数Kh=_____________。
10-7.1 mol·L-1
4
1
2
3
自我测试
由图可知当pH=6.9时,H2S和HS-在水溶液中的物质的量分数相同,
4
1
2
3
自我测试
10
4
返回
第3章 第3节
第4课时 四大平衡常数的综合
应用
1.比较掌握溶液中四大平衡的特点,能用平衡观分析电解质在溶液中的变化
(重点)。
2.能用四大常数定量分析电解质在溶液中的变化,掌握四大常数的关系及简单
计算(重、难点)。
学习目标
电离平衡、水解平衡、沉淀溶解平衡的比较
一
平衡 类型 电离平衡 (如CH3COOH溶液) 水解平衡 (如CH3COONa溶液) 沉淀溶解平衡 (如AgCl浊液)
影响因素 升温 促进电离 Ka增大 促进水解 Kh增大 若溶解度与温度成正比,促进溶解;反之,抑制溶解 若溶解度与温度成正比,则Ksp增大;反之,则Ksp减小
加水 促进电离 Ka不变 促进水解 Kh不变 促进溶解 Ksp不变
影响因素 加入相 应离子 加入CH3COONa或盐酸,抑制电离 Ka不变 加入CH3COOH或NaOH,抑制水解 Kh不变 加入AgNO3或NaCl,抑制溶解 Ksp不变
加入反 应离子 加入OH-,促进电离 Ka不变 加入H+,促进水解 Kh不变 加入氨水,促进溶解 Ksp不变
1.室温下,下列说法正确的是
对点训练
B.等物质的量浓度的HCOONa和NaF溶液,前者pH较大,则可发生反
应:HCOOH+NaF===HF+HCOONa
C.pH=9的CH3COONa溶液与pH=5的CH3COOH溶液,水的电离程度
相同
D.等浓度、等体积的NaOH溶液和二元弱酸H2A溶液混合后溶液呈酸性,
则混合液中:c(HA-)>c(A2-)>c(H2A)
√
等物质的量浓度的HCOONa和NaF溶液,前者pH较大,说明HCOO-的水解程度大于F-,酸性:HF>HCOOH,则反应HCOOH+NaF===HF+HCOONa不能发生,违背了强酸制弱酸的原理,B错误;
pH=9的CH3COONa溶液由水电离产生的氢离子浓度为10-5 mol·L-1,pH=5的CH3COOH溶液由水电离产生的氢离子浓度为10-9 mol·L-1,二者水的电离程度不相同,C错误;
两溶液混合后,溶液中的溶质为NaHA,溶液呈酸性,说明HA-的电离程度大于其水解程度,则混合液中:c(HA-)>c(A2-)>c(H2A),D正确。
2.(2022·淮安市期中)室温下,通过下列实验探究Na2SO3溶液的性质。
对点训练
实验 实验操作和现象
1 用pH试纸测定某Na2SO3溶液的pH,测得pH约为9
2 向Na2SO3溶液中滴加酸性KMnO4溶液,溶液紫红色褪去
3 将浓度均为0.01 mol·L-1的Na2SO3和Ba(OH)2溶液等体积混合,产生白色沉淀
4 向Na2SO3溶液中滴加稀盐酸,产生有刺激性气味的气体
下列有关说法正确的是
B.实验2说明Na2SO3溶液具有漂白性
C.依据实验3的现象得出Ksp(BaSO3)<2.5×10-5 mol2·L-2
D.实验4中生成的有刺激性气味的气体可能为Cl2
√
向亚硫酸钠溶液中滴加酸性高锰酸钾溶液,因发生氧化还原反应而使酸性高锰酸钾溶液褪色,说明亚硫酸钠溶液具有还原性,故B错误;
向亚硫酸钠溶液中加入稀盐酸有气泡产生,发生复分解反应生成二氧化硫气体,D错误。
已知:Ksp[Mg(OH)2]=5.6×10-12 mol3·L-3,Ksp(BaSO4)=1.1×10-10 mol2·
L-2,Ksp(BaCO3)=2.6×10-9 mol2·L-2。
对点训练
下列说法不正确的是
A.常温时,调节溶液的pH>12,可使滤液中c(Mg2+)<1×10-5mol·L-1
D.若步骤①加入BaCl2溶液后进行过滤,可以避免白色沉淀M的生成
√
流程中加入过量饱和碳酸钠溶液会将部分硫酸钡转化为碳酸钡沉淀,同时生成硫酸根离子,故步骤①加入BaCl2溶液后进行过滤,可以避免白色沉淀M的生成,D正确。
返回
四大常数的区别与联系
二
平衡常数 符号 适用体系 影响因素 表达式
水的离子 积常数 Kw 稀的电解质溶液及纯水 温度升高,Kw增大 Kw=c平(OH-)·c平(H+)
电离常数 酸Ka 弱酸溶液 升温,K 增大
碱Kb 弱碱溶液
1.四大平衡常数的比较
盐的水 解常数 Kh 某些 盐溶液 升温,Kh 增大
溶度积 常数 Ksp 难溶电解质溶液 升温,大多数Ksp增大
2.水溶液中几个平衡常数及它们之间的关系
(1)平衡常数都只与温度有关,温度不变,平衡常数不变。升高温度,Ka、Kb、Kw、Kh均增大。
(3)对二元酸的Ka1、Ka2与相应酸根离子的Kh1、Kh2的关系式为Ka1·Kh2=Kw,Ka2·Kh1=Kw。
1.Ka、Kw、Kh、Ksp分别表示电离常数、水的离子积常数、水解常数、溶度积常数,下列判断不正确的是
A.室温下Ka(HClO)
对点训练
C.已知25 ℃时,AgCl和砖红色沉淀Ag2CrO4的Ksp分别为1.8×10-10 mol2·
L-2和2.0×10-12 mol3·L-3,则用AgNO3标准溶液滴定Cl-时,可采
用K2CrO4作指示剂
D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh越大
√
室温下Ka(HClO)
2.25 ℃时,已知H2SO3的电离常数为Ka1=1.4×10-2 mol·L-1,Ka2=6.0×10-8 mol·L-1;H2CO3的电离常数为Ka1=4.5×10-7 mol·L-1,Ka2=4.7×10-11 mol·L-1,回答下列问题:
(1)可用Na2CO3溶液吸收CO2制备NaHCO3,该反应的离子方程式是_________________________, 水解常数为________________(结果保留2位有效数字,下同)。
对点训练
2.2×10-8 mol·L-1
对点训练
1.7×10-7 mol·L-1
3.沉淀转化需要满足一定条件。25 ℃时,几种难溶盐的溶度积常数(单位省略)如表:
对点训练
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
回答下列问题:
(1)一般来说,相同类型的难溶电解质相互转化时,溶度积小的沉淀转化为溶度积____的沉淀容易实现。向AgCl悬浊液中加入0.1 mol·L-1的KI溶液,充分振荡,可以观察到的现象是_____________。
更小
沉淀变为黄色
由表格可知AgI比AgCl的溶度积更小,所以白色的AgCl沉淀可以转化为黄色的AgI沉淀。
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
(2)AgBr转化为AgI的离子方程式为______________________________,此反应的平衡常数为_________(结果保留3位有效数字,下同)。
对点训练
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
AgBr(s)+I-(aq)===AgI(s)+Br-(aq)
6.29×103
(3)不同类型的难溶电解质,沉淀转化需要具体分析。25 ℃时,Ag2CrO4(s)+2Cl-(aq)===2AgCl(s)+ (aq)的平衡常数K=_______
___________,由此可见,溶度积小的Ag2CrO4也可以转化为溶度积较大的AgCl。
对点训练
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
6.39×
107 mol-1·L
难溶盐 AgCl AgBr AgI Ag2CrO4
Ksp 1.77×10-10 5.35×10-13 8.51×10-17 2.0×10-12
1
2
3
自我测试
1.下列溶液或浊液中,关于离子浓度的说法正确的是
C.0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1的NaOH溶液等体积
混合后:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+)
D.常温下,Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=2.0×10-12 mol3·
L-3,则Ag2CrO4悬浊液中的c(Ag+)一定小于AgCl悬浊液中的c(Ag+)
√
4
1
2
3
自我测试
4
1
2
3
自我测试
0.2 mol·L-1的醋酸(CH3COOH)溶液与0.1 mol·L-1的NaOH溶液等体积混合后醋酸过量,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+)和物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+)可知,溶液中c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),C正确;
4
1
2
3
自我测试
2.已知pH=6的含磷废水中的磷以磷酸及其盐的形式存在。某温度下,磷酸的pKa与溶液的pH的关系如图,下列叙述不正确的是
D.向废水中加入CaCl2生成Ca5(PO4)3OH沉淀除磷后,溶液pH将增大
√
4
1
2
3
自我测试
4
1
2
3
自我测试
4
1
2
3
自我测试
3.如图为常温下H2S、HS-、S2-在水溶液中的物质的量分数随pH变化的分布曲线,回答下列问题:
(1)当pH=8时,含硫废水中最主要的含硫微粒为_____。
HS-
4
1
2
3
自我测试
随着溶液碱性逐渐增强,H2S的电离程度越来越大,图中从左至右对应曲线中,逐渐减小的为H2S,先增大后减小的为HS-,最右侧逐渐增大的为S2-,当pH=8时,含硫废水中最主要的含硫微粒为HS-。
4
1
2
3
自我测试
(2)NaHS溶液呈_____(填“酸性”“碱性”或“中性”),NaHS水解的离子方程式为_______________________。
碱性
HS-+H2O H2S+OH-
4
1
2
3
自我测试
(3)由图判断,NaHS在常温下发生水解的平衡常数Kh=_____________。
10-7.1 mol·L-1
4
1
2
3
自我测试
由图可知当pH=6.9时,H2S和HS-在水溶液中的物质的量分数相同,
4
1
2
3
自我测试
10
4
返回
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
