第3章 第1、2节 第2课时 水溶液中的常考图像题 复习课件(共41张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 第1、2节 第2课时 水溶液中的常考图像题 复习课件(共41张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 14:13:00 | ||
图片预览











文档简介
(共41张PPT)
第2课时 水溶液中的常考图像题
第3章 第1、2节 复习课
1.了解水溶液中常考的曲线形式,掌握特殊点法分析曲线的思维模式。
2.能用守恒思想、平衡观念分析酸碱的用量与溶液中微粒存在形式及浓度的关
系(重、难点)。
学习目标
弱酸(碱)稀释过程中pH变化曲线
一
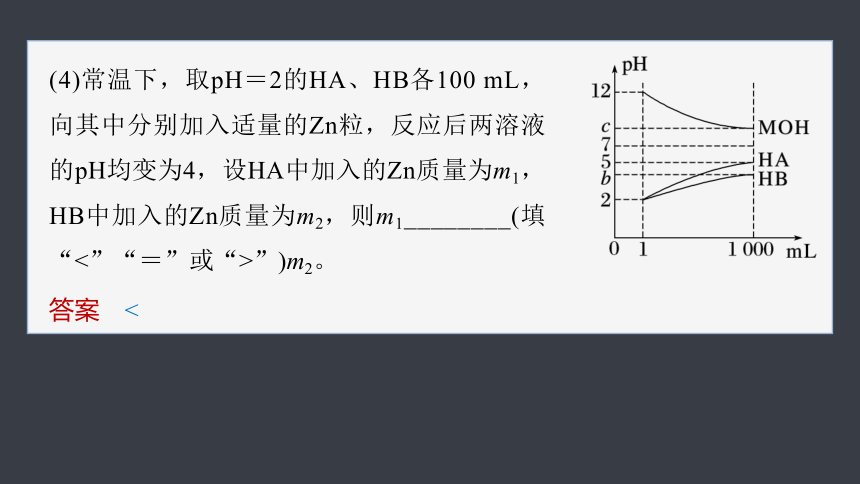
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,常温下分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
例1
(1)HA为________(填“强”或“弱”,下同)酸,HB为________酸。
答案 强 弱
将pH=2的酸溶液稀释1 000倍,强酸溶液稀释后溶液pH为5,弱酸溶液稀释过程中促进弱酸电离,稀释后溶液pH小于5,由图可知,HA是强酸、HB是弱酸。
(2)若c=9,则将pH=2的HB与pH=12的MOH等体积混合后,溶液呈______(填“酸”“碱”或“中”)性。
答案 酸
将pH=12的碱溶液稀释1 000倍,强碱溶液稀释后溶液pH为9,若c=9,则MOH是强碱,将pH=2的弱酸HB与pH=12的强碱MOH等体积混合时,弱酸HB溶液过量,溶液呈酸性。
(3)若c=9,常温下稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为______(用酸、碱化学式表示)。
答案 MOH=HA>HB
由图可知,稀释后的溶液中,HB溶液中氢离子浓度大于HA溶液中氢离子浓度,HA溶液中氢离子浓度等于MOH溶液中氢氧根离子浓度,则对水的电离抑制程度为MOH=HAHB。
(4)常温下,取pH=2的HA、HB各100 mL,向其中分别加入适量的Zn粒,反应后两溶液的pH均变为4,设HA中加入的Zn质量为m1,HB中加入的Zn质量为m2,则m1________(填“<”“=”或“>”)m2。
答案 <
1.(2019·天津,5)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
对点训练
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
√
根据HNO2和CH3COOH的电离常数,可知酸性:HNO2>CH3COOH。相同pH的两种酸溶液,稀释相同倍数时,弱酸的pH变化较小,故曲线Ⅰ代表CH3COOH溶液,A项错误;
两种酸溶液中水的电离受到抑制,b点溶液pH小于c点溶液pH,则b点对应酸电离出的c(H+)大,对水的电离抑制程度大,故水的电离程度:b点相同体积a点的两溶液中,由于c(CH3COOH)>
c(HNO2),故n(CH3COOH)>n(HNO2),因此与NaOH恰好中和后,溶液中n(Na+)不同,D项错误。
2.常温下,两种一元碱MOH和ROH的溶液分别
加水稀释,溶液pH的变化如图所示,下列叙述
不正确的是
A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的
10倍
√
对点训练
A项,由图像可知稀释相同倍数,MOH的pH变化小,故MOH为弱碱;
B项,在x点时MOH和ROH溶液中c(OH-)相等,故c(M+)=c(R+);
C项,MOH为弱碱,ROH为强碱,则稀释前c(ROH)<10c(MOH);
D项,稀释前MOH溶液中由水电离出的c(OH-)=10-12 mol·L-1,ROH溶液中由水电离出的c(OH-)=10-13 mol·L-1,故前者是后者的10倍。
返回
酸碱中和反应过程中pH变化曲线
二
常温下,以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 HA溶液为例,其滴定曲线如图。
例2
关键点 粒子浓度关系
起点(点①) 起点为HA的单一溶液,0.100 0 mol·L-1 HA的pH>1,说明是弱酸,c(HA)>c(H+)>c(A-)>c(OH-)
反应一半点 (点②) 两者反应生成等物质的量的HA和NaA混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
中性点(点③) 此时溶液pH=7,溶液呈中性,酸没有完全反应,c(A-)=c(Na+)>c(HA)>c(H+)=c(OH-)
恰好完全反应点(点④) 此时两者恰好完全反应生成NaA,为强碱弱酸盐,溶液呈碱性,c(Na+)>c(A-)>c(OH-)>c(H+)
过量点 (点⑤) 此时NaOH过量或者远远过量,溶液显碱性,可能出现c(Na+)>c(A-)>c(OH-)>c(H+),也可能出现c(Na+)>c(OH-)>c(A-)>c(H+)
在上述过程中,点④代表的溶液中水的电离程度最大
常温下,用0.10 mol·L-1NaOH溶液分别滴定
20.00 mL浓度均为0.10 mol·L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)
对点训练
B.点③和点④所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
√
A项,点①的溶液中存在电荷守恒:c(OH-)+c(CN-)=c(Na+)+c(H+),且c(OH-)>c(H+),点②溶液中的电荷守恒为c(OH-)+c(CH3COO-)
=c(Na+)+c(H+),且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),
错误;
B项,点③溶液pH=7,则c(OH-)=c(H+),则点③溶液中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),错误;
C项,点①所示的溶液中存在物料守恒:c(HCN)+c(CN-)=2c(Na+),点②所示的溶液中存在物料守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),
即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),正确。
返回
分布系数曲线
三
1.认识分布系数(以CH3COOH为例)
CH3COOH H++CH3COO-,当体系处于平衡状态时,各种形式微粒的浓度即为平衡浓度,各种存在形式平衡浓度之和称为总浓度。某一存在形式的平衡浓度占总浓度的分数,即为该存在形式的分布系数,以δ表示。
2.一元弱酸的分布系数图(以CH3COOH为例)
当δ(CH3COOH)=δ(CH3COO-)时,即 ,Ka=
c平(H+)=10-4.76 mol·L-1(图像中交点)。
3.二元弱酸的分布系数图(以H2C2O4为例)
分布系数图像如下
(1)δ0为H2C2O4的分布系数,δ1为 的分布系数,δ2为 的分布系数。
下列叙述错误的是
A.pH=1.2时,c(H2A)=c(HA-)
B.lg [K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
√
对点训练
A项,根据图像,pH=1.2时,H2A和HA-相交,则有c(H2A)=c(HA-),正确;
C项,根据图像,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),正确;
D项,根据pH=4.2时,c(HA-)=c(A2-),且c(HA-)+c(A2-)约为0.1 mol·L-1,而c(H+)=10-4.2 mol·L-1,可知c(HA-)=c(A2-)>c(H+),错误。
返回
对数曲线及应用
四
2.解题策略
(1)先确定图像的类型是对数图像还是负对数图像。
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
(3)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
(5)将图像中数据或曲线的变化与所学知识对接,得出题目的正确答案。
1.常温下,将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
对点训练
(1)该温度下,己二酸(H2X)的两级电离常数的数量级:Ka1为______,Ka2为_____。
10-5
10-6
(3)HX-的电离程度_____(填“大于”“小于”或“等于”)X2-的水解程度,其理由是_____________________________________。
N
大于
当HX-和X2-浓度相等时,溶液pH小于7
(4)当反应进行到混合溶液呈中性时,溶液中各种离子的浓度由大到小的顺序是____________________________________。
c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
依据题图坐标(0,4.4)以及(0,5.4)标注分布系数图像中的特殊点画出分布系数图:
依据图像解题:
点(0,4.4)在曲线N上,对应Ka1=10-4.4 mol·L-1,数量级为10-5,点(0,5.4)在曲线M上,对应Ka2=10-5.4 mol·L-1,数量级为10-6;溶液呈中性时,pH=7,在C点右侧,此时c(X2-)>c(HX-),c(Na+)最大。
下列说法正确的是
A.常温下,CH3COOH的电离常数为10-4 mol·L-1
B.当溶液的pH=7时,消耗NaOH溶液20.00 mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
√
对点训练
向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液20 mL,溶质为CH3COONa,为强碱弱酸盐,水解显碱性,此时溶液的pH>7,故B不符合题意;
CH3COONa溶液中,由于醋酸根离子水解,c(Na+)>c(CH3COO-),但水解较微弱,c(CH3COO-)>c(OH-),所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D符合题意。
返回
第2课时 水溶液中的常考图像题
第3章 第1、2节 复习课
1.了解水溶液中常考的曲线形式,掌握特殊点法分析曲线的思维模式。
2.能用守恒思想、平衡观念分析酸碱的用量与溶液中微粒存在形式及浓度的关
系(重、难点)。
学习目标
弱酸(碱)稀释过程中pH变化曲线
一
某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验:将pH=2的两种酸溶液HA、HB和pH=12的MOH碱溶液各1 mL,常温下分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
例1
(1)HA为________(填“强”或“弱”,下同)酸,HB为________酸。
答案 强 弱
将pH=2的酸溶液稀释1 000倍,强酸溶液稀释后溶液pH为5,弱酸溶液稀释过程中促进弱酸电离,稀释后溶液pH小于5,由图可知,HA是强酸、HB是弱酸。
(2)若c=9,则将pH=2的HB与pH=12的MOH等体积混合后,溶液呈______(填“酸”“碱”或“中”)性。
答案 酸
将pH=12的碱溶液稀释1 000倍,强碱溶液稀释后溶液pH为9,若c=9,则MOH是强碱,将pH=2的弱酸HB与pH=12的强碱MOH等体积混合时,弱酸HB溶液过量,溶液呈酸性。
(3)若c=9,常温下稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为______(用酸、碱化学式表示)。
答案 MOH=HA>HB
由图可知,稀释后的溶液中,HB溶液中氢离子浓度大于HA溶液中氢离子浓度,HA溶液中氢离子浓度等于MOH溶液中氢氧根离子浓度,则对水的电离抑制程度为MOH=HA
(4)常温下,取pH=2的HA、HB各100 mL,向其中分别加入适量的Zn粒,反应后两溶液的pH均变为4,设HA中加入的Zn质量为m1,HB中加入的Zn质量为m2,则m1________(填“<”“=”或“>”)m2。
答案 <
1.(2019·天津,5)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
A.曲线Ⅰ代表HNO2溶液
B.溶液中水的电离程度:b点>c点
对点训练
D.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
√
根据HNO2和CH3COOH的电离常数,可知酸性:HNO2>CH3COOH。相同pH的两种酸溶液,稀释相同倍数时,弱酸的pH变化较小,故曲线Ⅰ代表CH3COOH溶液,A项错误;
两种酸溶液中水的电离受到抑制,b点溶液pH小于c点溶液pH,则b点对应酸电离出的c(H+)大,对水的电离抑制程度大,故水的电离程度:b点
c(HNO2),故n(CH3COOH)>n(HNO2),因此与NaOH恰好中和后,溶液中n(Na+)不同,D项错误。
2.常温下,两种一元碱MOH和ROH的溶液分别
加水稀释,溶液pH的变化如图所示,下列叙述
不正确的是
A.MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)=10c(MOH)
D.稀释前MOH溶液和ROH溶液中由水电离出的c(OH-)前者是后者的
10倍
√
对点训练
A项,由图像可知稀释相同倍数,MOH的pH变化小,故MOH为弱碱;
B项,在x点时MOH和ROH溶液中c(OH-)相等,故c(M+)=c(R+);
C项,MOH为弱碱,ROH为强碱,则稀释前c(ROH)<10c(MOH);
D项,稀释前MOH溶液中由水电离出的c(OH-)=10-12 mol·L-1,ROH溶液中由水电离出的c(OH-)=10-13 mol·L-1,故前者是后者的10倍。
返回
酸碱中和反应过程中pH变化曲线
二
常温下,以0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 HA溶液为例,其滴定曲线如图。
例2
关键点 粒子浓度关系
起点(点①) 起点为HA的单一溶液,0.100 0 mol·L-1 HA的pH>1,说明是弱酸,c(HA)>c(H+)>c(A-)>c(OH-)
反应一半点 (点②) 两者反应生成等物质的量的HA和NaA混合液,此时溶液pH<7,说明HA的电离程度大于A-的水解程度,c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-)
中性点(点③) 此时溶液pH=7,溶液呈中性,酸没有完全反应,c(A-)=c(Na+)>c(HA)>c(H+)=c(OH-)
恰好完全反应点(点④) 此时两者恰好完全反应生成NaA,为强碱弱酸盐,溶液呈碱性,c(Na+)>c(A-)>c(OH-)>c(H+)
过量点 (点⑤) 此时NaOH过量或者远远过量,溶液显碱性,可能出现c(Na+)>c(A-)>c(OH-)>c(H+),也可能出现c(Na+)>c(OH-)>c(A-)>c(H+)
在上述过程中,点④代表的溶液中水的电离程度最大
常温下,用0.10 mol·L-1NaOH溶液分别滴定
20.00 mL浓度均为0.10 mol·L-1 CH3COOH溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
A.点①和点②所示溶液中:c(CH3COO-)<c(CN-)
对点训练
B.点③和点④所示溶液中:
c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D.点②和点③所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
√
A项,点①的溶液中存在电荷守恒:c(OH-)+c(CN-)=c(Na+)+c(H+),且c(OH-)>c(H+),点②溶液中的电荷守恒为c(OH-)+c(CH3COO-)
=c(Na+)+c(H+),且c(OH-)<c(H+),二者中钠离子浓度相同,所以c(CH3COO-)>c(CN-),
错误;
B项,点③溶液pH=7,则c(OH-)=c(H+),则点③溶液中c(Na+)=c(CH3COO-)>c(H+)=c(OH-),错误;
C项,点①所示的溶液中存在物料守恒:c(HCN)+c(CN-)=2c(Na+),点②所示的溶液中存在物料守恒:c(CH3COOH)+c(CH3COO-)=2c(Na+),二者中钠离子浓度相同,则c(HCN)+c(CN-)=c(CH3COOH)+c(CH3COO-),
即c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),正确。
返回
分布系数曲线
三
1.认识分布系数(以CH3COOH为例)
CH3COOH H++CH3COO-,当体系处于平衡状态时,各种形式微粒的浓度即为平衡浓度,各种存在形式平衡浓度之和称为总浓度。某一存在形式的平衡浓度占总浓度的分数,即为该存在形式的分布系数,以δ表示。
2.一元弱酸的分布系数图(以CH3COOH为例)
当δ(CH3COOH)=δ(CH3COO-)时,即 ,Ka=
c平(H+)=10-4.76 mol·L-1(图像中交点)。
3.二元弱酸的分布系数图(以H2C2O4为例)
分布系数图像如下
(1)δ0为H2C2O4的分布系数,δ1为 的分布系数,δ2为 的分布系数。
下列叙述错误的是
A.pH=1.2时,c(H2A)=c(HA-)
B.lg [K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
√
对点训练
A项,根据图像,pH=1.2时,H2A和HA-相交,则有c(H2A)=c(HA-),正确;
C项,根据图像,pH=2.7时,H2A和A2-相交,则有c(H2A)=c(A2-),正确;
D项,根据pH=4.2时,c(HA-)=c(A2-),且c(HA-)+c(A2-)约为0.1 mol·L-1,而c(H+)=10-4.2 mol·L-1,可知c(HA-)=c(A2-)>c(H+),错误。
返回
对数曲线及应用
四
2.解题策略
(1)先确定图像的类型是对数图像还是负对数图像。
(2)再弄清楚图像中横坐标和纵坐标的含义,是浓度对数还是比值对数。
(3)理清图像中曲线的变化趋势及含义,根据含义判断线上、线下的点所表示的意义。
(5)将图像中数据或曲线的变化与所学知识对接,得出题目的正确答案。
1.常温下,将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。
对点训练
(1)该温度下,己二酸(H2X)的两级电离常数的数量级:Ka1为______,Ka2为_____。
10-5
10-6
(3)HX-的电离程度_____(填“大于”“小于”或“等于”)X2-的水解程度,其理由是_____________________________________。
N
大于
当HX-和X2-浓度相等时,溶液pH小于7
(4)当反应进行到混合溶液呈中性时,溶液中各种离子的浓度由大到小的顺序是____________________________________。
c(Na+)>c(X2-)>c(HX-)>c(H+)=c(OH-)
依据题图坐标(0,4.4)以及(0,5.4)标注分布系数图像中的特殊点画出分布系数图:
依据图像解题:
点(0,4.4)在曲线N上,对应Ka1=10-4.4 mol·L-1,数量级为10-5,点(0,5.4)在曲线M上,对应Ka2=10-5.4 mol·L-1,数量级为10-6;溶液呈中性时,pH=7,在C点右侧,此时c(X2-)>c(HX-),c(Na+)最大。
下列说法正确的是
A.常温下,CH3COOH的电离常数为10-4 mol·L-1
B.当溶液的pH=7时,消耗NaOH溶液20.00 mL
C.溶液中水的电离程度大小:a>b>c
D.c点溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
√
对点训练
向20.00 mL 0.100 0 mol·L-1的CH3COOH溶液中滴加0.100 0 mol·L-1的NaOH溶液20 mL,溶质为CH3COONa,为强碱弱酸盐,水解显碱性,此时溶液的pH>7,故B不符合题意;
CH3COONa溶液中,由于醋酸根离子水解,c(Na+)>c(CH3COO-),但水解较微弱,c(CH3COO-)>c(OH-),所以c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D符合题意。
返回
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
