第3章 章末复习离子反应在化工流程中的应用 复习课件(共40张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 章末复习离子反应在化工流程中的应用 复习课件(共40张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 14:15:42 | ||
图片预览










文档简介
(共40张PPT)
第3章 章末复习
第1课时 离子反应在化工流程
中的应用
学习目标
1.了解常考中和反应的曲线形式,掌握特殊点法分析曲线的思维模式。
2.能用守恒思想、平衡观念分析酸碱的用量与溶液中微粒存在形式及浓度的关
系(重、难点)。
工艺流程题的一般呈现形式
一
返回
工艺流程题解题思路
二
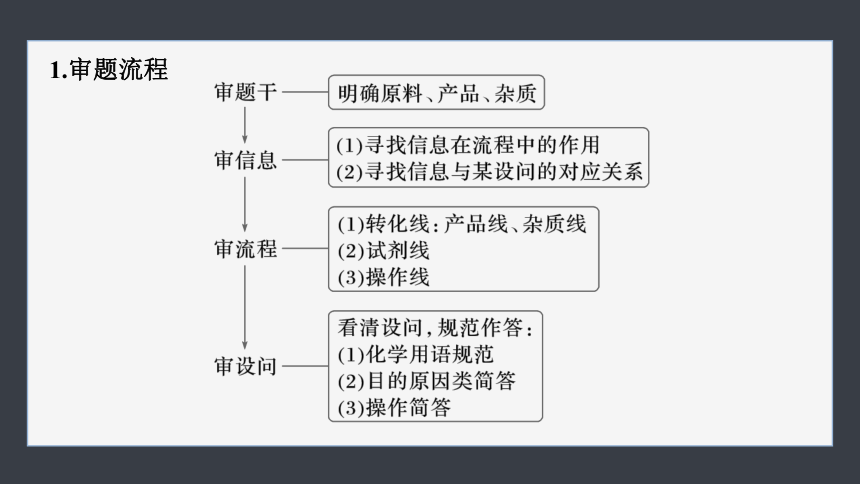
1.审题流程
2.识图技巧
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
返回
典例剖析
三
(2022·全国乙卷,26)废旧铅酸蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
例1
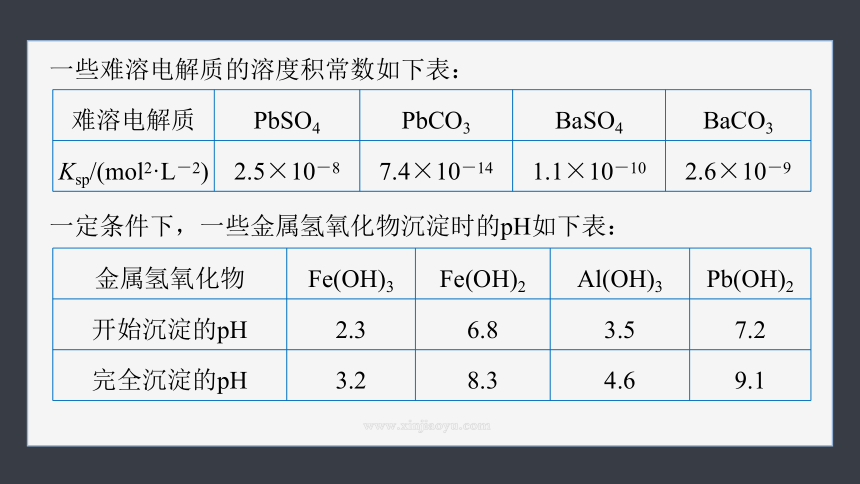
一些难溶电解质的溶度积常数如下表:
难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3
Ksp/(mol2·L-2) 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为__________,用沉淀溶解平衡原理解释选择Na2CO3的原因:____________。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是_________
_________________________。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是___________________________________;
答案 Fe2+
过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子。
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为______________;
过氧化氢促进金属Pb在醋酸溶液中转化为Pb(Ac)2,过氧化氢与Pb、HAc发生氧化还原反应生成Pb(Ac)2和H2O,依据得失电子守恒和原子守恒可知,反应的化学方程式为Pb+H2O2+2HAc===Pb(Ac)2+2H2O。
答案 Pb+H2O2+2HAc===Pb(Ac)2+2H2O
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是______________。
答案 作还原剂
过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到+2价,PbO2是氧化剂,则过氧化氢是还原剂。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是__________。
答案 Fe(OH)3、Al(OH)3
酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣的主要成分为氢氧化铝、氢氧化铁。
(5)“沉铅”的滤液中,金属离子有___________________。
答案 Ba2+、Na+
加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子分别转化为氢氧化铁、氢氧化铝沉淀,铅转化为氢氧化铅,最终转化为氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+。
流程解读 铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,向铅膏中加入碳酸钠溶液进行脱硫,硫酸铅转化为碳酸铅,过滤,向所得固体中加入醋酸、过氧化氢进行酸浸,过氧化氢可将溶液中的亚铁离子氧化为铁离子,酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁,过滤后,向滤液中加入氢氧化钠溶液进行沉铅,得到氢氧化铅沉淀,滤液中的金属阳离子主要为钠离子和钡离子,氢氧化铅再进行处理得到PbO。
[2022·广东,18(1)(3)(4)(5)]稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
例2
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8 mol3·L-3,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是__________。
答案 Fe2+
“氧化调pH”的目的是除去含铁、铝等元素的离子,需要将Fe2+氧化为Fe3+,以便后续除杂,所以化合价有变化的金属离子是Fe2+。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·
L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)
低于__________ mol·L-1(保留两位有效数字)。
答案 4.0×10-4
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是____________________________________________________________。
答案 加热搅拌可加快反应速率
②“操作X”的过程为先________,再固液分离。
答案 冷却结晶
“操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)的熔点为44 ℃,故“操作X”的过程为先冷却结晶,再固液分离。
(5)该工艺中,可再生循环利用的物质有__________(写化学式)。
答案 MgSO4
1
2
自我测试
1.(2023·山西忻州高二月考)四水合磷酸锌[Zn3(PO4)2·4H2O]难溶于水,是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下:
已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36。
下列说法错误的是
A.滤渣Ⅰ的主要成分是SiO2
B.步骤Ⅰ中,调节溶液的pH约为5后加KMnO4溶液反应的离子方程式为
+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+
C.若试剂a为ZnS,反应ZnS(s)+Cu2+(aq)===Zn2+(aq)+CuS(s)的K=2.5
×1011
D.沉锌后的母液中可回收利用的物质有K2SO4、(NH4)2SO4
1
2
自我测试
√
1
2
自我测试
原料锌灰(含Zn、ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)中,SiO2不与酸反应,PbO与硫酸反应转化为难溶的PbSO4,其余完全变成相应的硫酸盐进入溶液,滤渣Ⅰ为硫酸铅和SiO2。加入高锰酸钾氧化硫酸亚铁,其自身被还原为MnO2,硫酸亚铁最终转化为氢氧化铁,滤渣Ⅱ为MnO2、Fe(OH)3,试剂a用来除掉溶液中的铜离子。加入碳酸氢铵溶液得到ZnCO3和Zn(OH)2,加入H3PO4溶液得到Zn3(PO4)2·4H2O。
1
2
自我测试
1
2
自我测试
2.钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及活性炭)为原料制取钴的氧化物的流程如下。
已知:萃取时发生的反应为Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+。
1
2
自我测试
(1)除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:__________________________________
______。
3H2O
1
2
自我测试
(2)除Ca、Mg:当某离子浓度c≤1×10-6 mol·L-1时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥_____mol·L-1。
0.01
1
2
自我测试
Ksp(CaF2)=1.0×10-10 mol3·L-3,Ksp(MgF2)=7.4×10-11 mol3·L-3,
则氟化钙溶解度更大,钙离子除尽需要保证氟离子浓度至少为
1
2
自我测试
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是______________________________________________________。
[Ksp(CaF2)=1.0×10-10 mol3·L-3,Ksp(MgF2)=7.4×10-11 mol3·L-3,Ka(HF)=3.5×10-4 mol·L-1]
pH偏低,氢离子浓度过大导致氟离子和氢离子结合成HF分子
1
2
自我测试
(3)萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
①该工艺中设计萃取、反萃取的目的是______________________。
实现Co2+的提取和富集
该工艺中设计萃取、反萃取的目的是将Co2+从滤液中提取到有机层中,然后分液后再反萃取到水层中,实现Co2+的提取和富集。
1
2
自我测试
②Co2+萃取率随pH升高先增大后减小的可能原因是_________________
___________________________________________________________________________________________________________________________________________。
随着pH升高,氢离
子浓度减小,Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+平衡正向移动,导致Co2+萃取率升高;若pH过高,则Co2+转化为Co(OH)2沉淀,导致Co2+萃取率下降
返回
第3章 章末复习
第1课时 离子反应在化工流程
中的应用
学习目标
1.了解常考中和反应的曲线形式,掌握特殊点法分析曲线的思维模式。
2.能用守恒思想、平衡观念分析酸碱的用量与溶液中微粒存在形式及浓度的关
系(重、难点)。
工艺流程题的一般呈现形式
一
返回
工艺流程题解题思路
二
1.审题流程
2.识图技巧
图1箭头表示反应物加入同时生成物出来;
图2箭头表示反应物分步加入和生成物出来;
图3箭头表示循环反应。
返回
典例剖析
三
(2022·全国乙卷,26)废旧铅酸蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
例1
一些难溶电解质的溶度积常数如下表:
难溶电解质 PbSO4 PbCO3 BaSO4 BaCO3
Ksp/(mol2·L-2) 2.5×10-8 7.4×10-14 1.1×10-10 2.6×10-9
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 Fe(OH)3 Fe(OH)2 Al(OH)3 Pb(OH)2
开始沉淀的pH 2.3 6.8 3.5 7.2
完全沉淀的pH 3.2 8.3 4.6 9.1
回答下列问题:
(1)在“脱硫”中PbSO4转化反应的离子方程式为__________,用沉淀溶解平衡原理解释选择Na2CO3的原因:____________。
(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是_________
_________________________。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。
(ⅰ)能被H2O2氧化的离子是___________________________________;
答案 Fe2+
过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子。
(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为______________;
过氧化氢促进金属Pb在醋酸溶液中转化为Pb(Ac)2,过氧化氢与Pb、HAc发生氧化还原反应生成Pb(Ac)2和H2O,依据得失电子守恒和原子守恒可知,反应的化学方程式为Pb+H2O2+2HAc===Pb(Ac)2+2H2O。
答案 Pb+H2O2+2HAc===Pb(Ac)2+2H2O
(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是______________。
答案 作还原剂
过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到+2价,PbO2是氧化剂,则过氧化氢是还原剂。
(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是__________。
答案 Fe(OH)3、Al(OH)3
酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣的主要成分为氢氧化铝、氢氧化铁。
(5)“沉铅”的滤液中,金属离子有___________________。
答案 Ba2+、Na+
加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子分别转化为氢氧化铁、氢氧化铝沉淀,铅转化为氢氧化铅,最终转化为氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+。
流程解读 铅膏中主要含有PbSO4、PbO2、PbO和Pb,还有少量Ba、Fe、Al的盐或氧化物等,向铅膏中加入碳酸钠溶液进行脱硫,硫酸铅转化为碳酸铅,过滤,向所得固体中加入醋酸、过氧化氢进行酸浸,过氧化氢可将溶液中的亚铁离子氧化为铁离子,酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁,过滤后,向滤液中加入氢氧化钠溶液进行沉铅,得到氢氧化铅沉淀,滤液中的金属阳离子主要为钠离子和钡离子,氢氧化铅再进行处理得到PbO。
[2022·广东,18(1)(3)(4)(5)]稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
例2
已知:月桂酸(C11H23COOH)的熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8 mol3·L-3,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
离子 Mg2+ Fe3+ Al3+ RE3+
开始沉淀时的pH 8.8 1.5 3.6 6.2~7.4
沉淀完全时的pH / 3.2 4.7 /
(1)“氧化调pH”中,化合价有变化的金属离子是__________。
答案 Fe2+
“氧化调pH”的目的是除去含铁、铝等元素的离子,需要将Fe2+氧化为Fe3+,以便后续除杂,所以化合价有变化的金属离子是Fe2+。
(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·
L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)
低于__________ mol·L-1(保留两位有效数字)。
答案 4.0×10-4
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是____________________________________________________________。
答案 加热搅拌可加快反应速率
②“操作X”的过程为先________,再固液分离。
答案 冷却结晶
“操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)的熔点为44 ℃,故“操作X”的过程为先冷却结晶,再固液分离。
(5)该工艺中,可再生循环利用的物质有__________(写化学式)。
答案 MgSO4
1
2
自我测试
1.(2023·山西忻州高二月考)四水合磷酸锌[Zn3(PO4)2·4H2O]难溶于水,是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如下:
已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=6.4×10-36。
下列说法错误的是
A.滤渣Ⅰ的主要成分是SiO2
B.步骤Ⅰ中,调节溶液的pH约为5后加KMnO4溶液反应的离子方程式为
+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+
C.若试剂a为ZnS,反应ZnS(s)+Cu2+(aq)===Zn2+(aq)+CuS(s)的K=2.5
×1011
D.沉锌后的母液中可回收利用的物质有K2SO4、(NH4)2SO4
1
2
自我测试
√
1
2
自我测试
原料锌灰(含Zn、ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)中,SiO2不与酸反应,PbO与硫酸反应转化为难溶的PbSO4,其余完全变成相应的硫酸盐进入溶液,滤渣Ⅰ为硫酸铅和SiO2。加入高锰酸钾氧化硫酸亚铁,其自身被还原为MnO2,硫酸亚铁最终转化为氢氧化铁,滤渣Ⅱ为MnO2、Fe(OH)3,试剂a用来除掉溶液中的铜离子。加入碳酸氢铵溶液得到ZnCO3和Zn(OH)2,加入H3PO4溶液得到Zn3(PO4)2·4H2O。
1
2
自我测试
1
2
自我测试
2.钴的氧化物常用于制取催化剂和颜料等。以含钴废料(含Co2O3和少量Fe、Al、Mn、Ca、Mg等的氧化物及活性炭)为原料制取钴的氧化物的流程如下。
已知:萃取时发生的反应为Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+。
1
2
自我测试
(1)除Fe、Al:先加入NaClO3溶液,再加入Na2CO3溶液调节pH。写出NaClO3氧化Fe2+的离子方程式:__________________________________
______。
3H2O
1
2
自我测试
(2)除Ca、Mg:当某离子浓度c≤1×10-6 mol·L-1时,认为该离子已除尽。
①为使Ca2+、Mg2+除尽,必须保持溶液中c(F-)≥_____mol·L-1。
0.01
1
2
自我测试
Ksp(CaF2)=1.0×10-10 mol3·L-3,Ksp(MgF2)=7.4×10-11 mol3·L-3,
则氟化钙溶解度更大,钙离子除尽需要保证氟离子浓度至少为
1
2
自我测试
②若调节溶液的pH偏低,将会导致Ca2+、Mg2+沉淀不完全,其原因是______________________________________________________。
[Ksp(CaF2)=1.0×10-10 mol3·L-3,Ksp(MgF2)=7.4×10-11 mol3·L-3,Ka(HF)=3.5×10-4 mol·L-1]
pH偏低,氢离子浓度过大导致氟离子和氢离子结合成HF分子
1
2
自我测试
(3)萃取、反萃取:加入某有机酸萃取剂(HA)2,实验测得Co2+萃取率随pH的变化如图所示。向萃取所得有机相中加入H2SO4,反萃取得到水相。
①该工艺中设计萃取、反萃取的目的是______________________。
实现Co2+的提取和富集
该工艺中设计萃取、反萃取的目的是将Co2+从滤液中提取到有机层中,然后分液后再反萃取到水层中,实现Co2+的提取和富集。
1
2
自我测试
②Co2+萃取率随pH升高先增大后减小的可能原因是_________________
___________________________________________________________________________________________________________________________________________。
随着pH升高,氢离
子浓度减小,Co2++n(HA)2 CoA2·(n-1)(HA)2+2H+平衡正向移动,导致Co2+萃取率升高;若pH过高,则Co2+转化为Co(OH)2沉淀,导致Co2+萃取率下降
返回
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
