1.2研究有机化合物的一般方法同步练习(含解析)2023-2024学年人教版(2019)高中化学选择性必修3
文档属性
| 名称 | 1.2研究有机化合物的一般方法同步练习(含解析)2023-2024学年人教版(2019)高中化学选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 14:55:03 | ||
图片预览



文档简介
1.2研究有机化合物的一般方法
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.二甲醚和乙醇互为同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或者金属钾 B.利用质谱法测相对分子质量
C.利用红外光谱法 D.利用核磁共振氢谱
2.某有机物4.6克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与8.8克,该有机物可能是( )
A.CH4 B.C2H4 C.C2H6 D.C2H6O
3.天然提取和人工合成的有机物往往是混合物,假设给你一份有机混合物让你进行研究,一般要采取的几个步骤是
A.分离、提纯→确定分子式→确定实验式→确定结构式
B.分离、提纯→确定实验式→确定分子式→确定结构式
C.分离、提纯→确定结构式→确定实验式→确定分子式
D.确定分子式→确定实验式→确定结构式→分离、提纯
4.二甲醚(CH3-O-CH3)和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用质谱法
B.利用红外光谱法
C.利用核磁共振氢谱
D.利用金属钠或者金属钾
5.下列叙述正确的是
A.同温同压下,等体积的氦气和氘气所含中子数之比为2:1
B.等质量的葡萄糖和乳酸所含原子总数相等
C.铁粉分别与稀硫酸、浓硫酸完全反应失去电子数一定不相等
D.等物质的量的乙烷、丙酸在纯氧气中完全燃烧消耗分子数之比为1:2
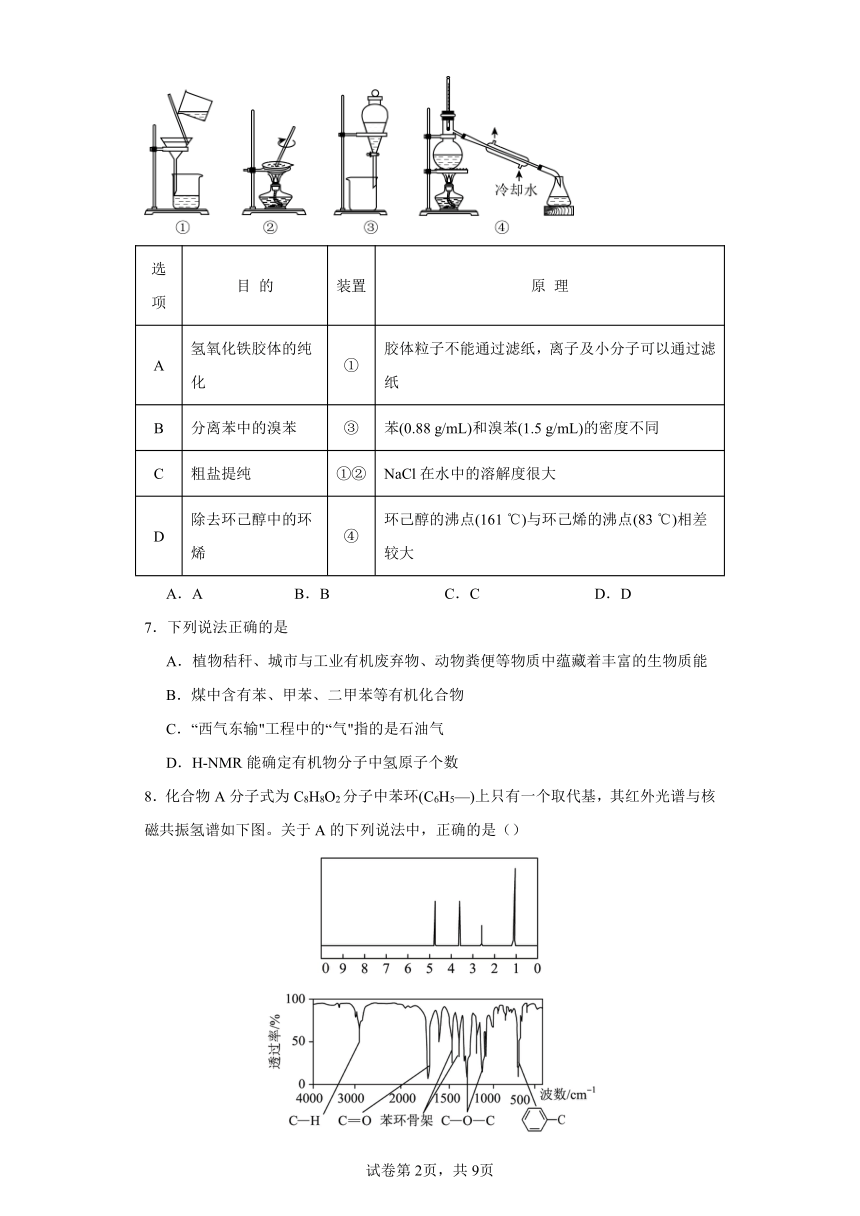
6.实验中,所选取的分离装置与对应原理都正确的是
选项 目 的 装置 原 理
A 氢氧化铁胶体的纯化 ① 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸
B 分离苯中的溴苯 ③ 苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同
C 粗盐提纯 ①② NaCl在水中的溶解度很大
D 除去环己醇中的环烯 ④ 环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大
A.A B.B C.C D.D
7.下列说法正确的是
A.植物秸秆、城市与工业有机废弃物、动物粪便等物质中蕴藏着丰富的生物质能
B.煤中含有苯、甲苯、二甲苯等有机化合物
C.“西气东输"工程中的“气"指的是石油气
D.H-NMR能确定有机物分子中氢原子个数
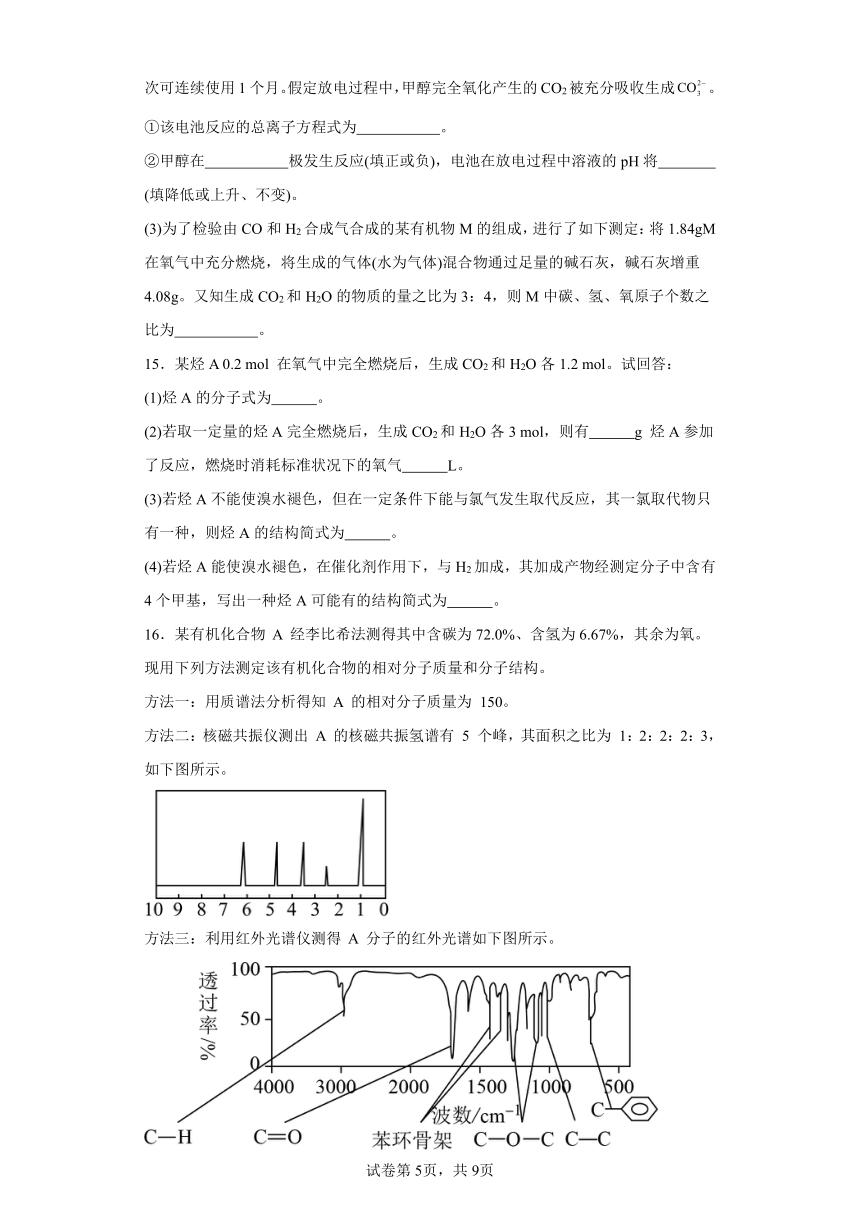
8.化合物A分子式为C8H8O2分子中苯环(C6H5—)上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是()
A.核磁共振氢谱数据在推理A的结构式时用处不大 B.A的结构式可表示为C6H5-COOCH3
C.符合题中A分子结构特征的有机物有2种 D.碥定A的分子结构还需要实验数据
9.仪器分析是重要的分析化学手段,符合下列波谱的有机化合物X为
A. B.
C. D.
10.下列除杂方法正确的是
A.乙烷中混有少量乙烯,可通过溴的四氯化碳溶液除去
B.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
C.乙酸乙酯中混有乙酸,可加入足量的NaOH溶液,经分液除去
D.溴苯中混有溴,加入足量的NaOH溶液,经分液除去
二、填空题
11.某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。
已知:试写出:
(1)A的分子式: 。
(2)化合物A和G的结构简式:A ,G
(3)与G同类的同分异构体(含G)可能有 种。
12.下列两幅谱图是结构简式为CH3CH2CH2OH和的两种有机化合物的1H核磁共振谱图。请判断哪一幅是的1H-NMR谱图,并说明理由 。
A. B.
13.回答下列问题:
(1)某有机化合物的结构简式为,写出其分子式: 。
(2)下面列出了几组物质:①金刚石与“足球烯”C60;②D2O与H2O;③16O、18O;④氧气与臭氧;⑤与;⑥CH3CH2CH2CH3和;⑦CH4和CH3CH2CH3;⑧CH3CH3和。其中互为同位素的是 ;互为同素异形体的是 ;属于同系物的是 ;互为同分异构体 。
(3)写出下列有机物的系统命名或结构简式:
①(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3 。
② 。
③2-甲基-2-丁烯 。
14.研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应,也可以处理NO2。当反应生成氮气转移12mol电子时,消耗的NO2在标准状况下体积是 L。
(2)CO可用于合成甲醇,反应方程式为。由甲醇和氧气以强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,充电一次可连续使用1个月。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成。
①该电池反应的总离子方程式为 。
②甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填降低或上升、不变)。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体(水为气体)混合物通过足量的碱石灰,碱石灰增重4.08g。又知生成CO2和H2O的物质的量之比为3:4,则M中碳、氢、氧原子个数之比为 。
15.某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为 。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有 g 烃A参加了反应,燃烧时消耗标准状况下的氧气 L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为 。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,写出一种烃A可能有的结构简式为 。
16.某有机化合物 A 经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知 A 的相对分子质量为 150。
方法二:核磁共振仪测出 A 的核磁共振氢谱有 5 个峰,其面积之比为 1:2:2:2:3,如下图所示。
方法三:利用红外光谱仪测得 A 分子的红外光谱如下图所示。
请填空:
(1)A的分子式为 。
(2)A的分子中含一个甲基的依据是 。
a.A 的相对分子质量 b.A 的分子式
c.A的核磁共振氢谱图 d.A 分子的红外光谱图
(3)A的结构简式为 。
(4)A的芳香类同分异构体有多种,其中符合下列条件:
①分子结构中只含一个官能团;
②分子结构中含有一个甲基;
③苯环上只有一个取代基。
则该类A的同分异构体共有 种,结构简式为 。
17.萃取分液法
原理:
①液—液萃取:利用待分离组分在两种不互溶的溶剂中的 ,使待分离组分从溶解度较小的溶剂中转移到溶解度较大的溶剂中。
②固—液萃取:用溶剂从固体物质中溶解出待分离组分。
18.两种有机化合物A和B可以互溶,有关性质如表:
相对密度(20℃) 熔点 沸点 溶解性
A 0.7893 -117.3℃ 78.5℃ 与水以任意比混溶
B 0.7137 -116.6℃ 34.5℃ 不溶于水
(1)若要除去A和B的混合物中少量的B,采用 (填序号)方法即可得到A。
A.重结晶 B.蒸馏 C.萃取 D.加水充分振荡,分液
(2)将有机化合物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的最简式为 。已知有机化合物A的核磁共振氢谱、质谱如图所示,则A的结构简式为 。
(3)若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为 。
19.为了测定某有机物A的结构,进行如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水,
②用质谱仪测定其相对分子质量,得到如图所示的质谱图。
试回答下列问题:
(1)有机物A的相对分子质量是 。
(2)有机物A的实验式是 。
(3)能否根据A的实验式确定其分子式 (填“能”或“不能”,并对应回答后面问题)。若能,则A的分子式是 ,若不能,请说明原因: 。
20.金属单质及其化合物常应用于有机物的反应和分析之中。某芳香族化合物X分子式为C8H10O2,为测定其结构做如下分析:(可能用到的信息:中的羟基氢比醇羟基中的氢活性更强。)
(1)为确定羟基的个数,将1molX与足量钠反应生成氢气22.4L(标准状况下),说明X分子中含羟基 个。
(2)X分子中有3种化学环境不同的氢原子,其个数比为1:2:2,则X的结构简式 。
(3)X在Cu催化下可被氧气氧化生成有机物Y,Y的相对分子质量比X小4。试写出该反应的方程式: 。
(4)0.1molY与新制Cu(OH)2共热煮沸后,生成了砖红色的Cu2O、水和另一种有机产物,则该反应中Y被 (填“氧化”或“还原”)。
(5)芳香族化合物Z是有机物Y的一种同分异构体。1molZ与足量钠反应同样生成氢气22.4L(标况下),试写出满足此条件的有机物Z的结构简式: (写出一种即可)。
三、实验探究题
21.三聚氰胺污染牛奶事件社会影响极坏。向牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氧三种元素,其相对分子质量为126。为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:
(1)产生的氧气按从左向右的流向,所选装置各导管的连接顺序是
g接、 接 、 接j、k接 、 接 。
(2)装置F中 CuO的作用是 。
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为 ,又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,试写出三聚氰胺的结构简式 。
(4)按(1)的连接方法,此实验装置存在的缺点是 。
22.选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(2) 分离水和汽油的混合物。
(3) 分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4) 除去混在乙烷中的乙烯。
(5) 提取碘水中的碘。
23.青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。
(1)操作Ⅰ、Ⅱ中,不会用到的装置是 (填序号)
(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是 。
(3)操作Ⅲ的分离提纯方法名称是 。
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】二甲醚和乙醇中分别含有-O-和-OH,二者性质不同,-OH可与Na反应,二者含有的H原子的种类和性质不同,以此解答该题。
【详解】A.乙醇中含有-OH,可与金属钠或金属钾反应生成氢气,可鉴别,A正确;
B.二者的相对分子质量相等,利用质谱法通过测相对分子质量不能鉴别,B错误;
C.二甲醚和乙醇中分别含有-O-和-OH,官能团不同,可用红外光谱法鉴别,C正确;
D.二者含有的H原子的种类和性质不同,可用核磁共振氢谱鉴别,D正确;
故合理选项是B。
2.D
【详解】有机物完全燃烧后的产物依次通过浓硫酸增加的质量是水的质量,通过NaOH溶液,吸收的质量是CO2的质量。n(H2O)= 5.4g÷18g/mol=0.3mol;n(CO2)=8.8g÷44g/mol=0.2mol。所以n(C):n(H)=1:3,则物质可能是C2H6、C2H6O;它们的物质的量是0.1mol,若是C2H6,0.1mol的质量是3.0g,不符合题意;若是C2H6O,0.1mol的质量是4.6g,因此选项是D。
3.B
【详解】从天然资源提取有机物,首先得到是含有有机物的粗品,需经过分离、提纯才能得到纯品,再进行鉴定和研究未知有机物的结构和性质,一般先利用元素定量分析确定实验式,再测定相对分子质量确定分子式,因为有机物存在同分异构现象,故最后利用波谱分析确定结构式,故答案选B。
4.A
【详解】A.二甲醚和乙醇是同分异构体,相对分子质量相同,不能利用质谱法鉴别,A项选;
B.二甲醚和乙醇中分别含有-O-和-OH,官能团不同,可用红外光谱法鉴别,B项不选;
C.二者含有的H原子的种类和性质不同,可用核磁共振氢谱鉴别,C项不选;
D.乙醇中含有-OH,可与金属钠或金属钾反应生成氢气,可鉴别,D项不选;
答案选A。
5.B
【详解】A.同温同压下,等体积的气体物质的量相同,1molHe的中子数为2mol,1mol氘气()的中子数为2mol,其中子数之比为1:1,故A错误;
B.葡萄糖和乳酸最简式均为CH2O,当两者质量相等时,所含原子总数也相等,故B正确;
C.未说明稀硫酸与浓硫酸的用量,即可能存在电子数相等的情况,例如生成等量的硫酸亚铁,故C错误;
D.由可知,1mol乙烷(C2H6),完全燃烧消耗的O2为3.5mol,1mol丙酸(C3H6O2),完全燃烧消耗的O2为3.5mol,其分子数之比为1:1,故D错误;
故选B。
6.D
【详解】A.氢氧化铁胶体的纯化,根据胶粒不能透过半透膜能透过滤纸,用渗析的方法分离,不能用过滤,故A错误;
B.苯和溴苯相互混溶,不能分液分离,应选择蒸馏操作,故B错误;
C.可氯化钠溶液中获得NaCl晶体,只需要蒸发结晶即可,故C错误;
D.相互混溶的环己醇和环己烯根据沸点差异,选择蒸馏操作分离,故D正确;
答案为D。
7.A
【详解】A.植物秸秆、城市与工业有机废弃物、动物粪便等物质中蕴藏着丰富的生物质能,可供利用,故A正确;
B.煤经过干馏可得煤焦油,煤焦油分馏可以得到苯,甲苯等物质,但煤本身不含有苯、甲苯、二甲苯等有机化合物,故B错误;
C.“西气东输"工程中的“气"指的是天然气,故C错误;
D.H-NMR能确定有机物分子中等效氢的种类及个数比,不能确定氢原子个数,故D错误;
故选A。
8.B
【详解】有机物A的分子式为C8H8O2,不饱和度为=5,且A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,苯环上有三类氢原子,个数分别为1、2、2,所以剩余侧链上的3个氢等效,为-CH3,结合红外光谱可知,分子中存在酯基,故有机物A的结构简式
为Ph-COOCH3 苯甲酸甲酯;
A.核磁共振氢谱数据在推理A的结构式时,确定H原子的种类,选项A错误;
B.A的结构式可表示为C6H5-COOCH3,选项B正确;
C.符合题中A分子结构特征的有机物只有1种,C6H5-COOCH3,选项C错误;
D.根据以上数据能确定A的分子结构,选项D错误;
答案选B。
9.C
【分析】根据图1的质谱图可知,有机化合物X的相对分子质量为90,根据图2的红外光谱图可知,有机物结构中存在羧基、羟基、碳氢单键、碳碳单键和碳氧单键,结合核磁共振氢谱可知,分子中存在4组吸收峰,即存在4种不同环境的氢原子,且峰面积之比为1:1:1:3,据此分析解答。
【详解】A.结构中存在3种不同环境的氢原子,与图3信息描述不符,A不符合题意;
B.的相对分子质量为90,存在羧基、羟基、碳氢单键、碳碳单键和碳氧单键,且有4种不同环境氢原子,但氢原子个数比(吸收峰面积)为1:2:2:1,B不符合题意;
C.的相对分子质量为90,存在羧基、羟基、碳氢单键、碳碳单键和碳氧单键,且有4种不同环境氢原子,且峰面积之比为1:1:1:3,C符合题意;
D.D中含酯基和醛基,不含羧基,与图2的红外光谱图信息不符,D不符合题意;
故选C。
10.D
【详解】A.乙烯与溴的四氯化碳溶液反应,能用来除杂,但乙烷可溶于四氯化碳,故A错误;
B.苯酚与溴水反应生成三溴苯酚,三溴苯酚易溶于苯,不能除杂,故B错误;
C.乙酸乙酯和乙酸均与NaOH溶液反应,不能除杂,故C错误;
D.溴和氢氧化钠溶液反应生成的NaBr、NaBrO,两者难溶于溴苯、易溶于水,故溴苯中混有溴,加入足量的NaOH溶液后会分层,上层是NaBr、NaBrO溶液,下层是溴苯,再分液即可除杂,故D正确;
答案选D。
11. C10H20 4
【分析】根据烃的相对分子质量和碳元素的含量分析其分子式,在根据结构要求书写其结构。
【详解】(1) 烃A中N(C)=140×0.857/12=10,N(H)=140×0.143/1=20,故A的分子式为C10H20
(2) A分子中有两个碳原子不与氢原子直接相连,说明有两个的结构,A在一定条件下氧化只生成G,G能使石蕊试液变红,则G含有羧基,说明A分子中有—CH=CH—,且为对称结构,则A的结构简式为,则G为
(3)的同分异构体中属于羧酸类,即为C4H9COOH,C4H9—有4种结构:C—C—C—C—、、、,则与G同类的同分异构体(含G)可能有4种。
考点:有机推断
12.A,CH3CH(OH)CH3有3种不同环境下的氢原子,所以1H核磁共振谱图中有3组峰,
【详解】从结构上分析,CH3CH(OH)CH3有三种不同化学环境的H,CH3CH2CH2OH有四种不同的H,所以1H核磁共振谱图中A有三组峰,而B四组峰,故A是CH3CH(OH)CH3的1H-NMR谱图。
13.(1)C16H16O5
(2) ③ ①④ ⑦⑧ ⑥
(3) 2-甲基-5-乙基辛烷 5-甲基-3-乙基-1-己炔
【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长--选最长碳链为主链;②多--遇等长碳链时,支链最多为主链;③近--离支链最近一端编号;④小--支链编号之和最小;⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号。如取代基不同,就把简单的写在前面,复杂的写在后面;含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
【详解】(1)根据该结构简式可得出其分子式:C16H16O5,故答案为:C16H16O5。
(2)关于“四同”的比较:
同位素:质子数相同中子数不同的核素;同素异形体:一种元素构成的不同物质,一定是单质;同分异构体:分子式相同,结构不同,必为化合物;同系物:结构相似,分子式相差若干CH2原子团。
①金刚石与“足球烯”C60都是由碳元素形成的不同单质,互为同素异形体;
②D2O与H2O都是氢的同位素与氧元素形成的化合物;
③16O与18O质子数相同,中子数不同,互为同位素;
④氧气(O2)与臭氧(O3)都是由氧元素形成的不同单质,互为同素异形体;
⑤与均为丙烷,属于同种物质;
⑥CH3CH2CH2CH3和分子式相同,但结构不同,互为同分异构体
⑦CH4和CH3CH2CH3结构相似,分子组成相差2个“CH2”原子团,互为同系物,
⑧CH3CH3和结构相似,分子组成相差3个“CH2”原子团,故互为同系物;
即互为同位素的是③;互为同素异形体的是①④;属于同系物的是⑦⑧;互为同分异构体⑥ ;
答案: ③;①④;⑦⑧;⑥。
(3)把碳链打开按照烷烃命名规则命名:,最长的碳链含有8个C,主链为辛烷,编号从左边开始,取代基的编号最小,2号C一个甲基、5号C一个乙基,名称:2-甲基-5-乙基辛烷;故答案为:2-甲基-5-乙基辛烷。
首先选择含有碳碳三键的最长碳链作为主链,按主链中所含碳原子的数目命名为某炔;给主链编号时从距离碳碳三键最近的一端开始,侧链视为取代基,碳碳三键的位次须标明;其它同烷烃的命名规则;,名称: 5-甲基-3-乙基-1-己炔;
故答案为: 5-甲基-3-乙基-1-己炔。
2-甲基-2-丁烯,碳碳双键在2号C,甲基在2号C,主链为丁烯,结构简式为;故答案为:。
14. 67.2 2CH3OH+3O2+4OH-=2+6H2O 负 降低 3:8:3
【详解】(1)在反应中,NO2中氮元素的化合价从+4价降低到N2中的0价,1molNO2得到4mol电子,即转移4mol电子,可以处理1molNO2。当反应转移12mol电子时,消耗的NO2的物质的量为3mol,在标准状况下体积是3mol×22.4L/mol=67.2L。
(2)①甲醇和氧气以强碱做电解质溶液的电池,总反应是甲醇和氧气反应,生成碳酸盐和水,离子方程式为:2CH3OH+3O2+4OH-=2+6H2O。
②甲醇失去电子,在负极发生氧化反应。根据总反应式可知,电池在放电过程中消耗OH-,溶液的pH将降低。
(3) 生成CO2和H2O的物质的量之比为3:4,碱石灰增重4.08g即生成的CO2和H2O的总质量是4.08g,设CO2的物质的量为3x,则H2O的物质的量为4x,根据总质量为4.08g,有44×3x+18×4x=4.08,解得x=0.02,则CO2为0.06mol,H2O为0.08mol。0.06molCO2中C的物质的量为0.06mol,质量为0.72g;0.08molH2O中H为0.16mol,质量为0.16g,所以有机物中有氧1.84g-0.72g-0.16g=0.96g,物质的量为0.06mol,所以M中碳、氢、氧原子个数之比为0.06:0.16:0.06=3:8:3。
15.(1)C6H12
(2) 42 100.8
(3)
(4)(CH3)3CCH=CH2、CH2=C(CH3)CH(CH3)2、(CH3)2C=C(CH3)2
【详解】(1)某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol.,则1mol的烃中含有6mol C原子,含有12mol H原子,所以烃A的分子式为C6H12;
(2)烃A燃烧的方程式是:C6H12+9O26CO2+6H2O,若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有0.5mol的A发生反应,反应消耗的A的质量是m(A)=0.5mol×84g/mol=42g;0.5mol的A反应消耗氧气的物质的量是4.5mol,其体积是V(O2)= 4.5mol×22.4L/mol=100.8L;
(3)烃A的不饱和度为1,若烃A不能使溴水褪色,则不含碳碳双键,在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A是环己烷,结构简式为;
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,则A分子内含1个碳碳双键,其加成产物经测定分子中含有4个甲基,则烃A可能有的结构简式为(CH3)3CCH=CH2或CH2=C(CH3)CH(CH3)2或(CH3)2C=C(CH3)2。
16. C9H10O2 bc 5 、 、 、 、
【分析】A的相对分子质量为150,其中含碳为72.0%、含氢为6. 67%,其余全为氧,则C原子个数是;H原子个数是;含有O原子个数是,所以物质A的分子式是C9H10O2;核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,说明分子中含有5种不同的H原子,个数之比是1:2:2:2:3,由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个.由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及其它基团,所以符合条件的有机物A结构简式为 。
【详解】(1)A的分子式为C9H10O2;
(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的核磁共振氢谱图,故答案为bc;
(3)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个.由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及其它基团,所以符合条件的有机物A结构简式为 ;
(4)①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基;符合条件的同分异构体的结构简式为: 、 、 、 、 ,共5种。
17.溶解性不同
【详解】液—液萃取:利用待分离组分在两种不互溶的溶剂中的溶解性不同,使待分离组分从溶解度较小的溶剂中转移到溶解度较大的溶剂中。
18.(1)B
(2) C2H6O CH3CH2OH
(3)CH3CH2OCH2CH3
【详解】(1)由题干信息可知,A和B为互溶的两种液体,沸点相差较大,若要除去A和B的混合物中少量的B,采用蒸馏方法即可得到A,故答案为:B;
(2)将有机化合物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则原有机物中含有n(H)=2n(H2O)==0.6mol,n(C)=n(CO2)==0.2mol,n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3mol+0.2mol×2-2×=0.1mol,故有机物中n(C):n(H):n(O)=0.2mol:0.6mol:0.1mol=2:6:1,则该物质的最简式为C2H6O,已知有机化合物A的核磁共振氢谱图中三种吸收峰、质谱图中最大吸收峰为46,故A的相对分子质量为46,A的分子式为C2H6O,则A的结构简式为CH3CH2OH,故答案为:C2H6O;CH3CH2OH;
(3)若质谱图显示B的相对分子质量为74,由红外光谱图可知,分子中含有对称的-CH3、对称的-CH2-和C-O-C键,故可推知B的结构简式为CH3CH2OCH2CH3,故答案为:CH3CH2OCH2CH3。
19. 46 C2H6O 能 C2H6O 不用填写
【分析】(1)根据质荷比可以知道,有机物A的相对分子质量为46;
(2)根据n=计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素;若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)根据有机物的最简式中H原子是否已经饱和,来判定实验式与分子式关系。
【详解】(1)根据质荷比可以知道,有机物A的相对分子质量为46;
(2) 2.3g有机物燃烧生成生成0.1mol CO2和2.7g水,则n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)==0.15mol,m(H)=2×0.15mol×1g/mol=0.3g,则m(H)+m(C)=1.2+0.3=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)==0.05mol,n(C): n(H): n(O)=0.1:0.3:0.05=2:6:1,即该有机物最简式为C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和,所以该有机物最简式即为其分子式。
20.(1)2
(2)
(3)
(4)氧化
(5)或
【分析】芳香族化合物X分子式为C8H10O2,X的不饱和度是4,X分子中有1个苯环,侧链没有双键;
(1)
,1molX与足量钠反应生成1mol氢气,说明X分子中含羟基2个。
(2)
X分子中有3种化学环境不同的氢原子,其个数比为1:2:2,说明X分子结构对称,则X的结构简式。
(3)
X在Cu催化下可被氧气氧化生成有机物Y,Y的相对分子质量比X小4,说明Y比X少4个H原子,2个羟基被氧化为2个醛基,Y是,该反应的方程式。
(4)
0.1mol与新制Cu(OH)2共热煮沸后,生成了砖红色的Cu2O、水和另一种有机产物,铜元素化合价降低,则Y中碳元素化合价升高,则该反应中被氧化。
(5)
芳香族化合物Z是有机物的一种同分异构体,1molZ与足量钠反应同样生成氢气22.4L(标况下),说明Z中含有2个羟基,满足此条件的有机物Z的结构简式为、等。
21.(1) f e h i c d a
(2)氧化没有燃烧完全的CO
(3) C3H6N6
(4)空气中的水蒸气和CO2进入A装置,影响CO2的测定值
【详解】(1)在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,制取的氧气必须要用浓硫酸来干燥,所以开始连接顺序是e、f、h、i,一氧化碳含量测定用氧化铜,但是一氧化碳的检验必须在前,在测定一氧化碳的含量之前要用无水氯化钙对气体进行干燥,可以用A装置测定二氧化碳的量,并且放在最后来检测,所以连接顺序是:f、e、h、i、c、d、j、k、a。答案为f;e;h;i;c;d;a;
(2)有机物燃烧产物含有一氧化碳,用氧化铜可以氧化没有燃烧完全的CO。答案为氧化没有燃烧完全的CO;
(3)三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,2.52g即0.02mol三聚氰胺样品氧化成CO2、H2O和N2,A、B两装置分别测定的是二氧化碳、水的质量,所以二氧化碳质量是2.64g,即0.06mol,所以碳原子数目是3。水的质量是1.08g,即0.06mol,所以氢原子个数是6,则三聚氰胺的分子式为C3H6N6,又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,则三聚氰胺的结构简式为。答案为C3H6N6;;
(4)为了保证测得二氧化碳中的碳元素全部来自有机物,所以要避开空气中二氧化碳的干扰,还缺少尾部缺少一个干燥装置。答案为空气中的水蒸气和CO2进入A装置,影响CO2测定值。
22. CF D E G A
【详解】(1)硝酸钾和氯化钠的溶解度随温度的变化不同,从硝酸钾和氯化钠的混合溶液中获得硝酸钾需要重结晶后过滤,答案选CF;
(2)水与汽油分层,则选择分液法分离,答案选D;
(3)二者互溶,但沸点不同,则选择蒸馏法分离,答案选E;
(4)乙烯与溴水反应,而乙烷不能,则选择盛有溴水的洗气瓶洗气除杂,答案选G;
(5)碘不易溶于水,易溶于有机溶剂,则选择萃取分液提取碘水中的碘,答案选A。
23.(1)C
(2)浸取青蒿素
(3)重结晶
(4)
【分析】青蒿素可溶于乙醇、乙醚等有机溶剂,难溶于水,黄花蒿干燥、破碎后,加入乙醚浸取其中的青蒿素,经过滤得到浸出液,浸出液经蒸馏得到粗品,粗品经重结晶得到精品。
【详解】(1)操作Ⅰ分离得到浸出液和残渣,操作Ⅰ为过滤,使用装置B;操作Ⅱ将浸出液中乙醚分离出去,该操作为蒸馏,使用装置A;故操作Ⅰ、Ⅱ中不会使用的装置是C;
(2)青蒿素可溶于水乙醇、乙醚等有机溶剂,难溶于水,向干燥、破碎后的黄花蒿中加入乙醚的作用是浸取青蒿素;
(3)青蒿素是无色针状晶体,故从粗品获得精品的操作Ⅲ为重结晶;
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,说明青蒿素表现氧化性,将I-氧化成I2,根据青蒿素的键线式可知因为其中存在“—O—O—”,圈出对应的基团为 。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.二甲醚和乙醇互为同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或者金属钾 B.利用质谱法测相对分子质量
C.利用红外光谱法 D.利用核磁共振氢谱
2.某有机物4.6克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与8.8克,该有机物可能是( )
A.CH4 B.C2H4 C.C2H6 D.C2H6O
3.天然提取和人工合成的有机物往往是混合物,假设给你一份有机混合物让你进行研究,一般要采取的几个步骤是
A.分离、提纯→确定分子式→确定实验式→确定结构式
B.分离、提纯→确定实验式→确定分子式→确定结构式
C.分离、提纯→确定结构式→确定实验式→确定分子式
D.确定分子式→确定实验式→确定结构式→分离、提纯
4.二甲醚(CH3-O-CH3)和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是( )
A.利用质谱法
B.利用红外光谱法
C.利用核磁共振氢谱
D.利用金属钠或者金属钾
5.下列叙述正确的是
A.同温同压下,等体积的氦气和氘气所含中子数之比为2:1
B.等质量的葡萄糖和乳酸所含原子总数相等
C.铁粉分别与稀硫酸、浓硫酸完全反应失去电子数一定不相等
D.等物质的量的乙烷、丙酸在纯氧气中完全燃烧消耗分子数之比为1:2
6.实验中,所选取的分离装置与对应原理都正确的是
选项 目 的 装置 原 理
A 氢氧化铁胶体的纯化 ① 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸
B 分离苯中的溴苯 ③ 苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同
C 粗盐提纯 ①② NaCl在水中的溶解度很大
D 除去环己醇中的环烯 ④ 环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大
A.A B.B C.C D.D
7.下列说法正确的是
A.植物秸秆、城市与工业有机废弃物、动物粪便等物质中蕴藏着丰富的生物质能
B.煤中含有苯、甲苯、二甲苯等有机化合物
C.“西气东输"工程中的“气"指的是石油气
D.H-NMR能确定有机物分子中氢原子个数
8.化合物A分子式为C8H8O2分子中苯环(C6H5—)上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是()
A.核磁共振氢谱数据在推理A的结构式时用处不大 B.A的结构式可表示为C6H5-COOCH3
C.符合题中A分子结构特征的有机物有2种 D.碥定A的分子结构还需要实验数据
9.仪器分析是重要的分析化学手段,符合下列波谱的有机化合物X为
A. B.
C. D.
10.下列除杂方法正确的是
A.乙烷中混有少量乙烯,可通过溴的四氯化碳溶液除去
B.向苯和苯酚的混合液中加入浓溴水,充分反应后过滤,可除去苯中少量的苯酚
C.乙酸乙酯中混有乙酸,可加入足量的NaOH溶液,经分液除去
D.溴苯中混有溴,加入足量的NaOH溶液,经分液除去
二、填空题
11.某烃A,相对分子质量为140,其中碳的质量分数为0.857。A分子中有两个碳原子不与氢直接相连。A在一定条件下氧化只生成G,G能使石蕊试液变红。
已知:试写出:
(1)A的分子式: 。
(2)化合物A和G的结构简式:A ,G
(3)与G同类的同分异构体(含G)可能有 种。
12.下列两幅谱图是结构简式为CH3CH2CH2OH和的两种有机化合物的1H核磁共振谱图。请判断哪一幅是的1H-NMR谱图,并说明理由 。
A. B.
13.回答下列问题:
(1)某有机化合物的结构简式为,写出其分子式: 。
(2)下面列出了几组物质:①金刚石与“足球烯”C60;②D2O与H2O;③16O、18O;④氧气与臭氧;⑤与;⑥CH3CH2CH2CH3和;⑦CH4和CH3CH2CH3;⑧CH3CH3和。其中互为同位素的是 ;互为同素异形体的是 ;属于同系物的是 ;互为同分异构体 。
(3)写出下列有机物的系统命名或结构简式:
①(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3 。
② 。
③2-甲基-2-丁烯 。
14.研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义。
(1)NO2可用水吸收,利用反应,也可以处理NO2。当反应生成氮气转移12mol电子时,消耗的NO2在标准状况下体积是 L。
(2)CO可用于合成甲醇,反应方程式为。由甲醇和氧气以强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,充电一次可连续使用1个月。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成。
①该电池反应的总离子方程式为 。
②甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填降低或上升、不变)。
(3)为了检验由CO和H2合成气合成的某有机物M的组成,进行了如下测定:将1.84gM在氧气中充分燃烧,将生成的气体(水为气体)混合物通过足量的碱石灰,碱石灰增重4.08g。又知生成CO2和H2O的物质的量之比为3:4,则M中碳、氢、氧原子个数之比为 。
15.某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol。试回答:
(1)烃A的分子式为 。
(2)若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有 g 烃A参加了反应,燃烧时消耗标准状况下的氧气 L。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为 。
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,写出一种烃A可能有的结构简式为 。
16.某有机化合物 A 经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知 A 的相对分子质量为 150。
方法二:核磁共振仪测出 A 的核磁共振氢谱有 5 个峰,其面积之比为 1:2:2:2:3,如下图所示。
方法三:利用红外光谱仪测得 A 分子的红外光谱如下图所示。
请填空:
(1)A的分子式为 。
(2)A的分子中含一个甲基的依据是 。
a.A 的相对分子质量 b.A 的分子式
c.A的核磁共振氢谱图 d.A 分子的红外光谱图
(3)A的结构简式为 。
(4)A的芳香类同分异构体有多种,其中符合下列条件:
①分子结构中只含一个官能团;
②分子结构中含有一个甲基;
③苯环上只有一个取代基。
则该类A的同分异构体共有 种,结构简式为 。
17.萃取分液法
原理:
①液—液萃取:利用待分离组分在两种不互溶的溶剂中的 ,使待分离组分从溶解度较小的溶剂中转移到溶解度较大的溶剂中。
②固—液萃取:用溶剂从固体物质中溶解出待分离组分。
18.两种有机化合物A和B可以互溶,有关性质如表:
相对密度(20℃) 熔点 沸点 溶解性
A 0.7893 -117.3℃ 78.5℃ 与水以任意比混溶
B 0.7137 -116.6℃ 34.5℃ 不溶于水
(1)若要除去A和B的混合物中少量的B,采用 (填序号)方法即可得到A。
A.重结晶 B.蒸馏 C.萃取 D.加水充分振荡,分液
(2)将有机化合物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的最简式为 。已知有机化合物A的核磁共振氢谱、质谱如图所示,则A的结构简式为 。
(3)若质谱图显示B的相对分子质量为74,红外光谱如图所示,则B的结构简式为 。
19.为了测定某有机物A的结构,进行如下实验:
①将2.3g该有机物完全燃烧,生成0.1mol CO2和2.7g水,
②用质谱仪测定其相对分子质量,得到如图所示的质谱图。
试回答下列问题:
(1)有机物A的相对分子质量是 。
(2)有机物A的实验式是 。
(3)能否根据A的实验式确定其分子式 (填“能”或“不能”,并对应回答后面问题)。若能,则A的分子式是 ,若不能,请说明原因: 。
20.金属单质及其化合物常应用于有机物的反应和分析之中。某芳香族化合物X分子式为C8H10O2,为测定其结构做如下分析:(可能用到的信息:中的羟基氢比醇羟基中的氢活性更强。)
(1)为确定羟基的个数,将1molX与足量钠反应生成氢气22.4L(标准状况下),说明X分子中含羟基 个。
(2)X分子中有3种化学环境不同的氢原子,其个数比为1:2:2,则X的结构简式 。
(3)X在Cu催化下可被氧气氧化生成有机物Y,Y的相对分子质量比X小4。试写出该反应的方程式: 。
(4)0.1molY与新制Cu(OH)2共热煮沸后,生成了砖红色的Cu2O、水和另一种有机产物,则该反应中Y被 (填“氧化”或“还原”)。
(5)芳香族化合物Z是有机物Y的一种同分异构体。1molZ与足量钠反应同样生成氢气22.4L(标况下),试写出满足此条件的有机物Z的结构简式: (写出一种即可)。
三、实验探究题
21.三聚氰胺污染牛奶事件社会影响极坏。向牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氧三种元素,其相对分子质量为126。为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2。回答下列问题:
(1)产生的氧气按从左向右的流向,所选装置各导管的连接顺序是
g接、 接 、 接j、k接 、 接 。
(2)装置F中 CuO的作用是 。
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为 ,又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,试写出三聚氰胺的结构简式 。
(4)按(1)的连接方法,此实验装置存在的缺点是 。
22.选择下列实验方法分离提纯物质,将分离提纯方法的序号填在横线上。
A.萃取分液 B.升华 C.重结晶 D.分液 E.蒸馏 F.过滤 G.洗气
(1) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
(2) 分离水和汽油的混合物。
(3) 分离CCl4(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
(4) 除去混在乙烷中的乙烯。
(5) 提取碘水中的碘。
23.青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。
(1)操作Ⅰ、Ⅱ中,不会用到的装置是 (填序号)
(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是 。
(3)操作Ⅲ的分离提纯方法名称是 。
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【分析】二甲醚和乙醇中分别含有-O-和-OH,二者性质不同,-OH可与Na反应,二者含有的H原子的种类和性质不同,以此解答该题。
【详解】A.乙醇中含有-OH,可与金属钠或金属钾反应生成氢气,可鉴别,A正确;
B.二者的相对分子质量相等,利用质谱法通过测相对分子质量不能鉴别,B错误;
C.二甲醚和乙醇中分别含有-O-和-OH,官能团不同,可用红外光谱法鉴别,C正确;
D.二者含有的H原子的种类和性质不同,可用核磁共振氢谱鉴别,D正确;
故合理选项是B。
2.D
【详解】有机物完全燃烧后的产物依次通过浓硫酸增加的质量是水的质量,通过NaOH溶液,吸收的质量是CO2的质量。n(H2O)= 5.4g÷18g/mol=0.3mol;n(CO2)=8.8g÷44g/mol=0.2mol。所以n(C):n(H)=1:3,则物质可能是C2H6、C2H6O;它们的物质的量是0.1mol,若是C2H6,0.1mol的质量是3.0g,不符合题意;若是C2H6O,0.1mol的质量是4.6g,因此选项是D。
3.B
【详解】从天然资源提取有机物,首先得到是含有有机物的粗品,需经过分离、提纯才能得到纯品,再进行鉴定和研究未知有机物的结构和性质,一般先利用元素定量分析确定实验式,再测定相对分子质量确定分子式,因为有机物存在同分异构现象,故最后利用波谱分析确定结构式,故答案选B。
4.A
【详解】A.二甲醚和乙醇是同分异构体,相对分子质量相同,不能利用质谱法鉴别,A项选;
B.二甲醚和乙醇中分别含有-O-和-OH,官能团不同,可用红外光谱法鉴别,B项不选;
C.二者含有的H原子的种类和性质不同,可用核磁共振氢谱鉴别,C项不选;
D.乙醇中含有-OH,可与金属钠或金属钾反应生成氢气,可鉴别,D项不选;
答案选A。
5.B
【详解】A.同温同压下,等体积的气体物质的量相同,1molHe的中子数为2mol,1mol氘气()的中子数为2mol,其中子数之比为1:1,故A错误;
B.葡萄糖和乳酸最简式均为CH2O,当两者质量相等时,所含原子总数也相等,故B正确;
C.未说明稀硫酸与浓硫酸的用量,即可能存在电子数相等的情况,例如生成等量的硫酸亚铁,故C错误;
D.由可知,1mol乙烷(C2H6),完全燃烧消耗的O2为3.5mol,1mol丙酸(C3H6O2),完全燃烧消耗的O2为3.5mol,其分子数之比为1:1,故D错误;
故选B。
6.D
【详解】A.氢氧化铁胶体的纯化,根据胶粒不能透过半透膜能透过滤纸,用渗析的方法分离,不能用过滤,故A错误;
B.苯和溴苯相互混溶,不能分液分离,应选择蒸馏操作,故B错误;
C.可氯化钠溶液中获得NaCl晶体,只需要蒸发结晶即可,故C错误;
D.相互混溶的环己醇和环己烯根据沸点差异,选择蒸馏操作分离,故D正确;
答案为D。
7.A
【详解】A.植物秸秆、城市与工业有机废弃物、动物粪便等物质中蕴藏着丰富的生物质能,可供利用,故A正确;
B.煤经过干馏可得煤焦油,煤焦油分馏可以得到苯,甲苯等物质,但煤本身不含有苯、甲苯、二甲苯等有机化合物,故B错误;
C.“西气东输"工程中的“气"指的是天然气,故C错误;
D.H-NMR能确定有机物分子中等效氢的种类及个数比,不能确定氢原子个数,故D错误;
故选A。
8.B
【详解】有机物A的分子式为C8H8O2,不饱和度为=5,且A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,苯环上有三类氢原子,个数分别为1、2、2,所以剩余侧链上的3个氢等效,为-CH3,结合红外光谱可知,分子中存在酯基,故有机物A的结构简式
为Ph-COOCH3 苯甲酸甲酯;
A.核磁共振氢谱数据在推理A的结构式时,确定H原子的种类,选项A错误;
B.A的结构式可表示为C6H5-COOCH3,选项B正确;
C.符合题中A分子结构特征的有机物只有1种,C6H5-COOCH3,选项C错误;
D.根据以上数据能确定A的分子结构,选项D错误;
答案选B。
9.C
【分析】根据图1的质谱图可知,有机化合物X的相对分子质量为90,根据图2的红外光谱图可知,有机物结构中存在羧基、羟基、碳氢单键、碳碳单键和碳氧单键,结合核磁共振氢谱可知,分子中存在4组吸收峰,即存在4种不同环境的氢原子,且峰面积之比为1:1:1:3,据此分析解答。
【详解】A.结构中存在3种不同环境的氢原子,与图3信息描述不符,A不符合题意;
B.的相对分子质量为90,存在羧基、羟基、碳氢单键、碳碳单键和碳氧单键,且有4种不同环境氢原子,但氢原子个数比(吸收峰面积)为1:2:2:1,B不符合题意;
C.的相对分子质量为90,存在羧基、羟基、碳氢单键、碳碳单键和碳氧单键,且有4种不同环境氢原子,且峰面积之比为1:1:1:3,C符合题意;
D.D中含酯基和醛基,不含羧基,与图2的红外光谱图信息不符,D不符合题意;
故选C。
10.D
【详解】A.乙烯与溴的四氯化碳溶液反应,能用来除杂,但乙烷可溶于四氯化碳,故A错误;
B.苯酚与溴水反应生成三溴苯酚,三溴苯酚易溶于苯,不能除杂,故B错误;
C.乙酸乙酯和乙酸均与NaOH溶液反应,不能除杂,故C错误;
D.溴和氢氧化钠溶液反应生成的NaBr、NaBrO,两者难溶于溴苯、易溶于水,故溴苯中混有溴,加入足量的NaOH溶液后会分层,上层是NaBr、NaBrO溶液,下层是溴苯,再分液即可除杂,故D正确;
答案选D。
11. C10H20 4
【分析】根据烃的相对分子质量和碳元素的含量分析其分子式,在根据结构要求书写其结构。
【详解】(1) 烃A中N(C)=140×0.857/12=10,N(H)=140×0.143/1=20,故A的分子式为C10H20
(2) A分子中有两个碳原子不与氢原子直接相连,说明有两个的结构,A在一定条件下氧化只生成G,G能使石蕊试液变红,则G含有羧基,说明A分子中有—CH=CH—,且为对称结构,则A的结构简式为,则G为
(3)的同分异构体中属于羧酸类,即为C4H9COOH,C4H9—有4种结构:C—C—C—C—、、、,则与G同类的同分异构体(含G)可能有4种。
考点:有机推断
12.A,CH3CH(OH)CH3有3种不同环境下的氢原子,所以1H核磁共振谱图中有3组峰,
【详解】从结构上分析,CH3CH(OH)CH3有三种不同化学环境的H,CH3CH2CH2OH有四种不同的H,所以1H核磁共振谱图中A有三组峰,而B四组峰,故A是CH3CH(OH)CH3的1H-NMR谱图。
13.(1)C16H16O5
(2) ③ ①④ ⑦⑧ ⑥
(3) 2-甲基-5-乙基辛烷 5-甲基-3-乙基-1-己炔
【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长--选最长碳链为主链;②多--遇等长碳链时,支链最多为主链;③近--离支链最近一端编号;④小--支链编号之和最小;⑤简--两取代基距离主链两端等距离时,从简单取代基开始编号。如取代基不同,就把简单的写在前面,复杂的写在后面;含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小。
【详解】(1)根据该结构简式可得出其分子式:C16H16O5,故答案为:C16H16O5。
(2)关于“四同”的比较:
同位素:质子数相同中子数不同的核素;同素异形体:一种元素构成的不同物质,一定是单质;同分异构体:分子式相同,结构不同,必为化合物;同系物:结构相似,分子式相差若干CH2原子团。
①金刚石与“足球烯”C60都是由碳元素形成的不同单质,互为同素异形体;
②D2O与H2O都是氢的同位素与氧元素形成的化合物;
③16O与18O质子数相同,中子数不同,互为同位素;
④氧气(O2)与臭氧(O3)都是由氧元素形成的不同单质,互为同素异形体;
⑤与均为丙烷,属于同种物质;
⑥CH3CH2CH2CH3和分子式相同,但结构不同,互为同分异构体
⑦CH4和CH3CH2CH3结构相似,分子组成相差2个“CH2”原子团,互为同系物,
⑧CH3CH3和结构相似,分子组成相差3个“CH2”原子团,故互为同系物;
即互为同位素的是③;互为同素异形体的是①④;属于同系物的是⑦⑧;互为同分异构体⑥ ;
答案: ③;①④;⑦⑧;⑥。
(3)把碳链打开按照烷烃命名规则命名:,最长的碳链含有8个C,主链为辛烷,编号从左边开始,取代基的编号最小,2号C一个甲基、5号C一个乙基,名称:2-甲基-5-乙基辛烷;故答案为:2-甲基-5-乙基辛烷。
首先选择含有碳碳三键的最长碳链作为主链,按主链中所含碳原子的数目命名为某炔;给主链编号时从距离碳碳三键最近的一端开始,侧链视为取代基,碳碳三键的位次须标明;其它同烷烃的命名规则;,名称: 5-甲基-3-乙基-1-己炔;
故答案为: 5-甲基-3-乙基-1-己炔。
2-甲基-2-丁烯,碳碳双键在2号C,甲基在2号C,主链为丁烯,结构简式为;故答案为:。
14. 67.2 2CH3OH+3O2+4OH-=2+6H2O 负 降低 3:8:3
【详解】(1)在反应中,NO2中氮元素的化合价从+4价降低到N2中的0价,1molNO2得到4mol电子,即转移4mol电子,可以处理1molNO2。当反应转移12mol电子时,消耗的NO2的物质的量为3mol,在标准状况下体积是3mol×22.4L/mol=67.2L。
(2)①甲醇和氧气以强碱做电解质溶液的电池,总反应是甲醇和氧气反应,生成碳酸盐和水,离子方程式为:2CH3OH+3O2+4OH-=2+6H2O。
②甲醇失去电子,在负极发生氧化反应。根据总反应式可知,电池在放电过程中消耗OH-,溶液的pH将降低。
(3) 生成CO2和H2O的物质的量之比为3:4,碱石灰增重4.08g即生成的CO2和H2O的总质量是4.08g,设CO2的物质的量为3x,则H2O的物质的量为4x,根据总质量为4.08g,有44×3x+18×4x=4.08,解得x=0.02,则CO2为0.06mol,H2O为0.08mol。0.06molCO2中C的物质的量为0.06mol,质量为0.72g;0.08molH2O中H为0.16mol,质量为0.16g,所以有机物中有氧1.84g-0.72g-0.16g=0.96g,物质的量为0.06mol,所以M中碳、氢、氧原子个数之比为0.06:0.16:0.06=3:8:3。
15.(1)C6H12
(2) 42 100.8
(3)
(4)(CH3)3CCH=CH2、CH2=C(CH3)CH(CH3)2、(CH3)2C=C(CH3)2
【详解】(1)某烃A 0.2 mol 在氧气中完全燃烧后,生成CO2和H2O各1.2 mol.,则1mol的烃中含有6mol C原子,含有12mol H原子,所以烃A的分子式为C6H12;
(2)烃A燃烧的方程式是:C6H12+9O26CO2+6H2O,若取一定量的烃A完全燃烧后,生成CO2和H2O各3 mol,则有0.5mol的A发生反应,反应消耗的A的质量是m(A)=0.5mol×84g/mol=42g;0.5mol的A反应消耗氧气的物质的量是4.5mol,其体积是V(O2)= 4.5mol×22.4L/mol=100.8L;
(3)烃A的不饱和度为1,若烃A不能使溴水褪色,则不含碳碳双键,在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A是环己烷,结构简式为;
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,则A分子内含1个碳碳双键,其加成产物经测定分子中含有4个甲基,则烃A可能有的结构简式为(CH3)3CCH=CH2或CH2=C(CH3)CH(CH3)2或(CH3)2C=C(CH3)2。
16. C9H10O2 bc 5 、 、 、 、
【分析】A的相对分子质量为150,其中含碳为72.0%、含氢为6. 67%,其余全为氧,则C原子个数是;H原子个数是;含有O原子个数是,所以物质A的分子式是C9H10O2;核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,说明分子中含有5种不同的H原子,个数之比是1:2:2:2:3,由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个.由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及其它基团,所以符合条件的有机物A结构简式为 。
【详解】(1)A的分子式为C9H10O2;
(2)A的核磁共振氢谱有5个峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的核磁共振氢谱图,故答案为bc;
(3)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个.由A的核磁共振氢谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及其它基团,所以符合条件的有机物A结构简式为 ;
(4)①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基;符合条件的同分异构体的结构简式为: 、 、 、 、 ,共5种。
17.溶解性不同
【详解】液—液萃取:利用待分离组分在两种不互溶的溶剂中的溶解性不同,使待分离组分从溶解度较小的溶剂中转移到溶解度较大的溶剂中。
18.(1)B
(2) C2H6O CH3CH2OH
(3)CH3CH2OCH2CH3
【详解】(1)由题干信息可知,A和B为互溶的两种液体,沸点相差较大,若要除去A和B的混合物中少量的B,采用蒸馏方法即可得到A,故答案为:B;
(2)将有机化合物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则原有机物中含有n(H)=2n(H2O)==0.6mol,n(C)=n(CO2)==0.2mol,n(O)=n(H2O)+2n(CO2)-2n(O2)=0.3mol+0.2mol×2-2×=0.1mol,故有机物中n(C):n(H):n(O)=0.2mol:0.6mol:0.1mol=2:6:1,则该物质的最简式为C2H6O,已知有机化合物A的核磁共振氢谱图中三种吸收峰、质谱图中最大吸收峰为46,故A的相对分子质量为46,A的分子式为C2H6O,则A的结构简式为CH3CH2OH,故答案为:C2H6O;CH3CH2OH;
(3)若质谱图显示B的相对分子质量为74,由红外光谱图可知,分子中含有对称的-CH3、对称的-CH2-和C-O-C键,故可推知B的结构简式为CH3CH2OCH2CH3,故答案为:CH3CH2OCH2CH3。
19. 46 C2H6O 能 C2H6O 不用填写
【分析】(1)根据质荷比可以知道,有机物A的相对分子质量为46;
(2)根据n=计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素;若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)根据有机物的最简式中H原子是否已经饱和,来判定实验式与分子式关系。
【详解】(1)根据质荷比可以知道,有机物A的相对分子质量为46;
(2) 2.3g有机物燃烧生成生成0.1mol CO2和2.7g水,则n(C)=n(CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,n(H2O)==0.15mol,m(H)=2×0.15mol×1g/mol=0.3g,则m(H)+m(C)=1.2+0.3=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)==0.05mol,n(C): n(H): n(O)=0.1:0.3:0.05=2:6:1,即该有机物最简式为C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和,所以该有机物最简式即为其分子式。
20.(1)2
(2)
(3)
(4)氧化
(5)或
【分析】芳香族化合物X分子式为C8H10O2,X的不饱和度是4,X分子中有1个苯环,侧链没有双键;
(1)
,1molX与足量钠反应生成1mol氢气,说明X分子中含羟基2个。
(2)
X分子中有3种化学环境不同的氢原子,其个数比为1:2:2,说明X分子结构对称,则X的结构简式。
(3)
X在Cu催化下可被氧气氧化生成有机物Y,Y的相对分子质量比X小4,说明Y比X少4个H原子,2个羟基被氧化为2个醛基,Y是,该反应的方程式。
(4)
0.1mol与新制Cu(OH)2共热煮沸后,生成了砖红色的Cu2O、水和另一种有机产物,铜元素化合价降低,则Y中碳元素化合价升高,则该反应中被氧化。
(5)
芳香族化合物Z是有机物的一种同分异构体,1molZ与足量钠反应同样生成氢气22.4L(标况下),说明Z中含有2个羟基,满足此条件的有机物Z的结构简式为、等。
21.(1) f e h i c d a
(2)氧化没有燃烧完全的CO
(3) C3H6N6
(4)空气中的水蒸气和CO2进入A装置,影响CO2的测定值
【详解】(1)在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,制取的氧气必须要用浓硫酸来干燥,所以开始连接顺序是e、f、h、i,一氧化碳含量测定用氧化铜,但是一氧化碳的检验必须在前,在测定一氧化碳的含量之前要用无水氯化钙对气体进行干燥,可以用A装置测定二氧化碳的量,并且放在最后来检测,所以连接顺序是:f、e、h、i、c、d、j、k、a。答案为f;e;h;i;c;d;a;
(2)有机物燃烧产物含有一氧化碳,用氧化铜可以氧化没有燃烧完全的CO。答案为氧化没有燃烧完全的CO;
(3)三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,2.52g即0.02mol三聚氰胺样品氧化成CO2、H2O和N2,A、B两装置分别测定的是二氧化碳、水的质量,所以二氧化碳质量是2.64g,即0.06mol,所以碳原子数目是3。水的质量是1.08g,即0.06mol,所以氢原子个数是6,则三聚氰胺的分子式为C3H6N6,又知三聚氰胺分子中有3个氨基(-NH2),且有类似苯环的对称结构,则三聚氰胺的结构简式为。答案为C3H6N6;;
(4)为了保证测得二氧化碳中的碳元素全部来自有机物,所以要避开空气中二氧化碳的干扰,还缺少尾部缺少一个干燥装置。答案为空气中的水蒸气和CO2进入A装置,影响CO2测定值。
22. CF D E G A
【详解】(1)硝酸钾和氯化钠的溶解度随温度的变化不同,从硝酸钾和氯化钠的混合溶液中获得硝酸钾需要重结晶后过滤,答案选CF;
(2)水与汽油分层,则选择分液法分离,答案选D;
(3)二者互溶,但沸点不同,则选择蒸馏法分离,答案选E;
(4)乙烯与溴水反应,而乙烷不能,则选择盛有溴水的洗气瓶洗气除杂,答案选G;
(5)碘不易溶于水,易溶于有机溶剂,则选择萃取分液提取碘水中的碘,答案选A。
23.(1)C
(2)浸取青蒿素
(3)重结晶
(4)
【分析】青蒿素可溶于乙醇、乙醚等有机溶剂,难溶于水,黄花蒿干燥、破碎后,加入乙醚浸取其中的青蒿素,经过滤得到浸出液,浸出液经蒸馏得到粗品,粗品经重结晶得到精品。
【详解】(1)操作Ⅰ分离得到浸出液和残渣,操作Ⅰ为过滤,使用装置B;操作Ⅱ将浸出液中乙醚分离出去,该操作为蒸馏,使用装置A;故操作Ⅰ、Ⅱ中不会使用的装置是C;
(2)青蒿素可溶于水乙醇、乙醚等有机溶剂,难溶于水,向干燥、破碎后的黄花蒿中加入乙醚的作用是浸取青蒿素;
(3)青蒿素是无色针状晶体,故从粗品获得精品的操作Ⅲ为重结晶;
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,说明青蒿素表现氧化性,将I-氧化成I2,根据青蒿素的键线式可知因为其中存在“—O—O—”,圈出对应的基团为 。
答案第1页,共2页
答案第1页,共2页
