第3章 第2节 第3课时 盐类水解原理 课件(共32张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 第2节 第3课时 盐类水解原理 课件(共32张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 15:09:16 | ||
图片预览




文档简介
(共32张PPT)
第3课时 盐类水解原理
第3章 第2节
学习目标
1.理解水解反应的本质,能正确判断不同盐溶液的酸碱性(重点)。
2.能正确书写水解反应的化学方程式和离子方程式(重点)。
3.了解溶液中的电荷守恒和物料守恒的含义及简单应用。
盐溶液的酸碱性及原因
一
Na2CO3的水溶液显碱性
Na2CO3的酚酞溶液
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸并使食品松软或酥脆,也常用于油污的清洗等。为什么Na2CO3可被当作“碱”使用呢
思考讨论
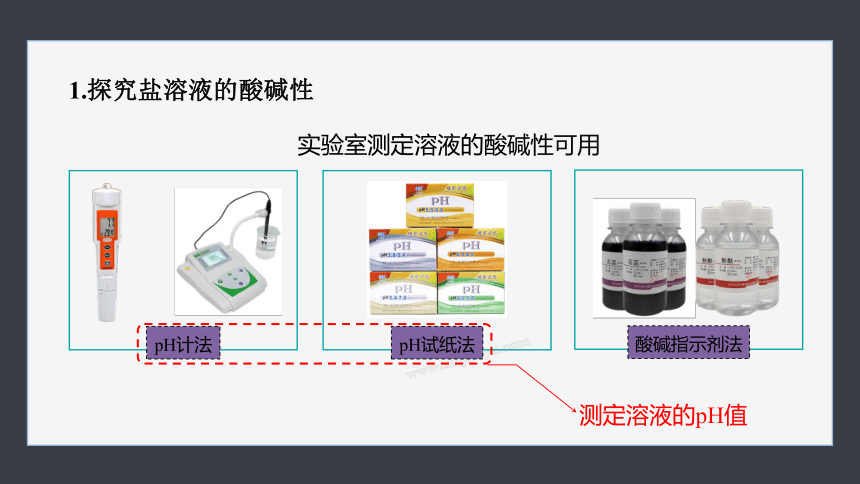
1.探究盐溶液的酸碱性
实验室测定溶液的酸碱性可用
测定溶液的pH值
pH试纸法
酸碱指示剂法
pH计法
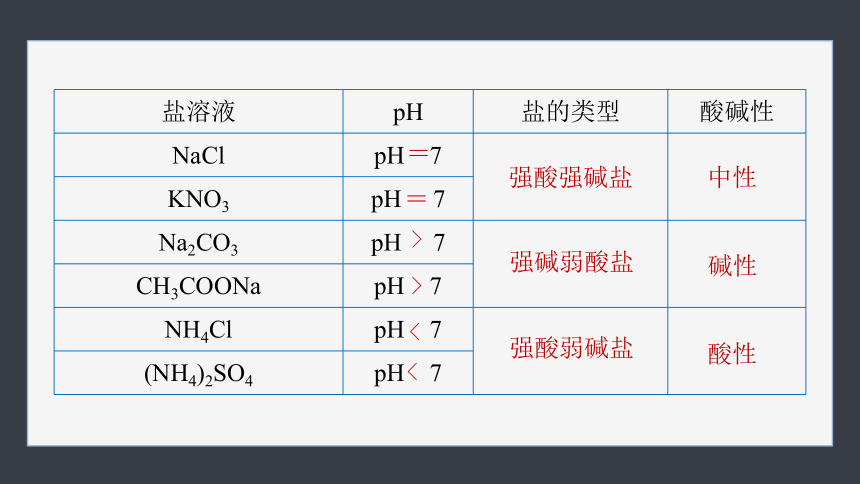
盐溶液 pH 盐的类型 酸碱性
NaCl pH 7
KNO3 pH 7
Na2CO3 pH 7
CH3COONa pH 7
NH4Cl pH 7
(NH4)2SO4 pH 7
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
中性
碱性
酸性
=
>
<
=
>
<
2.理论分析:盐溶液呈酸碱性的原因
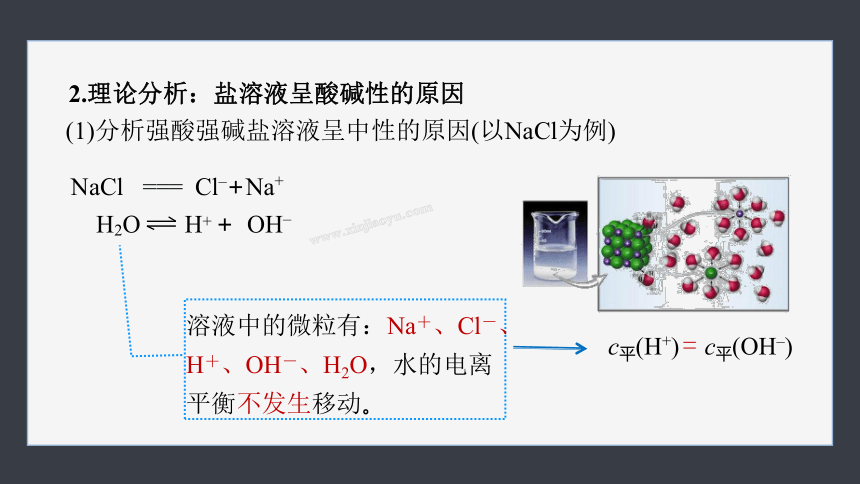
(1)分析强酸强碱盐溶液呈中性的原因(以NaCl为例)
NaCl === Cl–+Na+
H2O H+ + OH–
c平(H+) c平(OH–)
=
溶液中的微粒有:Na+、Cl-、H+、OH-、H2O,水的电离平衡不发生移动。
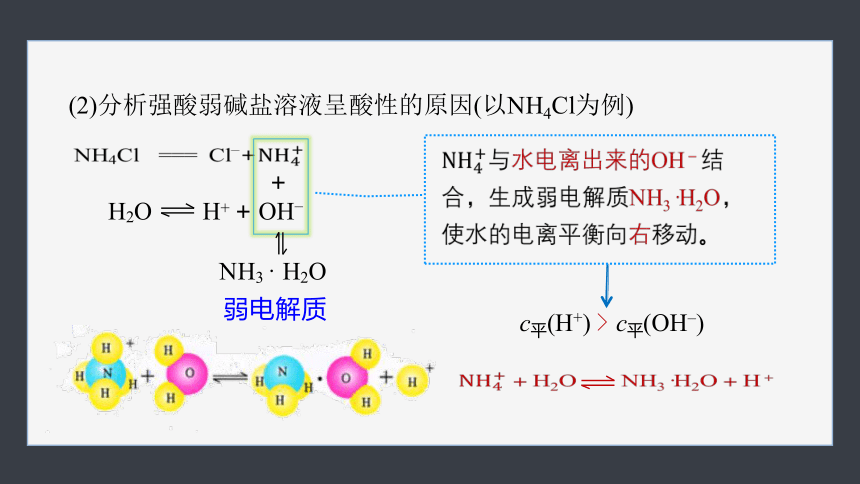
(2)分析强酸弱碱盐溶液呈酸性的原因(以NH4Cl为例)
H2O H+ + OH–
NH4Cl === Cl–+
弱电解质
+
NH3 · H2O
c平(H+) c平(OH–)
>
与水电离出来的OH-结合,生成弱电解质NH3·H2O,使水的电离平衡向右移动。
+H2O NH3·H2O+H+
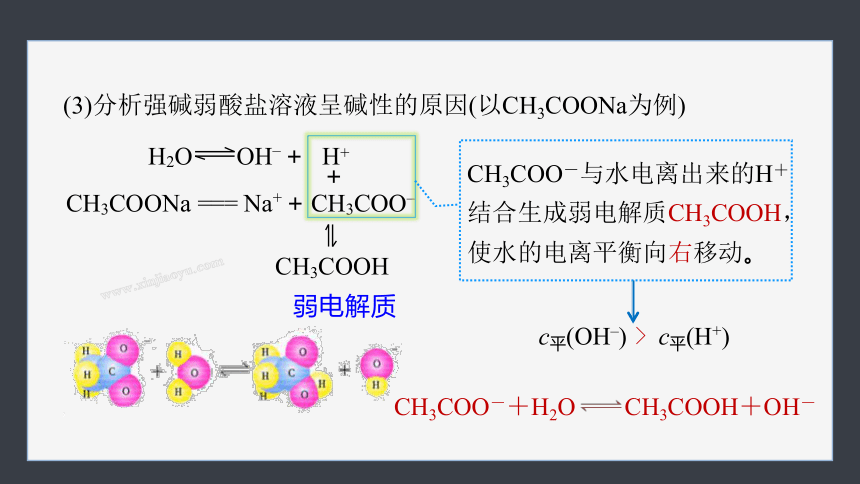
(3)分析强碱弱酸盐溶液呈碱性的原因(以CH3COONa为例)
CH3COONa === Na+ + CH3COO–
H2O OH– + H+
弱电解质
+
CH3COOH
c平(OH–) c平(H+)
>
CH3COO-与水电离出来的H+结合生成弱电解质CH3COOH,使水的电离平衡向右移动。
CH3COO-+H2O CH3COOH+OH-
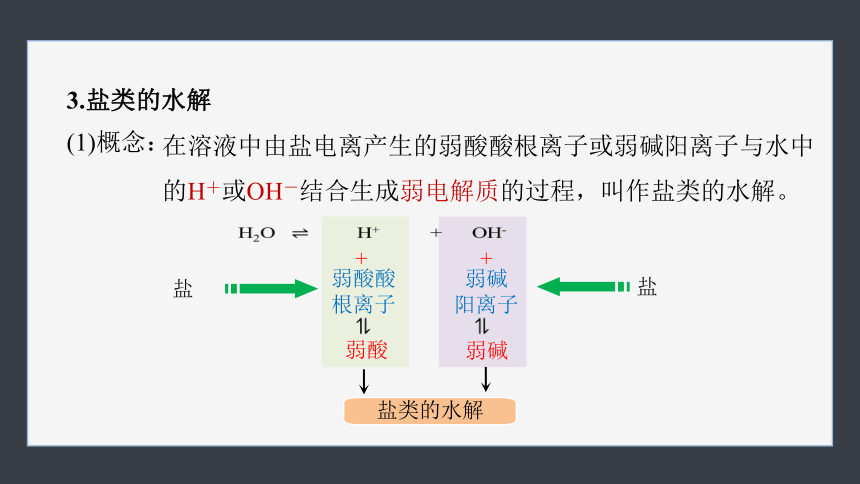
3.盐类的水解
在溶液中由盐电离产生的弱酸酸根离子或弱碱阳离子与水中的H+或OH-结合生成弱电解质的过程,叫作盐类的水解。
(1)概念:
H2O H+ + OH-
弱酸酸
根离子
弱碱
阳离子
+
弱酸
+
弱碱
盐
盐
盐类的水解
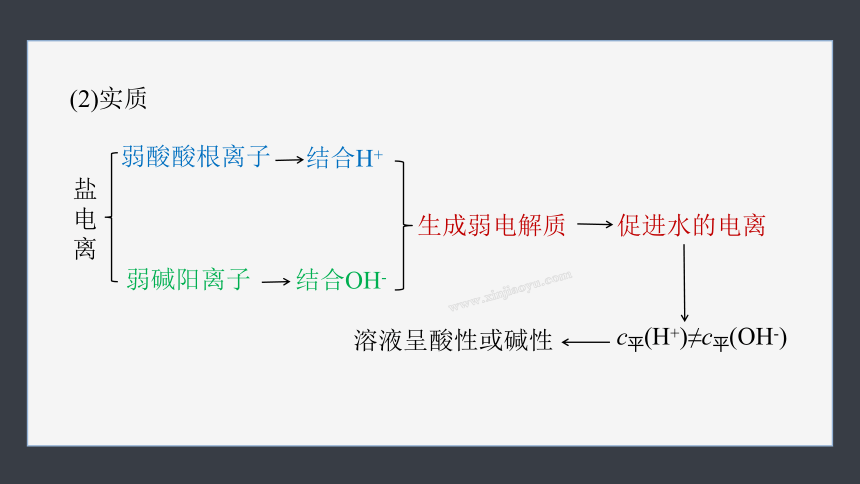
(2)实质
弱酸酸根离子
弱碱阳离子
结合H+
促进水的电离
c平(H+)≠c平(OH-)
溶液呈酸性或碱性
盐电离
生成弱电解质
结合OH-
(3)盐类水解的特点
可逆
水解反应是可逆反应
吸热
水解反应是中和反应的逆反应,是吸热反应
微弱
水解反应程度很微弱
4.盐类水解的规律——判断盐溶液酸碱性的方法
“有弱才水解,无弱不水解”
“谁强显谁性,同强显中性”
当盐中酸根离子对应的酸比阳离子对应的碱更容易电离时,盐溶液呈酸性,反之呈碱性。当二者均为强酸、强碱离子对应的盐时,盐溶液呈中性;当盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液呈中性。
盐中有弱酸酸根离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
盐溶液 水解的离子 酸碱性
Na2SO4
Cu(NO3)2
NaClO
NaHSO4
KAl(SO4)2
NaHCO3
无
中性
Cu2+
酸性
ClO-
碱性
无
酸性
Al3+
酸性
碱性
思考交流
1.正误判断
(1)盐类水解的实质是促进水的电离,使水的电离平衡右移
(2)酸式盐溶液可能呈酸性,也可能呈碱性
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同
√
√
√
思考交流
2.Na2CO3的水解情况与CH3COONa类似,由于H2CO3是二元酸,Na2CO3的水解复杂一些,请运用CH3COONa的水解情况,分析Na2CO3溶液中存在哪些微粒?
提示 第一步,Na2CO3在水中电离出来的发生水解:
离子方程式:+H2O +OH-
第二步,生成的进一步发生水解,离子方程式:+H2O H2CO3+OH-
第二步水解的程度很小,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
其溶液中存在的分子:H2O、H2CO3;离子:Na+、、、OH-、H+,且c平(OH-)>c平(H+)。
思考交流
3.(1)怎样用最简单的方法区别NaCl溶液、NH4Cl溶液和Na2CO3溶液?
紫色石蕊溶液
NaCl溶液
NH4Cl溶液
Na2CO3溶液
思考交流
(2)怎样证明Na2CO3溶液呈碱性是由水解引起的?
酚酞溶液
过量氯化钙溶液
以上可说明Na2CO3溶液呈碱性是由水解引起的。
Na2CO3溶液
产生白色沉淀,且溶液的红色褪去
溶液变红
思考交流
4.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题:
(1)该NH4Cl溶液中含氮元素的微粒有______________。
(2)该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)比值为____。
106
返回
pH=4的NH4Cl溶液中水电离的c水(H+)=10-4 mol·L-1,
pH=4的盐酸中水电离的c水(H+)=10-10 mol·L-1,
+H2O NH3·H2O+H+
水解方程式的书写
二
1.水解方程式的一般模式
阴(阳)离子+H2O 弱酸(或弱碱)+OH-(或H+)。
2.水解方程式的注意事项
(1)盐类水解是可逆反应,盐类水解的离子方程式一般不写“===”而写“ ”。
例如+H2O NH3·H2O+H+
(2)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,产物一般不标“↑”或“↓”。
例如:Fe3++3H2O Fe(OH)3+3H+
(3)多元弱酸酸根离子水解分步书写,多元弱碱阳离子水解一步写出。
+H2O H2CO3+OH-
例如溶液:+H2O +OH-
例如AlCl3溶液:
Al3++3H2O Al(OH)3+3H+
(5)要注意区分弱酸酸式酸根离子的水解和电离过程。
(4)少数水解完全的反应,书写时用“===”连接,可标“↓”或“↑”。
例如泡沫灭火器原理:Al3++3===Al(OH)3↓+3CO2↑。
思考交流
1.分类书写盐类水解离子方程式。
(1)一元弱酸(碱)强碱(酸)盐
①NaClO:__________________________;
②(NH4)2SO4:__________________________。
(2)多元弱酸强碱盐(正盐)
①Na2CO3:_________________________、_______________________
_______;
②Na2S:_______________________、_______________________。
ClO-+H2O HClO+OH-
+H2O
H2CO3
+OH-
S2-+H2O HS-+OH-
HS-+H2O H2S+OH-
思考交流
(3)多元弱碱强酸盐
AlCl3:____________________________。
(4)弱酸弱碱盐中阴、阳离子水解相互促进
①CH3COONH4:___________________________________________;
②Al2S3:_________________________________。
Al3++3H2O Al(OH)3+3H+
Al2S3+6H2O===2Al(OH)3↓+3H2S↑
2.用化学用语表示NaHCO3溶液中可能存在的平衡:________________
________________________________________________________________。
电离平衡:H2O
思考交流
3.下列属于水解方程式且正确的打“√”,不属于水解方程式或水解方程式错误的打“×”。
(1)Na2CO3:+2H2O===H2CO3+2OH-
(2)FeCl3溶液与NaHCO3溶液混合:Fe3++3===Fe(OH)3↓+3CO2↑
(3)H3PO4:H3PO4 H++
(4)NaHS的水解:HS-+H2O S2-+H3O+
×
√
×
×
+H2O OH-+
HS-+H2O OH-+ H2S
不属于水解方程式
思考交流
(5)制备Fe(OH)3胶体:Fe3++3H2O === Fe(OH)3(胶体)+3H+
(6)NaHCO3溶液中加NaOH溶液:+OH-===+H2O
(7)MgCl2溶液中:Cl-+H2O HCl+OH-
√
×
×
返回
不属于水解方程式
Mg2++2H2O 2H++Mg(OH)2
电解质溶液中的电荷守恒与物料守恒
三
1.电荷守恒
注意
(1)含义:
电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等,即电荷守恒,溶液呈电中性。
(2)应用:
c(OH-)+c()+2c()
如Na2CO3溶液中存在的离子有Na+、 、H+、OH-、,其电荷守恒有c(Na+)+c(H+)=
。
阴、阳离子浓度乘自身所带的电荷数建立等式。
2.物料守恒
(1)含义:
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。离子所含的某种元素在变化前后是守恒的,即物料守恒。
(2)应用:
如Na2CO3溶液中,由于水解,含碳微粒有:、、H2CO3,则其物料守恒关系有:c(Na+)= 。
2[c(H2CO3)+c()+c()]
思考交流
1.CH3COONa溶液中:
(1)电荷守恒:____________________________________。
(2)物料守恒:__________________________________。
(3)pH=5的CH3COOH与CH3COONa混合溶液中电荷守恒:_________
____________________________。
2.碳酸氢钠溶液中:
(1)电荷守恒:_________________________________________。
(2)物料守恒:__________________________________。
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c(Na+)=c(CH3COO-)+c(CH3COOH)
c(Na+)+
c(H+)=c(CH3COO-)+c(OH-)
返回
第3课时 盐类水解原理
第3章 第2节
学习目标
1.理解水解反应的本质,能正确判断不同盐溶液的酸碱性(重点)。
2.能正确书写水解反应的化学方程式和离子方程式(重点)。
3.了解溶液中的电荷守恒和物料守恒的含义及简单应用。
盐溶液的酸碱性及原因
一
Na2CO3的水溶液显碱性
Na2CO3的酚酞溶液
Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸并使食品松软或酥脆,也常用于油污的清洗等。为什么Na2CO3可被当作“碱”使用呢
思考讨论
1.探究盐溶液的酸碱性
实验室测定溶液的酸碱性可用
测定溶液的pH值
pH试纸法
酸碱指示剂法
pH计法
盐溶液 pH 盐的类型 酸碱性
NaCl pH 7
KNO3 pH 7
Na2CO3 pH 7
CH3COONa pH 7
NH4Cl pH 7
(NH4)2SO4 pH 7
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
中性
碱性
酸性
=
>
<
=
>
<
2.理论分析:盐溶液呈酸碱性的原因
(1)分析强酸强碱盐溶液呈中性的原因(以NaCl为例)
NaCl === Cl–+Na+
H2O H+ + OH–
c平(H+) c平(OH–)
=
溶液中的微粒有:Na+、Cl-、H+、OH-、H2O,水的电离平衡不发生移动。
(2)分析强酸弱碱盐溶液呈酸性的原因(以NH4Cl为例)
H2O H+ + OH–
NH4Cl === Cl–+
弱电解质
+
NH3 · H2O
c平(H+) c平(OH–)
>
与水电离出来的OH-结合,生成弱电解质NH3·H2O,使水的电离平衡向右移动。
+H2O NH3·H2O+H+
(3)分析强碱弱酸盐溶液呈碱性的原因(以CH3COONa为例)
CH3COONa === Na+ + CH3COO–
H2O OH– + H+
弱电解质
+
CH3COOH
c平(OH–) c平(H+)
>
CH3COO-与水电离出来的H+结合生成弱电解质CH3COOH,使水的电离平衡向右移动。
CH3COO-+H2O CH3COOH+OH-
3.盐类的水解
在溶液中由盐电离产生的弱酸酸根离子或弱碱阳离子与水中的H+或OH-结合生成弱电解质的过程,叫作盐类的水解。
(1)概念:
H2O H+ + OH-
弱酸酸
根离子
弱碱
阳离子
+
弱酸
+
弱碱
盐
盐
盐类的水解
(2)实质
弱酸酸根离子
弱碱阳离子
结合H+
促进水的电离
c平(H+)≠c平(OH-)
溶液呈酸性或碱性
盐电离
生成弱电解质
结合OH-
(3)盐类水解的特点
可逆
水解反应是可逆反应
吸热
水解反应是中和反应的逆反应,是吸热反应
微弱
水解反应程度很微弱
4.盐类水解的规律——判断盐溶液酸碱性的方法
“有弱才水解,无弱不水解”
“谁强显谁性,同强显中性”
当盐中酸根离子对应的酸比阳离子对应的碱更容易电离时,盐溶液呈酸性,反之呈碱性。当二者均为强酸、强碱离子对应的盐时,盐溶液呈中性;当盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液呈中性。
盐中有弱酸酸根离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
盐溶液 水解的离子 酸碱性
Na2SO4
Cu(NO3)2
NaClO
NaHSO4
KAl(SO4)2
NaHCO3
无
中性
Cu2+
酸性
ClO-
碱性
无
酸性
Al3+
酸性
碱性
思考交流
1.正误判断
(1)盐类水解的实质是促进水的电离,使水的电离平衡右移
(2)酸式盐溶液可能呈酸性,也可能呈碱性
(3)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同
√
√
√
思考交流
2.Na2CO3的水解情况与CH3COONa类似,由于H2CO3是二元酸,Na2CO3的水解复杂一些,请运用CH3COONa的水解情况,分析Na2CO3溶液中存在哪些微粒?
提示 第一步,Na2CO3在水中电离出来的发生水解:
离子方程式:+H2O +OH-
第二步,生成的进一步发生水解,离子方程式:+H2O H2CO3+OH-
第二步水解的程度很小,平衡时溶液中H2CO3的浓度很小,不会放出CO2气体。
其溶液中存在的分子:H2O、H2CO3;离子:Na+、、、OH-、H+,且c平(OH-)>c平(H+)。
思考交流
3.(1)怎样用最简单的方法区别NaCl溶液、NH4Cl溶液和Na2CO3溶液?
紫色石蕊溶液
NaCl溶液
NH4Cl溶液
Na2CO3溶液
思考交流
(2)怎样证明Na2CO3溶液呈碱性是由水解引起的?
酚酞溶液
过量氯化钙溶液
以上可说明Na2CO3溶液呈碱性是由水解引起的。
Na2CO3溶液
产生白色沉淀,且溶液的红色褪去
溶液变红
思考交流
4.常温下,某浓度的NH4Cl溶液的pH为4,回答下列问题:
(1)该NH4Cl溶液中含氮元素的微粒有______________。
(2)该NH4Cl溶液中c水(H+)与pH=4的盐酸中c水(H+)比值为____。
106
返回
pH=4的NH4Cl溶液中水电离的c水(H+)=10-4 mol·L-1,
pH=4的盐酸中水电离的c水(H+)=10-10 mol·L-1,
+H2O NH3·H2O+H+
水解方程式的书写
二
1.水解方程式的一般模式
阴(阳)离子+H2O 弱酸(或弱碱)+OH-(或H+)。
2.水解方程式的注意事项
(1)盐类水解是可逆反应,盐类水解的离子方程式一般不写“===”而写“ ”。
例如+H2O NH3·H2O+H+
(2)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,产物一般不标“↑”或“↓”。
例如:Fe3++3H2O Fe(OH)3+3H+
(3)多元弱酸酸根离子水解分步书写,多元弱碱阳离子水解一步写出。
+H2O H2CO3+OH-
例如溶液:+H2O +OH-
例如AlCl3溶液:
Al3++3H2O Al(OH)3+3H+
(5)要注意区分弱酸酸式酸根离子的水解和电离过程。
(4)少数水解完全的反应,书写时用“===”连接,可标“↓”或“↑”。
例如泡沫灭火器原理:Al3++3===Al(OH)3↓+3CO2↑。
思考交流
1.分类书写盐类水解离子方程式。
(1)一元弱酸(碱)强碱(酸)盐
①NaClO:__________________________;
②(NH4)2SO4:__________________________。
(2)多元弱酸强碱盐(正盐)
①Na2CO3:_________________________、_______________________
_______;
②Na2S:_______________________、_______________________。
ClO-+H2O HClO+OH-
+H2O
H2CO3
+OH-
S2-+H2O HS-+OH-
HS-+H2O H2S+OH-
思考交流
(3)多元弱碱强酸盐
AlCl3:____________________________。
(4)弱酸弱碱盐中阴、阳离子水解相互促进
①CH3COONH4:___________________________________________;
②Al2S3:_________________________________。
Al3++3H2O Al(OH)3+3H+
Al2S3+6H2O===2Al(OH)3↓+3H2S↑
2.用化学用语表示NaHCO3溶液中可能存在的平衡:________________
________________________________________________________________。
电离平衡:H2O
思考交流
3.下列属于水解方程式且正确的打“√”,不属于水解方程式或水解方程式错误的打“×”。
(1)Na2CO3:+2H2O===H2CO3+2OH-
(2)FeCl3溶液与NaHCO3溶液混合:Fe3++3===Fe(OH)3↓+3CO2↑
(3)H3PO4:H3PO4 H++
(4)NaHS的水解:HS-+H2O S2-+H3O+
×
√
×
×
+H2O OH-+
HS-+H2O OH-+ H2S
不属于水解方程式
思考交流
(5)制备Fe(OH)3胶体:Fe3++3H2O === Fe(OH)3(胶体)+3H+
(6)NaHCO3溶液中加NaOH溶液:+OH-===+H2O
(7)MgCl2溶液中:Cl-+H2O HCl+OH-
√
×
×
返回
不属于水解方程式
Mg2++2H2O 2H++Mg(OH)2
电解质溶液中的电荷守恒与物料守恒
三
1.电荷守恒
注意
(1)含义:
电解质溶液中阳离子所带的电荷总数与阴离子所带的电荷总数相等,即电荷守恒,溶液呈电中性。
(2)应用:
c(OH-)+c()+2c()
如Na2CO3溶液中存在的离子有Na+、 、H+、OH-、,其电荷守恒有c(Na+)+c(H+)=
。
阴、阳离子浓度乘自身所带的电荷数建立等式。
2.物料守恒
(1)含义:
在电解质溶液中,由于某些离子发生水解或电离,离子的存在形式发生了变化。离子所含的某种元素在变化前后是守恒的,即物料守恒。
(2)应用:
如Na2CO3溶液中,由于水解,含碳微粒有:、、H2CO3,则其物料守恒关系有:c(Na+)= 。
2[c(H2CO3)+c()+c()]
思考交流
1.CH3COONa溶液中:
(1)电荷守恒:____________________________________。
(2)物料守恒:__________________________________。
(3)pH=5的CH3COOH与CH3COONa混合溶液中电荷守恒:_________
____________________________。
2.碳酸氢钠溶液中:
(1)电荷守恒:_________________________________________。
(2)物料守恒:__________________________________。
c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
c(Na+)=c(CH3COO-)+c(CH3COOH)
c(Na+)+
c(H+)=c(CH3COO-)+c(OH-)
返回
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
