第3章 第3节 第1课时 沉淀溶解平衡与溶度积 课件(共26页) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 第3节 第1课时 沉淀溶解平衡与溶度积 课件(共26页) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 15:10:17 | ||
图片预览








文档简介
(共26张PPT)
第1课时 沉淀溶解平衡与溶度积
第3章 第3节
学习目标
1.掌握难溶电解质存在沉淀溶解平衡及影响因素(重点)。
2.掌握溶度积常数的概念并能进行简单计算以及判断反应进行的方向(重、难点)。
沉淀溶解平衡及影响因素
一
【情境创设】
肾结石为泌尿系统常见病,多发病,人群发病率。病因是尿液中成石物质浓度升高或溶解度降低,析出晶体并局部生长聚积形成结石。
肾结石的主要成分:CaC2O4
Ca2++== CaC2O4↓
为什么多喝水能有效缓解肾结石?
难溶物在水中存在溶解现象和平衡?
肾结石的产生与治疗
1.难溶电解质
25 ℃时,电解质溶解性与溶解度的关系
习惯上将溶解度小于0.01g的电解质称为难溶电解质。像CaCO3、Mg(OH)2和FeS等电解质在水中难以溶解,都是难溶电解质。
实验操作
实验现象
结论
在上层清液中加入KI溶液后,有黄色沉淀生成
上层清液中有Pb2+存在,PbI2在水中存在沉淀溶解平衡:PbI2(s) Pb2+(aq)+2I-(aq),当加入KI溶液后,I-浓度增大,平衡左移,从而有PbI2黄色沉淀生成。
2.实验探究难溶电解质在溶液中存在沉淀溶解平衡(以PbI2固体为例)
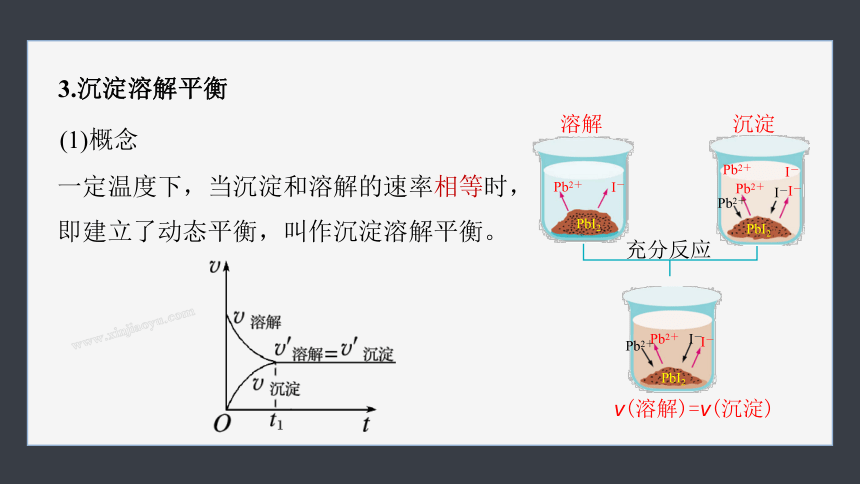
3.沉淀溶解平衡
一定温度下,当沉淀和溶解的速率相等时,即建立了动态平衡,叫作沉淀溶解平衡。
(1)概念
Pb2+
PbI2
I-
充分反应
溶解
沉淀
v(溶解)=v(沉淀)
Pb2+
I-
I-
Pb2+
PbI2
PbI2
Pb2+
Pb2+
I-
I-
Pb2+
I-
(2)特征
动态平衡,溶解速率和沉淀速率不等于0
溶解速率和沉淀速率相等
平衡状态时,溶液中的离子浓度保持不变
当改变外界条件时,沉淀溶解平衡发生移动
动
等
定
变
4.沉淀溶解平衡的影响因素
(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒·夏特列原理。
①温度:一般来说,温度越高,固体物质的溶解度越大;极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
③外加其他物质(与电解质电离的离子反应),平衡向沉淀溶解的方向移动,溶解度增大。
②同离子效应:加入与电解质电离的离子相同的可溶性盐,平衡向生成沉淀的方向移动,溶解度减小。
条件改变 移动方向 c平(Mg2+) c平(OH-)
加少量水
升温
加MgCl2(s)
加盐酸
加NaOH(s)
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
(3)实例分析
正向移动
正向移动
逆向移动
正向移动
逆向移动
不变
增大
增大
增大
增大
增大
减小
减小
减小
不变
思考交流
1.正误判断
(1)BaSO4在相同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同
(2)升高温度,沉淀溶解平衡一定正向移动
(3)向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,溶液中的Na+总数不变
×
×
×
升温,平衡向吸热方向移动,沉淀溶解不一定吸热,如Ca(OH)2(s)溶解就放热 。
Na2O + H2O == 2NaOH,溶剂减少,溶液中 N(Na+ )减少。
思考交流
2.常温下,把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的叙述,正确的打“√”,错误的打“×”。
(1)升高温度,平衡逆向移动
(2)恒温下,向溶液中加入CaO,溶液的pH升高
(3)给溶液加热,溶液的pH升高
(4)向溶液中加入少量NaOH固体,Ca(OH)2固体增多
(5)向溶液中加入Na2CO3溶液,Ca(OH)2固体增多
×
√
×
√
×
平衡向吸热方向移动,逆反应是吸热反应。
恒温,溶解度不变,饱和溶液中的离子浓度不变,pH不变。
Ca(OH)2溶解度随温度升高而减小,c(OH-)减小,pH减小。
NaOH === Na++OH-,溶液中 c(OH-)增大,Ca(OH)2沉淀溶解平衡逆向移动。
思考交流
3.将AgCl分别放入①5 mL H2O、②10 mL 0.2 mol·L-1 MgCl2溶液、
③20 mL 0.5 mol·L-1 AgNO3溶液、④40 mL 0.1 mol·L-1 HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是_____________(用序号表示)。
③>①>④>②
改变条件 平衡移动方向/程度 c(Ag+)
①5 mL H2O AgCl(s) Ag+ (aq) + Cl- (aq) ③ 最大
①
④
②
②10 mL 0.2 mol·L-1 MgCl2溶液 c(Cl- )=0.4 mol·L-1 逆向移动/大
③20 mL 0.5 mol·L-1 AgNO3溶液 c(Ag+)=0. 5 mol·L-1 逆向移动/最大 最小
④40 mL 0.1 mol·L-1 HCl溶液 c(Cl- )=0.1 mol·L-1 逆向移动/较小
沉淀溶解平衡
平衡移动
方向和程度
改变条件
c(Ag+)
判断
>
>
思考交流
(1)饮用纯净水能否保护牙齿?为什么?
返回
4.牙齿表面有一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3(aq)+OH-(aq)。
提示 不能。饮用纯净水,对Ca2+或的浓度没有影响,起不到保护牙齿的作用。
提示 能。牙膏中添加适量的Ca2+或会促使Ca5(PO4)3OH的沉淀溶解平衡向左移动,有利于牙齿的保护。
(2)在牙膏中添加适量的Ca2+或,能否保护牙齿?为什么?
溶度积常数
二
1. Ca2+与的浓度要具体达到多少,才会在人体内形成沉淀
我们需要获得什么样的数据才能进行计算
平衡中的定量计算依据—平衡常数 ( Ka Kb Kw Kh )
2. 难溶电解质的沉淀溶解平衡常数—K
Ksp
【问题思考】
2.表达式
难溶电解质的沉淀溶解平衡也存在平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
1.概念
AmBn(s) mAn+(aq)+nBm-(aq)
Ksp=
如:Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp= 。
3.影响因素
溶度积Ksp只与难溶电解质的性质和温度有关。
4.Ksp的意义
反映了难溶电解质在水中的溶解程度。
难溶物 Ksp(25 oC) 溶解度 难溶物 Ksp(25 oC) 溶解度
AgCl 1.8×10-10 mol2·L-2 1.5×10-4 BaSO4 1.1×10-10 mol2·L-2 2.4×10-4
AgBr 5.0×10-13 mol2·L-2 8.4×10-6 Fe(OH)3 2.6×10-39 mol4·L-4 3.0×10-9
AgI 8.3×10-17 mol2·L-2 2.1×10-7 Mg(OH)2 5.6×10-12 mol3·L-3 9.0×10-4
一般而言,组成类型相同的物质,Ksp越小,溶解度越小。如AgCl、AgBr、AgI。
组成类型不同的物质,溶解度应根据Ksp计算后得出。如BaSO4、Mg(OH)2。
(1)Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
——定量判断给定条件下有无沉淀生成。
5.应用
AmBn(s) mAn+(aq)+nBm-(aq)
Ksp=
平衡时,才有溶度积Ksp
任意时刻(不一定平衡)
浓度商:
Q=cm(An+)·cn(Bm-)
(2)Q=Ksp,溶液饱和,沉淀与溶解处于平衡状态。
(3)Q思考交流
1.正误判断
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
(2)溶度积常数Ksp只受温度影响,温度升高,Ksp一定增大
(3)Ksp越小,难溶电解质在水中的溶解能力一定越弱
(4)改变外界条件使沉淀溶解平衡正向移动,Ksp一定增大
×
×
×
×
不一定,如 Ca(OH)2(s)溶解放热,升温, Ksp减小。
浓度幂
一般而言,组成类型相同的物质,Ksp越小,溶解度越小。如AgCl、AgBr、AgI。
Ksp只受温度影响。
思考交流
2.已知几种难溶电解质在25 ℃时的溶度积(单位省略)。
化学式 AgCl AgBr AgI Mg(OH)2 Ag2CrO4
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 5.6×10-12 2.0×10-12
(1)25 ℃时AgCl(s)、AgBr(s)、AgI(s)溶于水形成的饱和溶液中,c(Ag+)大小关系能否直接判断?三种物质的溶解能力由大到小如何排序?
提示 能。溶解能力由大到小:AgCl>AgBr>AgI。
组成相似,可直接根据Ksp判断。
思考交流
(2)能否利用上表数据直接比较25 ℃时AgCl、Mg(OH)2的溶解能力?计算分析二者溶解能力的大小?
化学式 AgCl AgBr AgI Mg(OH)2 Ag2CrO4
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 5.6×10-12 2.0×10-12
思考交流
(3)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为______________,由此可得出______更难溶。
Ag2CrO4>AgCl
AgCl
Ag2CrO4(s) 2Ag+(aq) +(aq)
2x mol·L-1 x mol·L-1
AgCl饱和溶液中:c平(Ag+) ≈ 1.34×10-5 mol·L-1,
所以Ag+浓度大小顺序为Ag2CrO4>AgCl,则AgCl更难溶。
思考交流
(4)25 ℃时将等体积的4×10-3 mol·L-1的AgNO3溶液和4×10-3 mol·L-1的K2CrO4溶液混合,请通过计算说明是否有Ag2CrO4沉淀产生。
提示 等体积混合后:c(Ag+)=2×10-3 mol·L-1,c()=2×10-3 mol·L-1,Q=c2(Ag+)·c()=(2×10-3)2×2×10-3 mol3·L-3=8×10-9 mol3·L-3>Ksp(Ag2CrO4)=2.0×10-12 mol3·L-3,有Ag2CrO4沉淀产生。
思考交流
(5)25 ℃时,取一定量含有I-、Cl-的溶液,向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,计算溶液中=_________(结果保留两位有效数字)。
4.7×10-7
AgCl和AgI同时沉淀时,溶液中的c平(Ag+)是相同的
= =
(1)Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中的离子浓度无关。
(2)对于同类型物质(如AgCl、AgBr、AgI等),可直接用溶度积比较难溶电解质的溶解能力,Ksp越大,难溶电解质在水中的溶解能力越强。
(3)对于不同类型的物质,Ksp不能直接作为比较溶解能力的依据,而应通过计算将Ksp转化为饱和溶液中溶质的物质的量浓度来确定溶解能力的强弱。
归纳总结
第1课时 沉淀溶解平衡与溶度积
第3章 第3节
学习目标
1.掌握难溶电解质存在沉淀溶解平衡及影响因素(重点)。
2.掌握溶度积常数的概念并能进行简单计算以及判断反应进行的方向(重、难点)。
沉淀溶解平衡及影响因素
一
【情境创设】
肾结石为泌尿系统常见病,多发病,人群发病率。病因是尿液中成石物质浓度升高或溶解度降低,析出晶体并局部生长聚积形成结石。
肾结石的主要成分:CaC2O4
Ca2++== CaC2O4↓
为什么多喝水能有效缓解肾结石?
难溶物在水中存在溶解现象和平衡?
肾结石的产生与治疗
1.难溶电解质
25 ℃时,电解质溶解性与溶解度的关系
习惯上将溶解度小于0.01g的电解质称为难溶电解质。像CaCO3、Mg(OH)2和FeS等电解质在水中难以溶解,都是难溶电解质。
实验操作
实验现象
结论
在上层清液中加入KI溶液后,有黄色沉淀生成
上层清液中有Pb2+存在,PbI2在水中存在沉淀溶解平衡:PbI2(s) Pb2+(aq)+2I-(aq),当加入KI溶液后,I-浓度增大,平衡左移,从而有PbI2黄色沉淀生成。
2.实验探究难溶电解质在溶液中存在沉淀溶解平衡(以PbI2固体为例)
3.沉淀溶解平衡
一定温度下,当沉淀和溶解的速率相等时,即建立了动态平衡,叫作沉淀溶解平衡。
(1)概念
Pb2+
PbI2
I-
充分反应
溶解
沉淀
v(溶解)=v(沉淀)
Pb2+
I-
I-
Pb2+
PbI2
PbI2
Pb2+
Pb2+
I-
I-
Pb2+
I-
(2)特征
动态平衡,溶解速率和沉淀速率不等于0
溶解速率和沉淀速率相等
平衡状态时,溶液中的离子浓度保持不变
当改变外界条件时,沉淀溶解平衡发生移动
动
等
定
变
4.沉淀溶解平衡的影响因素
(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒·夏特列原理。
①温度:一般来说,温度越高,固体物质的溶解度越大;极少数固体物质的溶解度随温度的升高而减小,如Ca(OH)2。
③外加其他物质(与电解质电离的离子反应),平衡向沉淀溶解的方向移动,溶解度增大。
②同离子效应:加入与电解质电离的离子相同的可溶性盐,平衡向生成沉淀的方向移动,溶解度减小。
条件改变 移动方向 c平(Mg2+) c平(OH-)
加少量水
升温
加MgCl2(s)
加盐酸
加NaOH(s)
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)
(3)实例分析
正向移动
正向移动
逆向移动
正向移动
逆向移动
不变
增大
增大
增大
增大
增大
减小
减小
减小
不变
思考交流
1.正误判断
(1)BaSO4在相同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同
(2)升高温度,沉淀溶解平衡一定正向移动
(3)向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,溶液中的Na+总数不变
×
×
×
升温,平衡向吸热方向移动,沉淀溶解不一定吸热,如Ca(OH)2(s)溶解就放热 。
Na2O + H2O == 2NaOH,溶剂减少,溶液中 N(Na+ )减少。
思考交流
2.常温下,把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq) ΔH<0,下列有关该平衡体系的叙述,正确的打“√”,错误的打“×”。
(1)升高温度,平衡逆向移动
(2)恒温下,向溶液中加入CaO,溶液的pH升高
(3)给溶液加热,溶液的pH升高
(4)向溶液中加入少量NaOH固体,Ca(OH)2固体增多
(5)向溶液中加入Na2CO3溶液,Ca(OH)2固体增多
×
√
×
√
×
平衡向吸热方向移动,逆反应是吸热反应。
恒温,溶解度不变,饱和溶液中的离子浓度不变,pH不变。
Ca(OH)2溶解度随温度升高而减小,c(OH-)减小,pH减小。
NaOH === Na++OH-,溶液中 c(OH-)增大,Ca(OH)2沉淀溶解平衡逆向移动。
思考交流
3.将AgCl分别放入①5 mL H2O、②10 mL 0.2 mol·L-1 MgCl2溶液、
③20 mL 0.5 mol·L-1 AgNO3溶液、④40 mL 0.1 mol·L-1 HCl溶液中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是_____________(用序号表示)。
③>①>④>②
改变条件 平衡移动方向/程度 c(Ag+)
①5 mL H2O AgCl(s) Ag+ (aq) + Cl- (aq) ③ 最大
①
④
②
②10 mL 0.2 mol·L-1 MgCl2溶液 c(Cl- )=0.4 mol·L-1 逆向移动/大
③20 mL 0.5 mol·L-1 AgNO3溶液 c(Ag+)=0. 5 mol·L-1 逆向移动/最大 最小
④40 mL 0.1 mol·L-1 HCl溶液 c(Cl- )=0.1 mol·L-1 逆向移动/较小
沉淀溶解平衡
平衡移动
方向和程度
改变条件
c(Ag+)
判断
>
>
思考交流
(1)饮用纯净水能否保护牙齿?为什么?
返回
4.牙齿表面有一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3(aq)+OH-(aq)。
提示 不能。饮用纯净水,对Ca2+或的浓度没有影响,起不到保护牙齿的作用。
提示 能。牙膏中添加适量的Ca2+或会促使Ca5(PO4)3OH的沉淀溶解平衡向左移动,有利于牙齿的保护。
(2)在牙膏中添加适量的Ca2+或,能否保护牙齿?为什么?
溶度积常数
二
1. Ca2+与的浓度要具体达到多少,才会在人体内形成沉淀
我们需要获得什么样的数据才能进行计算
平衡中的定量计算依据—平衡常数 ( Ka Kb Kw Kh )
2. 难溶电解质的沉淀溶解平衡常数—K
Ksp
【问题思考】
2.表达式
难溶电解质的沉淀溶解平衡也存在平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
1.概念
AmBn(s) mAn+(aq)+nBm-(aq)
Ksp=
如:Fe(OH)3(s) Fe3+(aq)+3OH-(aq) Ksp= 。
3.影响因素
溶度积Ksp只与难溶电解质的性质和温度有关。
4.Ksp的意义
反映了难溶电解质在水中的溶解程度。
难溶物 Ksp(25 oC) 溶解度 难溶物 Ksp(25 oC) 溶解度
AgCl 1.8×10-10 mol2·L-2 1.5×10-4 BaSO4 1.1×10-10 mol2·L-2 2.4×10-4
AgBr 5.0×10-13 mol2·L-2 8.4×10-6 Fe(OH)3 2.6×10-39 mol4·L-4 3.0×10-9
AgI 8.3×10-17 mol2·L-2 2.1×10-7 Mg(OH)2 5.6×10-12 mol3·L-3 9.0×10-4
一般而言,组成类型相同的物质,Ksp越小,溶解度越小。如AgCl、AgBr、AgI。
组成类型不同的物质,溶解度应根据Ksp计算后得出。如BaSO4、Mg(OH)2。
(1)Q>Ksp,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
——定量判断给定条件下有无沉淀生成。
5.应用
AmBn(s) mAn+(aq)+nBm-(aq)
Ksp=
平衡时,才有溶度积Ksp
任意时刻(不一定平衡)
浓度商:
Q=cm(An+)·cn(Bm-)
(2)Q=Ksp,溶液饱和,沉淀与溶解处于平衡状态。
(3)Q
1.正误判断
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
(2)溶度积常数Ksp只受温度影响,温度升高,Ksp一定增大
(3)Ksp越小,难溶电解质在水中的溶解能力一定越弱
(4)改变外界条件使沉淀溶解平衡正向移动,Ksp一定增大
×
×
×
×
不一定,如 Ca(OH)2(s)溶解放热,升温, Ksp减小。
浓度幂
一般而言,组成类型相同的物质,Ksp越小,溶解度越小。如AgCl、AgBr、AgI。
Ksp只受温度影响。
思考交流
2.已知几种难溶电解质在25 ℃时的溶度积(单位省略)。
化学式 AgCl AgBr AgI Mg(OH)2 Ag2CrO4
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 5.6×10-12 2.0×10-12
(1)25 ℃时AgCl(s)、AgBr(s)、AgI(s)溶于水形成的饱和溶液中,c(Ag+)大小关系能否直接判断?三种物质的溶解能力由大到小如何排序?
提示 能。溶解能力由大到小:AgCl>AgBr>AgI。
组成相似,可直接根据Ksp判断。
思考交流
(2)能否利用上表数据直接比较25 ℃时AgCl、Mg(OH)2的溶解能力?计算分析二者溶解能力的大小?
化学式 AgCl AgBr AgI Mg(OH)2 Ag2CrO4
Ksp 1.8×10-10 5.4×10-13 8.5×10-17 5.6×10-12 2.0×10-12
思考交流
(3)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为______________,由此可得出______更难溶。
Ag2CrO4>AgCl
AgCl
Ag2CrO4(s) 2Ag+(aq) +(aq)
2x mol·L-1 x mol·L-1
AgCl饱和溶液中:c平(Ag+) ≈ 1.34×10-5 mol·L-1,
所以Ag+浓度大小顺序为Ag2CrO4>AgCl,则AgCl更难溶。
思考交流
(4)25 ℃时将等体积的4×10-3 mol·L-1的AgNO3溶液和4×10-3 mol·L-1的K2CrO4溶液混合,请通过计算说明是否有Ag2CrO4沉淀产生。
提示 等体积混合后:c(Ag+)=2×10-3 mol·L-1,c()=2×10-3 mol·L-1,Q=c2(Ag+)·c()=(2×10-3)2×2×10-3 mol3·L-3=8×10-9 mol3·L-3>Ksp(Ag2CrO4)=2.0×10-12 mol3·L-3,有Ag2CrO4沉淀产生。
思考交流
(5)25 ℃时,取一定量含有I-、Cl-的溶液,向其中滴加AgNO3溶液,当AgCl和AgI同时沉淀时,计算溶液中=_________(结果保留两位有效数字)。
4.7×10-7
AgCl和AgI同时沉淀时,溶液中的c平(Ag+)是相同的
= =
(1)Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中的离子浓度无关。
(2)对于同类型物质(如AgCl、AgBr、AgI等),可直接用溶度积比较难溶电解质的溶解能力,Ksp越大,难溶电解质在水中的溶解能力越强。
(3)对于不同类型的物质,Ksp不能直接作为比较溶解能力的依据,而应通过计算将Ksp转化为饱和溶液中溶质的物质的量浓度来确定溶解能力的强弱。
归纳总结
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
