第3章 第4节 第2课时 离子反应的应用(一) 课件(共29张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 第4节 第2课时 离子反应的应用(一) 课件(共29张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 15:12:33 | ||
图片预览








文档简介
(共29张PPT)
第2课时 离子反应的应用(一)
第3章 第4节
1.学会常见物质的检验方法,建立离子检验与推断的思维模型(重点)。
2.了解离子反应在物质的制备与纯化的应用,了解生活中的常见离子反应(难点)。
学习目标
新课导入
为什么豆腐不可与菠菜一起煮?
菠菜中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐中含有钙盐,如氯化钙等。一起煮时上述物质发生复分解反应,生成草酸钙(CaC2O4)沉淀等物质。从医学的观点看:混合食用,生成草酸钙沉淀,是产生结石的诱因;从营养学的观点看:混合食用会破坏它们的营养成分。
离子的检验与推断
一
1.常见阳离子的检验
检验离子 试剂与方法 现象
Fe3+ 加入NaOH溶液 产生红褐色沉淀
Fe2+ 产生白色沉淀→迅速变为灰绿色→最后变为红褐色
Al3+ 开始生成白色沉淀→加至过量沉淀溶解
Cu2+ 生成蓝色沉淀
加入NaOH溶液并加热 生成可使湿润的红色石蕊试纸变蓝的气体
Fe3+ 加入KSCN溶液 溶液呈血红色
Fe2+ 加入KSCN溶液→再加入氯水 开始无明显现象,加氯水后溶液呈血红色
加入K3[Fe(CN)6] 生成蓝色沉淀
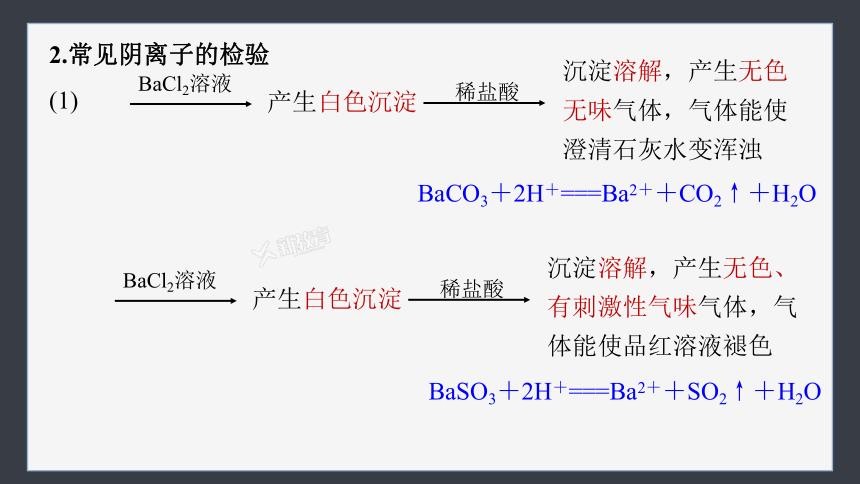
2.常见阴离子的检验
(1)
BaCl2溶液
产生白色沉淀
稀盐酸
沉淀溶解,产生无色无味气体,气体能使澄清石灰水变浑浊
BaCO3+2H+===Ba2++CO2↑+H2O
BaCl2溶液
产生白色沉淀
稀盐酸
沉淀溶解,产生无色、有刺激性气味气体,气体能使品红溶液褪色
BaSO3+2H+===Ba2++SO2↑+H2O
2.常见阴离子的检验
(1)
产生白色沉淀
稀盐酸
无现象
BaCl2溶液
顺序能否颠倒?
(2)
白
Cl-+Ag+===AgCl↓
浅黄
Br-+Ag+===AgBr↓
黄
I-+Ag+===AgI↓
(2)
橙红
2Br-+Cl2===Br2+2Cl-
蓝
2I-+Cl2===I2+2Cl-
3.离子推断的方法
肯定原则
互斥原则
电中性原则
进出原则
据现象推断肯定存在或肯定不存在的离子
实验中反应生成的离子或引入的离子对后续实验的干扰
肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在
注意题目中的隐含条件
溶液呈电中性,且溶液中阴、阳离子所带正电荷总数相等
4.电荷守恒在定量型离子推断试题中的应用
离子定量推断试题常根据离子的物质的量(或浓度)定量推断最后一种离子的存在:
如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
思考交流
1.正误判断
×
(3)向某溶液中滴加氯水,再加入KSCN溶液,溶液变血红色,溶液中不一定存在Fe2+
(4)做某溶液的焰色试验,火焰呈黄色,溶液中一定存在钠元素,不可能存在钾元素
×
√
×
思考交流
2.对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是
A.步骤①所加试剂可以是浓KOH溶液
C.可以用湿润的蓝色石蕊试纸检验生成的无色气体
√
思考交流
3.某学生欲确定某盐的成分,将其配成溶液甲,鉴定流程如图所示:
下列说法正确的是
A.如果甲中含有S2-,则乙是硫黄沉淀
B.丙中肯定含有Fe3+,所以甲是FeBr2溶液
C.甲中含有铁元素,可能显+2价或+3价
D.若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有
Fe2+
√
AgBr
Fe3+
Fe2+、Fe3+
不可能含有S2-,
不一定为FeBr2
可能是溴离子被氧化
生活中常见的离子反应 物质的制备与纯化
二
1.物质的制备:
3.用离子反应揭示生产生活中的某些现象变化的本质。
利用离子反应,将离子转化为目标物质。
2.物质的纯化:利用离子反应将杂质离子转化为沉淀或气体除去。
思考交流
1.按要求完成制备物质的离子方程式。
(1)实验室制取CO2:_________________________________。
(2)实验室可用KMnO4与浓盐酸反应制取氯气:____________________
________________________。
CaCO3+2H+===Ca2++CO2↑+H2O
===2Mn2++5Cl2↑+8H2O
思考交流
2.从海水中提取二氧化碳
(1)a室为_____室,发生反应为____________
______________。
(2)c室为_____室,发生反应为____________
________________。
阳极
2H2O-4e-
===O2↑+4H+
阴极
4H2O+4e-
===4OH-+2H2↑
(3)a室产生的____通过阳离子交换膜进入b室,与b室中的_______发生反应,生成二氧化碳:_________________________。
H+
思考交流
3.制备高纯度的氯化钠:除去其中少量的 、Mg2+、Ca2+,需要的试剂及加入的正确顺序是______________________________________
(答案合理均可)。
NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
在进行物质的纯化时的注意事项
(1)根据杂质离子选择相应的除杂试剂。
(2)除杂时,所加试剂要过量。
(3)如果有多种杂质,则要确定添加试剂的顺序,保证后加的试剂能将前面过量的试剂和杂质除去。
(4)不能引入新的杂质。
归纳总结
思考交流
4.铬是造成水体重度污染的元素之一,还原沉淀法是水体除铬的常用方法。
向水体中加入FeSO4、CaSO3等将高毒性Cr(Ⅵ)还原为低毒性Cr(Ⅲ),再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
(1)Cr(Ⅵ)在水溶液中的存在形态分布如图甲所示。向pH=1.5的含Cr(Ⅵ)污水中
加入FeSO4,发生的主要反应的离子方程式为_____________________
______________________。
===3Fe3++Cr3++4H2O
思考交流
(2)Cr(Ⅲ)在水溶液中的存在形态分布如图乙所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为__________________________。
Cr(OH)3+OH-===[Cr(OH)4]-
思考交流
5.生活中常见的离子反应
(1)胃酸过多的治疗
①服用小苏打片(胃溃疡患者慎用):
离子反应为________________________。
②服用“胃舒平”:
离子反应为____________________________。
Al(OH)3+3H+===Al3++3H2O
思考交流
(2)硬水的形成及软化
①含义:自然界里含______、______较多的水。
②形成(暂时硬水)
主要的离子反应为MgCO3+CO2+H2O===_____________;
CaCO3+CO2+H2O===_____________。
Ca2+
Mg2+
思考交流
③软化方法
CaCO3↓+CO2↑+H2O
b.加沉淀剂法:在硬水中加入________等沉淀剂,离子反应为_______
________________;_______________________。
Na2CO3
Ca2++
1
2
3
自我测试
1.除去下列括号内杂质的试剂正确且除杂过程涉及氧化还原反应的是
A.N2(O2):镁粉
B.FeCl2溶液(FeCl3):Cl2
C.CO2(SO2):酸性KMnO4溶液、浓硫酸
D.NaCl溶液(MgCl2):NaOH溶液、稀盐酸
√
1
2
3
自我测试
2.(2022·全国乙卷,9)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
√
√
√
Na2SO3、Na2CO3与过量稀盐酸反应的现象可以被Na2S2O3与过量稀盐酸反应的现象覆盖掉
1
2
3
自我测试
3.一种用软锰矿(主要成分是MnO2、Al2O3、SiO2)和黄铁矿(主要成分是FeS2、SiO2)为原料制取MnSO4溶液的流程如下:
(1)“浸出”后溶液中含有阳离子H+、Fe2+、Mn2+等,“浸出”过程中MnO2反应的离子方程式为__________________________________________。
MnO2+FeS2+4H+===Mn2++Fe2++2S+2H2O
(2)“氧化”过程中发生反应的离子方程式为________________________
_____________。
2Fe2++H2O2+2H+===
2Fe3++2H2O
第2课时 离子反应的应用(一)
第3章 第4节
1.学会常见物质的检验方法,建立离子检验与推断的思维模型(重点)。
2.了解离子反应在物质的制备与纯化的应用,了解生活中的常见离子反应(难点)。
学习目标
新课导入
为什么豆腐不可与菠菜一起煮?
菠菜中含有丰富的草酸(H2C2O4)、草酸钠(Na2C2O4),豆腐中含有钙盐,如氯化钙等。一起煮时上述物质发生复分解反应,生成草酸钙(CaC2O4)沉淀等物质。从医学的观点看:混合食用,生成草酸钙沉淀,是产生结石的诱因;从营养学的观点看:混合食用会破坏它们的营养成分。
离子的检验与推断
一
1.常见阳离子的检验
检验离子 试剂与方法 现象
Fe3+ 加入NaOH溶液 产生红褐色沉淀
Fe2+ 产生白色沉淀→迅速变为灰绿色→最后变为红褐色
Al3+ 开始生成白色沉淀→加至过量沉淀溶解
Cu2+ 生成蓝色沉淀
加入NaOH溶液并加热 生成可使湿润的红色石蕊试纸变蓝的气体
Fe3+ 加入KSCN溶液 溶液呈血红色
Fe2+ 加入KSCN溶液→再加入氯水 开始无明显现象,加氯水后溶液呈血红色
加入K3[Fe(CN)6] 生成蓝色沉淀
2.常见阴离子的检验
(1)
BaCl2溶液
产生白色沉淀
稀盐酸
沉淀溶解,产生无色无味气体,气体能使澄清石灰水变浑浊
BaCO3+2H+===Ba2++CO2↑+H2O
BaCl2溶液
产生白色沉淀
稀盐酸
沉淀溶解,产生无色、有刺激性气味气体,气体能使品红溶液褪色
BaSO3+2H+===Ba2++SO2↑+H2O
2.常见阴离子的检验
(1)
产生白色沉淀
稀盐酸
无现象
BaCl2溶液
顺序能否颠倒?
(2)
白
Cl-+Ag+===AgCl↓
浅黄
Br-+Ag+===AgBr↓
黄
I-+Ag+===AgI↓
(2)
橙红
2Br-+Cl2===Br2+2Cl-
蓝
2I-+Cl2===I2+2Cl-
3.离子推断的方法
肯定原则
互斥原则
电中性原则
进出原则
据现象推断肯定存在或肯定不存在的离子
实验中反应生成的离子或引入的离子对后续实验的干扰
肯定某些离子存在的同时,结合离子共存规律,否定一些离子的存在
注意题目中的隐含条件
溶液呈电中性,且溶液中阴、阳离子所带正电荷总数相等
4.电荷守恒在定量型离子推断试题中的应用
离子定量推断试题常根据离子的物质的量(或浓度)定量推断最后一种离子的存在:
如果多种离子共存,且只有一种离子的物质的量未知,可以用电荷守恒来确定最后一种离子是否存在,即阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
思考交流
1.正误判断
×
(3)向某溶液中滴加氯水,再加入KSCN溶液,溶液变血红色,溶液中不一定存在Fe2+
(4)做某溶液的焰色试验,火焰呈黄色,溶液中一定存在钠元素,不可能存在钾元素
×
√
×
思考交流
2.对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是
A.步骤①所加试剂可以是浓KOH溶液
C.可以用湿润的蓝色石蕊试纸检验生成的无色气体
√
思考交流
3.某学生欲确定某盐的成分,将其配成溶液甲,鉴定流程如图所示:
下列说法正确的是
A.如果甲中含有S2-,则乙是硫黄沉淀
B.丙中肯定含有Fe3+,所以甲是FeBr2溶液
C.甲中含有铁元素,可能显+2价或+3价
D.若甲溶液滴加酸性KMnO4溶液,溶液变为黄色,则甲中一定含有
Fe2+
√
AgBr
Fe3+
Fe2+、Fe3+
不可能含有S2-,
不一定为FeBr2
可能是溴离子被氧化
生活中常见的离子反应 物质的制备与纯化
二
1.物质的制备:
3.用离子反应揭示生产生活中的某些现象变化的本质。
利用离子反应,将离子转化为目标物质。
2.物质的纯化:利用离子反应将杂质离子转化为沉淀或气体除去。
思考交流
1.按要求完成制备物质的离子方程式。
(1)实验室制取CO2:_________________________________。
(2)实验室可用KMnO4与浓盐酸反应制取氯气:____________________
________________________。
CaCO3+2H+===Ca2++CO2↑+H2O
===2Mn2++5Cl2↑+8H2O
思考交流
2.从海水中提取二氧化碳
(1)a室为_____室,发生反应为____________
______________。
(2)c室为_____室,发生反应为____________
________________。
阳极
2H2O-4e-
===O2↑+4H+
阴极
4H2O+4e-
===4OH-+2H2↑
(3)a室产生的____通过阳离子交换膜进入b室,与b室中的_______发生反应,生成二氧化碳:_________________________。
H+
思考交流
3.制备高纯度的氯化钠:除去其中少量的 、Mg2+、Ca2+,需要的试剂及加入的正确顺序是______________________________________
(答案合理均可)。
NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
在进行物质的纯化时的注意事项
(1)根据杂质离子选择相应的除杂试剂。
(2)除杂时,所加试剂要过量。
(3)如果有多种杂质,则要确定添加试剂的顺序,保证后加的试剂能将前面过量的试剂和杂质除去。
(4)不能引入新的杂质。
归纳总结
思考交流
4.铬是造成水体重度污染的元素之一,还原沉淀法是水体除铬的常用方法。
向水体中加入FeSO4、CaSO3等将高毒性Cr(Ⅵ)还原为低毒性Cr(Ⅲ),再调节pH使Cr(Ⅲ)生成Cr(OH)3沉淀除去。
(1)Cr(Ⅵ)在水溶液中的存在形态分布如图甲所示。向pH=1.5的含Cr(Ⅵ)污水中
加入FeSO4,发生的主要反应的离子方程式为_____________________
______________________。
===3Fe3++Cr3++4H2O
思考交流
(2)Cr(Ⅲ)在水溶液中的存在形态分布如图乙所示。当pH>12时,铬去除率下降的原因可用离子方程式表示为__________________________。
Cr(OH)3+OH-===[Cr(OH)4]-
思考交流
5.生活中常见的离子反应
(1)胃酸过多的治疗
①服用小苏打片(胃溃疡患者慎用):
离子反应为________________________。
②服用“胃舒平”:
离子反应为____________________________。
Al(OH)3+3H+===Al3++3H2O
思考交流
(2)硬水的形成及软化
①含义:自然界里含______、______较多的水。
②形成(暂时硬水)
主要的离子反应为MgCO3+CO2+H2O===_____________;
CaCO3+CO2+H2O===_____________。
Ca2+
Mg2+
思考交流
③软化方法
CaCO3↓+CO2↑+H2O
b.加沉淀剂法:在硬水中加入________等沉淀剂,离子反应为_______
________________;_______________________。
Na2CO3
Ca2++
1
2
3
自我测试
1.除去下列括号内杂质的试剂正确且除杂过程涉及氧化还原反应的是
A.N2(O2):镁粉
B.FeCl2溶液(FeCl3):Cl2
C.CO2(SO2):酸性KMnO4溶液、浓硫酸
D.NaCl溶液(MgCl2):NaOH溶液、稀盐酸
√
1
2
3
自我测试
2.(2022·全国乙卷,9)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:
①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。
该样品中确定存在的是
A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3
C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
√
√
√
Na2SO3、Na2CO3与过量稀盐酸反应的现象可以被Na2S2O3与过量稀盐酸反应的现象覆盖掉
1
2
3
自我测试
3.一种用软锰矿(主要成分是MnO2、Al2O3、SiO2)和黄铁矿(主要成分是FeS2、SiO2)为原料制取MnSO4溶液的流程如下:
(1)“浸出”后溶液中含有阳离子H+、Fe2+、Mn2+等,“浸出”过程中MnO2反应的离子方程式为__________________________________________。
MnO2+FeS2+4H+===Mn2++Fe2++2S+2H2O
(2)“氧化”过程中发生反应的离子方程式为________________________
_____________。
2Fe2++H2O2+2H+===
2Fe3++2H2O
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
