第3章 第4节 第1课时 离子反应发生的条件 课件(共25张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 第4节 第1课时 离子反应发生的条件 课件(共25张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 15:14:36 | ||
图片预览








文档简介
(共25张PPT)
第1课时 离子反应发生的条件
第3章 第4节
学习目标
1.通过分析离子反应的实质和离子反应发生的条件培养变化观念与平衡思想。
2.能依据要求判断离子方程式的正误或书写离子方程式。
新课导入
美丽的离子反应
离子反应发生的条件
一
1.离子反应
(1)定义:
溶液中离子之间以及离子与原子或分子之间发生的反应。
(2)实质:溶液中某种或某些离子浓度降低。
(3)表示方法:通常用离子方程式表示。
思考讨论
(1)Na2SO4溶液与BaCl2溶液。
(2)石灰乳[Ca(OH)2浊液]与Na2CO3溶液。
(3)Na2CO3溶液与盐酸。
(4)盐酸与锌粒
(5)CH3COONa溶液与盐酸
(6)KI溶液与溴水
以下两种物质混合时,溶液中存在哪些离子 哪些离子之间会发生反应 写出有关反应的离子方程式。
+Ba2+ ===BaSO4↓
Ca(OH)2+===CaCO3 ↓ +2OH-
+2H+===H2O+CO2↑
Zn+2H+===Zn2++H2↑
CH3COO-+H+===CH3COOH
2I-+Br2===2Br-+I2
有沉淀生成
有气体生成
有弱电解质生成
有氧化还原反应发生
你还学过哪些离子反应
它们各有什么特点
你认为在满足哪些条件时离子反应能够发生
为什么在这些条件下离子反应能够发生
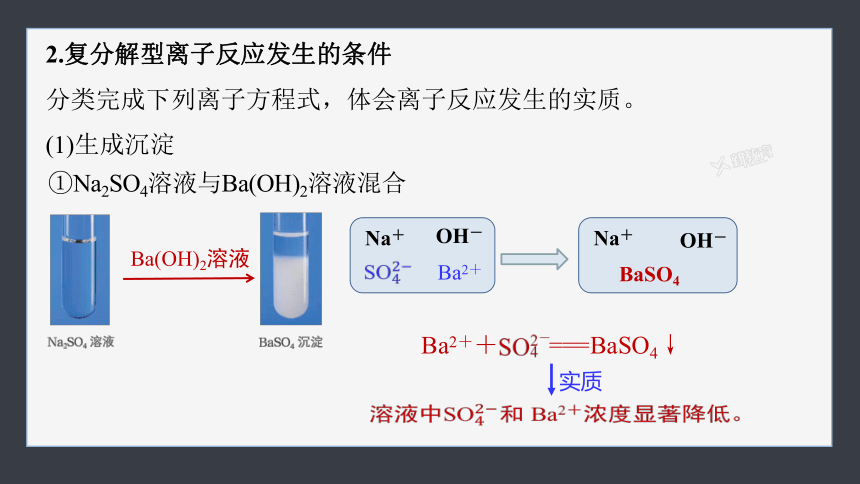
2.复分解型离子反应发生的条件
分类完成下列离子方程式,体会离子反应发生的实质。
(1)生成沉淀
Ba2++ ===BaSO4↓
Ba(OH)2溶液
①Na2SO4溶液与Ba(OH)2溶液混合
Ba2+
Na+
OH-
BaSO4
Na+
OH-
溶液中和 Ba2+浓度显著降低。
实质
②沉淀的转化,向MgCO3悬浊液中加入NaOH溶液。
MgCO3+2OH-===Mg(OH)2+
MgCO3 Mg2+ +
2NaOH === 2OH-+2Na+
Mg(OH)2
总结:离子反应形成沉淀会使相应的离子浓度降低。
沉淀的转化是一种难溶电解质在水中电离生成的离子与其他离子反应,生成另一种难溶电解质,使相应离子的浓度降低,促进原沉淀继续溶解并转化为新的沉淀的过程。
MgCO3在水中电离出Mg2+,与OH-结合生成了更难溶的Mg(OH)2沉淀,使Mg2+浓度降低,促进MgCO3继续溶解,转化为新的沉淀Mg(OH)2 。
(2)生成弱电解质
①NaOH溶液与盐酸混合。
②盐酸与CH3COONa溶液混合。
③向NH4NO3溶液中加入NaOH稀溶液。
H++OH-===H2O
H++CH3COO-===CH3COOH
+OH-===NH3·H2O
强酸制弱酸
强碱制弱碱
(3)生成气体(或挥发性物质)
①Na2CO3溶液与稀硫酸混合。
②向NH4NO3溶液中加入NaOH浓溶液。
+2H+===H2O+CO2↑
+OH-===NH3↑+H2O
总结:生成气体的离子反应与生成弱电解质的离子反应本质上是相同的,它们生成的也是弱电解质,只是由于某些弱电解质不稳定,进一步分解生成气体逸出,从而发生有关的离子反应。
3.氧化还原型离子反应
(1)一般的氧化还原反应
在溶液中,具有氧化性的离子和具有还原性的离子相遇时,二者能发生氧化还原反应而使离子浓度降低。
完成下列离子方程式。
①向FeSO4溶液中加入酸性KMnO4溶液:
。
②向CH2SO4溶液中加入锌片: 。
③用FeCl3溶液腐蚀印刷电路铜板: 。
5Fe2++ +8H+===5Fe3++Mn2++4H2O
Zn+2H+===Zn2++H2↑
2Fe3++Cu===2Fe2++Cu2+
(2)电化学中电池反应的离子方程式
①铜锌原电池的电池反应 。
②电解饱和食盐水的反应 。
4.其他类型的离子反应
(1)相互促进的水解反应
硫酸铝溶液与碳酸氢钠溶液混合 。
(2)络合反应
Fe3+与KSCN反应 。
2Cl-+2H2O 2OH-+H2↑+Cl2↑。
Fe3++3SCN- Fe(SCN)3
Al3++3 ===Al(OH)3↓+3CO2↑
Cu2++Zn===Cu+Zn2+
思考交流
复杂离子方程式的书写
(1)Ca(HCO3)2溶液与NaOH溶液反应:
①NaOH不足:_________________________________;
②NaOH过量:___________________________________________。
“少定多变”法书写与量有关的离子方程式
先根据题给条件判断“少量物质”,以“少量物质”的离子计量数(充分反应)确定所需“过量物质”的离子数目。
如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为
归纳总结
思考交流
(2)向含有Fe2+、Cl-、Na+、H+的溶液中滴入H2O2:______________
____________________。
(3)离子竞争型氧化还原反应
多种还原性离子共存并且浓度相近时,向其中加入强氧化剂,一般是___________的离子首先被氧化。多种氧化性离子共存并且浓度相近时,向其中加入强还原剂,一般是__________的离子首先被还原。如,向FeBr2溶液中通入Cl2,按要求完成下列离子方程式。
2Fe2++H2O2+
2H+===2Fe3++2H2O
还原性最强
氧化性最强
思考交流
①通入少量Cl2:_________________________。
②通入过量Cl2:______________________________________。
③通入Cl2,满足n(FeBr2)∶n(Cl2)=1∶1:________________________
_________________。
Cl2+2Fe2+===2Fe3++2Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
2Fe2++2Br-+2Cl2===
2Fe3++Br2+4Cl-
返回
离子能否大量共存的判断方法
二
1.离子共存的本质
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的四个方面
生成沉淀(或微溶性物质)
生成难电离的物质或气体
溶液中会发生氧化还原反应
发生相互促进的水解反应
均不能大量共存
思考交流
1.下列各组离子在指定的溶液中,一定能大量共存的是_____(填序号)。
①含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-
③⑦
思考交流
2.S2-与 ,Cl-与ClO-在碱性条件下能否大量共存:___(填“能”或“不能”)。写出上述两组离子在酸性条件下反应的离子方程式:______________________________、____________________________
_____。
能
Cl-+ClO-+2H+===Cl2↑+
H2O
判断离子能否大量共存的注意事项
(1)在做有关离子共存题目时,还应注意题干中的“关键词”,如
①“一定大量共存”还是“可能大量共存”。
②“透明溶液”还是“无色透明溶液”,CuSO4溶液为蓝色透明溶液,NaCl溶液为无色透明溶液。
③“酸性”“碱性”或其他指定离子。
(2)常见有颜色的离子
练后反思
1
2
3
自我测试
1.(2021·福建,6)室温下,下列各组离子一定能与指定溶液共存的是
4
D.0.1 mol·L-1的Ba(OH)2溶液:Na+、K+、Cl-、ClO-
√
相互促进水解,生成硅酸沉淀
生成络合物
发生氧化还原反应
1
2
3
自我测试
2.(2021·湖南,12)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
4
粒子组 判断和分析
A Na+、Al3+、Cl-、NH3·H2O 不能大量共存,因发生反应:
Al3++4NH3·H2O===[Al(OH)4]-+4
B 不能大量共存,因发生反应:
C 能大量共存,粒子间不反应
D 能大量共存,粒子间不反应
√
生成Al(OH)3沉淀
Fe3+会催化H2O2分解
1
2
3
自我测试
3.(2022·广东,14)下列关于Na的化合物之间转化反应的离子方程式书写正确的是
4
B.碱转化为两种盐:2OH-+Cl2===ClO-+Cl-+H2O
D.盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
√
Na2O2不能拆成离子
要写成离子
自我测试
4.(2021·湖北,4)对于下列实验,不能正确描述其反应的离子方程式的是
A.向氢氧化钡溶液中加入盐酸:H++OH-===H2O
B.向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-===AgI↓
C.向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O===2[Al(OH)4]-+
3H2↑
1
2
3
4
√
产物是CaCO3和HClO,离子方程式为Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO。
第1课时 离子反应发生的条件
第3章 第4节
学习目标
1.通过分析离子反应的实质和离子反应发生的条件培养变化观念与平衡思想。
2.能依据要求判断离子方程式的正误或书写离子方程式。
新课导入
美丽的离子反应
离子反应发生的条件
一
1.离子反应
(1)定义:
溶液中离子之间以及离子与原子或分子之间发生的反应。
(2)实质:溶液中某种或某些离子浓度降低。
(3)表示方法:通常用离子方程式表示。
思考讨论
(1)Na2SO4溶液与BaCl2溶液。
(2)石灰乳[Ca(OH)2浊液]与Na2CO3溶液。
(3)Na2CO3溶液与盐酸。
(4)盐酸与锌粒
(5)CH3COONa溶液与盐酸
(6)KI溶液与溴水
以下两种物质混合时,溶液中存在哪些离子 哪些离子之间会发生反应 写出有关反应的离子方程式。
+Ba2+ ===BaSO4↓
Ca(OH)2+===CaCO3 ↓ +2OH-
+2H+===H2O+CO2↑
Zn+2H+===Zn2++H2↑
CH3COO-+H+===CH3COOH
2I-+Br2===2Br-+I2
有沉淀生成
有气体生成
有弱电解质生成
有氧化还原反应发生
你还学过哪些离子反应
它们各有什么特点
你认为在满足哪些条件时离子反应能够发生
为什么在这些条件下离子反应能够发生
2.复分解型离子反应发生的条件
分类完成下列离子方程式,体会离子反应发生的实质。
(1)生成沉淀
Ba2++ ===BaSO4↓
Ba(OH)2溶液
①Na2SO4溶液与Ba(OH)2溶液混合
Ba2+
Na+
OH-
BaSO4
Na+
OH-
溶液中和 Ba2+浓度显著降低。
实质
②沉淀的转化,向MgCO3悬浊液中加入NaOH溶液。
MgCO3+2OH-===Mg(OH)2+
MgCO3 Mg2+ +
2NaOH === 2OH-+2Na+
Mg(OH)2
总结:离子反应形成沉淀会使相应的离子浓度降低。
沉淀的转化是一种难溶电解质在水中电离生成的离子与其他离子反应,生成另一种难溶电解质,使相应离子的浓度降低,促进原沉淀继续溶解并转化为新的沉淀的过程。
MgCO3在水中电离出Mg2+,与OH-结合生成了更难溶的Mg(OH)2沉淀,使Mg2+浓度降低,促进MgCO3继续溶解,转化为新的沉淀Mg(OH)2 。
(2)生成弱电解质
①NaOH溶液与盐酸混合。
②盐酸与CH3COONa溶液混合。
③向NH4NO3溶液中加入NaOH稀溶液。
H++OH-===H2O
H++CH3COO-===CH3COOH
+OH-===NH3·H2O
强酸制弱酸
强碱制弱碱
(3)生成气体(或挥发性物质)
①Na2CO3溶液与稀硫酸混合。
②向NH4NO3溶液中加入NaOH浓溶液。
+2H+===H2O+CO2↑
+OH-===NH3↑+H2O
总结:生成气体的离子反应与生成弱电解质的离子反应本质上是相同的,它们生成的也是弱电解质,只是由于某些弱电解质不稳定,进一步分解生成气体逸出,从而发生有关的离子反应。
3.氧化还原型离子反应
(1)一般的氧化还原反应
在溶液中,具有氧化性的离子和具有还原性的离子相遇时,二者能发生氧化还原反应而使离子浓度降低。
完成下列离子方程式。
①向FeSO4溶液中加入酸性KMnO4溶液:
。
②向CH2SO4溶液中加入锌片: 。
③用FeCl3溶液腐蚀印刷电路铜板: 。
5Fe2++ +8H+===5Fe3++Mn2++4H2O
Zn+2H+===Zn2++H2↑
2Fe3++Cu===2Fe2++Cu2+
(2)电化学中电池反应的离子方程式
①铜锌原电池的电池反应 。
②电解饱和食盐水的反应 。
4.其他类型的离子反应
(1)相互促进的水解反应
硫酸铝溶液与碳酸氢钠溶液混合 。
(2)络合反应
Fe3+与KSCN反应 。
2Cl-+2H2O 2OH-+H2↑+Cl2↑。
Fe3++3SCN- Fe(SCN)3
Al3++3 ===Al(OH)3↓+3CO2↑
Cu2++Zn===Cu+Zn2+
思考交流
复杂离子方程式的书写
(1)Ca(HCO3)2溶液与NaOH溶液反应:
①NaOH不足:_________________________________;
②NaOH过量:___________________________________________。
“少定多变”法书写与量有关的离子方程式
先根据题给条件判断“少量物质”,以“少量物质”的离子计量数(充分反应)确定所需“过量物质”的离子数目。
如向Ca(HCO3)2溶液中加入过量NaOH溶液的离子方程式的书写方法为
归纳总结
思考交流
(2)向含有Fe2+、Cl-、Na+、H+的溶液中滴入H2O2:______________
____________________。
(3)离子竞争型氧化还原反应
多种还原性离子共存并且浓度相近时,向其中加入强氧化剂,一般是___________的离子首先被氧化。多种氧化性离子共存并且浓度相近时,向其中加入强还原剂,一般是__________的离子首先被还原。如,向FeBr2溶液中通入Cl2,按要求完成下列离子方程式。
2Fe2++H2O2+
2H+===2Fe3++2H2O
还原性最强
氧化性最强
思考交流
①通入少量Cl2:_________________________。
②通入过量Cl2:______________________________________。
③通入Cl2,满足n(FeBr2)∶n(Cl2)=1∶1:________________________
_________________。
Cl2+2Fe2+===2Fe3++2Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
2Fe2++2Br-+2Cl2===
2Fe3++Br2+4Cl-
返回
离子能否大量共存的判断方法
二
1.离子共存的本质
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的四个方面
生成沉淀(或微溶性物质)
生成难电离的物质或气体
溶液中会发生氧化还原反应
发生相互促进的水解反应
均不能大量共存
思考交流
1.下列各组离子在指定的溶液中,一定能大量共存的是_____(填序号)。
①含有大量Fe3+的溶液:Na+、SCN-、Cl-、I-
③⑦
思考交流
2.S2-与 ,Cl-与ClO-在碱性条件下能否大量共存:___(填“能”或“不能”)。写出上述两组离子在酸性条件下反应的离子方程式:______________________________、____________________________
_____。
能
Cl-+ClO-+2H+===Cl2↑+
H2O
判断离子能否大量共存的注意事项
(1)在做有关离子共存题目时,还应注意题干中的“关键词”,如
①“一定大量共存”还是“可能大量共存”。
②“透明溶液”还是“无色透明溶液”,CuSO4溶液为蓝色透明溶液,NaCl溶液为无色透明溶液。
③“酸性”“碱性”或其他指定离子。
(2)常见有颜色的离子
练后反思
1
2
3
自我测试
1.(2021·福建,6)室温下,下列各组离子一定能与指定溶液共存的是
4
D.0.1 mol·L-1的Ba(OH)2溶液:Na+、K+、Cl-、ClO-
√
相互促进水解,生成硅酸沉淀
生成络合物
发生氧化还原反应
1
2
3
自我测试
2.(2021·湖南,12)对下列粒子组在溶液中能否大量共存的判断和分析均正确的是
4
粒子组 判断和分析
A Na+、Al3+、Cl-、NH3·H2O 不能大量共存,因发生反应:
Al3++4NH3·H2O===[Al(OH)4]-+4
B 不能大量共存,因发生反应:
C 能大量共存,粒子间不反应
D 能大量共存,粒子间不反应
√
生成Al(OH)3沉淀
Fe3+会催化H2O2分解
1
2
3
自我测试
3.(2022·广东,14)下列关于Na的化合物之间转化反应的离子方程式书写正确的是
4
B.碱转化为两种盐:2OH-+Cl2===ClO-+Cl-+H2O
D.盐转化为另一种盐:Na2SiO3+2H+===H2SiO3↓+2Na+
√
Na2O2不能拆成离子
要写成离子
自我测试
4.(2021·湖北,4)对于下列实验,不能正确描述其反应的离子方程式的是
A.向氢氧化钡溶液中加入盐酸:H++OH-===H2O
B.向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-===AgI↓
C.向烧碱溶液中加入一小段铝片:2Al+2OH-+6H2O===2[Al(OH)4]-+
3H2↑
1
2
3
4
√
产物是CaCO3和HClO,离子方程式为Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
