第3章 第1节 第1课时 水的电离 电解质在水溶液中的存在形态 课件(29页)2023-2024学年高二化学鲁科版(2019)选择性必修第一册
文档属性
| 名称 | 第3章 第1节 第1课时 水的电离 电解质在水溶液中的存在形态 课件(29页)2023-2024学年高二化学鲁科版(2019)选择性必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 179.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 15:16:23 | ||
图片预览





文档简介
第3章 第1节
第1课时 水的电离 电解质在
水溶液中的存在形态
1.认识水的电离存在电离平衡;了解水的电离平衡及影响因素,会分析水的电
离平衡移动;理解水的离子积常数,并能用其进行相关计算(重、难点)。
2.通过分析、推理等方法了解强、弱电解质的区别和弱电解质的电离特点,会
书写常见电解质的电离方程式。
3.了解电解质溶液的导电性。
学习目标
水的电离
一
电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗?为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会是怎样的?
水的电离极其微弱
电导率仪
联想·质疑
H2O H++OH-
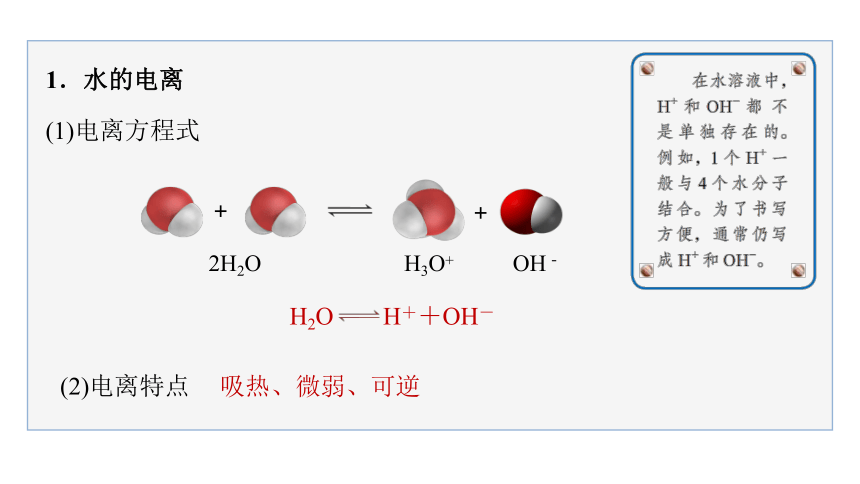
1.水的电离
(1)电离方程式
+
+
2H2O
OH-
H3O+
(2)电离特点
吸热、微弱、可逆
H2O H++OH-
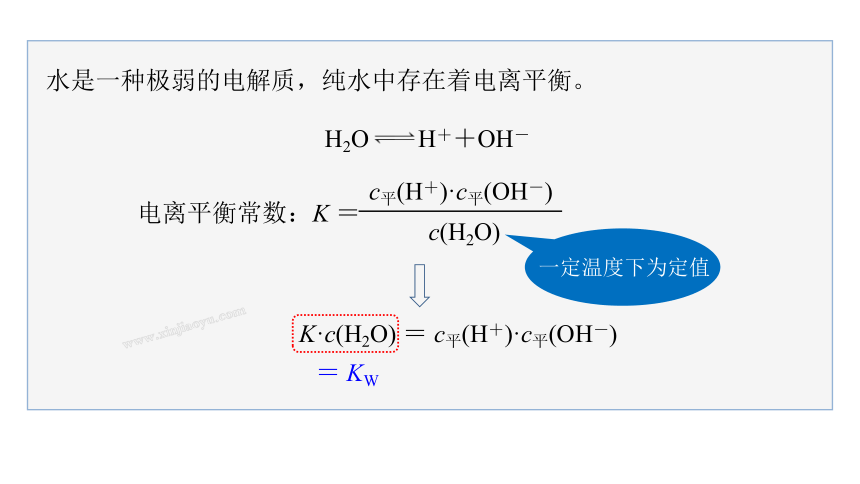
水是一种极弱的电解质,纯水中存在着电离平衡。
K·c(H2O) = c平(H+)·c平(OH-)
电离平衡常数:K =
c平(H+)·c平(OH-)
c(H2O)
= KW
一定温度下为定值
2.水的离子积常数
表达式:
适用范围:Kw 适用于纯水及稀的电解质水溶液
影响因素:
Kw=c平(H+)·c平(OH-)
只与温度有关,随温度的升高, Kw增大
25℃时,Kw=1.0×10-14 mol2·L-2
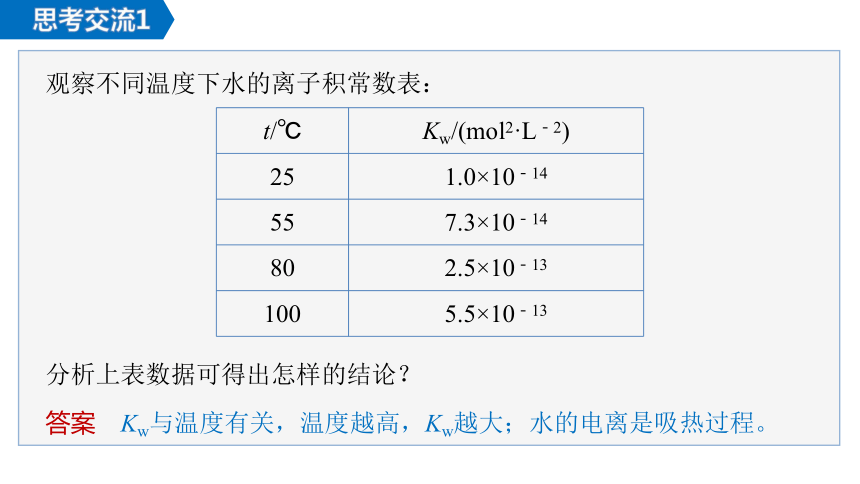
思考交流1
观察不同温度下水的离子积常数表:
{BC89EF96-8CEA-46FF-86C4-4CE0E7609802}t/℃
Kw/(mol2·L-2)
25
1.0×10-14
55
7.3×10-14
80
2.5×10-13
100
5.5×10-13
分析上表数据可得出怎样的结论?
答案 Kw与温度有关,温度越高,Kw越大;水的电离是吸热过程。
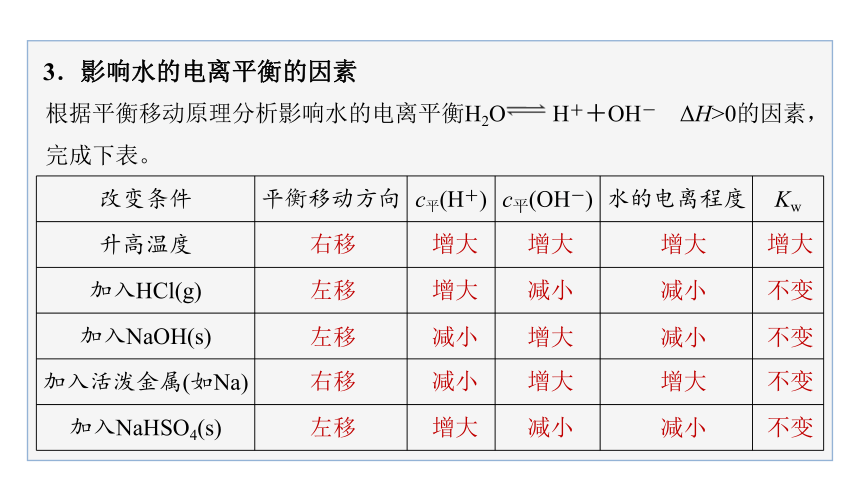
3.影响水的电离平衡的因素
根据平衡移动原理分析影响水的电离平衡H2O H++OH- ΔH>0的因素,完成下表。
改变条件
平衡移动方向
c平(H+)
c平(OH-)
水的电离程度
Kw
升高温度
加入HCl(g)
加入NaOH(s)
加入活泼金属(如Na)
加入NaHSO4(s)
右移
增大
增大
增大
增大
左移
增大
减小
减小
不变
左移
减小
增大
减小
不变
右移
减小
增大
增大
不变
左移
增大
减小
减小
不变
思考交流2
1.正误判断
(1)升高温度,水的电离程度减小
(2)向水中加入少量氨水,水的电离平衡逆向移动,c平(OH-)降低
(3)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小
(4)溶液中c平(H+)、c平(OH-)可能不同,但水电离出的H+与OH-总是相等的
×
×
×
√
思考交流2
2.分析下列过程中H2O的电离程度的变化(25 ℃)。
(1)Zn与稀硫酸反应制H2:_____。
(2)氨水加水稀释时:_____。
(3)向NaOH溶液中滴入盐酸至过量:_____________。
(4)向SO2水溶液中通入Cl2至恰好反应:_____。
增大
增大
先增大后减小
减小
返回
水的离子积常数的应用
二
1.计算酸(或碱)溶液中水电离的c水(H+)或c水(OH-)
(1)25 ℃时,0.1 mol·L-1的稀盐酸中,水电离的c水(H+)、c水(OH-)各为多少?
c水(H+) 很小,可忽略,c总(H+)≈c(HCl)=0.1 mol·L-1
酸溶液中的OH-全部由水电离产生
水电离产生的H+与OH-的浓度相同,则
c水(OH-)=c水(H+)=1.0×10-13 mol·L-1
酸电离的H+抑制水的电离
(2)25 ℃时,0.01 mol·L-1的NaOH溶液中,水电离的c水(H+)、c水(OH-)各为多少?
c水(OH-) 很小,可忽略,c总(OH-)≈c(NaOH)=0.01 mol·L-1
碱溶液中的H+全部由水电离产生
水电离产生的H+与OH-的浓度相同,则
c水(H+)=c水(OH-)=1.0×10-12 mol·L-1
碱电离的OH-抑制水的电离
归纳总结
酸或碱溶液中c水(H+)、c水(OH-)的计算方法
(1)在酸或碱溶液中水的电离虽然受到抑制,但c水(H+)=c水(OH-)。
(2)酸溶液中c水(H+)=c水(OH-)= [忽略水电离出的H+的浓度,
酸电离的H+浓度认为是溶液中总c(H+)]。
(3)碱溶液中c水(OH-)=c水(H+)= [忽略水电离出的OH-的浓
度,碱电离的OH-浓度认为是溶液中总c(OH-)]。
2.水的电离平衡曲线的理解与识别
某温度下,水溶液中H+和OH-的浓度变化曲线
(1)曲线上的任意点(如a、b、c):Kw都相同
即c平(H+)·c平(OH-)相同,温度相同
(2)曲线外的任意点(如d)与曲线上任意点:
Kw不同,温度不同
(3)曲线上点之间转化:
需保持温度不变,改变酸碱性
曲线上点与曲线外点之间的转化:
一定改变温度
思考交流
在不同温度下的水溶液中c平(H+)与c平(OH-)的关系如图所示。请回答下列问题:
(1)曲线Ⅰ代表的温度下,水的离子积为_________________,曲线Ⅰ所代表的温度_____(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是____________________________________________________
________________________________________________________________。
1×10-12 mol2·L-2
高于
曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离
过程是吸热过程,温度越高,水的离子积越大,故曲线Ⅱ代表的温度低
思考交流
(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液的c平(H+)为______ mol·L-1。
10-10
返回
电解质在水溶液中的存在形态
三
电解质溶液的导电能力一样吗?
以上水溶液的导电能力相同吗?为什么?
观察思考
1.实验探究:同浓度的电解质溶液的导电能力是否相同
{BC89EF96-8CEA-46FF-86C4-4CE0E7609802}电解质溶液
灯泡亮度
导电能力
盐酸
氨水
NaCl溶液
CH3COOH溶液
亮
强
亮
强
暗
弱
暗
弱
溶液的导电能力取决于什么?以上水溶液导电能力不同的原因是什么?
溶液的导电能力取决于自由移动离子的浓度大小和离子所带电荷。
盐酸、NaCl溶液中自由移动的离子浓度大,氨水、醋酸溶液中自由移动的离子浓度小。
HCl
H+
Cl-
H+
CH3COOH
CH3COOH
CH3COO-
完全电离
存在电离平衡
HCl和CH3COOH电离情况的比较
思考
氯化氢、醋酸等电解质在溶于水的过程中发生了什么变化?
它们最终以什么形态存在?
CH3COOH H++CH3COO-
HCl===H++Cl-
NaCl
Na+
Cl-
NH3·H2O
NH3·H2O
OH-
完全电离
存在电离平衡
NaCl和NH3·H2O电离情况的比较
NaCl===Na++Cl-
2.强电解质与弱电解质的比较
强电解质
在稀的水溶液中能完全电离的电解质
溶液中只有阴、阳离子
强酸、强碱、大部分盐(包括难溶性盐)等
弱电解质
在溶于水时部分电离的电解质
溶液中既有阴、阳离子,又有电解质分子
弱酸、弱碱、水
H+、Cl-
盐酸
H+、CH3COO-、CH3COOH
醋酸溶液
3.溶剂化作用
概念:溶质离子或分子与溶剂分子相互吸引的作用。
电解质溶于水后形成的离子或分子实际以“水合离子”或“水合分子”的形态存在。
思考交流
下列物质中,能导电的是_______(填序号,下同),属于电解质的是_________,其中属于强电解质的是________,属于弱电解质的是____。
①H2SO4 ②稀盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜
⑦CH3COOH ⑧熔融的KCl ⑨CO2
②⑥⑧
①④⑦⑧
①④⑧
⑦
4.电离方程式的书写
强电解质用“===”
(1)H2SO4:
NaOH:
(2)NaHSO4(水溶液中):
NaHSO4(熔融):
NaHCO3:
KAl(SO4)2:
NaOH===Na++OH-
水溶液中HSO4?完全电离
?
弱电解质用“ ”
多元弱酸分步书写,第一步为主,一级比一级难电离;
多元弱碱用一步电离表示。
CH3COOH:
H2CO3:
NH3·H2O:
Cu(OH)2:
CH3COOH CH3COO-+H+
Cu(OH)2 Cu2++2OH-
第1课时 水的电离 电解质在
水溶液中的存在形态
1.认识水的电离存在电离平衡;了解水的电离平衡及影响因素,会分析水的电
离平衡移动;理解水的离子积常数,并能用其进行相关计算(重、难点)。
2.通过分析、推理等方法了解强、弱电解质的区别和弱电解质的电离特点,会
书写常见电解质的电离方程式。
3.了解电解质溶液的导电性。
学习目标
水的电离
一
电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗?为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会是怎样的?
水的电离极其微弱
电导率仪
联想·质疑
H2O H++OH-
1.水的电离
(1)电离方程式
+
+
2H2O
OH-
H3O+
(2)电离特点
吸热、微弱、可逆
H2O H++OH-
水是一种极弱的电解质,纯水中存在着电离平衡。
K·c(H2O) = c平(H+)·c平(OH-)
电离平衡常数:K =
c平(H+)·c平(OH-)
c(H2O)
= KW
一定温度下为定值
2.水的离子积常数
表达式:
适用范围:Kw 适用于纯水及稀的电解质水溶液
影响因素:
Kw=c平(H+)·c平(OH-)
只与温度有关,随温度的升高, Kw增大
25℃时,Kw=1.0×10-14 mol2·L-2
思考交流1
观察不同温度下水的离子积常数表:
{BC89EF96-8CEA-46FF-86C4-4CE0E7609802}t/℃
Kw/(mol2·L-2)
25
1.0×10-14
55
7.3×10-14
80
2.5×10-13
100
5.5×10-13
分析上表数据可得出怎样的结论?
答案 Kw与温度有关,温度越高,Kw越大;水的电离是吸热过程。
3.影响水的电离平衡的因素
根据平衡移动原理分析影响水的电离平衡H2O H++OH- ΔH>0的因素,完成下表。
改变条件
平衡移动方向
c平(H+)
c平(OH-)
水的电离程度
Kw
升高温度
加入HCl(g)
加入NaOH(s)
加入活泼金属(如Na)
加入NaHSO4(s)
右移
增大
增大
增大
增大
左移
增大
减小
减小
不变
左移
减小
增大
减小
不变
右移
减小
增大
增大
不变
左移
增大
减小
减小
不变
思考交流2
1.正误判断
(1)升高温度,水的电离程度减小
(2)向水中加入少量氨水,水的电离平衡逆向移动,c平(OH-)降低
(3)常温下,加水稀释稀醋酸溶液,溶液中所有的离子浓度都减小
(4)溶液中c平(H+)、c平(OH-)可能不同,但水电离出的H+与OH-总是相等的
×
×
×
√
思考交流2
2.分析下列过程中H2O的电离程度的变化(25 ℃)。
(1)Zn与稀硫酸反应制H2:_____。
(2)氨水加水稀释时:_____。
(3)向NaOH溶液中滴入盐酸至过量:_____________。
(4)向SO2水溶液中通入Cl2至恰好反应:_____。
增大
增大
先增大后减小
减小
返回
水的离子积常数的应用
二
1.计算酸(或碱)溶液中水电离的c水(H+)或c水(OH-)
(1)25 ℃时,0.1 mol·L-1的稀盐酸中,水电离的c水(H+)、c水(OH-)各为多少?
c水(H+) 很小,可忽略,c总(H+)≈c(HCl)=0.1 mol·L-1
酸溶液中的OH-全部由水电离产生
水电离产生的H+与OH-的浓度相同,则
c水(OH-)=c水(H+)=1.0×10-13 mol·L-1
酸电离的H+抑制水的电离
(2)25 ℃时,0.01 mol·L-1的NaOH溶液中,水电离的c水(H+)、c水(OH-)各为多少?
c水(OH-) 很小,可忽略,c总(OH-)≈c(NaOH)=0.01 mol·L-1
碱溶液中的H+全部由水电离产生
水电离产生的H+与OH-的浓度相同,则
c水(H+)=c水(OH-)=1.0×10-12 mol·L-1
碱电离的OH-抑制水的电离
归纳总结
酸或碱溶液中c水(H+)、c水(OH-)的计算方法
(1)在酸或碱溶液中水的电离虽然受到抑制,但c水(H+)=c水(OH-)。
(2)酸溶液中c水(H+)=c水(OH-)= [忽略水电离出的H+的浓度,
酸电离的H+浓度认为是溶液中总c(H+)]。
(3)碱溶液中c水(OH-)=c水(H+)= [忽略水电离出的OH-的浓
度,碱电离的OH-浓度认为是溶液中总c(OH-)]。
2.水的电离平衡曲线的理解与识别
某温度下,水溶液中H+和OH-的浓度变化曲线
(1)曲线上的任意点(如a、b、c):Kw都相同
即c平(H+)·c平(OH-)相同,温度相同
(2)曲线外的任意点(如d)与曲线上任意点:
Kw不同,温度不同
(3)曲线上点之间转化:
需保持温度不变,改变酸碱性
曲线上点与曲线外点之间的转化:
一定改变温度
思考交流
在不同温度下的水溶液中c平(H+)与c平(OH-)的关系如图所示。请回答下列问题:
(1)曲线Ⅰ代表的温度下,水的离子积为_________________,曲线Ⅰ所代表的温度_____(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是____________________________________________________
________________________________________________________________。
1×10-12 mol2·L-2
高于
曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离
过程是吸热过程,温度越高,水的离子积越大,故曲线Ⅱ代表的温度低
思考交流
(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液的c平(H+)为______ mol·L-1。
10-10
返回
电解质在水溶液中的存在形态
三
电解质溶液的导电能力一样吗?
以上水溶液的导电能力相同吗?为什么?
观察思考
1.实验探究:同浓度的电解质溶液的导电能力是否相同
{BC89EF96-8CEA-46FF-86C4-4CE0E7609802}电解质溶液
灯泡亮度
导电能力
盐酸
氨水
NaCl溶液
CH3COOH溶液
亮
强
亮
强
暗
弱
暗
弱
溶液的导电能力取决于什么?以上水溶液导电能力不同的原因是什么?
溶液的导电能力取决于自由移动离子的浓度大小和离子所带电荷。
盐酸、NaCl溶液中自由移动的离子浓度大,氨水、醋酸溶液中自由移动的离子浓度小。
HCl
H+
Cl-
H+
CH3COOH
CH3COOH
CH3COO-
完全电离
存在电离平衡
HCl和CH3COOH电离情况的比较
思考
氯化氢、醋酸等电解质在溶于水的过程中发生了什么变化?
它们最终以什么形态存在?
CH3COOH H++CH3COO-
HCl===H++Cl-
NaCl
Na+
Cl-
NH3·H2O
NH3·H2O
OH-
完全电离
存在电离平衡
NaCl和NH3·H2O电离情况的比较
NaCl===Na++Cl-
2.强电解质与弱电解质的比较
强电解质
在稀的水溶液中能完全电离的电解质
溶液中只有阴、阳离子
强酸、强碱、大部分盐(包括难溶性盐)等
弱电解质
在溶于水时部分电离的电解质
溶液中既有阴、阳离子,又有电解质分子
弱酸、弱碱、水
H+、Cl-
盐酸
H+、CH3COO-、CH3COOH
醋酸溶液
3.溶剂化作用
概念:溶质离子或分子与溶剂分子相互吸引的作用。
电解质溶于水后形成的离子或分子实际以“水合离子”或“水合分子”的形态存在。
思考交流
下列物质中,能导电的是_______(填序号,下同),属于电解质的是_________,其中属于强电解质的是________,属于弱电解质的是____。
①H2SO4 ②稀盐酸 ③氯气 ④硫酸钡 ⑤乙醇 ⑥铜
⑦CH3COOH ⑧熔融的KCl ⑨CO2
②⑥⑧
①④⑦⑧
①④⑧
⑦
4.电离方程式的书写
强电解质用“===”
(1)H2SO4:
NaOH:
(2)NaHSO4(水溶液中):
NaHSO4(熔融):
NaHCO3:
KAl(SO4)2:
NaOH===Na++OH-
水溶液中HSO4?完全电离
?
弱电解质用“ ”
多元弱酸分步书写,第一步为主,一级比一级难电离;
多元弱碱用一步电离表示。
CH3COOH:
H2CO3:
NH3·H2O:
Cu(OH)2:
CH3COOH CH3COO-+H+
Cu(OH)2 Cu2++2OH-
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
