专题2 化学反应速率与化学平衡 单元检测题 (含解析)2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 专题2 化学反应速率与化学平衡 单元检测题 (含解析)2023-2024学年高二上学期化学苏教版(2019)选择性必修1 | 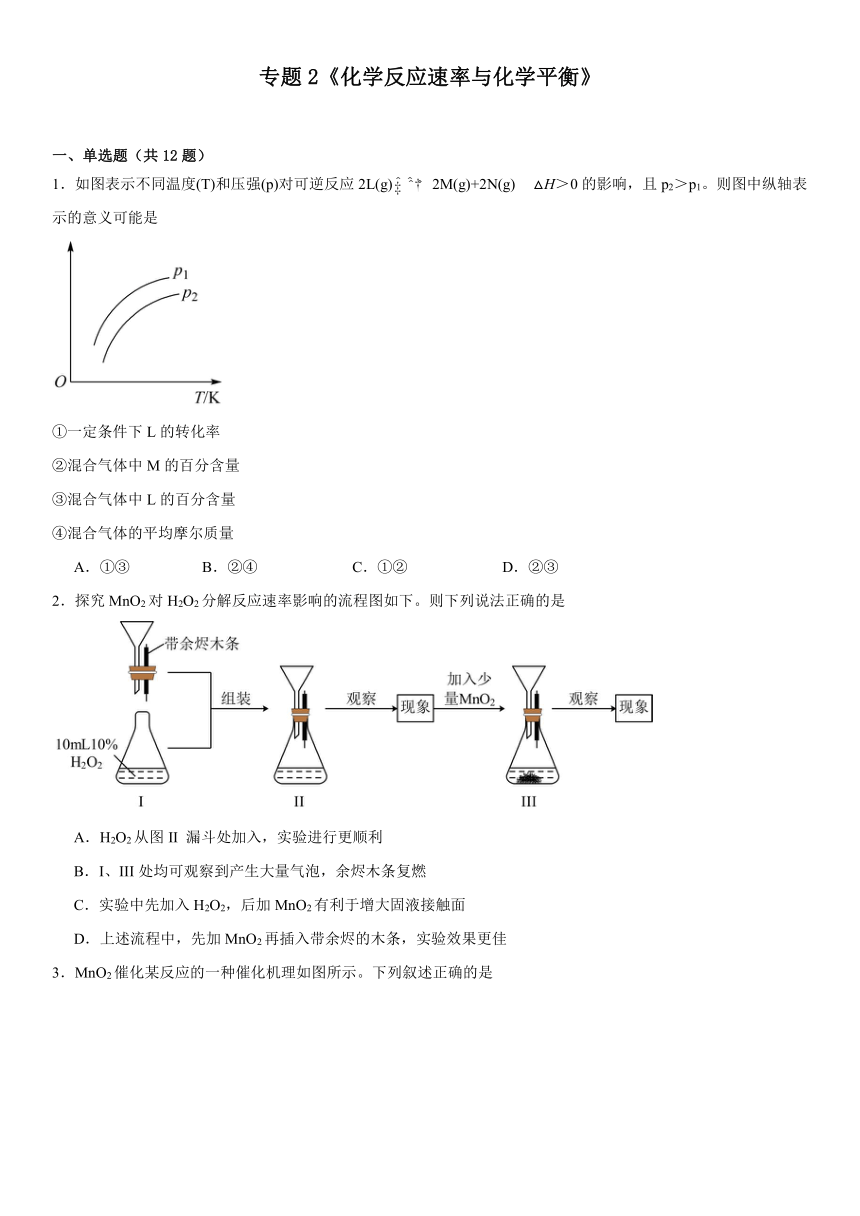 | |
| 格式 | docx | ||
| 文件大小 | 841.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 16:44:18 | ||
图片预览




文档简介
专题2《化学反应速率与化学平衡》
一、单选题(共12题)
1.如图表示不同温度(T)和压强(p)对可逆反应2L(g)2M(g)+2N(g) △H>0的影响,且p2>p1。则图中纵轴表示的意义可能是
①一定条件下L的转化率
②混合气体中M的百分含量
③混合气体中L的百分含量
④混合气体的平均摩尔质量
A.①③ B.②④ C.①② D.②③
2.探究MnO2对H2O2分解反应速率影响的流程图如下。则下列说法正确的是
A.H2O2从图II 漏斗处加入,实验进行更顺利
B.I、III处均可观察到产生大量气泡,余烬木条复燃
C.实验中先加入H2O2,后加MnO2有利于增大固液接触面
D.上述流程中,先加MnO2再插入带余烬的木条,实验效果更佳
3.MnO2催化某反应的一种催化机理如图所示。下列叙述正确的是
A.该机理的总反应为HCHO+O2CO2+H2O
B.催化过程中,所发生的反应均为氧化还原反应
C.图中的O与Na2O2中所含阴离子相同
D.该过程涉及化合物均为电解质
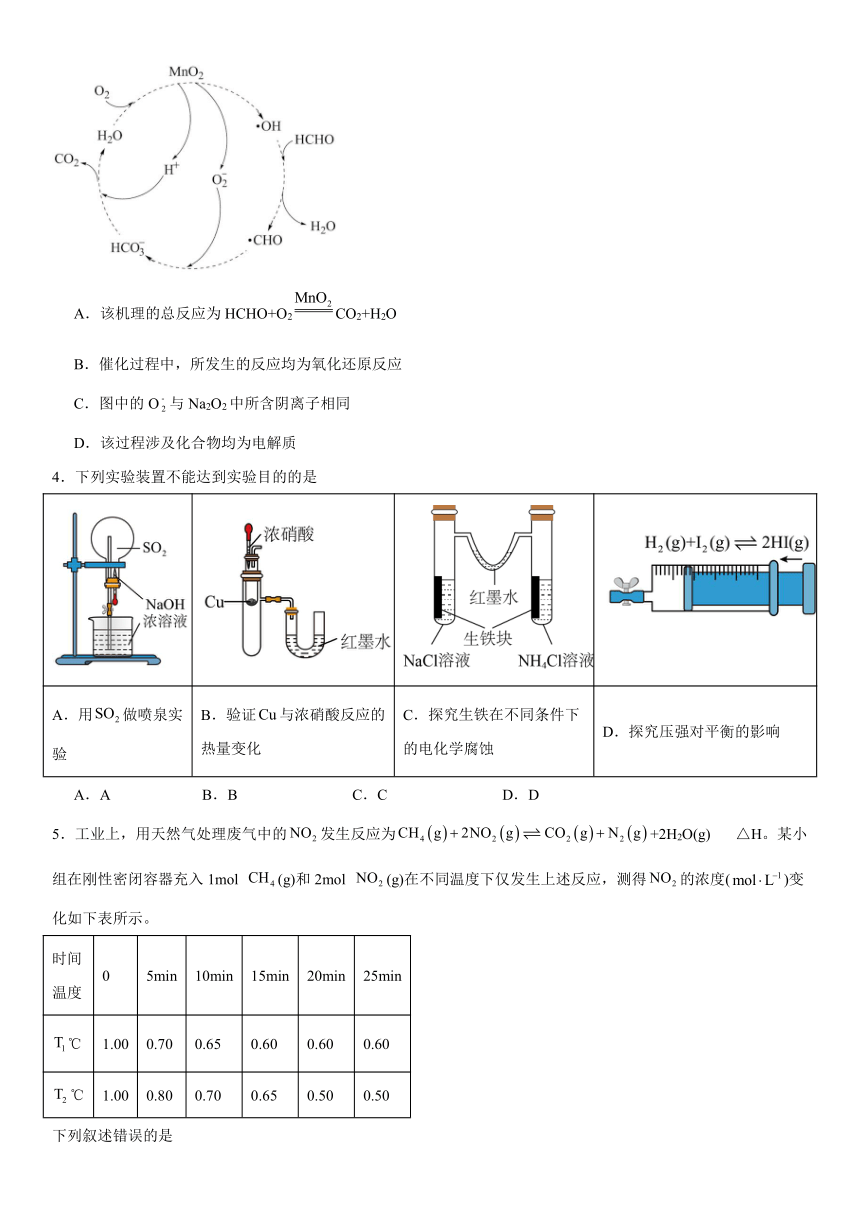
4.下列实验装置不能达到实验目的的是
A.用做喷泉实验 B.验证与浓硝酸反应的热量变化 C.探究生铁在不同条件下的电化学腐蚀 D.探究压强对平衡的影响
A.A B.B C.C D.D
5.工业上,用天然气处理废气中的发生反应为+2H2O(g) △H。某小组在刚性密闭容器充入1mol (g)和2mol (g)在不同温度下仅发生上述反应,测得的浓度()变化如下表所示。
时间 温度 0 5min 10min 15min 20min 25min
℃ 1.00 0.70 0.65 0.60 0.60 0.60
℃ 1.00 0.80 0.70 0.65 0.50 0.50
下列叙述错误的是
A.上述反应温度T:
B.℃下,若开始加入催化剂,则平衡所用时间小于15min
C.℃下,20min时充入少量,则平衡转化率增大
D.℃下,上述反应的平衡常数
6.关于反应 说法正确的是
A.反应的
B.反应中,(E表示键能,CO中为键)
C.平衡后,保持其他条件不变,再加入少量,的数值不变
D.相同条件下,向容器中充入1mol和1mol,充分反应放出206.3kJ热量
7.工业上可通过甲醇羰基化法制取甲酸甲酯:CH3OH(g)+CO(g)HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示,下列说法正确的是
A.反应速率vb>vd
B.由图可知生产时反应温度控制在80~85℃为宜
C.向该容器中充入N2,CH3OH的转化率增大
D.d→e,CO的转化率随温度的升高而减小,是因为该反应是吸热反应,升高温度反应正向移动
8.科学家研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅱ)表面发生解离时历程与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物质用*标注。
下列说法正确的是
A.基元反应①②③④都是吸热反应
B.该历程的活化能等于基元反应活化能之和
C.该历程的总方程式为
D.过渡态5生成时释放能量少,所以过渡态5非常稳定
9.向体积均为的两恒容密闭容器中分别充入发生反应: (为红色气体、为无色气体),其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. B.气体的颜色深浅:点浅于点
C.乙条件下的平衡常数 D.点平衡常数
10.已知一定温度压强下,N2(g) + 3H2(g)2 NH3(g) ΔH = -92 kJ/mol,在同温下向某定容密闭容器甲中通入1.0 mol N2和3.0 mol H2,反应完成时放出热量Q1 kJ,向另一体积相同的定容密闭容器乙中通入1.5 mol N2和3.0 mol H2,相同条件下反应完成时放出热量为Q2 kJ,则下列关系正确的是
A.2 Q2 = Q1 = 92.4 B.Q2 < Q1 < 92.4 C.Q1 = Q2 = 92.4 D.Q1 < Q2 < 92.4
11.工业上合成氨反应为:N2(g)+3H2(g) 2NH3(g),在实际生产中为提高合成氨的反应速率,下列说法正确的是
A.温度越高,反应速率越快,因此采取的温度越高越好
B.压强越高,反应速率越快,转化率越高,因此采取的压强越高越好
C.合成氨的温度选择主要是考虑催化剂活性的最适宜温度
D.可向容器中加入一定量的水蒸气,使氨气溶解以提高反应转化率
12.叔丁基溴在乙醇中反应的能量变化如图所示。
反应1:(CH3)3CBr→(CH3)2C=CH2+HBr
反应2:C2H5OH+(CH3)3CBr→(CH3)3C—OC2H5 +HBr
下列说法正确的是
A.过渡态能量:①>③>②
B.(CH3)3CBr转化为(CH3)3C+Br-的反应速率比(CH3)3C+Br-转化为(CH3)3C=CH2的反应速率快
C.(CH3)3C+是反应1和反应2共同的催化剂
D.反应1和反应2都是放热反应
二、填空题(共9题)
13.在一定条件下,可逆反应2NO2(g) N2O4(g) ΔH<0达到平衡,当分别改变下列条件时,请回答下列问题:
(1)保持容器容积不变,通入一定量NO2,则达到平衡时 (填“增大”“减小”或“不变”,下同);保持容器容积不变,通入一定量N2O4,则达到平衡时
(2)保持压强不变,通入一定量NO2,则达到平衡时NO2的百分含量 ;保持压强不变,通入一定量N2O4,则达到平衡时NO2的百分含量 。
(3)保持容器容积不变,通入一定量氖气,则达到平衡时NO2的转化率 ;保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时NO2的转化率 。
(4)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)N2O4(g),反应中测得相关数据如下表所示:
反应时间/min 0 10 20 30 40 50
气体相对分子质量 46 57 64 69 69 69
①此条件下该反应的化学平衡常数K= 。
②在50min末,向容器中加入molNO2,若要保持平衡不发生移动,应加入N2O4为 mol。
14.如图所示,在烧杯A、B中均盛有20 ℃的50 mL水,C与D相通,其中充有红棕色气体,存在平衡:2NO2N2O4(正反应放热)。若向A中加入10 g NaOH固体使其溶解,向B中加入50 g硝酸铵固体也使其溶解,则:
(1)A、B两烧杯中,A烧杯中溶液温度 ,B烧杯中溶液温度 。(填“升高”“降低”或“不变”)
(2)C中气体颜色 ,D中气体颜色 。(填“变深”“变浅”或“不变”)
(3)在测定NO2的相对分子质量时,较为适宜的条件是 (填“较高温度”或“较低温度”)。
15.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
0(填“>、<或= ”)
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、<或= ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为 极。
①写出b极的电极反应式 。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。
16.在表中填写改变某一条件(反应在密闭体系中进行,并假设其他条件不变)对以下反应的速率和化学平衡的影响。
A(g)+B(g)C(g) △H>0
条件的改变 化学平衡 化学反应速率
增大反应物浓度
增大容器中气体的压强
提高温度
使用适当的催化剂
17.运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v(逆) (填“>”“<”或“=”)v(正)
③平衡常数K(A) K(C)(填“>”“<”或“=”)
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 (填编号)。
A.使用更高效的催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,如图表示N2的物质的量随时间的变化曲线。从第11min起,升高温度,则n(N2)的变化曲线为 (填编号)。
18.雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是 。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为 ,在=1的条件下,为更好的除去NOx,应控制的最佳温度在 K左右。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度(℃) 活性炭 NO E F
初始 3.000 0.10 0 0
T1 2.960 0.020 0.040 0.040
T2 2.975 0.050 0.025 0.025
①写出NO与活性炭反应的化学方程式: 。
②若T1<T2,则该反应的Q 0(填“>”“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为 。
19.环境问题,能源问题事关人类生存、社会可持续发展。回答下列问题:
(1)氮硫的氧化物的转化:
①已知:NO(g)+O2(g) NO2(g) H=-56.5kJ mol-1;K1
2SO2(g)+O2(g) 2SO3(g) H=-196.6kJ mol-1;K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g) H= kJ mol-1;K= 。(用K1、K2表示)
②一定条件下,将NO2与SO2以一定比例(不是等物质的量)置于恒温恒容的密闭容器中发生上述反应,下列能说明反应一定达到平衡状态的有 。
a.混合气体的密度不变
b.反应速率v(NO2):v(SO2):v(SO3):v(NO)=1:1:1:1
c.NO2和SO2的体积分数之比保持不变
d.混合气体颜色保持不变
(2)通常合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g) H<0,起始时容器中只有1mol/L CO和2mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①压强为p1温度为T1和T2时对应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)请说明理由 。
②若在温度为T1、压强为p1的条件下向密闭容器中加入等物质的量的CO、H2气体,则反应开始时v(CO)正 v(CO)逆。(填“>”、“<”、“=”、“无法确定”)
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3.常温下碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,NH3 H2O的电离常数Kb=1.8×10-5,则NH4HCO3溶液中c(NH) c(HCO)。(填“>”、“<”“=”)
20.已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度/ (mol·L-1) 0.44 0.6 0.6
(1)比较此时正.逆反应速率的大小:v正 v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
21.已知下列反应:
①;ΔH=196.6kJ mol-1
②;ΔH<0
③;ΔH=92.4 kJ mol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量 (填“<”“>”“=”)98.3kJ;理由是 ;
(2)反应②的化学平衡常数表达式K= ,温度降低时,K值 (填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率= ;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有 。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
试卷第1页,共3页
参考答案:
1.C
【分析】根据图示及反应方程式可知:压强不变时,升高温度平衡正向移动;温度不变时,增大压强,化学平衡向气体体积减小的逆反应方向移动。
【详解】①压强不变时,升高温度化学平衡向吸热的正反应方向移动,L的转化率增大;温度不变时,增大压强,化学平衡向气体体积减小的逆反应方向移动,L的转化率减小,图象符合与L的转化率吻合,①正确;
②压强不变时,升高温度平衡正向移动,混合气体中M的百分含量增大;温度不变时,增大压强,平衡逆向移动,混合气体中M的百分含量减小,图象中M的百分含量符合,②正确;
③压强不变时,升高温度平衡正向移动,L的百分含量减小;温度不变时,增大压强,平衡逆向移动,L的转化率增大,图象与L的百分含量不符合,③错误;
④压强不变时,升高温度平衡正向移动,气体的物质的量增大,混合气体平均摩尔质量减小;温度不变时,增大压强,平衡逆向移动,混合气体平均摩尔质量增大,图象与混合气体的平均摩尔质量不符合,④错误;
综上所述可知:说法正确的是①②,故合理选项是C。
2.C
【详解】A. 若连接好装置后,从装置Ⅱ的漏斗无法直接加入双氧水,为使实验顺利进行,H2O2应该从图Ⅰ漏斗处加入,故A错误;
B. 在I处产生气泡较少或者基本没有,带余烬木条不会复燃,在Ⅲ处产生大量气泡,带余烬木条复燃,故B错误;
C. 实验过程中先加入H2O2后加入二氧化锰,能使二氧化锰和双氧水充分接触,可以增大固液接触面积,加快反应速率,故C正确;
D. 上述流程中,应该先加入带余烬木条,证明双氧水分解速率较慢,然后加入催化剂,证明催化剂加快了双氧水的分解速率,故D错误;
故选:C。
3.A
【详解】A.分析题中催化机理图,除去中间产物,可得该反应总反应为:HCHO+O2CO2+H2O,A正确;
B.催化机理存在一步HCO与H+反应生成CO2的过程,不是氧化还原反应,B错误;
C.Na2O2中所含阴离子为O,与O不同,C错误;
D.CO2、HCHO自身不能电离,为非电解质,D错误;
综上所述答案为A。
4.D
【详解】A.能与溶液反应,该实验装置能形成喷泉实验,A正确;
B.与浓硝酸反应,放出大量的热,具支试管中的空气受热膨胀,U形管中的红墨水左低右高,可验证与浓硝酸反应的热量变化,B正确;
C.左边溶液呈中性,生铁发生吸氧腐蚀,气体体积减小,右边溶液呈酸性,生铁发生析氢腐蚀,气体体积增大,红墨水左高右低,能达到探究目的,C正确;
D.该可逆反应是气体分子数保持不变的反应,增大压强,虽然气体颜色变深,但平衡不移动,该装置只是增大压强使气体浓度增大而已,不能达到探究目的,D错误;
故答案为:D。
5.D
【详解】A.观察表格数据,其他条件相同,℃下,浓度变化较快,速率较大,即温度较高;观察平衡时浓度知,℃→℃时降低,平衡时浓度减小,说明平衡向正反应方向移动,即正反应是放热反应,降温时平衡常数增大,A项正确;
B.加入催化剂,反应加快,缩短达到平衡的时间,B项正确;
C.达到平衡时充入,则平衡向正反应方向移动,的平衡转化率增大,C项正确;
D.℃下平衡时,,,,代入数据可计算,D项错误;
故选D。
6.B
【详解】A.该反应是气体分子数增大的反应,体系的混乱度增大,则反应的,A错误;
B.该反应的,可知反应物的总键能比生成物的总键能低,则,B正确;
C.平衡后,保持其他条件不变,再加入少量即增大反应物的浓度,平衡正向移动,c(H2O)减小,温度不变则该反应的平衡常数K不变,由的数值变小,C错误;
D.该反应是可逆反应,不能反应完全,则相同条件下,向容器中充入1mol和1mol,充分反应放出低于206.3kJ热量,D错误;
故选:B。
7.B
【详解】A.b点温度比d点温度低,反应速率vb<vd,A错误;
B.由图可知生产时反应温度控制在80~85℃为宜,因此此温度区间内转化率最高,B正确;
C.容积一定,向该容器中充入N2,各组分浓度不变平衡不移动,CH3OH的转化率不变,C错误;
D.反应图象可知,CO的转化率先增大后减小,83°C左右即图象最高点时反应达到平衡状态,83°C以前反应没有达到平衡状态,83°C后升高温度,CO的转化率减小,则平衡逆向移动,说明该反应正向为放热反应,d→e,CO的转化率随温度的升高而减小,因为升高温度反应正向移动,D错误;
答案选B。
8.C
【详解】A.基元反应①②是吸热反应,③④是放热反应,A错误;
B.历程的活化能是根据阿伦尼乌斯公式作图得出的,和基元反应的活化能意义不一样,B错误;
C.由图知,该历程的总方程式为,C正确;
D.过渡态都很不稳定,而且生成释放的能量也与过渡态的稳定性无关,与过渡态的相对能量有关,D错误;
故选C。
9.D
【详解】
A.甲为绝热过程,正向反应为气体物质的量减少的反应,容积恒定,随着反应进行,甲过程刚开始压强还增大,说明该反应放热,温度升高,才会使压强增大,A错误;
B.a、c两点压强相同,但甲过程为绝热过程,反应放热温度升高,甲过程温度高,说明甲过程气体总的物质的量小于乙过程,甲过程正向进行的程度更大,容器内X的浓度较小,颜色较浅,气体的颜色深浅:c点浅于a点,B错误;
C.乙过程到达平衡时,压强不再变化,但图中没有给出平衡时的压强数据,无法计算, C错误;
D.甲过程到达平衡时,c点压强为1.5p,若假设温度不变,
2p-x=1.5p, x=0.5p, ,但由于甲为绝热过程,该反应放热,温度升高,体系压强增大,故< D正确;
故选D。
10.D
【详解】由热化学方程式可知,25 ℃、101 kPa下,1.0 mol N2和3.0 mol H2完全反应生成2 mol NH3时放出92 kJ热量,但题给条件下,合成氨是可逆反应,反应的氮气小于1.0 mol,因此放出的热量Q1 < 92.4;由题意可知,甲→乙就是其它条件不变时增大氮气或反应物的浓度,合成氨的平衡向生成氨气的方向移动,因此放出更多的热量,即Q1 < Q2 ,但是3.0 mol H2仍然不可能彻底消耗,因此不可能放出92 kJ热量,即Q2 < 92.4,D正确;
答案选D。
11.C
【详解】A.温度升高,反应速率加快,但该反应是放热反应,升高温度,化学平衡逆向移动,会导致NH3的反应产率降低,因此采取的温度不是越高越好,而是应该采用一定的温度,A错误;
B.增大压强,物质的浓度增大,反应速率加快。由于该反应的正反应是气体体积减小的反应,增大压强,化学平衡正向移动,可以提高NH3的平衡产率,但压强越高,需要的动力就越大,对材料承受的压力要求也越高,因此不是压强越高越好,而是应该在一定压强下进行,B错误;
C.合成氨要保证一定的反应速率及氨的平衡产率在一定范围,为使催化剂达到最佳催化活性,应该选择一定温度下进行,故反应的温度选择主要是考虑催化剂活性的最适宜温度,C正确;
D.向容器中加入一定量的水蒸气,使氨气溶解可以降低氨气的浓度,能够使化学平衡正向移动,能够提高反应转化率,但不能提高合成氨的反应速率,D错误;
故合理选项是C。
12.D
【详解】A.根据图中信息可知,过渡态能量:①>②>③,选项A错误;
B.转化为的活化能更大,(CH3)3CBr转化为(CH3)3C+Br-的反应速率比(CH3)3C+Br-转化为(CH3)3C=CH2的反应速率慢,选项B错误;
C.是反应的中间产物,选项C错误;
D.反应1和反应2都是反应物总能量大于生成物总能量,故都为放热反应,选项D正确;
答案选D。
13.(1) 减小 减小
(2) 不变 不变
(3) 不变 减小
(4) 60 mol
【解析】(1)保持容器容积不变,通入一定量的NO2,相当于加压,平衡正向移动,达到平衡时NO2的百分含量减小,N2O4的百分含量增大,故减小;保持容器容积不变,通入一定量N2O4,相当于加压,平衡正向移动,达到平衡时NO2的百分含量减小,N2O4的百分含量增大,故减小;
(2)保持压强不变,通入一定量的NO2,容器体积增大,与原平衡为等效平衡,达到平衡时NO2的百分含量不变;保持压强不变,通入一定量N2O4,容器体积增大,与原平衡为等效平衡,达到平衡时NO2的百分含量不变;
(3)保持容器容积不变,通入一定量的氖气,各反应物浓度不变,平衡不移动,达到平衡时NO2的转化率不变;保持压强不变,通入氖气使体系的容积增大一倍,相当于减压,平衡逆向移动,达到平衡时NO2的转化率减小。
(4)①设NO2转化的物质的量为x,根据题意可列出三段式:,解得,由三段式知平衡时NO2以及N2O4的物质的量浓度均为,则此条件下该反应的化学平衡常数K=;②在50 min末,向容器中加入mol NO2,若要保持平衡不发生移动,则QC=K,故,解得,故应加入的N2O4为mol。
14.(1) 升高 降低
(2) 变深 变浅
(3)较高温度
【详解】(1)NaOH固体溶于水放热,而硝酸铵固体溶于水吸热,所以A烧杯中溶液温度升高,而B烧杯中溶液温度降低。故答案是升高;降低;
(2)2NO2N2O4(正反应放热), C中加入氢氧化钠固体,温度升高,平衡左移,NO2含量增大,气体颜色变深;D中加入硝酸铵,温度降低,平衡右移,NO2含量变小,颜色变浅。故答案是变深;变浅;
(3)测定NO2的相对分子质量时,应使平衡尽可能左移,因此应选择较高温度。
15.(1)<(2分)
(2)<(1分)
(3)0.55(2分)
(4)阳(1分)
①CH3OH+8OH--6e-==CO2-3+6H2O(2分)
②2.24(2分)
【分析】(1)230℃处于平衡状态,再升高温度甲醇的体积分数,说明升高温度平衡向逆反应方向移动;
(2)说明升高温度平衡向逆反应方向移动,平衡常数减小;
(3)参加反应CO为2.5mol×90%=2.25mol,进而计算平衡时混合气体总物质的量,恒温恒容下,压强之比等于物质的量之比;
(4)b电极通入甲醇,发生氧化反应,a电极通入氧气,发生还原反应,则a为正极、b为负极,Cu连接a极,则为阳极,b电极上甲醇失去电子,碱性条件下生成碳酸根离子与水;根据电子转移守恒计算消耗氧气的体积。
【详解】(1)230℃处于平衡状态,再升高温度甲醇的体积分数,说明升高温度平衡向逆反应方向移动,而升高温度平衡向吸热反应移动,故正反应为放热反应,则△H<0,因此,本题正确答案是:<;
(2)正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,则K<1,因此,本题正确答案是:<;
(3)参加反应CO为2.5mol×90%=2.25mol,则:
CO(g)+2H2(g) CH3OH(g) 气体物质的量减小
1 2
2.25mol 4.5mol
故平衡后混合气体总物质的量为2.5mol+7.5mol-4.5mol=5.5mol,恒温恒容下,压强之比等于物质的量之比,此时容器内的压强为开始时的5.5/(2.5+7.5)=0.55倍,
因此,本题正确答案是:0.55。
(4)b电极通入甲醇,发生氧化反应,a电极通入氧气,发生还原反应,则a为正极、b为负极,Cu连接a极,则为阳极;
①b电极上甲醇失去电子,碱性条件下生成碳酸根离子与水,电极反应式为:CH3OH+8OH--6e-=CO2-3+6H2O;
②当铜片的质量变化为12.8g时,消耗的Cu为12.8/64=0.2mol,根据电子转移守恒可以知道消耗氧气为0.2×2/4=0.1mol,则a极上消耗的O2在标准状况下的体积为0.1mol×22.4L/mol=2.24L;
因此,本题正确答案是:阳;CH3OH+8OH--6e-=CO2-3+6H2O;2.24。
16. 正向移动 加快 正向移动 加快 正向移动 加快 不移动 加快
【详解】增大反应物的浓度,平衡正向移动,反应速率加快;该反应为气体系数之和减小的反应,增大容器中气体的压强,平衡正向移动,反应速率加快;该反应焓变大于0,为吸热反应,提高温度平衡向吸热方向移动,即正向移动,反应速率加快;使用适当的催化剂可以加快反应速率,但不影响平衡。
17.(1) 向左 < >
(2) D c
【详解】(1)①恒温恒压条件下向平衡体系通入氦气,使容器体积增大,气态反应物与气态生成物浓度均减小,相当于降低压强,该反应是气体体积减小的反应,因此平衡向左移动。
②反应进行到状态D时,SO3的百分含量未达到该条件下的最大含量,表示反应还在向正方向进行中,因此。
③根据SO3含量随温度变化关系知A点时SO3含量大于C点时,即A点时生成物所占比例高于C点时,因此平衡常数。
(2)①A.催化剂只改变反应速率,不改变化学平衡状态,A不选;
B.升高温度,化学反应速率增大,该反应为放热反应,升高温度平衡向逆反应方向移动,B不选;
C.及时分离出氨气,使氨气浓度减小,反应速率减小,平衡向正反应方向移动,C不选;
D.保持容器体积不变,充入氮气,使氮气浓度增大,反应速率增大,平衡向正反应方向移动,D选;
故选D。
②该反应为放热反应,升高温度平衡向逆反应方向移动,n(N2)逐渐增大,对应曲线为c。
18. D NO的分解为放热反应,升高温度不利于反应正向进行 870(850-900之间) C(s)+2NO(g) CO2(g)+N2(g) > 80%
【分析】(1)根据化学平衡状态特征:正逆反应速率相等,各组分含量保持不变分析;
(2)NO的分解为放热反应,升温不利于其分解;选择NO转化率最大的温度;
(3)①NO和活性炭反应,生成氮气和二氧化碳,据此书写;
②根据温度对化学平衡的影响分析;
③利用等效平衡思想求解。
【详解】(1)A.组分都是气体,则气体质量不变,容器为恒容状态,因此密度不变,不能作为该反应达到平衡的标志,故A错误;
B.反应前后气体系数之和相等,压强之比等于物质的量之比,因此压强不变,不能作为该反应达到平衡的标志,故B错误;
C.因为没有起始物质的量,因此无法判断是否达到平衡,故C错误;
D.氧气的转化率不变,说明反应达到平衡,故D正确;
故答案为:D;
(2)N2(g)+O2(g) 2NO(g)△H>0,因此NO的分解为放热反应,升高温度,不利于反应正向进行;根据图像,870K时,NO的转化率几乎最大;故答案为:NO的分解为放热反应,升高温度不利于反应正向进行;870(850-900之间);
(3)①因为是处理污染,因此NO和活性炭反应,N元素转化成N2,C转化成CO2,即反应方程式为C(s)+2NO(g) CO2(g)+N2(g);故答案为:C(s)+2NO(g) CO2(g)+N2(g);
②根据图中数据,升高温度时,NO的物质的量增多,CO2和N2的物质的量减小,反应向逆反应方向进行,根据勒夏特列原理,正反应方向为放热反应,即Q>0;故答案为:>;
③反应C+2NO N2+CO2是一个气体体积不变的反应,而反应物只有一种气体,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为 ×100%=80%,则达到新平衡时NO的转化率为80%,故答案为:80%。
【点睛】反应C+2NO N2+CO2是一个气体体积不变的反应,而且反应物只有一种气体,故加入NO气体,建立的平衡和原平衡为等效平衡,两平衡中各组分的物质的量分数、气体体积分数、质量分数、物质百分含量相等。
19. -41.8 cd > 该反应为放热反应,当压强不变,温度升高,平衡逆向移动,据图可知T1K2 > >
【详解】(1)①已知:a:NO(g)+O2(g) NO2(g) H=-56.5kJ mol-1;K1= ;b: 2SO2(g)+O2(g) 2SO3(g) H=-196.6kJ mol-1;K2= ,根据盖斯定律分析,有,则反应NO2(g)+SO2(g) SO3(g)+NO(g) H==-41.8kJ mol-1;K= =;
②a.反应体系全为气体,且为恒容容器,混合气体的密度始终不变,故不能确定到平衡;b.反应速率v(NO2):v(SO2):v(SO3):v(NO)=1:1:1:1没有说明正逆方向,不能确定平衡;c.NO2和SO2的体积分数之比保持不变可以说明反应到平衡;d.混合气体中只有二氧化氮有颜色,颜色保持不变,说明二氧化氮的浓度不变,可以说明到平衡。故选cd;
(2)①反应为放热反应,恒压条件下升温,平衡逆向移动,甲醇的物质的量分数减小,所以T1温度低, K1>K2;
②若在温度为T1、压强为p1的条件下向密闭容器中加入等物质的量的CO、H2气体,则反应开始时反应正向进行,所以v(CO)正>v(CO)逆;
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3.常温下碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,NH3 H2O的电离常数Kb=1.8×10-5,则NH4HCO3溶液中存在铵根离子水解,和碳酸氢根离子的电离和水解,铵根离子水解平衡常数为,碳酸氢根离子电离平衡常数为Ka2=4.7×10-11,水解平衡常数为,碳酸氢根离子的水解大于电离,也大于铵根离子水解,所以c(NH)>c(HCO)。
20. > 0.04mol/L 0.16mol/(L·min)
【详解】(1)该反应的平衡常数表达式为:K=,将所给浓度带入平衡常数表达式:=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,故答案为>;
(2) 2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol/L):0.44 0.6 0.6
转化浓度(mol/L): 2x x x
平衡浓度(mol/L): 0.44-2x 0.6+x 0.6+x
K=,解得x=0.2mol/L,故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,起始时在密闭容器中加入CH3OH,则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,则10min转化甲醇1.64moL/L-0.04moL/L=1.6mol/L,所以甲醇的反应速率为v(CH3OH)===0.16 mol/(L min)。
21. < 可逆反应不能进行到底 增大 50% BD
【详解】(1)根据反应:①2SO2(g)+O2(g) 2SO3(g) ΔH=196.6kJ mol-1可知,生成1molSO3放出热量98.3kJ;由于可逆反应不能进行到底,故在一定条件下向一密闭容器中充入1mol SO2和0.5molO2,充分反应后,放出热量<98.3kJ;综上所述,本题答案是:<;可逆反应不能进行到底。
② 4NH3(g)+5O2(g) 4NO(g)+6H2O ΔH<0的化学平衡常数表达式K=c4(NO)c6(H2O)/c4(NH3)c5(O2);该反应为放热反应,温度降低时,平衡正向移动,K值增大;综上所述,本题答案是:c4(NO)c6(H2O)/c4(NH3)c5(O2); 增大。
(3)设平衡时氨气的转化率为x,则
N2(g)+3H2(g) 2NH3(g)
起始量 1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
平衡混合气的总物质的量为3mol,则1-x+3-3x+2x=3,x=0.5,则平衡时氮气的转化率=0.5/1×100%=50%;综上所述,本题答案是:50%。
(4)为有效提高氢气的转化率,可采取的措施有:A.反应是放热反应,升温平衡左移,氢气的转化率降低,不符合;B.增大压强,平衡向气体体积减小的方向移动,即向右移动,氢气的转化率增大,符合;C.减小压强,平衡向气体体积增大的方向移动,即向左移动,氢气的转化率减小,不符合; D.及时移出氨,平衡右移, 氢气的转化率增大,符合;E.循环利用和不断补充氢气,增大了氮气的转化率但是降低了氢气的转化率,不符合;综上所述,本题答案是:BD。
【点睛】对于N2(g)+3H2(g) 2NH3(g)可逆反应,在体积温度不变的情况下,增加N2的浓度,平衡右移,但是N2的转化率降低,H2的转化率增大;即两种物质参加反应,增加该物质浓度,该物质的转化率减小,另外一种物质的转化率增大
一、单选题(共12题)
1.如图表示不同温度(T)和压强(p)对可逆反应2L(g)2M(g)+2N(g) △H>0的影响,且p2>p1。则图中纵轴表示的意义可能是
①一定条件下L的转化率
②混合气体中M的百分含量
③混合气体中L的百分含量
④混合气体的平均摩尔质量
A.①③ B.②④ C.①② D.②③
2.探究MnO2对H2O2分解反应速率影响的流程图如下。则下列说法正确的是
A.H2O2从图II 漏斗处加入,实验进行更顺利
B.I、III处均可观察到产生大量气泡,余烬木条复燃
C.实验中先加入H2O2,后加MnO2有利于增大固液接触面
D.上述流程中,先加MnO2再插入带余烬的木条,实验效果更佳
3.MnO2催化某反应的一种催化机理如图所示。下列叙述正确的是
A.该机理的总反应为HCHO+O2CO2+H2O
B.催化过程中,所发生的反应均为氧化还原反应
C.图中的O与Na2O2中所含阴离子相同
D.该过程涉及化合物均为电解质
4.下列实验装置不能达到实验目的的是
A.用做喷泉实验 B.验证与浓硝酸反应的热量变化 C.探究生铁在不同条件下的电化学腐蚀 D.探究压强对平衡的影响
A.A B.B C.C D.D
5.工业上,用天然气处理废气中的发生反应为+2H2O(g) △H。某小组在刚性密闭容器充入1mol (g)和2mol (g)在不同温度下仅发生上述反应,测得的浓度()变化如下表所示。
时间 温度 0 5min 10min 15min 20min 25min
℃ 1.00 0.70 0.65 0.60 0.60 0.60
℃ 1.00 0.80 0.70 0.65 0.50 0.50
下列叙述错误的是
A.上述反应温度T:
B.℃下,若开始加入催化剂,则平衡所用时间小于15min
C.℃下,20min时充入少量,则平衡转化率增大
D.℃下,上述反应的平衡常数
6.关于反应 说法正确的是
A.反应的
B.反应中,(E表示键能,CO中为键)
C.平衡后,保持其他条件不变,再加入少量,的数值不变
D.相同条件下,向容器中充入1mol和1mol,充分反应放出206.3kJ热量
7.工业上可通过甲醇羰基化法制取甲酸甲酯:CH3OH(g)+CO(g)HCOOCH3(g),在容积固定的密闭容器中,投入等物质的量CH3OH和CO,测得相同时间内CO的转化率随温度变化如图所示,下列说法正确的是
A.反应速率vb>vd
B.由图可知生产时反应温度控制在80~85℃为宜
C.向该容器中充入N2,CH3OH的转化率增大
D.d→e,CO的转化率随温度的升高而减小,是因为该反应是吸热反应,升高温度反应正向移动
8.科学家研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅱ)表面发生解离时历程与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物质用*标注。
下列说法正确的是
A.基元反应①②③④都是吸热反应
B.该历程的活化能等于基元反应活化能之和
C.该历程的总方程式为
D.过渡态5生成时释放能量少,所以过渡态5非常稳定
9.向体积均为的两恒容密闭容器中分别充入发生反应: (为红色气体、为无色气体),其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是
A. B.气体的颜色深浅:点浅于点
C.乙条件下的平衡常数 D.点平衡常数
10.已知一定温度压强下,N2(g) + 3H2(g)2 NH3(g) ΔH = -92 kJ/mol,在同温下向某定容密闭容器甲中通入1.0 mol N2和3.0 mol H2,反应完成时放出热量Q1 kJ,向另一体积相同的定容密闭容器乙中通入1.5 mol N2和3.0 mol H2,相同条件下反应完成时放出热量为Q2 kJ,则下列关系正确的是
A.2 Q2 = Q1 = 92.4 B.Q2 < Q1 < 92.4 C.Q1 = Q2 = 92.4 D.Q1 < Q2 < 92.4
11.工业上合成氨反应为:N2(g)+3H2(g) 2NH3(g),在实际生产中为提高合成氨的反应速率,下列说法正确的是
A.温度越高,反应速率越快,因此采取的温度越高越好
B.压强越高,反应速率越快,转化率越高,因此采取的压强越高越好
C.合成氨的温度选择主要是考虑催化剂活性的最适宜温度
D.可向容器中加入一定量的水蒸气,使氨气溶解以提高反应转化率
12.叔丁基溴在乙醇中反应的能量变化如图所示。
反应1:(CH3)3CBr→(CH3)2C=CH2+HBr
反应2:C2H5OH+(CH3)3CBr→(CH3)3C—OC2H5 +HBr
下列说法正确的是
A.过渡态能量:①>③>②
B.(CH3)3CBr转化为(CH3)3C+Br-的反应速率比(CH3)3C+Br-转化为(CH3)3C=CH2的反应速率快
C.(CH3)3C+是反应1和反应2共同的催化剂
D.反应1和反应2都是放热反应
二、填空题(共9题)
13.在一定条件下,可逆反应2NO2(g) N2O4(g) ΔH<0达到平衡,当分别改变下列条件时,请回答下列问题:
(1)保持容器容积不变,通入一定量NO2,则达到平衡时 (填“增大”“减小”或“不变”,下同);保持容器容积不变,通入一定量N2O4,则达到平衡时
(2)保持压强不变,通入一定量NO2,则达到平衡时NO2的百分含量 ;保持压强不变,通入一定量N2O4,则达到平衡时NO2的百分含量 。
(3)保持容器容积不变,通入一定量氖气,则达到平衡时NO2的转化率 ;保持压强不变,通入氖气使体系的容积增大一倍,则达到平衡时NO2的转化率 。
(4)一定温度下,向容积为20L的密闭容器中充入1molNO2气体,发生反应2NO2(g)N2O4(g),反应中测得相关数据如下表所示:
反应时间/min 0 10 20 30 40 50
气体相对分子质量 46 57 64 69 69 69
①此条件下该反应的化学平衡常数K= 。
②在50min末,向容器中加入molNO2,若要保持平衡不发生移动,应加入N2O4为 mol。
14.如图所示,在烧杯A、B中均盛有20 ℃的50 mL水,C与D相通,其中充有红棕色气体,存在平衡:2NO2N2O4(正反应放热)。若向A中加入10 g NaOH固体使其溶解,向B中加入50 g硝酸铵固体也使其溶解,则:
(1)A、B两烧杯中,A烧杯中溶液温度 ,B烧杯中溶液温度 。(填“升高”“降低”或“不变”)
(2)C中气体颜色 ,D中气体颜色 。(填“变深”“变浅”或“不变”)
(3)在测定NO2的相对分子质量时,较为适宜的条件是 (填“较高温度”或“较低温度”)。
15.能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)CH3OH(g)△H;右图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H
0(填“>、<或= ”)
(2)若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、<或= ”)
(3)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的 倍。
(4)利用甲醇燃料电池设计如右图所示的装置:则该装置中Cu极为 极。
①写出b极的电极反应式 。
②当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。
16.在表中填写改变某一条件(反应在密闭体系中进行,并假设其他条件不变)对以下反应的速率和化学平衡的影响。
A(g)+B(g)C(g) △H>0
条件的改变 化学平衡 化学反应速率
增大反应物浓度
增大容器中气体的压强
提高温度
使用适当的催化剂
17.运用化学反应原理研究化学反应有重要意义。
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态)。
①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 (填“向左”“向右”或“不”)移动。
②若反应进行到状态D时,v(逆) (填“>”“<”或“=”)v(正)
③平衡常数K(A) K(C)(填“>”“<”或“=”)
(2)课本里介绍的合成氨技术叫哈伯法:N2(g)+3H2(g) 2NH3(g) ΔH<0,应用此法反应达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 (填编号)。
A.使用更高效的催化剂 B.升高温度
C.及时分离出氨气 D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,如图表示N2的物质的量随时间的变化曲线。从第11min起,升高温度,则n(N2)的变化曲线为 (填编号)。
18.雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5、SO2、NOx等污染。
请回答下列问题:
(1)汽车尾气中NOx和CO的生成:已知汽缸中生成NO的反应为:N2(g)+O2(g)2NO(g)—Q。恒温、恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是 。
A.混合气体的密度不再变化
B.混合气体的压强不再变化
C.N2、O2、NO的物质的量之比为1∶1∶2
D.氧气的转化率不再变化
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为 ,在=1的条件下,为更好的除去NOx,应控制的最佳温度在 K左右。
(3)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:
物质 温度(℃) 活性炭 NO E F
初始 3.000 0.10 0 0
T1 2.960 0.020 0.040 0.040
T2 2.975 0.050 0.025 0.025
①写出NO与活性炭反应的化学方程式: 。
②若T1<T2,则该反应的Q 0(填“>”“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为 。
19.环境问题,能源问题事关人类生存、社会可持续发展。回答下列问题:
(1)氮硫的氧化物的转化:
①已知:NO(g)+O2(g) NO2(g) H=-56.5kJ mol-1;K1
2SO2(g)+O2(g) 2SO3(g) H=-196.6kJ mol-1;K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g) H= kJ mol-1;K= 。(用K1、K2表示)
②一定条件下,将NO2与SO2以一定比例(不是等物质的量)置于恒温恒容的密闭容器中发生上述反应,下列能说明反应一定达到平衡状态的有 。
a.混合气体的密度不变
b.反应速率v(NO2):v(SO2):v(SO3):v(NO)=1:1:1:1
c.NO2和SO2的体积分数之比保持不变
d.混合气体颜色保持不变
(2)通常合成甲醇的主要反应为:CO(g)+2H2(g) CH3OH(g) H<0,起始时容器中只有1mol/L CO和2mol/L H2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
①压强为p1温度为T1和T2时对应的平衡常数分别为K1、K2,则K1 K2(填“>”、“<”、“=”)请说明理由 。
②若在温度为T1、压强为p1的条件下向密闭容器中加入等物质的量的CO、H2气体,则反应开始时v(CO)正 v(CO)逆。(填“>”、“<”、“=”、“无法确定”)
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3.常温下碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,NH3 H2O的电离常数Kb=1.8×10-5,则NH4HCO3溶液中c(NH) c(HCO)。(填“>”、“<”“=”)
20.已知反应2CH3OH(g)CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度/ (mol·L-1) 0.44 0.6 0.6
(1)比较此时正.逆反应速率的大小:v正 v逆(填“>”“<”或“=”)。
(2)若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
21.已知下列反应:
①;ΔH=196.6kJ mol-1
②;ΔH<0
③;ΔH=92.4 kJ mol-1
(1)在一定条件下向一密闭容器中充入1mol SO2和0.5mol O2,充分反应后,放出的热量 (填“<”“>”“=”)98.3kJ;理由是 ;
(2)反应②的化学平衡常数表达式K= ,温度降低时,K值 (填“增大”、“减小”或“无影响”);
(3)在0.2L的密闭容器中,加入1.0mol N2 和 3.0mol H2当该反应达到平衡时,测出平衡混合气的总物质的量为3 mol,则平衡时氮气的转化率= ;
(4)反应③中为有效提高氢气的转化率,理论上可采取的措施有 。
A.升高温度 B.增大压强 C.减小压强 D.及时移出氨 E.循环利用和不断补充氢气
试卷第1页,共3页
参考答案:
1.C
【分析】根据图示及反应方程式可知:压强不变时,升高温度平衡正向移动;温度不变时,增大压强,化学平衡向气体体积减小的逆反应方向移动。
【详解】①压强不变时,升高温度化学平衡向吸热的正反应方向移动,L的转化率增大;温度不变时,增大压强,化学平衡向气体体积减小的逆反应方向移动,L的转化率减小,图象符合与L的转化率吻合,①正确;
②压强不变时,升高温度平衡正向移动,混合气体中M的百分含量增大;温度不变时,增大压强,平衡逆向移动,混合气体中M的百分含量减小,图象中M的百分含量符合,②正确;
③压强不变时,升高温度平衡正向移动,L的百分含量减小;温度不变时,增大压强,平衡逆向移动,L的转化率增大,图象与L的百分含量不符合,③错误;
④压强不变时,升高温度平衡正向移动,气体的物质的量增大,混合气体平均摩尔质量减小;温度不变时,增大压强,平衡逆向移动,混合气体平均摩尔质量增大,图象与混合气体的平均摩尔质量不符合,④错误;
综上所述可知:说法正确的是①②,故合理选项是C。
2.C
【详解】A. 若连接好装置后,从装置Ⅱ的漏斗无法直接加入双氧水,为使实验顺利进行,H2O2应该从图Ⅰ漏斗处加入,故A错误;
B. 在I处产生气泡较少或者基本没有,带余烬木条不会复燃,在Ⅲ处产生大量气泡,带余烬木条复燃,故B错误;
C. 实验过程中先加入H2O2后加入二氧化锰,能使二氧化锰和双氧水充分接触,可以增大固液接触面积,加快反应速率,故C正确;
D. 上述流程中,应该先加入带余烬木条,证明双氧水分解速率较慢,然后加入催化剂,证明催化剂加快了双氧水的分解速率,故D错误;
故选:C。
3.A
【详解】A.分析题中催化机理图,除去中间产物,可得该反应总反应为:HCHO+O2CO2+H2O,A正确;
B.催化机理存在一步HCO与H+反应生成CO2的过程,不是氧化还原反应,B错误;
C.Na2O2中所含阴离子为O,与O不同,C错误;
D.CO2、HCHO自身不能电离,为非电解质,D错误;
综上所述答案为A。
4.D
【详解】A.能与溶液反应,该实验装置能形成喷泉实验,A正确;
B.与浓硝酸反应,放出大量的热,具支试管中的空气受热膨胀,U形管中的红墨水左低右高,可验证与浓硝酸反应的热量变化,B正确;
C.左边溶液呈中性,生铁发生吸氧腐蚀,气体体积减小,右边溶液呈酸性,生铁发生析氢腐蚀,气体体积增大,红墨水左高右低,能达到探究目的,C正确;
D.该可逆反应是气体分子数保持不变的反应,增大压强,虽然气体颜色变深,但平衡不移动,该装置只是增大压强使气体浓度增大而已,不能达到探究目的,D错误;
故答案为:D。
5.D
【详解】A.观察表格数据,其他条件相同,℃下,浓度变化较快,速率较大,即温度较高;观察平衡时浓度知,℃→℃时降低,平衡时浓度减小,说明平衡向正反应方向移动,即正反应是放热反应,降温时平衡常数增大,A项正确;
B.加入催化剂,反应加快,缩短达到平衡的时间,B项正确;
C.达到平衡时充入,则平衡向正反应方向移动,的平衡转化率增大,C项正确;
D.℃下平衡时,,,,代入数据可计算,D项错误;
故选D。
6.B
【详解】A.该反应是气体分子数增大的反应,体系的混乱度增大,则反应的,A错误;
B.该反应的,可知反应物的总键能比生成物的总键能低,则,B正确;
C.平衡后,保持其他条件不变,再加入少量即增大反应物的浓度,平衡正向移动,c(H2O)减小,温度不变则该反应的平衡常数K不变,由的数值变小,C错误;
D.该反应是可逆反应,不能反应完全,则相同条件下,向容器中充入1mol和1mol,充分反应放出低于206.3kJ热量,D错误;
故选:B。
7.B
【详解】A.b点温度比d点温度低,反应速率vb<vd,A错误;
B.由图可知生产时反应温度控制在80~85℃为宜,因此此温度区间内转化率最高,B正确;
C.容积一定,向该容器中充入N2,各组分浓度不变平衡不移动,CH3OH的转化率不变,C错误;
D.反应图象可知,CO的转化率先增大后减小,83°C左右即图象最高点时反应达到平衡状态,83°C以前反应没有达到平衡状态,83°C后升高温度,CO的转化率减小,则平衡逆向移动,说明该反应正向为放热反应,d→e,CO的转化率随温度的升高而减小,因为升高温度反应正向移动,D错误;
答案选B。
8.C
【详解】A.基元反应①②是吸热反应,③④是放热反应,A错误;
B.历程的活化能是根据阿伦尼乌斯公式作图得出的,和基元反应的活化能意义不一样,B错误;
C.由图知,该历程的总方程式为,C正确;
D.过渡态都很不稳定,而且生成释放的能量也与过渡态的稳定性无关,与过渡态的相对能量有关,D错误;
故选C。
9.D
【详解】
A.甲为绝热过程,正向反应为气体物质的量减少的反应,容积恒定,随着反应进行,甲过程刚开始压强还增大,说明该反应放热,温度升高,才会使压强增大,A错误;
B.a、c两点压强相同,但甲过程为绝热过程,反应放热温度升高,甲过程温度高,说明甲过程气体总的物质的量小于乙过程,甲过程正向进行的程度更大,容器内X的浓度较小,颜色较浅,气体的颜色深浅:c点浅于a点,B错误;
C.乙过程到达平衡时,压强不再变化,但图中没有给出平衡时的压强数据,无法计算, C错误;
D.甲过程到达平衡时,c点压强为1.5p,若假设温度不变,
2p-x=1.5p, x=0.5p, ,但由于甲为绝热过程,该反应放热,温度升高,体系压强增大,故< D正确;
故选D。
10.D
【详解】由热化学方程式可知,25 ℃、101 kPa下,1.0 mol N2和3.0 mol H2完全反应生成2 mol NH3时放出92 kJ热量,但题给条件下,合成氨是可逆反应,反应的氮气小于1.0 mol,因此放出的热量Q1 < 92.4;由题意可知,甲→乙就是其它条件不变时增大氮气或反应物的浓度,合成氨的平衡向生成氨气的方向移动,因此放出更多的热量,即Q1 < Q2 ,但是3.0 mol H2仍然不可能彻底消耗,因此不可能放出92 kJ热量,即Q2 < 92.4,D正确;
答案选D。
11.C
【详解】A.温度升高,反应速率加快,但该反应是放热反应,升高温度,化学平衡逆向移动,会导致NH3的反应产率降低,因此采取的温度不是越高越好,而是应该采用一定的温度,A错误;
B.增大压强,物质的浓度增大,反应速率加快。由于该反应的正反应是气体体积减小的反应,增大压强,化学平衡正向移动,可以提高NH3的平衡产率,但压强越高,需要的动力就越大,对材料承受的压力要求也越高,因此不是压强越高越好,而是应该在一定压强下进行,B错误;
C.合成氨要保证一定的反应速率及氨的平衡产率在一定范围,为使催化剂达到最佳催化活性,应该选择一定温度下进行,故反应的温度选择主要是考虑催化剂活性的最适宜温度,C正确;
D.向容器中加入一定量的水蒸气,使氨气溶解可以降低氨气的浓度,能够使化学平衡正向移动,能够提高反应转化率,但不能提高合成氨的反应速率,D错误;
故合理选项是C。
12.D
【详解】A.根据图中信息可知,过渡态能量:①>②>③,选项A错误;
B.转化为的活化能更大,(CH3)3CBr转化为(CH3)3C+Br-的反应速率比(CH3)3C+Br-转化为(CH3)3C=CH2的反应速率慢,选项B错误;
C.是反应的中间产物,选项C错误;
D.反应1和反应2都是反应物总能量大于生成物总能量,故都为放热反应,选项D正确;
答案选D。
13.(1) 减小 减小
(2) 不变 不变
(3) 不变 减小
(4) 60 mol
【解析】(1)保持容器容积不变,通入一定量的NO2,相当于加压,平衡正向移动,达到平衡时NO2的百分含量减小,N2O4的百分含量增大,故减小;保持容器容积不变,通入一定量N2O4,相当于加压,平衡正向移动,达到平衡时NO2的百分含量减小,N2O4的百分含量增大,故减小;
(2)保持压强不变,通入一定量的NO2,容器体积增大,与原平衡为等效平衡,达到平衡时NO2的百分含量不变;保持压强不变,通入一定量N2O4,容器体积增大,与原平衡为等效平衡,达到平衡时NO2的百分含量不变;
(3)保持容器容积不变,通入一定量的氖气,各反应物浓度不变,平衡不移动,达到平衡时NO2的转化率不变;保持压强不变,通入氖气使体系的容积增大一倍,相当于减压,平衡逆向移动,达到平衡时NO2的转化率减小。
(4)①设NO2转化的物质的量为x,根据题意可列出三段式:,解得,由三段式知平衡时NO2以及N2O4的物质的量浓度均为,则此条件下该反应的化学平衡常数K=;②在50 min末,向容器中加入mol NO2,若要保持平衡不发生移动,则QC=K,故,解得,故应加入的N2O4为mol。
14.(1) 升高 降低
(2) 变深 变浅
(3)较高温度
【详解】(1)NaOH固体溶于水放热,而硝酸铵固体溶于水吸热,所以A烧杯中溶液温度升高,而B烧杯中溶液温度降低。故答案是升高;降低;
(2)2NO2N2O4(正反应放热), C中加入氢氧化钠固体,温度升高,平衡左移,NO2含量增大,气体颜色变深;D中加入硝酸铵,温度降低,平衡右移,NO2含量变小,颜色变浅。故答案是变深;变浅;
(3)测定NO2的相对分子质量时,应使平衡尽可能左移,因此应选择较高温度。
15.(1)<(2分)
(2)<(1分)
(3)0.55(2分)
(4)阳(1分)
①CH3OH+8OH--6e-==CO2-3+6H2O(2分)
②2.24(2分)
【分析】(1)230℃处于平衡状态,再升高温度甲醇的体积分数,说明升高温度平衡向逆反应方向移动;
(2)说明升高温度平衡向逆反应方向移动,平衡常数减小;
(3)参加反应CO为2.5mol×90%=2.25mol,进而计算平衡时混合气体总物质的量,恒温恒容下,压强之比等于物质的量之比;
(4)b电极通入甲醇,发生氧化反应,a电极通入氧气,发生还原反应,则a为正极、b为负极,Cu连接a极,则为阳极,b电极上甲醇失去电子,碱性条件下生成碳酸根离子与水;根据电子转移守恒计算消耗氧气的体积。
【详解】(1)230℃处于平衡状态,再升高温度甲醇的体积分数,说明升高温度平衡向逆反应方向移动,而升高温度平衡向吸热反应移动,故正反应为放热反应,则△H<0,因此,本题正确答案是:<;
(2)正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,则K<1,因此,本题正确答案是:<;
(3)参加反应CO为2.5mol×90%=2.25mol,则:
CO(g)+2H2(g) CH3OH(g) 气体物质的量减小
1 2
2.25mol 4.5mol
故平衡后混合气体总物质的量为2.5mol+7.5mol-4.5mol=5.5mol,恒温恒容下,压强之比等于物质的量之比,此时容器内的压强为开始时的5.5/(2.5+7.5)=0.55倍,
因此,本题正确答案是:0.55。
(4)b电极通入甲醇,发生氧化反应,a电极通入氧气,发生还原反应,则a为正极、b为负极,Cu连接a极,则为阳极;
①b电极上甲醇失去电子,碱性条件下生成碳酸根离子与水,电极反应式为:CH3OH+8OH--6e-=CO2-3+6H2O;
②当铜片的质量变化为12.8g时,消耗的Cu为12.8/64=0.2mol,根据电子转移守恒可以知道消耗氧气为0.2×2/4=0.1mol,则a极上消耗的O2在标准状况下的体积为0.1mol×22.4L/mol=2.24L;
因此,本题正确答案是:阳;CH3OH+8OH--6e-=CO2-3+6H2O;2.24。
16. 正向移动 加快 正向移动 加快 正向移动 加快 不移动 加快
【详解】增大反应物的浓度,平衡正向移动,反应速率加快;该反应为气体系数之和减小的反应,增大容器中气体的压强,平衡正向移动,反应速率加快;该反应焓变大于0,为吸热反应,提高温度平衡向吸热方向移动,即正向移动,反应速率加快;使用适当的催化剂可以加快反应速率,但不影响平衡。
17.(1) 向左 < >
(2) D c
【详解】(1)①恒温恒压条件下向平衡体系通入氦气,使容器体积增大,气态反应物与气态生成物浓度均减小,相当于降低压强,该反应是气体体积减小的反应,因此平衡向左移动。
②反应进行到状态D时,SO3的百分含量未达到该条件下的最大含量,表示反应还在向正方向进行中,因此。
③根据SO3含量随温度变化关系知A点时SO3含量大于C点时,即A点时生成物所占比例高于C点时,因此平衡常数。
(2)①A.催化剂只改变反应速率,不改变化学平衡状态,A不选;
B.升高温度,化学反应速率增大,该反应为放热反应,升高温度平衡向逆反应方向移动,B不选;
C.及时分离出氨气,使氨气浓度减小,反应速率减小,平衡向正反应方向移动,C不选;
D.保持容器体积不变,充入氮气,使氮气浓度增大,反应速率增大,平衡向正反应方向移动,D选;
故选D。
②该反应为放热反应,升高温度平衡向逆反应方向移动,n(N2)逐渐增大,对应曲线为c。
18. D NO的分解为放热反应,升高温度不利于反应正向进行 870(850-900之间) C(s)+2NO(g) CO2(g)+N2(g) > 80%
【分析】(1)根据化学平衡状态特征:正逆反应速率相等,各组分含量保持不变分析;
(2)NO的分解为放热反应,升温不利于其分解;选择NO转化率最大的温度;
(3)①NO和活性炭反应,生成氮气和二氧化碳,据此书写;
②根据温度对化学平衡的影响分析;
③利用等效平衡思想求解。
【详解】(1)A.组分都是气体,则气体质量不变,容器为恒容状态,因此密度不变,不能作为该反应达到平衡的标志,故A错误;
B.反应前后气体系数之和相等,压强之比等于物质的量之比,因此压强不变,不能作为该反应达到平衡的标志,故B错误;
C.因为没有起始物质的量,因此无法判断是否达到平衡,故C错误;
D.氧气的转化率不变,说明反应达到平衡,故D正确;
故答案为:D;
(2)N2(g)+O2(g) 2NO(g)△H>0,因此NO的分解为放热反应,升高温度,不利于反应正向进行;根据图像,870K时,NO的转化率几乎最大;故答案为:NO的分解为放热反应,升高温度不利于反应正向进行;870(850-900之间);
(3)①因为是处理污染,因此NO和活性炭反应,N元素转化成N2,C转化成CO2,即反应方程式为C(s)+2NO(g) CO2(g)+N2(g);故答案为:C(s)+2NO(g) CO2(g)+N2(g);
②根据图中数据,升高温度时,NO的物质的量增多,CO2和N2的物质的量减小,反应向逆反应方向进行,根据勒夏特列原理,正反应方向为放热反应,即Q>0;故答案为:>;
③反应C+2NO N2+CO2是一个气体体积不变的反应,而反应物只有一种气体,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为 ×100%=80%,则达到新平衡时NO的转化率为80%,故答案为:80%。
【点睛】反应C+2NO N2+CO2是一个气体体积不变的反应,而且反应物只有一种气体,故加入NO气体,建立的平衡和原平衡为等效平衡,两平衡中各组分的物质的量分数、气体体积分数、质量分数、物质百分含量相等。
19. -41.8 cd > 该反应为放热反应,当压强不变,温度升高,平衡逆向移动,据图可知T1
【详解】(1)①已知:a:NO(g)+O2(g) NO2(g) H=-56.5kJ mol-1;K1= ;b: 2SO2(g)+O2(g) 2SO3(g) H=-196.6kJ mol-1;K2= ,根据盖斯定律分析,有,则反应NO2(g)+SO2(g) SO3(g)+NO(g) H==-41.8kJ mol-1;K= =;
②a.反应体系全为气体,且为恒容容器,混合气体的密度始终不变,故不能确定到平衡;b.反应速率v(NO2):v(SO2):v(SO3):v(NO)=1:1:1:1没有说明正逆方向,不能确定平衡;c.NO2和SO2的体积分数之比保持不变可以说明反应到平衡;d.混合气体中只有二氧化氮有颜色,颜色保持不变,说明二氧化氮的浓度不变,可以说明到平衡。故选cd;
(2)①反应为放热反应,恒压条件下升温,平衡逆向移动,甲醇的物质的量分数减小,所以T1温度低, K1>K2;
②若在温度为T1、压强为p1的条件下向密闭容器中加入等物质的量的CO、H2气体,则反应开始时反应正向进行,所以v(CO)正>v(CO)逆;
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3.常温下碳酸的电离常数Ka1=4.4×10-7、Ka2=4.7×10-11,NH3 H2O的电离常数Kb=1.8×10-5,则NH4HCO3溶液中存在铵根离子水解,和碳酸氢根离子的电离和水解,铵根离子水解平衡常数为,碳酸氢根离子电离平衡常数为Ka2=4.7×10-11,水解平衡常数为,碳酸氢根离子的水解大于电离,也大于铵根离子水解,所以c(NH)>c(HCO)。
20. > 0.04mol/L 0.16mol/(L·min)
【详解】(1)该反应的平衡常数表达式为:K=,将所给浓度带入平衡常数表达式:=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,故答案为>;
(2) 2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol/L):0.44 0.6 0.6
转化浓度(mol/L): 2x x x
平衡浓度(mol/L): 0.44-2x 0.6+x 0.6+x
K=,解得x=0.2mol/L,故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,起始时在密闭容器中加入CH3OH,则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,则10min转化甲醇1.64moL/L-0.04moL/L=1.6mol/L,所以甲醇的反应速率为v(CH3OH)===0.16 mol/(L min)。
21. < 可逆反应不能进行到底 增大 50% BD
【详解】(1)根据反应:①2SO2(g)+O2(g) 2SO3(g) ΔH=196.6kJ mol-1可知,生成1molSO3放出热量98.3kJ;由于可逆反应不能进行到底,故在一定条件下向一密闭容器中充入1mol SO2和0.5molO2,充分反应后,放出热量<98.3kJ;综上所述,本题答案是:<;可逆反应不能进行到底。
② 4NH3(g)+5O2(g) 4NO(g)+6H2O ΔH<0的化学平衡常数表达式K=c4(NO)c6(H2O)/c4(NH3)c5(O2);该反应为放热反应,温度降低时,平衡正向移动,K值增大;综上所述,本题答案是:c4(NO)c6(H2O)/c4(NH3)c5(O2); 增大。
(3)设平衡时氨气的转化率为x,则
N2(g)+3H2(g) 2NH3(g)
起始量 1 3 0
变化量 x 3x 2x
平衡量 1-x 3-3x 2x
平衡混合气的总物质的量为3mol,则1-x+3-3x+2x=3,x=0.5,则平衡时氮气的转化率=0.5/1×100%=50%;综上所述,本题答案是:50%。
(4)为有效提高氢气的转化率,可采取的措施有:A.反应是放热反应,升温平衡左移,氢气的转化率降低,不符合;B.增大压强,平衡向气体体积减小的方向移动,即向右移动,氢气的转化率增大,符合;C.减小压强,平衡向气体体积增大的方向移动,即向左移动,氢气的转化率减小,不符合; D.及时移出氨,平衡右移, 氢气的转化率增大,符合;E.循环利用和不断补充氢气,增大了氮气的转化率但是降低了氢气的转化率,不符合;综上所述,本题答案是:BD。
【点睛】对于N2(g)+3H2(g) 2NH3(g)可逆反应,在体积温度不变的情况下,增加N2的浓度,平衡右移,但是N2的转化率降低,H2的转化率增大;即两种物质参加反应,增加该物质浓度,该物质的转化率减小,另外一种物质的转化率增大
