4.1.1原子结构与核素(共25张PPT)2023-2024学年高一化学课件(人教版必修第一册)
文档属性
| 名称 | 4.1.1原子结构与核素(共25张PPT)2023-2024学年高一化学课件(人教版必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 51.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 17:36:42 | ||
图片预览





文档简介
(共25张PPT)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期律
第1 课时 原子结构 核素
1.知道原子的结构及构成原子的粒子间的关系。
2.根据原子核外电子排布规律,能画出1~20号元素的原子结构示意图。
3.了解预测、假设、模型等方法在研究原子结构中的作用。
4. 培养学生分析、处理数据的能力。
教学引入:原子的发现史
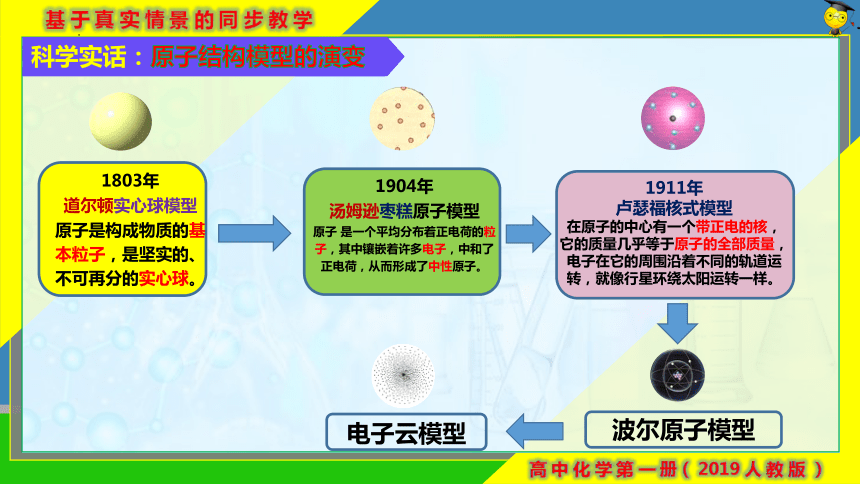
科学实话:原子结构模型的演变
1803年
道尔顿实心球模型
原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
1904年
汤姆逊枣糕原子模型
原子 是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
1911年
卢瑟福核式模型
在原子的中心有一个带正电的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
波尔原子模型
电子云模型
原子结构
01
1.1
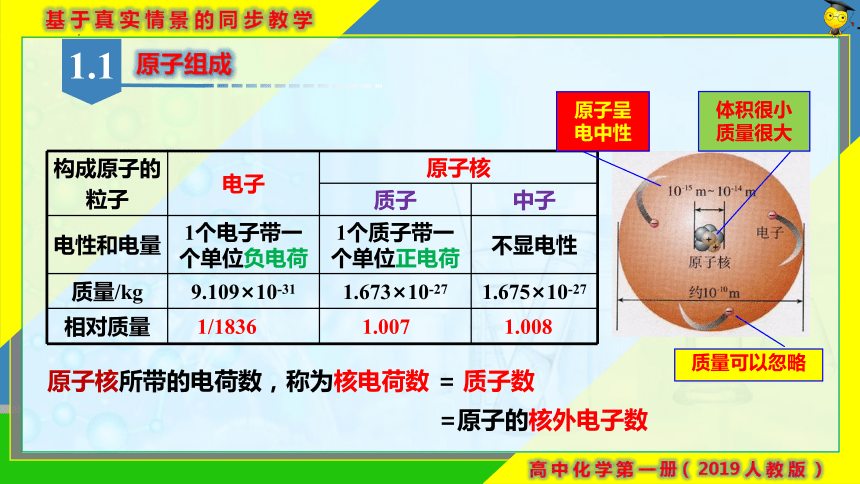
原子组成
构成原子的 粒子 电子 原子核
质子 中子
电性和电量 1个电子带一个单位负电荷 1个质子带一个单位正电荷 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量
1.007
1.008
1/1836
体积很小
质量很大
质量可以忽略
原子核所带的电荷数,称为核电荷数
= 质子数
=原子的核外电子数
原子呈
电中性
1.2
质量数
原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,所得的数值叫做质量数。
A = Z + N
质量数(A)= 质子数(Z)+ 中子数(N)
1.3
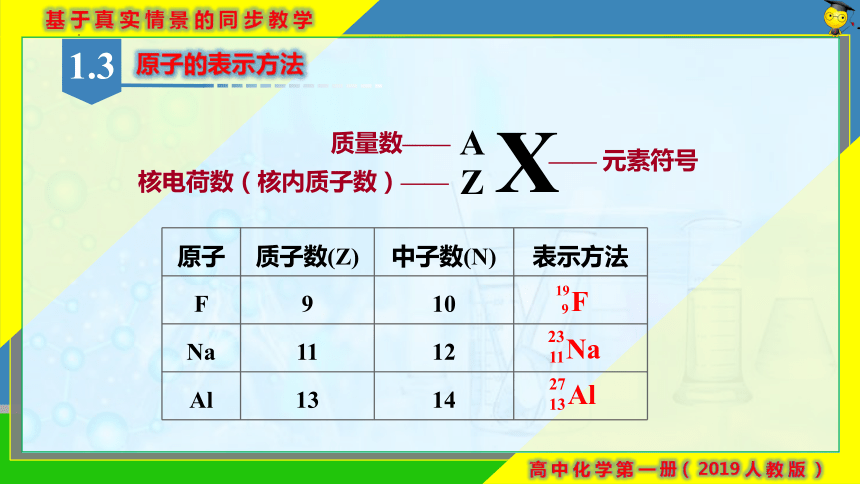
原子的表示方法
X
A
Z
—— 元素符号
质量数——
核电荷数(核内质子数)——
原子 质子数(Z) 中子数(N) 表示方法
F 9 10
Na 11 12
Al 13 14
F
19
9
Na
23
11
Al
27
13
1.3
原子的表示方法
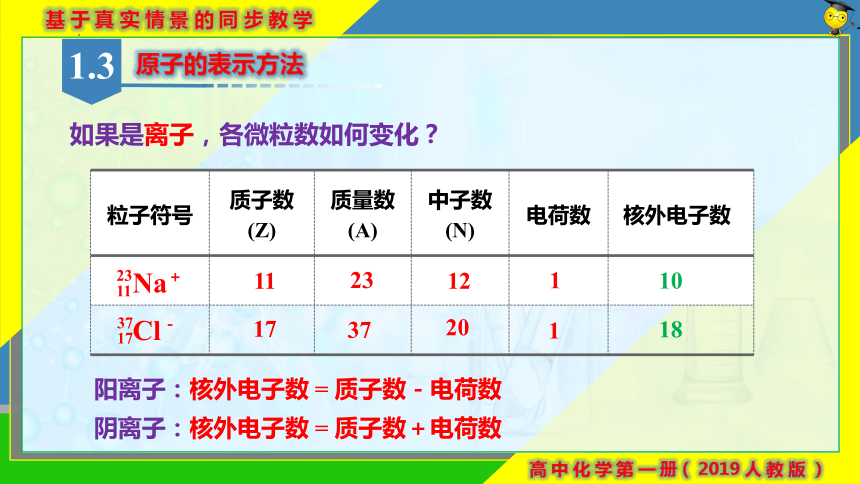
如果是离子,各微粒数如何变化?
粒子符号 质子数 (Z) 质量数(A) 中子数(N) 电荷数 核外电子数
10
11
23
12
17
37
20
1
1
18
阳离子:核外电子数 = 质子数-电荷数
阴离子:核外电子数 = 质子数+电荷数
23
11
Na
Cl
37
17
+
-
1.4
原子的核外电子排布
玻尔原子模型(1913年)
玻尔电子分层排布模型
一定轨道上绕核做高速圆周运动
现代电子云模型
1926~1935年电子云模型
电子在原子核外很小的空间内做高速运动,没有确定的轨道。
(2) ①多电子原子中,电子的能量不同。②在离核近区域运动的电子能量较低,在离核远区域运动的电子能量较高。
1.4
原子的核外电子排布
1.电子层
(1) 概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
M
L
K
原子核
电子层(n) 1 2 3 4 5 6 7
字母表示
能量
K
L
M
N
O
P
Q
低
高
N
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
观察表中的电子层排布,从中发现什么规律?
2
8
18
K层为最外层时不超过____个
其他层为最外层时最多不超过____个
次外层最多容纳_____个电子
第 n 层最多容纳______个电子
2n2
1.4
原子的核外电子排布
2.原子核外电子排布规律
不能孤立应用,
应协调统一
小结
原子核外电子排布的一般规律
1.5
原子结构示意图
Mg
粒子符号
原子核
核电荷数
或质子数
K
L
M
电子层
M层电子数
1.5
原子结构示意图
课堂检测
1.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。
(1)该微粒是中性微粒,这种微粒的符号是_____。
(2)该微粒对应的单质是一种能与水剧烈反应的金属,其与水作用的离子方程式为_____________________________.
(3)该微粒带两个单位的负电荷,画出其中性原子的结构示意图________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,这种微粒的符号是_ __。
Ne
2Na+2H2O=2Na++2OH-+H2↑
F-
1946年,美国芝加哥大学教授利比发明了14C断代法,即利用死亡生物中14C不断衰变的原理对文物进行年代测定,使考古学家由此可以判断各种史前文物的绝对年代,因此获得1960年诺贝尔化学奖。
当今,考古工作者正是利用14C衰变测定装置,对文物进行年代测定和研究。此外,考古研究中还利用13C和15N的测定,分析古代人类的食物结构,这对于研究当时的自然环境状况、社会生产力发展及社会文化风俗等具有重要参考价值。
【思考】这里的14C,13C以及前面学习的12C,它们的结构相同吗 是否属于同一种元素?
化学与职业——科技考古研究人员
核素
02
1.元素:具有相同核电荷数(即核内质子数)的同一类原子的总称。
2.核素:具有一定数目的质子和一定数目的中子的一种原子叫核素。
氢元素的原子核 原子名称 原子符号( )
质子数(Z) 中子数(N)
1 0 氕
1 1 氘 或D
1 2 氚 或T
2.1
元素与核素
2.2
同位素和同素异形体
1.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。如:1H,2H,3H互为同位素。
同位素的性质:①同位素在周期表里占有同一位置
②同位素的化学性质几乎相同
③天然存在的同位素,相互间保持一定的比率
2.同素异形体:由同种元素形成的不同单质,互称为同素异形体。如:氧气和臭氧、石墨和金刚石、红磷和白磷。
小结:元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类, 没有个数 化学反应中的 最小微粒 化学性质几乎相同,物理性质不同 组成元素相同,性质不同
思考:O2和O3互为同位素吗?H2O和D2O互为同位素吗?
O2和O3互为同素异形体; H2O和D2O为同种物质。
2.3
同位素的应用
(1)、用于制造氢弹;
(2)用于制造原子弹、核发电;
(3)考古时利用测定一些文物的年代;
(4)利用放射性同位素释放的射线育种、治疗恶性肿瘤。
课堂检测
2.(1)下列原子: 、 、 、 、 、 、 、 、
中,元素有________种,核素有________种,互为同位素的有_____________________________。
(2)18O2与16O2,二者的关系是________________________(填“互为同位素”“互为同素异形体”或“属于同一种物质”)。
6
9
属于同一种物质
3. “神舟十三号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,下列关于这三种物质的说法正确的是
A.等物质的量的三种物质质子数之比为1∶2∶3
B.等物质的量的三种物质中子数之比为1∶1∶1
C.等物质的量的三种物质摩尔质量之比为8∶9∶10
D.三种物质的化学性质不相同
课堂检测
C
第四章 物质结构 元素周期律
第一节 原子结构与元素周期律
第1 课时 原子结构 核素
第四章 物质结构 元素周期律
第一节 原子结构与元素周期律
第1 课时 原子结构 核素
1.知道原子的结构及构成原子的粒子间的关系。
2.根据原子核外电子排布规律,能画出1~20号元素的原子结构示意图。
3.了解预测、假设、模型等方法在研究原子结构中的作用。
4. 培养学生分析、处理数据的能力。
教学引入:原子的发现史
科学实话:原子结构模型的演变
1803年
道尔顿实心球模型
原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
1904年
汤姆逊枣糕原子模型
原子 是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
1911年
卢瑟福核式模型
在原子的中心有一个带正电的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
波尔原子模型
电子云模型
原子结构
01
1.1
原子组成
构成原子的 粒子 电子 原子核
质子 中子
电性和电量 1个电子带一个单位负电荷 1个质子带一个单位正电荷 不显电性
质量/kg 9.109×10-31 1.673×10-27 1.675×10-27
相对质量
1.007
1.008
1/1836
体积很小
质量很大
质量可以忽略
原子核所带的电荷数,称为核电荷数
= 质子数
=原子的核外电子数
原子呈
电中性
1.2
质量数
原子的质量主要集中在原子核上,质子和中子的相对质量都近似为1,如果忽略电子的质量,将核内所有质子和中子的相对质量取近似值加起来,所得的数值叫做质量数。
A = Z + N
质量数(A)= 质子数(Z)+ 中子数(N)
1.3
原子的表示方法
X
A
Z
—— 元素符号
质量数——
核电荷数(核内质子数)——
原子 质子数(Z) 中子数(N) 表示方法
F 9 10
Na 11 12
Al 13 14
F
19
9
Na
23
11
Al
27
13
1.3
原子的表示方法
如果是离子,各微粒数如何变化?
粒子符号 质子数 (Z) 质量数(A) 中子数(N) 电荷数 核外电子数
10
11
23
12
17
37
20
1
1
18
阳离子:核外电子数 = 质子数-电荷数
阴离子:核外电子数 = 质子数+电荷数
23
11
Na
Cl
37
17
+
-
1.4
原子的核外电子排布
玻尔原子模型(1913年)
玻尔电子分层排布模型
一定轨道上绕核做高速圆周运动
现代电子云模型
1926~1935年电子云模型
电子在原子核外很小的空间内做高速运动,没有确定的轨道。
(2) ①多电子原子中,电子的能量不同。②在离核近区域运动的电子能量较低,在离核远区域运动的电子能量较高。
1.4
原子的核外电子排布
1.电子层
(1) 概念:在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层,称作电子层。
M
L
K
原子核
电子层(n) 1 2 3 4 5 6 7
字母表示
能量
K
L
M
N
O
P
Q
低
高
N
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
观察表中的电子层排布,从中发现什么规律?
2
8
18
K层为最外层时不超过____个
其他层为最外层时最多不超过____个
次外层最多容纳_____个电子
第 n 层最多容纳______个电子
2n2
1.4
原子的核外电子排布
2.原子核外电子排布规律
不能孤立应用,
应协调统一
小结
原子核外电子排布的一般规律
1.5
原子结构示意图
Mg
粒子符号
原子核
核电荷数
或质子数
K
L
M
电子层
M层电子数
1.5
原子结构示意图
课堂检测
1.某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示作出自己的判断。
(1)该微粒是中性微粒,这种微粒的符号是_____。
(2)该微粒对应的单质是一种能与水剧烈反应的金属,其与水作用的离子方程式为_____________________________.
(3)该微粒带两个单位的负电荷,画出其中性原子的结构示意图________。
(4)该微粒的还原性很弱,失去1个电子后变为原子,这种微粒的符号是_ __。
Ne
2Na+2H2O=2Na++2OH-+H2↑
F-
1946年,美国芝加哥大学教授利比发明了14C断代法,即利用死亡生物中14C不断衰变的原理对文物进行年代测定,使考古学家由此可以判断各种史前文物的绝对年代,因此获得1960年诺贝尔化学奖。
当今,考古工作者正是利用14C衰变测定装置,对文物进行年代测定和研究。此外,考古研究中还利用13C和15N的测定,分析古代人类的食物结构,这对于研究当时的自然环境状况、社会生产力发展及社会文化风俗等具有重要参考价值。
【思考】这里的14C,13C以及前面学习的12C,它们的结构相同吗 是否属于同一种元素?
化学与职业——科技考古研究人员
核素
02
1.元素:具有相同核电荷数(即核内质子数)的同一类原子的总称。
2.核素:具有一定数目的质子和一定数目的中子的一种原子叫核素。
氢元素的原子核 原子名称 原子符号( )
质子数(Z) 中子数(N)
1 0 氕
1 1 氘 或D
1 2 氚 或T
2.1
元素与核素
2.2
同位素和同素异形体
1.同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。如:1H,2H,3H互为同位素。
同位素的性质:①同位素在周期表里占有同一位置
②同位素的化学性质几乎相同
③天然存在的同位素,相互间保持一定的比率
2.同素异形体:由同种元素形成的不同单质,互称为同素异形体。如:氧气和臭氧、石墨和金刚石、红磷和白磷。
小结:元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质 质子数(核电荷数)相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素组成的不同单质
范畴 同类原子 原子 原子 单质
特性 只有种类, 没有个数 化学反应中的 最小微粒 化学性质几乎相同,物理性质不同 组成元素相同,性质不同
思考:O2和O3互为同位素吗?H2O和D2O互为同位素吗?
O2和O3互为同素异形体; H2O和D2O为同种物质。
2.3
同位素的应用
(1)、用于制造氢弹;
(2)用于制造原子弹、核发电;
(3)考古时利用测定一些文物的年代;
(4)利用放射性同位素释放的射线育种、治疗恶性肿瘤。
课堂检测
2.(1)下列原子: 、 、 、 、 、 、 、 、
中,元素有________种,核素有________种,互为同位素的有_____________________________。
(2)18O2与16O2,二者的关系是________________________(填“互为同位素”“互为同素异形体”或“属于同一种物质”)。
6
9
属于同一种物质
3. “神舟十三号”的燃料是氢化锂三兄弟:LiH、LiD、LiT。其中Li的质量数为7,下列关于这三种物质的说法正确的是
A.等物质的量的三种物质质子数之比为1∶2∶3
B.等物质的量的三种物质中子数之比为1∶1∶1
C.等物质的量的三种物质摩尔质量之比为8∶9∶10
D.三种物质的化学性质不相同
课堂检测
C
第四章 物质结构 元素周期律
第一节 原子结构与元素周期律
第1 课时 原子结构 核素
