化学人教版(2019)必修第一册3.1.3铁盐 亚铁盐 课件(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1.3铁盐 亚铁盐 课件(共27张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 39.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-05 19:58:53 | ||
图片预览








文档简介
(共27张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第3课时 铁盐、亚铁盐
资料:缺铁性贫血症状
补铁盛宴
猪血汤
炒木耳
爆炒猪肝
蒜蓉生蚝
青椒牛柳
红豆薏米汤
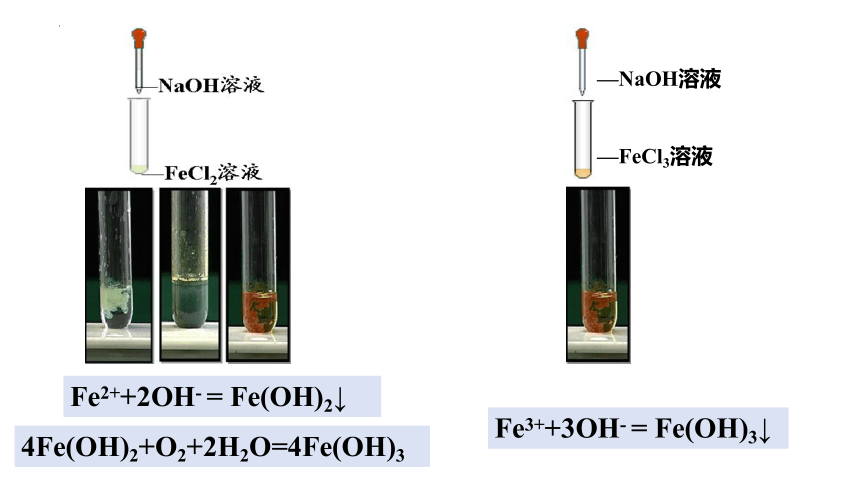
一、Fe3+和Fe2+ 的鉴别
Fe2+
Fe3+
—NaOH溶液
—FeCl3溶液
Fe3++3OH- = Fe(OH)3↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe2++2OH- = Fe(OH)2↓
P72 实验3-2 向FeCl3和FeCl2溶液中分别加KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色
溶液颜色无变化
Fe3+ + 3SCN- = Fe(SCN)3
(红色络合物)
【反应原理】Fe3+遇KSCN溶液立即显红色
Fe3+和KSCN不能共存
KSCN遇Fe3+ 显红色,可用作“道具血”
向FeCl3和FeCl2溶液中分别加K3[Fe(CN)6]溶液
滴入K3[Fe(CN)6]溶液
FeCl3溶液
FeCl2溶液
蓝色沉淀
溶液颜色无变化
【小结】Fe3+和Fe2+的鉴别
鉴别方法 Fe2+ Fe3+
加K3[Fe(CN)6] 铁氰化钾
溶液变成红色
浅绿色
棕黄色
生成白色沉淀,迅速变成灰绿色,最终变成红褐色
生成红褐色沉淀
无明显现象
观察法
加碱法
加KSCN法
硫氰化钾
蓝色沉淀
无明显现象
1.下列关于Fe2+和Fe3+的叙述中,错误的是( ) A.Fe2+的水溶液为浅绿色 B.Fe3+的水溶液为棕黄色 C.Fe3+只具有氧化性,Fe2+只具有还原性 D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色
2.有NaCl、FeCl3、FeCl2、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( ) A.盐酸 B.烧碱溶液 C.硫氰化钾溶液 D.硝酸银溶液
【课堂练习1】
C
B
3.下列离子的检验方法合理的是( ) A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+ B.向某溶液中通入K3[Fe(CN)6]溶液呈蓝色,说明原溶液中不含Fe3+ C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+ D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+,不含有Mg2+
C
操作 现象 反应的离子方程式
向盛有2mLFeCl2溶液的试管中滴入几滴KSCN溶液
再滴入几滴氯水,振荡 无明显现象
溶液变成红色
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
Fe3+
Fe2+
O2、氯水、H2O2、KMnO4(酸性)、硝酸
(氧化剂)
FeCl3溶液 现象 反应的离子方程式
在盛有2mLFeCl3溶液的试管中加入少量铁粉
滴入几滴KSCN溶液
取上层清液,滴入几滴氯水,振荡
2Fe3+ + Fe = 3Fe2+
2Fe2+ + Cl2=2Fe3+ + 2Cl-
Fe3++3SCN-===Fe(SCN)3
无明显现象
溶液变成红色
溶液由黄色变成浅绿色
实验室模拟印刷电路板
结论:Fe3+具有较强的氧化性。
离子方程式:2Fe3+ + Cu = 2Fe2+ + Cu2+
印刷前
印刷后
印刷电路板
Fe2+
Fe3+
铜、铁粉、淀粉KI溶液、维C溶液
(还原剂)
1.实验室保存亚铁盐溶液时为什么要加铁粉?(用离子方程式解释)
2.何除去FeCl2溶液中少量的FeCl3? 3.如何除去FeCl3溶液中少量的FeCl2?
2Fe3+ + Fe = 3Fe2+
加足量铁粉后过滤
通入氯气
注意:亚铁盐要现配现用,防止被空气中的氧气氧化
1.要除去FeCl2溶液中少量的FeCl3,下列方法可行的是( ) A.滴入KSCN溶液 B.加入铁粉C.通入氯气 D.加入铜粉
2.向某溶液中加入几滴KSCN溶液,溶液不变色; 向该溶液中继续通入Cl2,溶液变红色。关于原溶液下列说法正确的是( )A.一定没有Fe3+ B.一定有Fe2+ C.可能有Fe3+ D.不可能有Fe2+
【课堂练习2】
B
AB
3.下列各组离子能大量共存于同一溶液的是( )
A. Fe3+ 、NH4+、Cl-、H+
B. Fe2+、H+、CO32-、Cl-
C. Fe3+ 、SCN-、SO42-、Cl-
D. Fe2+ 、Ca2+ 、NO3- 、H+
A
Fe3+
Fe2+
O2、氯水、H2O2、KMnO4(酸性)、硝酸
(氧化剂)
铜、铁粉、淀粉KI溶液、维C溶液
(还原剂)
课堂小结
一、Fe3+和Fe2+的鉴别
①观察法 ②加碱法 ③加KSCN法
二、Fe2+和Fe3+的转化
Fe3+
Fe2+
氧化剂:O2、KMnO4、双氧水、氯水、硝酸等
还原剂:Cu、Fe、KI、维生素C等
Cl2、O2、H2O2、HNO3、KMnO4(H+) 等
只有还原性
只有氧化性
既有氧化性
又有还原性
(弱氧化剂)
(强氧化剂)
(强氧化剂)
Fe
Fe2+
Fe3+
Fe、Zn、Cu、I-、H2S 等
(还原剂)
请用图示的方法归纳Fe、Fe2+、Fe3+三者之间的相互转化关系
Fe3+、Cu2+、H+、S、I2
Cl2、HNO3、H2SO4(浓)
Zn、Al
CO
(还原剂)
(还原剂)
第三章 铁 金属材料
第一节 铁及其化合物
第3课时 铁盐、亚铁盐
资料:缺铁性贫血症状
补铁盛宴
猪血汤
炒木耳
爆炒猪肝
蒜蓉生蚝
青椒牛柳
红豆薏米汤
一、Fe3+和Fe2+ 的鉴别
Fe2+
Fe3+
—NaOH溶液
—FeCl3溶液
Fe3++3OH- = Fe(OH)3↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe2++2OH- = Fe(OH)2↓
P72 实验3-2 向FeCl3和FeCl2溶液中分别加KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色
溶液颜色无变化
Fe3+ + 3SCN- = Fe(SCN)3
(红色络合物)
【反应原理】Fe3+遇KSCN溶液立即显红色
Fe3+和KSCN不能共存
KSCN遇Fe3+ 显红色,可用作“道具血”
向FeCl3和FeCl2溶液中分别加K3[Fe(CN)6]溶液
滴入K3[Fe(CN)6]溶液
FeCl3溶液
FeCl2溶液
蓝色沉淀
溶液颜色无变化
【小结】Fe3+和Fe2+的鉴别
鉴别方法 Fe2+ Fe3+
加K3[Fe(CN)6] 铁氰化钾
溶液变成红色
浅绿色
棕黄色
生成白色沉淀,迅速变成灰绿色,最终变成红褐色
生成红褐色沉淀
无明显现象
观察法
加碱法
加KSCN法
硫氰化钾
蓝色沉淀
无明显现象
1.下列关于Fe2+和Fe3+的叙述中,错误的是( ) A.Fe2+的水溶液为浅绿色 B.Fe3+的水溶液为棕黄色 C.Fe3+只具有氧化性,Fe2+只具有还原性 D.Fe3+溶液中滴入含SCN-的溶液,立即出现红色
2.有NaCl、FeCl3、FeCl2、MgCl2四种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( ) A.盐酸 B.烧碱溶液 C.硫氰化钾溶液 D.硝酸银溶液
【课堂练习1】
C
B
3.下列离子的检验方法合理的是( ) A.向某溶液中滴入KSCN溶液呈红色,说明原溶液中不含Fe2+ B.向某溶液中通入K3[Fe(CN)6]溶液呈蓝色,说明原溶液中不含Fe3+ C.向某溶液中加入KSCN溶液呈红色,说明原溶液中含有Fe3+ D.向某溶液中加入NaOH溶液得白色沉淀,又观察到沉淀颜色逐渐变为红褐色,说明原溶液中含有Fe2+,不含有Mg2+
C
操作 现象 反应的离子方程式
向盛有2mLFeCl2溶液的试管中滴入几滴KSCN溶液
再滴入几滴氯水,振荡 无明显现象
溶液变成红色
2Fe2++Cl2===2Fe3++2Cl-
Fe3++3SCN-===Fe(SCN)3
Fe3+
Fe2+
O2、氯水、H2O2、KMnO4(酸性)、硝酸
(氧化剂)
FeCl3溶液 现象 反应的离子方程式
在盛有2mLFeCl3溶液的试管中加入少量铁粉
滴入几滴KSCN溶液
取上层清液,滴入几滴氯水,振荡
2Fe3+ + Fe = 3Fe2+
2Fe2+ + Cl2=2Fe3+ + 2Cl-
Fe3++3SCN-===Fe(SCN)3
无明显现象
溶液变成红色
溶液由黄色变成浅绿色
实验室模拟印刷电路板
结论:Fe3+具有较强的氧化性。
离子方程式:2Fe3+ + Cu = 2Fe2+ + Cu2+
印刷前
印刷后
印刷电路板
Fe2+
Fe3+
铜、铁粉、淀粉KI溶液、维C溶液
(还原剂)
1.实验室保存亚铁盐溶液时为什么要加铁粉?(用离子方程式解释)
2.何除去FeCl2溶液中少量的FeCl3? 3.如何除去FeCl3溶液中少量的FeCl2?
2Fe3+ + Fe = 3Fe2+
加足量铁粉后过滤
通入氯气
注意:亚铁盐要现配现用,防止被空气中的氧气氧化
1.要除去FeCl2溶液中少量的FeCl3,下列方法可行的是( ) A.滴入KSCN溶液 B.加入铁粉C.通入氯气 D.加入铜粉
2.向某溶液中加入几滴KSCN溶液,溶液不变色; 向该溶液中继续通入Cl2,溶液变红色。关于原溶液下列说法正确的是( )A.一定没有Fe3+ B.一定有Fe2+ C.可能有Fe3+ D.不可能有Fe2+
【课堂练习2】
B
AB
3.下列各组离子能大量共存于同一溶液的是( )
A. Fe3+ 、NH4+、Cl-、H+
B. Fe2+、H+、CO32-、Cl-
C. Fe3+ 、SCN-、SO42-、Cl-
D. Fe2+ 、Ca2+ 、NO3- 、H+
A
Fe3+
Fe2+
O2、氯水、H2O2、KMnO4(酸性)、硝酸
(氧化剂)
铜、铁粉、淀粉KI溶液、维C溶液
(还原剂)
课堂小结
一、Fe3+和Fe2+的鉴别
①观察法 ②加碱法 ③加KSCN法
二、Fe2+和Fe3+的转化
Fe3+
Fe2+
氧化剂:O2、KMnO4、双氧水、氯水、硝酸等
还原剂:Cu、Fe、KI、维生素C等
Cl2、O2、H2O2、HNO3、KMnO4(H+) 等
只有还原性
只有氧化性
既有氧化性
又有还原性
(弱氧化剂)
(强氧化剂)
(强氧化剂)
Fe
Fe2+
Fe3+
Fe、Zn、Cu、I-、H2S 等
(还原剂)
请用图示的方法归纳Fe、Fe2+、Fe3+三者之间的相互转化关系
Fe3+、Cu2+、H+、S、I2
Cl2、HNO3、H2SO4(浓)
Zn、Al
CO
(还原剂)
(还原剂)
