课题1 常见的酸和碱课时提升作业
文档属性
| 名称 | 课题1 常见的酸和碱课时提升作业 |  | |
| 格式 | zip | ||
| 文件大小 | 255.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-04-28 14:49:04 | ||
图片预览




文档简介
课时提升作业(十一)
常见的酸和碱
(45分钟 100分)
一、选择题(本题包括10小题,每小题4分,共40分)
1.下列有关物质的名称、俗名、化学式中,三者皆指同一物质的是( )
A.氧化钙、消石灰、CaO
B.石灰水、熟石灰、Ca(OH)2
C.碳酸钠、火碱、Na2CO3
D.氢氧化钠、烧碱、NaOH
【解析】选D。本题考查的是对常见物质的名 ( http: / / www.21cnjy.com )称、俗名、化学式等的认识,解题的关键是熟记常见酸、碱、盐的俗名、化学式,如氧化钙俗称生石灰;氢氧化钙俗称熟石灰,石灰水是氢氧化钙的水溶液;碳酸钠的俗称为纯碱、苏打;氢氧化钠的俗称是火碱、烧碱、苛性钠。
2.(2014·广安中考)下列物质敞口放置在空气中一段时间后,因发生化学反应使质量增加的是( )
A.浓硫酸 B.氯化钠 C.烧碱 D.浓盐酸
【解析】选C。浓硫酸具有吸水性,放置在空气 ( http: / / www.21cnjy.com )中会吸收空气中的水分,使其质量增加,但发生的是物理变化,故选项A错误;氯化钠不与空气中的成分发生化学反应,质量不变,故选项B错误;烧碱敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,故选项C正确;浓盐酸具有挥发性,会使其质量减少,故选项D错误。
3.下列对浓盐酸或浓硫酸的认识或使用正确的是( )
A.稀释浓硫酸时,在量筒中先加入适量浓硫酸,再缓慢加入水
B.打开盛浓盐酸的试剂瓶,发现瓶口有大量白烟出现
C.浓盐酸敞口放置一段时间,溶质的质量分数会减小
D.浓硫酸有强烈的腐蚀性,而稀硫酸没有腐蚀性,所以稀硫酸沾到皮肤上不必处理
【解析】选C。在稀释浓硫酸时,特别要注意的 ( http: / / www.21cnjy.com )是要将浓硫酸加入到水中,并且不能在量筒中稀释,应该用烧杯来稀释溶液,故A错;浓盐酸易挥发,在瓶口易形成白雾,而不是白烟,白烟指的是固体小颗粒,故B错;浓盐酸具有挥发性,敞口放置,挥发出氯化氢气体,溶质减少,所以溶液中溶质的质量分数会变小,故C正确;虽然稀硫酸不像浓硫酸那样具有强烈的腐蚀性,但由于稀硫酸中的水不断蒸发会转变为浓硫酸,从而使腐蚀性大大增强,所以必须及时处理,故D错。
4.下列气体既可以用氢氧化钠干燥,又可以用浓硫酸干燥的是( )
①二氧化碳 ②一氧化碳 ③氢气
④二氧化硫 ⑤氧气 ⑥氨气
A.①⑥ B.②③⑤ C.③⑤ D.②③④
【解析】选B。本题考查的是 ( http: / / www.21cnjy.com )气体干燥剂的选择。因为氢氧化钠和二氧化碳、二氧化硫反应,所以不能用其干燥,但可以用浓硫酸干燥;氨气可以与浓硫酸反应,而不与氢氧化钠反应,所以可用氢氧化钠干燥;一氧化碳、氢气、氧气既不与浓硫酸反应又不与氢氧化钠反应,所以都可以干燥这三种气体。因此本题选B。
5.(2013·湖南师大附中模拟)白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑像
C.大理石栏杆 D.铝合金门窗
【解析】选B。由题目信息可知,蚁酸化学 ( http: / / www.21cnjy.com )性质与盐酸相似,由此推知,蚁酸能与锌、铝、大理石反应,金属活动性顺序中铜在氢的后面,不能与蚁酸反应。故选项B符合题意。
6.(2013·迪庆中考)如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )
①稀盐酸和石灰石;②稀硫酸和锌;③水和氢氧化钠;④水和硝酸铵
( http: / / www.21cnjy.com )
A.①②③④ B.①②③
C.①②④ D.②③④
【解析】选B。①稀盐酸和石灰石反应 ( http: / / www.21cnjy.com )生成二氧化碳气体,使瓶内压强增大,注射器中的活塞向右移动,故可能;②稀硫酸和锌反应生成氢气,使瓶内压强增大,注射器中的活塞向右移动,故可能;③氢氧化钠溶于水放热,使瓶内压强增大,注射器中的活塞向右移动,故可能;④硝酸铵溶于水吸热,使瓶内压强减小,注射器中的活塞向左移动,故不可能。故选B。
7.(2013·邵阳中考)下图两圆相交部分是五种物质中两两之间相互反应的示意图。下列对反应现象的说法中,错误的是( )
( http: / / www.21cnjy.com )
A.a处形成浅绿色溶液 B.b处产生大量气泡
C.c处反应放热 D.d处溶液呈红色
【解析】选D。本题考查常见物质的反 ( http: / / www.21cnjy.com )应现象。A选项中铁与盐酸反应生成氯化亚铁,其水溶液呈浅绿色,故正确;B选项中盐酸与碳酸钠溶液反应生成二氧化碳,产生大量气泡,故正确;C选项中盐酸和氢氧化钠溶液反应产生大量的热,故正确;D选项中氢氧化钠溶液显碱性,使石蕊试液变蓝色,故错。
8.(2013·衡阳中考改编)某同学在化学晚 ( http: / / www.21cnjy.com )会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该同学所用的两种无色液体可能是( )
A.NaOH溶液、酚酞溶液
B.CuSO4溶液、NaOH溶液
C.紫色石蕊溶液、酚酞溶液
D.酚酞溶液、碳酸饮料
【解析】选A。本题主要考查 ( http: / / www.21cnjy.com )物质的颜色和酸碱指示剂。CuSO4溶液是蓝色,B不可能;石蕊溶液是紫色,C不可能;酚酞溶液遇到显酸性的碳酸饮料不变色,D不可能;NaOH溶液和酚酞溶液都是无色的,酚酞遇到显碱性的NaOH变红色,NaOH溶液和酚酞溶液可能是该同学所用的两种无色液体。
9.(2013·邵通中考)稀盐酸是化学实验中常用的试剂,但下列实验中不宜使用稀盐酸的是( )
A.除去熟石灰中的石灰石
B.除去铜粉中混有的铁粉
C.除去氯化钠溶液中的碳酸钠
D.清洗铁丝表面的锈迹
【解析】选A。A选项,熟 ( http: / / www.21cnjy.com )石灰可以和稀盐酸发生中和反应,所以不能用稀盐酸来除去熟石灰中的石灰石;B选项,铜不能和稀盐酸反应,而铁能和稀盐酸反应,所以可以用稀盐酸除去铜粉中的铁粉;C选项,碳酸钠可以和稀盐酸反应生成氯化钠,而氯化钠不能和稀盐酸反应;D选项,铁锈可以和稀盐酸反应,故可以用稀盐酸来除去铁丝表面的铁锈,但是要注意浸泡的时间,否则将会腐蚀铁丝。故选A。
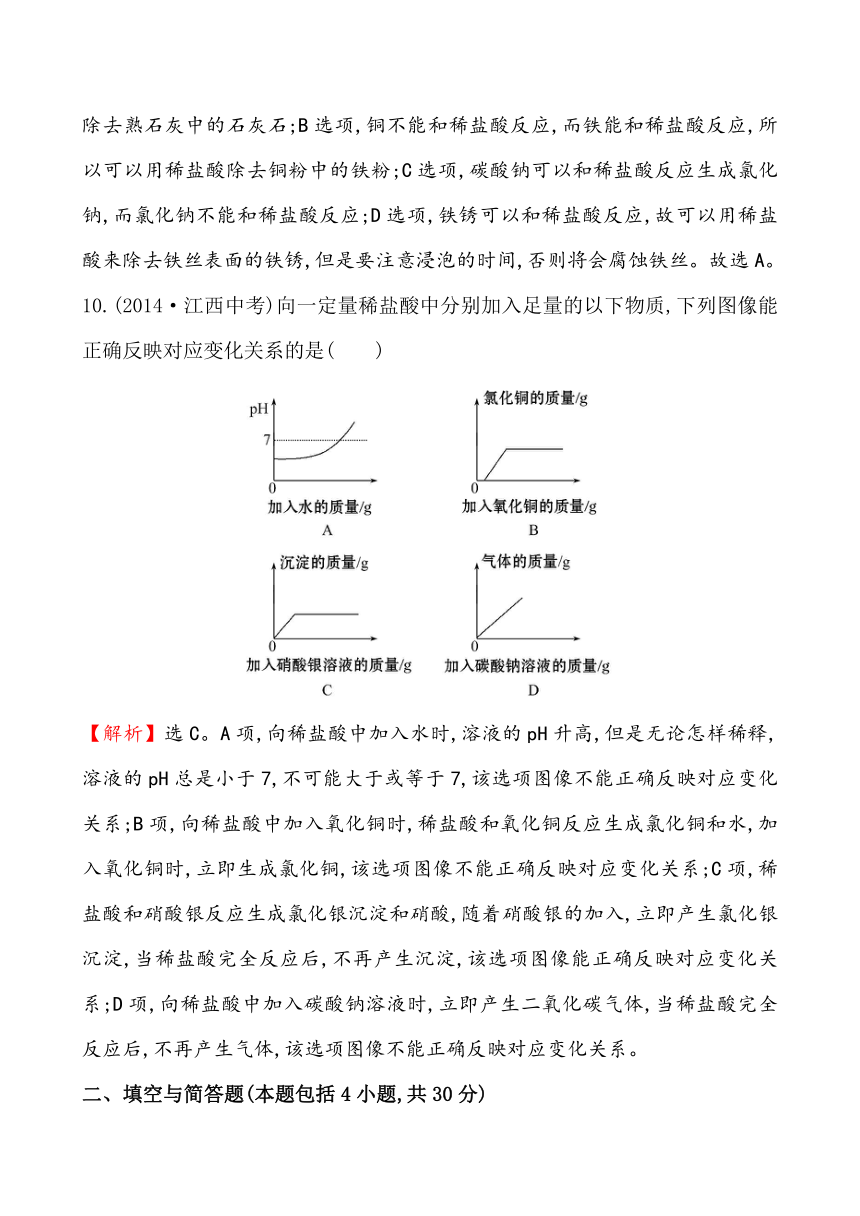
10.(2014·江西中考)向一定量稀盐酸中分别加入足量的以下物质,下列图像能正确反映对应变化关系的是( )
( http: / / www.21cnjy.com )
【解析】选C。A项,向稀盐酸中加入水时 ( http: / / www.21cnjy.com ),溶液的pH升高,但是无论怎样稀释,溶液的pH总是小于7,不可能大于或等于7,该选项图像不能正确反映对应变化关系;B项,向稀盐酸中加入氧化铜时,稀盐酸和氧化铜反应生成氯化铜和水,加入氧化铜时,立即生成氯化铜,该选项图像不能正确反映对应变化关系;C项,稀盐酸和硝酸银反应生成氯化银沉淀和硝酸,随着硝酸银的加入,立即产生氯化银沉淀,当稀盐酸完全反应后,不再产生沉淀,该选项图像能正确反映对应变化关系;D项,向稀盐酸中加入碳酸钠溶液时,立即产生二氧化碳气体,当稀盐酸完全反应后,不再产生气体,该选项图像不能正确反映对应变化关系。
二、填空与简答题(本题包括4小题,共30分)
11.(6分)(2013·大兴安岭中考 ( http: / / www.21cnjy.com ))生石灰可作食品包装袋内的干燥剂,其干燥的原理是(用化学方程式表示)____________________________。用过一段时间后,干燥剂中的物质最多有______种。有些食品包装袋内的干燥剂是铁粉,铁粉失效后会变成______色;铁粉为什么比生石灰更能延长食品保质期 ______________
___________________________________________________________________。
【解析】生石灰是氧化钙的俗称,能与水反应生成氢氧化钙,可作食品包装袋内的干燥剂,反应的化学方程式为CaO+H2OCa(OH)2。生成的氢氧化钙能与空气中的二氧化碳反应生成碳酸钙和水,用过一段时间后,干燥剂中的物质最多有氧化钙、氢氧化钙、碳酸钙三种。有些食品包装袋内的干燥剂是铁粉,铁粉与水、氧气充分接触时容易生锈,生成的铁锈的主要成分是氧化铁,氧化铁呈红色。铁和水、氧气共同作用时生成铁锈,所以与生石灰干燥剂比较,铁粉除了作干燥剂外,还可作吸氧剂,比生石灰更能延长食品保质期。
答案:CaO+H2OCa(OH)2 三 红 铁粉除了作干燥剂外,还可作吸氧剂
【迁移点拨】干燥剂的选择和使用
1.干燥装置的基本类型和气体流动方向:
干燥剂 液体干燥剂 固体干燥剂
装置示意图 ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
气体流动方向 长管进气,短管出气 U形干燥管,进气和出气没有区别;球形干燥管应该大口进气,小口出气
2.气体的分类:
酸性气体:CO2、SO2、NO2、HCl等
碱性气体:只有NH3
中性气体:H2、O2、CH4、CO、N2等
3.气体干燥剂的类型及选择:
(1)常用气体干燥剂按酸碱性分为三类。
①酸性干燥剂,如浓硫酸、五氧化二磷 ( http: / / www.21cnjy.com )。酸性干燥剂能够干燥酸性或中性的气体,如CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙、无水硫酸铜等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
(2)干燥剂选择的基本原则:根据干燥剂和气体的性质选择,其基本原则是干燥剂只吸收气体中的水分,不吸收被干燥的气体。
4.气体净化中干燥装置的位置顺序:气体的 ( http: / / www.21cnjy.com )干燥是气体净化的环节之一,在干燥装置和其他净化或反应装置连接时注意:一般情况下,若采用溶液作除杂试剂,则是先除杂后干燥;若采用加热除去杂质,则是先干燥后加热。
12.(10分)(2013·南平中考)根据硫酸、氢氧化钠、硫酸铜和二氧化碳等物质的性质,完成下列填空。
(1)稀释浓硫酸时,应把____________缓缓注入盛有__________的烧杯中。
(2)硫酸铜溶液的颜色是__________。
(3)氢氧化钠露置在空气中会变质,生成含钠的化合物是__________。
(4)任写出一个氢氧化钠溶液与上述物质能发生反应的化学方程式:
__________________________________________________________________。
【解析】本题考查学生对酸、碱、盐组成和性质的认识,解答本题关键应明确4点:
(1)稀释浓硫酸时,因浓硫酸溶于水放热,且浓硫酸的密度比水大,故应把浓硫酸注入水中;
(2)硫酸铜溶液的颜色为蓝色;
(3)氢氧化钠露置于空气中能与空气中的二氧化碳反应生成碳酸钠和水,其中含有钠元素的化合物是碳酸钠(或碳酸氢钠);
(4)根据氢氧化钠的性质,氢氧化钠与硫酸、硫酸铜和二氧化碳均能发生化学反应,因而该答案不唯一,正确即可。
答案:(1)浓硫酸 水
(2)蓝色
(3)碳酸钠(或碳酸氢钠)
(4)2NaOH+H2SO4Na2SO4+2H2O(或其他合理答案)
13.(4分)(2014·遵义中考)实验室有两瓶失去标签的稀盐酸和氢氧化钠溶液(记作A、B),小强用下列方法鉴别,回答下列问题。
(1)他取适量的A、B两种溶液于试管 ( http: / / www.21cnjy.com )中,分别加入适量氯化铁溶液,观察到A中产生红褐色沉淀,则A是________,发生反应的化学方程式为 ______________
___________________________________________________________________;
(2)他另取适量的A、B两种溶液于试管 ( http: / / www.21cnjy.com )中,分别加入适量碳酸钠溶液,观察到B中的现象为 ________________________________________________________,
发生反应的化学方程式为_____________________________________________;
(3)他通过测定溶液的酸碱度来鉴别:若pH________7,则溶液为________;
(4)他还利用了下列试剂进行鉴别,其中能鉴别的试剂是________。(填字母)
A.锌 B.硝酸钠 C.石蕊试液
【解析】(1)氢氧化钠与氯化铁反应生成红褐色氢氧化铁沉淀和NaCl,其化学方程式为FeCl3+3NaOHFe(OH)3↓+3NaCl;稀盐酸与氯化铁混合没有明显的实验现象;可以判断A为氢氧化钠溶液,B为稀盐酸;
(2)向稀盐酸中滴加碳酸钠溶液产生二氧化碳气体,故现象为有气泡产生,其反应方程式为Na2CO3+2HCl2NaCl+CO2↑+H2O;
(3)溶液酸碱度与pH的关系为酸性溶液pH<7;中性溶液pH=7;碱性溶液pH>7;稀盐酸呈酸性pH<7,氢氧化钠溶液呈碱性pH>7;
(4)锌和稀盐酸能反应生成气体 ( http: / / www.21cnjy.com ),与氢氧化钠不反应,故锌可以鉴别两溶液;硝酸钠与稀盐酸、氢氧化钠混合均没有明显的实验现象;石蕊试液与稀盐酸混合变红色,与氢氧化钠溶液混合变蓝色。
答案:(1)氢氧化钠溶液
FeCl3+3NaOHFe(OH)3↓+3NaCl
(2)有气泡产生
Na2CO3+2HCl2NaCl+CO2↑+H2O
(3)> 氢氧化钠溶液(< 稀盐酸)
(4)A、C
14.(10分)如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
( http: / / www.21cnjy.com )
(1)溶液X是________(填“酸”或“碱”),试剂A的名称是________________。
(2)若X是稀硫酸,B是氧化物,则B的化学式为___________________________。
(3)若X是稀盐酸,C是单质,则C的名称是_______________________________。
(4)若X是稀硫酸,D是氧化物,则X与D反应的化学方程式为_______________。
【解析】本题考查酸的化学性质的同时,也 ( http: / / www.21cnjy.com )进一步说明了化学学习离不开科学实验。(1)主要是考查酸能使紫色石蕊溶液变红的原理,所以溶液X是酸,试剂A是石蕊溶液;(2)和(4)考查了酸和金属氧化物的反应,根据溶液X与B反应,溶液变黄,说明生成的溶液中含有Fe3+,所以B是氧化铁;根据溶液X与D反应,溶液变蓝,说明生成的溶液中含有Cu2+,所以D是氧化铜;(3)考查了金属与活泼金属的反应,反应后溶液呈浅绿色,说明得到的溶液中有Fe2+,所以C是单质铁。
答案:(1)酸 石蕊溶液
(2)Fe2O3 (3)铁
(4)H2SO4+CuOCuSO4+H2O
三、实验与探究题(本题包括2小题,共18分)
15.(8分)某同学在自主学习酸的知识时,设计了以下实验报告,请将该实验报告补充完整。
【实验目的】________________________________________________________
__________________________________________________________________。
【实验用品】试管、铁片、铜片、稀盐酸、稀硫酸、NaOH溶液、石蕊和酚酞溶液等。
【实验内容】
实验步骤 ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
实验现象 溶液变为______色 稀酸中的铁片表面都有________产生,铜片表面都没有明显现象 溶液由红色变为无色
分析与结论 结论:稀酸能与指示剂作用 铁与稀硫酸反应的化学方程式为_______________结论:稀酸能与较活泼金属反应 结论:酸能________________________
【实验思考】从物质组成的角度解释酸具有通性的原因: ________________
__________________________________________________________________。
【解析】本题考查酸的化学性质,从题目设计的 ( http: / / www.21cnjy.com )实验内容看,应为酸的化学性质的实验探究。实验1中加入的是石蕊溶液,酸溶液能使石蕊溶液变红色;实验2是酸与金属的反应,酸溶液能与活泼金属反应生成H2;实验3是借助酚酞溶液探究酸与碱溶液的反应。
答案:【实验目的】探究酸的化学性质
【实验内容】红 气泡
Fe+H2SO4FeSO4+H2↑
与NaOH等碱发生反应
【实验思考】酸溶液中都存在共同的阳离子——H+
16.(10分)(2014· ( http: / / www.21cnjy.com )安徽中考)某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与 _____________________________________________________
____________________________________________________________________
___________________________________________________有关(写一条即可)。
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 设计这一步骤的目的 实验现象 实验结论
1.将NaOH溶液加热煮沸 溶液变红,过一会儿红色消失 甲同学猜想________(填“正确”或“不正确”)
2.向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方
(2)乙同学设计如图装置进行实验,一段 ( http: / / www.21cnjy.com )时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式: _________
__________________________________________________________________。
( http: / / www.21cnjy.com )
甲同学认为乙同学的实验不够严谨,理由是 ____________________________
__________________________________________________________________。
(3)丙同学使用了色度传感器测溶液的颜 ( http: / / www.21cnjy.com )色。他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH溶液,然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。请你观察下图回答问题。
( http: / / www.21cnjy.com )
①写出两条规律性结论:____________________________________________;
__________________________________________________________________。
②推测5%的NaOH溶液滴加2滴酚酞试液后褪为无色的时间约为________。
A.小于30 s B.30~90 s C.90~140 s
D.140~180 s E.180~280 s F.大于280 s
【解析】认真分析(3)题图可以得出:氢氧 ( http: / / www.21cnjy.com )化钠溶液的浓度越大,酚酞试液变红后褪色越快;氢氧化钠溶液的浓度越小,色度值越大。从图中看5%的NaOH溶液滴加2滴酚酞试液后140 s内色度从85升高至92,那么从92升高至100,所需时间要大于140 s。
答案:仪器不干净,含有酸性物质(合理均可)
(1)除去溶液中的氧气 隔绝氧气 不正确
(2)2NaOH+CO2Na2CO3+H2O
若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去
(3)①氢氧化钠溶液的浓度越大,酚酞试液变红后褪色越快
氢氧化钠溶液的浓度越小,色度值越大
②F
【方法指南】除杂质的基本原则和方法
基本原则:“不增、不减、易分离”。不增:不增加新的杂质;不减:不减少被提纯物质;易分离:杂质与被提纯物质容易分离。
常见方法:
物理方法——加水溶解、过滤、结晶、磁铁吸引等。
化学方法——(1)沉淀法:把杂质转化为沉淀除去,如NaNO3(NaCl)加入硝酸银溶液;
(2)把杂质转化为气体除去,如NaCl(Na2CO3)加入稀盐酸;
(3)加热法:如CaO(CaCO3);
(4)吸收法:如CO(CO2)通过氢氧化钠溶液而除去CO2;N2(O2)通过灼热的铜网而除去O2;
(5)置换法:FeSO4(CuSO4)加入铁粉与CuSO4反应而除去;又如银粉(铜粉)中加AgNO3溶液与Cu反应而除去。
四、计算题(本题包括1小题,共12分)
17.(2013·德阳中考)某校化学兴趣小组 ( http: / / www.21cnjy.com )的同学为了制取氢氧化镁,他们取9.5 g氯化镁固体全部溶解在40.5 g水中制成不饱和溶液,然后向其中加入55.8 g某溶质质量分数的氢氧化钠溶液恰好完全反应。请你帮他们计算该小组制得的氢氧化镁的质量和反应所得溶液中溶质的质量分数。
【解析】设反应后生成Mg(OH)2的质量为x,生成NaCl的质量为y。
MgCl2+2NaOHMg(OH)2↓+2NaCl
95 58 117
9.5 g x y
= x=5.8 g
=,y=11.7 g
所得溶液中溶质的质量分数
=×100%=11.7%
答:制得的氢氧化镁的质量为5.8 g,反应所得溶液中溶质的质量分数为11.7%。
答案:5.8 g 11.7%
【方法归纳】反应前后溶液质量变化问题规律总结
1.混合前后溶液质量不变的:
(1)相混合的两物质若不发生反应或都不溶解,溶液质量一定不变。
(2)相混合的两物质虽发生反应,但混合前两物质是溶液,反应后既无气体生成,也无沉淀生成,则溶液质量一定不变。
2.反应后溶液质量增加的:
(1)金属与酸反应时,反应后溶液质量一定增加。
(2)有固体或气体参加反应,反应后无气体或沉淀生成的,溶液质量一定增加。
(3)有固体或气体参加反应,反应后有 ( http: / / www.21cnjy.com )气体或沉淀生成,但生成的气体或沉淀质量小于参加反应的固体或气体的质量,溶液质量增加,如CaCO3与稀盐酸反应、Zn和CuSO4溶液反应等。
3.反应后溶液质量减少的:
(1)反应物均为溶液,生成物中有沉淀或气体生成的。如BaCl2溶液和稀硫酸反应,Na2CO3溶液和稀盐酸反应等。
(2)有固体或气体参加反应,反应后有气 ( http: / / www.21cnjy.com )体或沉淀生成,且生成的气体或沉淀质量大于参加反应的固体或气体质量,如CO2与石灰水反应、Fe和CuSO4溶液的反应等。
常见的酸和碱
(45分钟 100分)
一、选择题(本题包括10小题,每小题4分,共40分)
1.下列有关物质的名称、俗名、化学式中,三者皆指同一物质的是( )
A.氧化钙、消石灰、CaO
B.石灰水、熟石灰、Ca(OH)2
C.碳酸钠、火碱、Na2CO3
D.氢氧化钠、烧碱、NaOH
【解析】选D。本题考查的是对常见物质的名 ( http: / / www.21cnjy.com )称、俗名、化学式等的认识,解题的关键是熟记常见酸、碱、盐的俗名、化学式,如氧化钙俗称生石灰;氢氧化钙俗称熟石灰,石灰水是氢氧化钙的水溶液;碳酸钠的俗称为纯碱、苏打;氢氧化钠的俗称是火碱、烧碱、苛性钠。
2.(2014·广安中考)下列物质敞口放置在空气中一段时间后,因发生化学反应使质量增加的是( )
A.浓硫酸 B.氯化钠 C.烧碱 D.浓盐酸
【解析】选C。浓硫酸具有吸水性,放置在空气 ( http: / / www.21cnjy.com )中会吸收空气中的水分,使其质量增加,但发生的是物理变化,故选项A错误;氯化钠不与空气中的成分发生化学反应,质量不变,故选项B错误;烧碱敞口放置在空气中,能与空气中的二氧化碳发生化学反应生成碳酸钠和水,发生了化学反应导致质量增加,故选项C正确;浓盐酸具有挥发性,会使其质量减少,故选项D错误。
3.下列对浓盐酸或浓硫酸的认识或使用正确的是( )
A.稀释浓硫酸时,在量筒中先加入适量浓硫酸,再缓慢加入水
B.打开盛浓盐酸的试剂瓶,发现瓶口有大量白烟出现
C.浓盐酸敞口放置一段时间,溶质的质量分数会减小
D.浓硫酸有强烈的腐蚀性,而稀硫酸没有腐蚀性,所以稀硫酸沾到皮肤上不必处理
【解析】选C。在稀释浓硫酸时,特别要注意的 ( http: / / www.21cnjy.com )是要将浓硫酸加入到水中,并且不能在量筒中稀释,应该用烧杯来稀释溶液,故A错;浓盐酸易挥发,在瓶口易形成白雾,而不是白烟,白烟指的是固体小颗粒,故B错;浓盐酸具有挥发性,敞口放置,挥发出氯化氢气体,溶质减少,所以溶液中溶质的质量分数会变小,故C正确;虽然稀硫酸不像浓硫酸那样具有强烈的腐蚀性,但由于稀硫酸中的水不断蒸发会转变为浓硫酸,从而使腐蚀性大大增强,所以必须及时处理,故D错。
4.下列气体既可以用氢氧化钠干燥,又可以用浓硫酸干燥的是( )
①二氧化碳 ②一氧化碳 ③氢气
④二氧化硫 ⑤氧气 ⑥氨气
A.①⑥ B.②③⑤ C.③⑤ D.②③④
【解析】选B。本题考查的是 ( http: / / www.21cnjy.com )气体干燥剂的选择。因为氢氧化钠和二氧化碳、二氧化硫反应,所以不能用其干燥,但可以用浓硫酸干燥;氨气可以与浓硫酸反应,而不与氢氧化钠反应,所以可用氢氧化钠干燥;一氧化碳、氢气、氧气既不与浓硫酸反应又不与氢氧化钠反应,所以都可以干燥这三种气体。因此本题选B。
5.(2013·湖南师大附中模拟)白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是( )
A.镀锌水管 B.铜制塑像
C.大理石栏杆 D.铝合金门窗
【解析】选B。由题目信息可知,蚁酸化学 ( http: / / www.21cnjy.com )性质与盐酸相似,由此推知,蚁酸能与锌、铝、大理石反应,金属活动性顺序中铜在氢的后面,不能与蚁酸反应。故选项B符合题意。
6.(2013·迪庆中考)如图所示装置气密性良好、要使注射器中的活塞向右移动,使用的液体M和固体N可能是( )
①稀盐酸和石灰石;②稀硫酸和锌;③水和氢氧化钠;④水和硝酸铵
( http: / / www.21cnjy.com )
A.①②③④ B.①②③
C.①②④ D.②③④
【解析】选B。①稀盐酸和石灰石反应 ( http: / / www.21cnjy.com )生成二氧化碳气体,使瓶内压强增大,注射器中的活塞向右移动,故可能;②稀硫酸和锌反应生成氢气,使瓶内压强增大,注射器中的活塞向右移动,故可能;③氢氧化钠溶于水放热,使瓶内压强增大,注射器中的活塞向右移动,故可能;④硝酸铵溶于水吸热,使瓶内压强减小,注射器中的活塞向左移动,故不可能。故选B。
7.(2013·邵阳中考)下图两圆相交部分是五种物质中两两之间相互反应的示意图。下列对反应现象的说法中,错误的是( )
( http: / / www.21cnjy.com )
A.a处形成浅绿色溶液 B.b处产生大量气泡
C.c处反应放热 D.d处溶液呈红色
【解析】选D。本题考查常见物质的反 ( http: / / www.21cnjy.com )应现象。A选项中铁与盐酸反应生成氯化亚铁,其水溶液呈浅绿色,故正确;B选项中盐酸与碳酸钠溶液反应生成二氧化碳,产生大量气泡,故正确;C选项中盐酸和氢氧化钠溶液反应产生大量的热,故正确;D选项中氢氧化钠溶液显碱性,使石蕊试液变蓝色,故错。
8.(2013·衡阳中考改编)某同学在化学晚 ( http: / / www.21cnjy.com )会上用毛笔蘸取一种无色液体在一张白纸上书写了“化学魔术”四字,然后再喷上另一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该同学所用的两种无色液体可能是( )
A.NaOH溶液、酚酞溶液
B.CuSO4溶液、NaOH溶液
C.紫色石蕊溶液、酚酞溶液
D.酚酞溶液、碳酸饮料
【解析】选A。本题主要考查 ( http: / / www.21cnjy.com )物质的颜色和酸碱指示剂。CuSO4溶液是蓝色,B不可能;石蕊溶液是紫色,C不可能;酚酞溶液遇到显酸性的碳酸饮料不变色,D不可能;NaOH溶液和酚酞溶液都是无色的,酚酞遇到显碱性的NaOH变红色,NaOH溶液和酚酞溶液可能是该同学所用的两种无色液体。
9.(2013·邵通中考)稀盐酸是化学实验中常用的试剂,但下列实验中不宜使用稀盐酸的是( )
A.除去熟石灰中的石灰石
B.除去铜粉中混有的铁粉
C.除去氯化钠溶液中的碳酸钠
D.清洗铁丝表面的锈迹
【解析】选A。A选项,熟 ( http: / / www.21cnjy.com )石灰可以和稀盐酸发生中和反应,所以不能用稀盐酸来除去熟石灰中的石灰石;B选项,铜不能和稀盐酸反应,而铁能和稀盐酸反应,所以可以用稀盐酸除去铜粉中的铁粉;C选项,碳酸钠可以和稀盐酸反应生成氯化钠,而氯化钠不能和稀盐酸反应;D选项,铁锈可以和稀盐酸反应,故可以用稀盐酸来除去铁丝表面的铁锈,但是要注意浸泡的时间,否则将会腐蚀铁丝。故选A。
10.(2014·江西中考)向一定量稀盐酸中分别加入足量的以下物质,下列图像能正确反映对应变化关系的是( )
( http: / / www.21cnjy.com )
【解析】选C。A项,向稀盐酸中加入水时 ( http: / / www.21cnjy.com ),溶液的pH升高,但是无论怎样稀释,溶液的pH总是小于7,不可能大于或等于7,该选项图像不能正确反映对应变化关系;B项,向稀盐酸中加入氧化铜时,稀盐酸和氧化铜反应生成氯化铜和水,加入氧化铜时,立即生成氯化铜,该选项图像不能正确反映对应变化关系;C项,稀盐酸和硝酸银反应生成氯化银沉淀和硝酸,随着硝酸银的加入,立即产生氯化银沉淀,当稀盐酸完全反应后,不再产生沉淀,该选项图像能正确反映对应变化关系;D项,向稀盐酸中加入碳酸钠溶液时,立即产生二氧化碳气体,当稀盐酸完全反应后,不再产生气体,该选项图像不能正确反映对应变化关系。
二、填空与简答题(本题包括4小题,共30分)
11.(6分)(2013·大兴安岭中考 ( http: / / www.21cnjy.com ))生石灰可作食品包装袋内的干燥剂,其干燥的原理是(用化学方程式表示)____________________________。用过一段时间后,干燥剂中的物质最多有______种。有些食品包装袋内的干燥剂是铁粉,铁粉失效后会变成______色;铁粉为什么比生石灰更能延长食品保质期 ______________
___________________________________________________________________。
【解析】生石灰是氧化钙的俗称,能与水反应生成氢氧化钙,可作食品包装袋内的干燥剂,反应的化学方程式为CaO+H2OCa(OH)2。生成的氢氧化钙能与空气中的二氧化碳反应生成碳酸钙和水,用过一段时间后,干燥剂中的物质最多有氧化钙、氢氧化钙、碳酸钙三种。有些食品包装袋内的干燥剂是铁粉,铁粉与水、氧气充分接触时容易生锈,生成的铁锈的主要成分是氧化铁,氧化铁呈红色。铁和水、氧气共同作用时生成铁锈,所以与生石灰干燥剂比较,铁粉除了作干燥剂外,还可作吸氧剂,比生石灰更能延长食品保质期。
答案:CaO+H2OCa(OH)2 三 红 铁粉除了作干燥剂外,还可作吸氧剂
【迁移点拨】干燥剂的选择和使用
1.干燥装置的基本类型和气体流动方向:
干燥剂 液体干燥剂 固体干燥剂
装置示意图 ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
气体流动方向 长管进气,短管出气 U形干燥管,进气和出气没有区别;球形干燥管应该大口进气,小口出气
2.气体的分类:
酸性气体:CO2、SO2、NO2、HCl等
碱性气体:只有NH3
中性气体:H2、O2、CH4、CO、N2等
3.气体干燥剂的类型及选择:
(1)常用气体干燥剂按酸碱性分为三类。
①酸性干燥剂,如浓硫酸、五氧化二磷 ( http: / / www.21cnjy.com )。酸性干燥剂能够干燥酸性或中性的气体,如CO2、SO2、NO2、HCl、H2、Cl2、O2、CH4等气体。
②碱性干燥剂,如生石灰、碱石灰、固体NaOH。碱性干燥剂可以用来干燥碱性或中性的气体,如NH3、H2、O2、CH4等气体。
③中性干燥剂,如无水氯化钙、无水硫酸铜等,可以干燥中性、酸性、碱性气体,如O2、H2、CH4等。
(2)干燥剂选择的基本原则:根据干燥剂和气体的性质选择,其基本原则是干燥剂只吸收气体中的水分,不吸收被干燥的气体。
4.气体净化中干燥装置的位置顺序:气体的 ( http: / / www.21cnjy.com )干燥是气体净化的环节之一,在干燥装置和其他净化或反应装置连接时注意:一般情况下,若采用溶液作除杂试剂,则是先除杂后干燥;若采用加热除去杂质,则是先干燥后加热。
12.(10分)(2013·南平中考)根据硫酸、氢氧化钠、硫酸铜和二氧化碳等物质的性质,完成下列填空。
(1)稀释浓硫酸时,应把____________缓缓注入盛有__________的烧杯中。
(2)硫酸铜溶液的颜色是__________。
(3)氢氧化钠露置在空气中会变质,生成含钠的化合物是__________。
(4)任写出一个氢氧化钠溶液与上述物质能发生反应的化学方程式:
__________________________________________________________________。
【解析】本题考查学生对酸、碱、盐组成和性质的认识,解答本题关键应明确4点:
(1)稀释浓硫酸时,因浓硫酸溶于水放热,且浓硫酸的密度比水大,故应把浓硫酸注入水中;
(2)硫酸铜溶液的颜色为蓝色;
(3)氢氧化钠露置于空气中能与空气中的二氧化碳反应生成碳酸钠和水,其中含有钠元素的化合物是碳酸钠(或碳酸氢钠);
(4)根据氢氧化钠的性质,氢氧化钠与硫酸、硫酸铜和二氧化碳均能发生化学反应,因而该答案不唯一,正确即可。
答案:(1)浓硫酸 水
(2)蓝色
(3)碳酸钠(或碳酸氢钠)
(4)2NaOH+H2SO4Na2SO4+2H2O(或其他合理答案)
13.(4分)(2014·遵义中考)实验室有两瓶失去标签的稀盐酸和氢氧化钠溶液(记作A、B),小强用下列方法鉴别,回答下列问题。
(1)他取适量的A、B两种溶液于试管 ( http: / / www.21cnjy.com )中,分别加入适量氯化铁溶液,观察到A中产生红褐色沉淀,则A是________,发生反应的化学方程式为 ______________
___________________________________________________________________;
(2)他另取适量的A、B两种溶液于试管 ( http: / / www.21cnjy.com )中,分别加入适量碳酸钠溶液,观察到B中的现象为 ________________________________________________________,
发生反应的化学方程式为_____________________________________________;
(3)他通过测定溶液的酸碱度来鉴别:若pH________7,则溶液为________;
(4)他还利用了下列试剂进行鉴别,其中能鉴别的试剂是________。(填字母)
A.锌 B.硝酸钠 C.石蕊试液
【解析】(1)氢氧化钠与氯化铁反应生成红褐色氢氧化铁沉淀和NaCl,其化学方程式为FeCl3+3NaOHFe(OH)3↓+3NaCl;稀盐酸与氯化铁混合没有明显的实验现象;可以判断A为氢氧化钠溶液,B为稀盐酸;
(2)向稀盐酸中滴加碳酸钠溶液产生二氧化碳气体,故现象为有气泡产生,其反应方程式为Na2CO3+2HCl2NaCl+CO2↑+H2O;
(3)溶液酸碱度与pH的关系为酸性溶液pH<7;中性溶液pH=7;碱性溶液pH>7;稀盐酸呈酸性pH<7,氢氧化钠溶液呈碱性pH>7;
(4)锌和稀盐酸能反应生成气体 ( http: / / www.21cnjy.com ),与氢氧化钠不反应,故锌可以鉴别两溶液;硝酸钠与稀盐酸、氢氧化钠混合均没有明显的实验现象;石蕊试液与稀盐酸混合变红色,与氢氧化钠溶液混合变蓝色。
答案:(1)氢氧化钠溶液
FeCl3+3NaOHFe(OH)3↓+3NaCl
(2)有气泡产生
Na2CO3+2HCl2NaCl+CO2↑+H2O
(3)> 氢氧化钠溶液(< 稀盐酸)
(4)A、C
14.(10分)如图化学反应的溶液颜色变化体现了“魔法世界,魅力化学”,请回答:
( http: / / www.21cnjy.com )
(1)溶液X是________(填“酸”或“碱”),试剂A的名称是________________。
(2)若X是稀硫酸,B是氧化物,则B的化学式为___________________________。
(3)若X是稀盐酸,C是单质,则C的名称是_______________________________。
(4)若X是稀硫酸,D是氧化物,则X与D反应的化学方程式为_______________。
【解析】本题考查酸的化学性质的同时,也 ( http: / / www.21cnjy.com )进一步说明了化学学习离不开科学实验。(1)主要是考查酸能使紫色石蕊溶液变红的原理,所以溶液X是酸,试剂A是石蕊溶液;(2)和(4)考查了酸和金属氧化物的反应,根据溶液X与B反应,溶液变黄,说明生成的溶液中含有Fe3+,所以B是氧化铁;根据溶液X与D反应,溶液变蓝,说明生成的溶液中含有Cu2+,所以D是氧化铜;(3)考查了金属与活泼金属的反应,反应后溶液呈浅绿色,说明得到的溶液中有Fe2+,所以C是单质铁。
答案:(1)酸 石蕊溶液
(2)Fe2O3 (3)铁
(4)H2SO4+CuOCuSO4+H2O
三、实验与探究题(本题包括2小题,共18分)
15.(8分)某同学在自主学习酸的知识时,设计了以下实验报告,请将该实验报告补充完整。
【实验目的】________________________________________________________
__________________________________________________________________。
【实验用品】试管、铁片、铜片、稀盐酸、稀硫酸、NaOH溶液、石蕊和酚酞溶液等。
【实验内容】
实验步骤 ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com ) ( http: / / www.21cnjy.com )
实验现象 溶液变为______色 稀酸中的铁片表面都有________产生,铜片表面都没有明显现象 溶液由红色变为无色
分析与结论 结论:稀酸能与指示剂作用 铁与稀硫酸反应的化学方程式为_______________结论:稀酸能与较活泼金属反应 结论:酸能________________________
【实验思考】从物质组成的角度解释酸具有通性的原因: ________________
__________________________________________________________________。
【解析】本题考查酸的化学性质,从题目设计的 ( http: / / www.21cnjy.com )实验内容看,应为酸的化学性质的实验探究。实验1中加入的是石蕊溶液,酸溶液能使石蕊溶液变红色;实验2是酸与金属的反应,酸溶液能与活泼金属反应生成H2;实验3是借助酚酞溶液探究酸与碱溶液的反应。
答案:【实验目的】探究酸的化学性质
【实验内容】红 气泡
Fe+H2SO4FeSO4+H2↑
与NaOH等碱发生反应
【实验思考】酸溶液中都存在共同的阳离子——H+
16.(10分)(2014· ( http: / / www.21cnjy.com )安徽中考)某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与 _____________________________________________________
____________________________________________________________________
___________________________________________________有关(写一条即可)。
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 设计这一步骤的目的 实验现象 实验结论
1.将NaOH溶液加热煮沸 溶液变红,过一会儿红色消失 甲同学猜想________(填“正确”或“不正确”)
2.向冷却后的溶液中滴入酚酞,并滴一些植物油在其上方
(2)乙同学设计如图装置进行实验,一段 ( http: / / www.21cnjy.com )时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式: _________
__________________________________________________________________。
( http: / / www.21cnjy.com )
甲同学认为乙同学的实验不够严谨,理由是 ____________________________
__________________________________________________________________。
(3)丙同学使用了色度传感器测溶液的颜 ( http: / / www.21cnjy.com )色。他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH溶液,然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。请你观察下图回答问题。
( http: / / www.21cnjy.com )
①写出两条规律性结论:____________________________________________;
__________________________________________________________________。
②推测5%的NaOH溶液滴加2滴酚酞试液后褪为无色的时间约为________。
A.小于30 s B.30~90 s C.90~140 s
D.140~180 s E.180~280 s F.大于280 s
【解析】认真分析(3)题图可以得出:氢氧 ( http: / / www.21cnjy.com )化钠溶液的浓度越大,酚酞试液变红后褪色越快;氢氧化钠溶液的浓度越小,色度值越大。从图中看5%的NaOH溶液滴加2滴酚酞试液后140 s内色度从85升高至92,那么从92升高至100,所需时间要大于140 s。
答案:仪器不干净,含有酸性物质(合理均可)
(1)除去溶液中的氧气 隔绝氧气 不正确
(2)2NaOH+CO2Na2CO3+H2O
若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去
(3)①氢氧化钠溶液的浓度越大,酚酞试液变红后褪色越快
氢氧化钠溶液的浓度越小,色度值越大
②F
【方法指南】除杂质的基本原则和方法
基本原则:“不增、不减、易分离”。不增:不增加新的杂质;不减:不减少被提纯物质;易分离:杂质与被提纯物质容易分离。
常见方法:
物理方法——加水溶解、过滤、结晶、磁铁吸引等。
化学方法——(1)沉淀法:把杂质转化为沉淀除去,如NaNO3(NaCl)加入硝酸银溶液;
(2)把杂质转化为气体除去,如NaCl(Na2CO3)加入稀盐酸;
(3)加热法:如CaO(CaCO3);
(4)吸收法:如CO(CO2)通过氢氧化钠溶液而除去CO2;N2(O2)通过灼热的铜网而除去O2;
(5)置换法:FeSO4(CuSO4)加入铁粉与CuSO4反应而除去;又如银粉(铜粉)中加AgNO3溶液与Cu反应而除去。
四、计算题(本题包括1小题,共12分)
17.(2013·德阳中考)某校化学兴趣小组 ( http: / / www.21cnjy.com )的同学为了制取氢氧化镁,他们取9.5 g氯化镁固体全部溶解在40.5 g水中制成不饱和溶液,然后向其中加入55.8 g某溶质质量分数的氢氧化钠溶液恰好完全反应。请你帮他们计算该小组制得的氢氧化镁的质量和反应所得溶液中溶质的质量分数。
【解析】设反应后生成Mg(OH)2的质量为x,生成NaCl的质量为y。
MgCl2+2NaOHMg(OH)2↓+2NaCl
95 58 117
9.5 g x y
= x=5.8 g
=,y=11.7 g
所得溶液中溶质的质量分数
=×100%=11.7%
答:制得的氢氧化镁的质量为5.8 g,反应所得溶液中溶质的质量分数为11.7%。
答案:5.8 g 11.7%
【方法归纳】反应前后溶液质量变化问题规律总结
1.混合前后溶液质量不变的:
(1)相混合的两物质若不发生反应或都不溶解,溶液质量一定不变。
(2)相混合的两物质虽发生反应,但混合前两物质是溶液,反应后既无气体生成,也无沉淀生成,则溶液质量一定不变。
2.反应后溶液质量增加的:
(1)金属与酸反应时,反应后溶液质量一定增加。
(2)有固体或气体参加反应,反应后无气体或沉淀生成的,溶液质量一定增加。
(3)有固体或气体参加反应,反应后有 ( http: / / www.21cnjy.com )气体或沉淀生成,但生成的气体或沉淀质量小于参加反应的固体或气体的质量,溶液质量增加,如CaCO3与稀盐酸反应、Zn和CuSO4溶液反应等。
3.反应后溶液质量减少的:
(1)反应物均为溶液,生成物中有沉淀或气体生成的。如BaCl2溶液和稀硫酸反应,Na2CO3溶液和稀盐酸反应等。
(2)有固体或气体参加反应,反应后有气 ( http: / / www.21cnjy.com )体或沉淀生成,且生成的气体或沉淀质量大于参加反应的固体或气体质量,如CO2与石灰水反应、Fe和CuSO4溶液的反应等。
同课章节目录
