5.1.1 元素周期律 教学设计 2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 5.1.1 元素周期律 教学设计 2023-2024学年高一上学期化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 131.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-06 09:53:58 | ||
图片预览

文档简介
专题5 微观结构与物质的多样性
第一单元 元素周期律和元素周期表
第1课时 元素周期律
教学目标
1. 认识元素周期律,了解原子核外电子排布、元素原子半径、元素主要化合价的周期性变化;
2. 了解元素主要化合价与元素原子核外电子排布之间的等式关系。
教学重点
原子核外电排布、元素原子半径、元素主要化合价的周期性变化规律。
教学难点
原子半径大小的比较。
课前准备
ppt课件《元素周期律》
教学过程
知识回顾
同学们应熟练掌握1~18号元素原子核外电子排布的情况,能够熟练书写1~18号元素原子结构示意图。理解阴、阳离子的形成原理,能够书写常见简单阴、阳离子的离子结构示意图。
导入新课
[分析]从1~18号元素原子的核外电子排布我们可以看到原子核外电子的排布不仅符合上述规则,而且似乎具有一定的规律。这节课我们就将在上节课的基础上学习元素周期律。
一. 原子核外电子排布的周期性变化
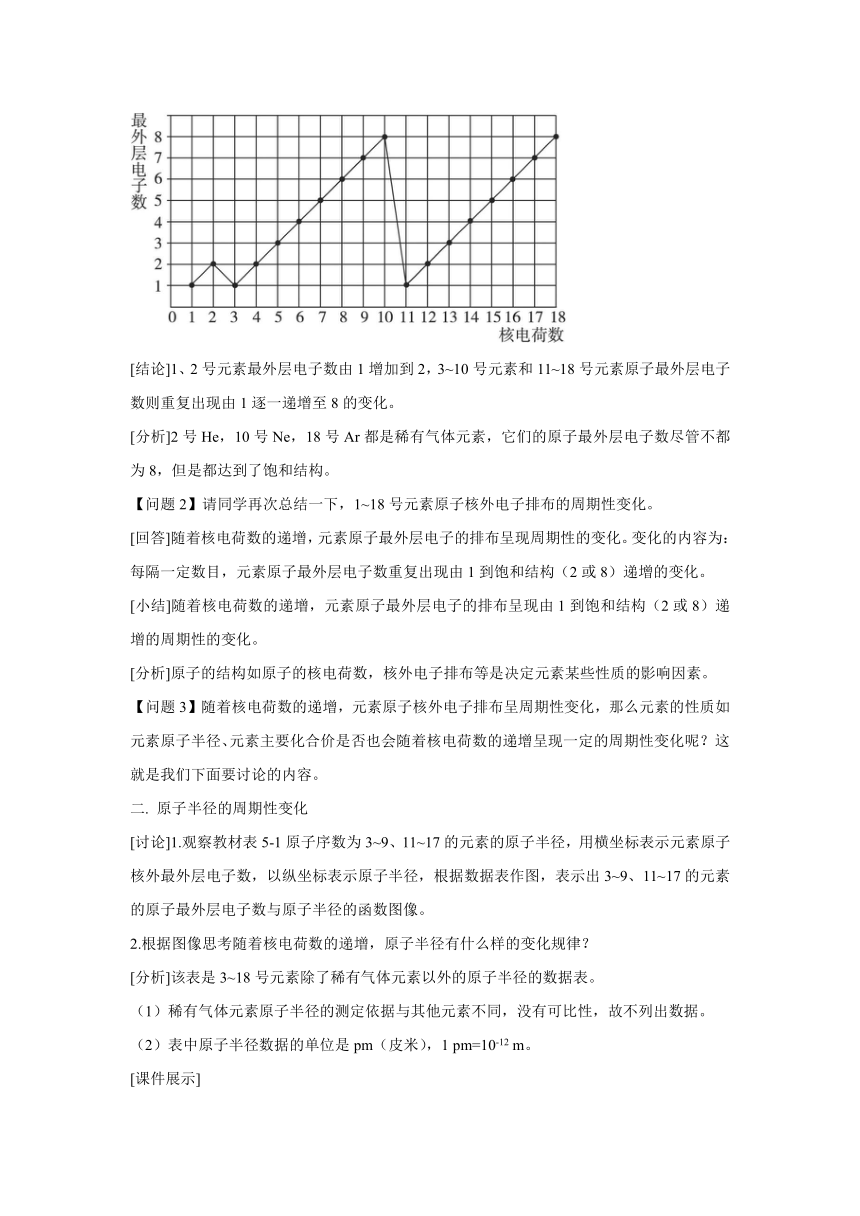
【问题1】观察教材图5-1,核电荷数为1~18的元素原子最外层电子数,请说出随着核电荷数的递增,元素原子最外层电子的排布呈现了怎样的周期性变化?
[课件展示]
[结论]1、2号元素最外层电子数由1增加到2,3~10号元素和11~18号元素原子最外层电子数则重复出现由1逐一递增至8的变化。
[分析]2号He,10号Ne,18号Ar都是稀有气体元素,它们的原子最外层电子数尽管不都为8,但是都达到了饱和结构。
【问题2】请同学再次总结一下,1~18号元素原子核外电子排布的周期性变化。
[回答]随着核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化。变化的内容为:每隔一定数目,元素原子最外层电子数重复出现由1到饱和结构(2或8)递增的变化。
[小结]随着核电荷数的递增,元素原子最外层电子的排布呈现由1到饱和结构(2或8)递增的周期性的变化。
[分析]原子的结构如原子的核电荷数,核外电子排布等是决定元素某些性质的影响因素。
【问题3】随着核电荷数的递增,元素原子核外电子排布呈周期性变化,那么元素的性质如元素原子半径、元素主要化合价是否也会随着核电荷数的递增呈现一定的周期性变化呢?这就是我们下面要讨论的内容。
二. 原子半径的周期性变化
[讨论]1.观察教材表5-1原子序数为3~9、11~17的元素的原子半径,用横坐标表示元素原子核外最外层电子数,以纵坐标表示原子半径,根据数据表作图,表示出3~9、11~17的元素的原子最外层电子数与原子半径的函数图像。
2.根据图像思考随着核电荷数的递增,原子半径有什么样的变化规律?
[分析]该表是3~18号元素除了稀有气体元素以外的原子半径的数据表。
(1)稀有气体元素原子半径的测定依据与其他元素不同,没有可比性,故不列出数据。
(2)表中原子半径数据的单位是pm(皮米),1 pm=10-12 m。
[课件展示]
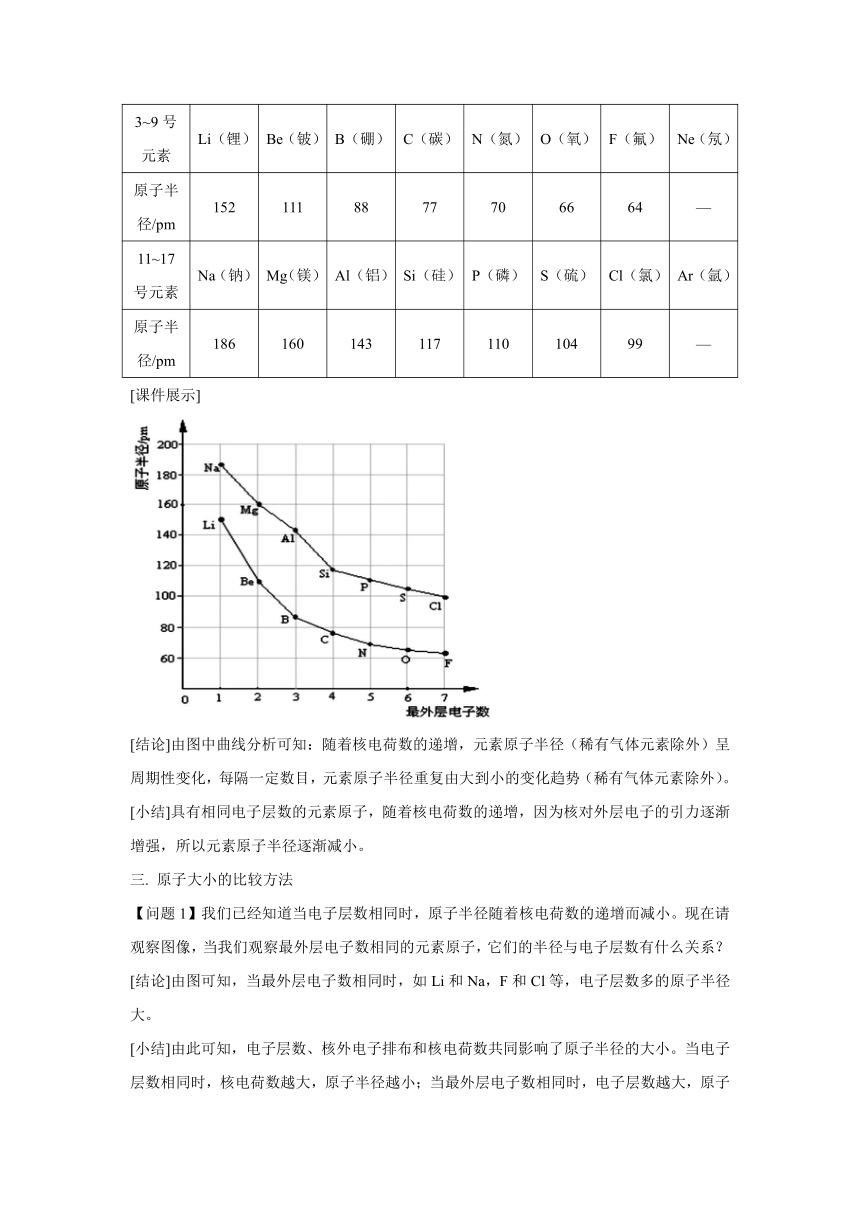
3~9号元素 Li(锂) Be(铍) B(硼) C(碳) N(氮) O(氧) F(氟) Ne(氖)
原子半径/pm 152 111 88 77 70 66 64 —
11~17号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷) S(硫) Cl(氯) Ar(氩)
原子半径/pm 186 160 143 117 110 104 99 —
[课件展示]
[结论]由图中曲线分析可知:随着核电荷数的递增,元素原子半径(稀有气体元素除外)呈周期性变化,每隔一定数目,元素原子半径重复由大到小的变化趋势(稀有气体元素除外)。
[小结]具有相同电子层数的元素原子,随着核电荷数的递增,因为核对外层电子的引力逐渐增强,所以元素原子半径逐渐减小。
三. 原子大小的比较方法
【问题1】我们已经知道当电子层数相同时,原子半径随着核电荷数的递增而减小。现在请观察图像,当我们观察最外层电子数相同的元素原子,它们的半径与电子层数有什么关系?
[结论]由图可知,当最外层电子数相同时,如Li和Na,F和Cl等,电子层数多的原子半径大。
[小结]由此可知,电子层数、核外电子排布和核电荷数共同影响了原子半径的大小。当电子层数相同时,核电荷数越大,原子半径越小;当最外层电子数相同时,电子层数越大,原子半径越大。
简而言之:从左到右,逐渐减小;从上到下,逐渐增大。(稀有气体元素除外)
【问题2】思考在1~18号元素原子中半径最小的原子和半径最大的原子分别是什么?
[结论]1~18号元素原子中半径最小的原子是氢原子(核外电子排布一层电子,最外层电子数为1),半径最大的原子为钠原子(核外电子排布三层电子,最外层电子数为1)。
[练习]比较原子半径的大小(填“>”或“<”)K_________Cs,O________F,Si________N。
[分析]K、Cs最外层电子数相同,电子层数K<Cs,故原子半径K<Cs。
O、F电子层数相同,核电荷数O<F,故原子半径O>F。
在Si、N原子半径的比较中,要善于找出比较“支点”。Si电子层3层,最外层电子数4,而N电子层为2层,最外层电子数5,我们可以找出电子层为3层,但是最外层电子数为5的原子即P作为比较的“支点”。原子半径Si>P,而P>N,故结论为原子半径Si>N。(用碳原子作为“支点”比较也可)
四. 化合价与原子的电子层结构
[分析]元素的主要化合价与原子的电子层结构,特别是与最外层电子数目密切相关。
[展示]3~9、11~17号元素的原子核外电子排布以及元素的最高正化合价与最低负化合价。
【问题】1.请观察思考,随着核电荷数的递增,元素的主要化合价是否也存在一定的周期性变化?
2.这种周期性变化是否是完全不变的简单重复?
3.观察元素最高正化合价与最低负化合价,结合元素原子的核外电子排布,思考它们之间是否存在一定的联系?
[结论]1.随着核电荷数的递增,元素的主要化合价呈周期性变化,每隔一定数目,元素的最高正化合价重复出现由+1到+7(3~7号元素最高正化合价由1到+5)递增,最低负化合价由-4到-1递增的变化。(稀有气体元素除外)
2.元素主要化合价的周期性变化并不是完全不变的简单重复,例如,O、F两种元素没有正价。
3.通过观察得出3~7、11~17号元素主要化合价、核外电子排布之间等式关系:
(1)元素最高正化合价 = 元素原子最外层电子数
(2)元素最高正化合价 + |元素最低负化合价| = 8
[练习]R元素形成的化合物RH3,其中R的化合价是其最低负化合价,则R元素最高价氧化物的化学式是( )
A.RO2 B.RO3 C.R2O5 D.R2O7
[解析]根据|元素最低负化合价|+元素最高正化合价=8,可知R元素最高正化合价为+5,故答案为C。
课堂小结
本节课同学们通过探究、讨论原子核外电子排布、原子半径数据,元素主要化合价的信息,学习了解了随着核电荷数递增,元素原子核外电子排布、原子半径、元素主要化合价呈周期性变化的规律。同时提醒同学们要注意规律的特殊性,例如在原子半径、元素化合价的学习时稀有气体元素是排除在外的,而周期性的变化也并非是完全相同的简单重复。
布置作业
1.从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多 B.原子半径逐渐增大
C.最高正化合价数值逐渐增大 D.从硅到氯,最低负化合价从-4到-1
2.在下列元素中,最高正化合价数值最大的是( )
A.Na B.P C.Cl D.Ar
[答案]1.AB 2.C
板书设计
元素周期律
1.随着核电荷数的递增
2.原子半径的比较方法:从左到右,逐渐减小;从上到下,逐渐增大。(稀有气体元素除外)
3.等式关系:
(1)元素最高正化合价=元素原子最外层电子数
(2)元素最高正化合价+|元素最低负化合价|=8
(3)元素最高正化合价=元素原子最外层电子数=8-|元素最低负化合价|
(稀有气体元素除外;O、F无正价)
教学反思
本节课的内容主要有三部分,分别是1.原子核外电子排布的周期性变化,2.原子半径的周期性变化,3.元素主要化合价的周期性变化。内容虽然较多,但是通过数据的观察、对比很容易得出周期性变化的规律。而教学中穿插的难点主要在于要理解并记忆原子半径的变化规律,能够对原子的半径大小进行比较;了解元素主要化合价与原子核外电子排布之间的关系,能够利用元素主要化合价及原子最外层电子数之间的等式关系进行一定的计算和解决一定的具体问题。教学中要注意授课的条理性,在突破难点的时候要注意学生的理解程度,适时地通过练习对新学规律进行巩固等,防止新授知识的混乱,避免学生对元素周期律这一重要的理论知识会产生厌烦和畏惧的情绪。
备课资料
1.原子半径
原子半径是元素的一个重要参数,对元素及其化合物的性质有较大的影响。
原子半径似乎应该是原子核到最外电子层的距离,但事实上,由于电子具有波动性,电子云没有明显的边界,因此单个原子的半径是无法测定的。原子总是以单质或化合物的形式存在。而在单质或化合物中,原子间总是以化学键结合的(稀有气体除外)。因此原子半径就与原子间以哪种键结合有关。一般说来,我们可以通过测定原子核间的距离求得原子半径,原子半径根据原子间的成键方式有以下几种。
共价半径:通常将同种元素原子形成共价单键时相邻两原子核间距离的一半称为共价半径,如把氯气分子中氯原子与氯原子核间距离的一半(99 pm)定为氯原子的共价半径。
金属半径:把金属晶体中相邻两原子核间距离的一半称为金属半径。原子的金属半径一般比它的单键共价半径大10%~15%。
范氏半径:在晶体中,相邻分子之间的两原子核间距离的一半称为范氏半径。如在CdCl2晶体中,测得不同的“分子”(实际是层状的大分子)里氯原子与氯原子的核间距离的一半即是氯原子的范氏半径(188 pm)。显然非金属元素的范氏半径大于共价半径。稀有气体是在极低的温度下形成单原子分子的分子晶体,在这种晶体中,两个原子核核间距离的一半就是该元素原子的范氏半径。
在一般的资料中,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。在教材中提到的比较原子半径大小的数据,要求用相同的测定方法测得,用的是共价半径,因此稀有气体不参与比较。
非金属元素和稀有气体元素的范氏半径(r范/nm)
H 0.12 He 0.122
N 0.15 O 0.140 F 0.135 Ne 0.160
P 0.19 S 0.185 Cl 0.180 Ar 0.191
As 0.20 Se 0.200 Br 0.195 Kr 0.198
Sb 0.22 Te 0.220 I 0.215 Xe 0.218
从上表可以看出,范氏半径也有一定的规律性。在同一周期中,从左到右基本上逐渐减小;同一主族中,从上到下逐渐增大。
主族元素的原子半径的递变规律十分明显。在同一短周期中,从左到右原子半径随着原子序数的增大而逐渐减小;同一主族中,从上到下原子半径随着原子序数的增大而逐渐增大
第一单元 元素周期律和元素周期表
第1课时 元素周期律
教学目标
1. 认识元素周期律,了解原子核外电子排布、元素原子半径、元素主要化合价的周期性变化;
2. 了解元素主要化合价与元素原子核外电子排布之间的等式关系。
教学重点
原子核外电排布、元素原子半径、元素主要化合价的周期性变化规律。
教学难点
原子半径大小的比较。
课前准备
ppt课件《元素周期律》
教学过程
知识回顾
同学们应熟练掌握1~18号元素原子核外电子排布的情况,能够熟练书写1~18号元素原子结构示意图。理解阴、阳离子的形成原理,能够书写常见简单阴、阳离子的离子结构示意图。
导入新课
[分析]从1~18号元素原子的核外电子排布我们可以看到原子核外电子的排布不仅符合上述规则,而且似乎具有一定的规律。这节课我们就将在上节课的基础上学习元素周期律。
一. 原子核外电子排布的周期性变化
【问题1】观察教材图5-1,核电荷数为1~18的元素原子最外层电子数,请说出随着核电荷数的递增,元素原子最外层电子的排布呈现了怎样的周期性变化?
[课件展示]
[结论]1、2号元素最外层电子数由1增加到2,3~10号元素和11~18号元素原子最外层电子数则重复出现由1逐一递增至8的变化。
[分析]2号He,10号Ne,18号Ar都是稀有气体元素,它们的原子最外层电子数尽管不都为8,但是都达到了饱和结构。
【问题2】请同学再次总结一下,1~18号元素原子核外电子排布的周期性变化。
[回答]随着核电荷数的递增,元素原子最外层电子的排布呈现周期性的变化。变化的内容为:每隔一定数目,元素原子最外层电子数重复出现由1到饱和结构(2或8)递增的变化。
[小结]随着核电荷数的递增,元素原子最外层电子的排布呈现由1到饱和结构(2或8)递增的周期性的变化。
[分析]原子的结构如原子的核电荷数,核外电子排布等是决定元素某些性质的影响因素。
【问题3】随着核电荷数的递增,元素原子核外电子排布呈周期性变化,那么元素的性质如元素原子半径、元素主要化合价是否也会随着核电荷数的递增呈现一定的周期性变化呢?这就是我们下面要讨论的内容。
二. 原子半径的周期性变化
[讨论]1.观察教材表5-1原子序数为3~9、11~17的元素的原子半径,用横坐标表示元素原子核外最外层电子数,以纵坐标表示原子半径,根据数据表作图,表示出3~9、11~17的元素的原子最外层电子数与原子半径的函数图像。
2.根据图像思考随着核电荷数的递增,原子半径有什么样的变化规律?
[分析]该表是3~18号元素除了稀有气体元素以外的原子半径的数据表。
(1)稀有气体元素原子半径的测定依据与其他元素不同,没有可比性,故不列出数据。
(2)表中原子半径数据的单位是pm(皮米),1 pm=10-12 m。
[课件展示]
3~9号元素 Li(锂) Be(铍) B(硼) C(碳) N(氮) O(氧) F(氟) Ne(氖)
原子半径/pm 152 111 88 77 70 66 64 —
11~17号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷) S(硫) Cl(氯) Ar(氩)
原子半径/pm 186 160 143 117 110 104 99 —
[课件展示]
[结论]由图中曲线分析可知:随着核电荷数的递增,元素原子半径(稀有气体元素除外)呈周期性变化,每隔一定数目,元素原子半径重复由大到小的变化趋势(稀有气体元素除外)。
[小结]具有相同电子层数的元素原子,随着核电荷数的递增,因为核对外层电子的引力逐渐增强,所以元素原子半径逐渐减小。
三. 原子大小的比较方法
【问题1】我们已经知道当电子层数相同时,原子半径随着核电荷数的递增而减小。现在请观察图像,当我们观察最外层电子数相同的元素原子,它们的半径与电子层数有什么关系?
[结论]由图可知,当最外层电子数相同时,如Li和Na,F和Cl等,电子层数多的原子半径大。
[小结]由此可知,电子层数、核外电子排布和核电荷数共同影响了原子半径的大小。当电子层数相同时,核电荷数越大,原子半径越小;当最外层电子数相同时,电子层数越大,原子半径越大。
简而言之:从左到右,逐渐减小;从上到下,逐渐增大。(稀有气体元素除外)
【问题2】思考在1~18号元素原子中半径最小的原子和半径最大的原子分别是什么?
[结论]1~18号元素原子中半径最小的原子是氢原子(核外电子排布一层电子,最外层电子数为1),半径最大的原子为钠原子(核外电子排布三层电子,最外层电子数为1)。
[练习]比较原子半径的大小(填“>”或“<”)K_________Cs,O________F,Si________N。
[分析]K、Cs最外层电子数相同,电子层数K<Cs,故原子半径K<Cs。
O、F电子层数相同,核电荷数O<F,故原子半径O>F。
在Si、N原子半径的比较中,要善于找出比较“支点”。Si电子层3层,最外层电子数4,而N电子层为2层,最外层电子数5,我们可以找出电子层为3层,但是最外层电子数为5的原子即P作为比较的“支点”。原子半径Si>P,而P>N,故结论为原子半径Si>N。(用碳原子作为“支点”比较也可)
四. 化合价与原子的电子层结构
[分析]元素的主要化合价与原子的电子层结构,特别是与最外层电子数目密切相关。
[展示]3~9、11~17号元素的原子核外电子排布以及元素的最高正化合价与最低负化合价。
【问题】1.请观察思考,随着核电荷数的递增,元素的主要化合价是否也存在一定的周期性变化?
2.这种周期性变化是否是完全不变的简单重复?
3.观察元素最高正化合价与最低负化合价,结合元素原子的核外电子排布,思考它们之间是否存在一定的联系?
[结论]1.随着核电荷数的递增,元素的主要化合价呈周期性变化,每隔一定数目,元素的最高正化合价重复出现由+1到+7(3~7号元素最高正化合价由1到+5)递增,最低负化合价由-4到-1递增的变化。(稀有气体元素除外)
2.元素主要化合价的周期性变化并不是完全不变的简单重复,例如,O、F两种元素没有正价。
3.通过观察得出3~7、11~17号元素主要化合价、核外电子排布之间等式关系:
(1)元素最高正化合价 = 元素原子最外层电子数
(2)元素最高正化合价 + |元素最低负化合价| = 8
[练习]R元素形成的化合物RH3,其中R的化合价是其最低负化合价,则R元素最高价氧化物的化学式是( )
A.RO2 B.RO3 C.R2O5 D.R2O7
[解析]根据|元素最低负化合价|+元素最高正化合价=8,可知R元素最高正化合价为+5,故答案为C。
课堂小结
本节课同学们通过探究、讨论原子核外电子排布、原子半径数据,元素主要化合价的信息,学习了解了随着核电荷数递增,元素原子核外电子排布、原子半径、元素主要化合价呈周期性变化的规律。同时提醒同学们要注意规律的特殊性,例如在原子半径、元素化合价的学习时稀有气体元素是排除在外的,而周期性的变化也并非是完全相同的简单重复。
布置作业
1.从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多 B.原子半径逐渐增大
C.最高正化合价数值逐渐增大 D.从硅到氯,最低负化合价从-4到-1
2.在下列元素中,最高正化合价数值最大的是( )
A.Na B.P C.Cl D.Ar
[答案]1.AB 2.C
板书设计
元素周期律
1.随着核电荷数的递增
2.原子半径的比较方法:从左到右,逐渐减小;从上到下,逐渐增大。(稀有气体元素除外)
3.等式关系:
(1)元素最高正化合价=元素原子最外层电子数
(2)元素最高正化合价+|元素最低负化合价|=8
(3)元素最高正化合价=元素原子最外层电子数=8-|元素最低负化合价|
(稀有气体元素除外;O、F无正价)
教学反思
本节课的内容主要有三部分,分别是1.原子核外电子排布的周期性变化,2.原子半径的周期性变化,3.元素主要化合价的周期性变化。内容虽然较多,但是通过数据的观察、对比很容易得出周期性变化的规律。而教学中穿插的难点主要在于要理解并记忆原子半径的变化规律,能够对原子的半径大小进行比较;了解元素主要化合价与原子核外电子排布之间的关系,能够利用元素主要化合价及原子最外层电子数之间的等式关系进行一定的计算和解决一定的具体问题。教学中要注意授课的条理性,在突破难点的时候要注意学生的理解程度,适时地通过练习对新学规律进行巩固等,防止新授知识的混乱,避免学生对元素周期律这一重要的理论知识会产生厌烦和畏惧的情绪。
备课资料
1.原子半径
原子半径是元素的一个重要参数,对元素及其化合物的性质有较大的影响。
原子半径似乎应该是原子核到最外电子层的距离,但事实上,由于电子具有波动性,电子云没有明显的边界,因此单个原子的半径是无法测定的。原子总是以单质或化合物的形式存在。而在单质或化合物中,原子间总是以化学键结合的(稀有气体除外)。因此原子半径就与原子间以哪种键结合有关。一般说来,我们可以通过测定原子核间的距离求得原子半径,原子半径根据原子间的成键方式有以下几种。
共价半径:通常将同种元素原子形成共价单键时相邻两原子核间距离的一半称为共价半径,如把氯气分子中氯原子与氯原子核间距离的一半(99 pm)定为氯原子的共价半径。
金属半径:把金属晶体中相邻两原子核间距离的一半称为金属半径。原子的金属半径一般比它的单键共价半径大10%~15%。
范氏半径:在晶体中,相邻分子之间的两原子核间距离的一半称为范氏半径。如在CdCl2晶体中,测得不同的“分子”(实际是层状的大分子)里氯原子与氯原子的核间距离的一半即是氯原子的范氏半径(188 pm)。显然非金属元素的范氏半径大于共价半径。稀有气体是在极低的温度下形成单原子分子的分子晶体,在这种晶体中,两个原子核核间距离的一半就是该元素原子的范氏半径。
在一般的资料中,金属元素有金属半径和共价半径的数据,非金属元素则有共价半径和范氏半径的数据,稀有气体只有范氏半径的数据。在教材中提到的比较原子半径大小的数据,要求用相同的测定方法测得,用的是共价半径,因此稀有气体不参与比较。
非金属元素和稀有气体元素的范氏半径(r范/nm)
H 0.12 He 0.122
N 0.15 O 0.140 F 0.135 Ne 0.160
P 0.19 S 0.185 Cl 0.180 Ar 0.191
As 0.20 Se 0.200 Br 0.195 Kr 0.198
Sb 0.22 Te 0.220 I 0.215 Xe 0.218
从上表可以看出,范氏半径也有一定的规律性。在同一周期中,从左到右基本上逐渐减小;同一主族中,从上到下逐渐增大。
主族元素的原子半径的递变规律十分明显。在同一短周期中,从左到右原子半径随着原子序数的增大而逐渐减小;同一主族中,从上到下原子半径随着原子序数的增大而逐渐增大
