山东省济宁市泗水县2023-2024学年高三上学期期中考试化学试题(含答案)
文档属性
| 名称 | 山东省济宁市泗水县2023-2024学年高三上学期期中考试化学试题(含答案) |

|
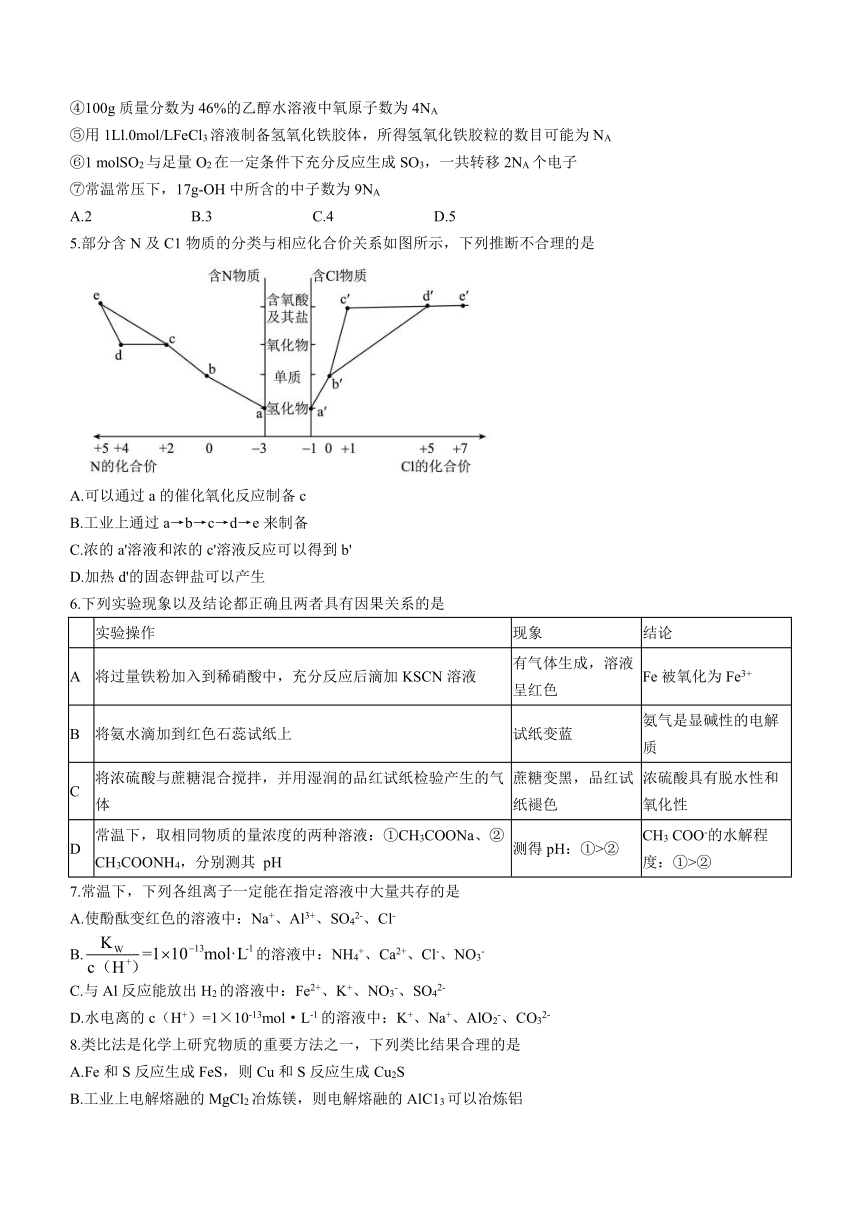
|
| 格式 | docx | ||
| 文件大小 | 443.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-06 11:49:22 | ||
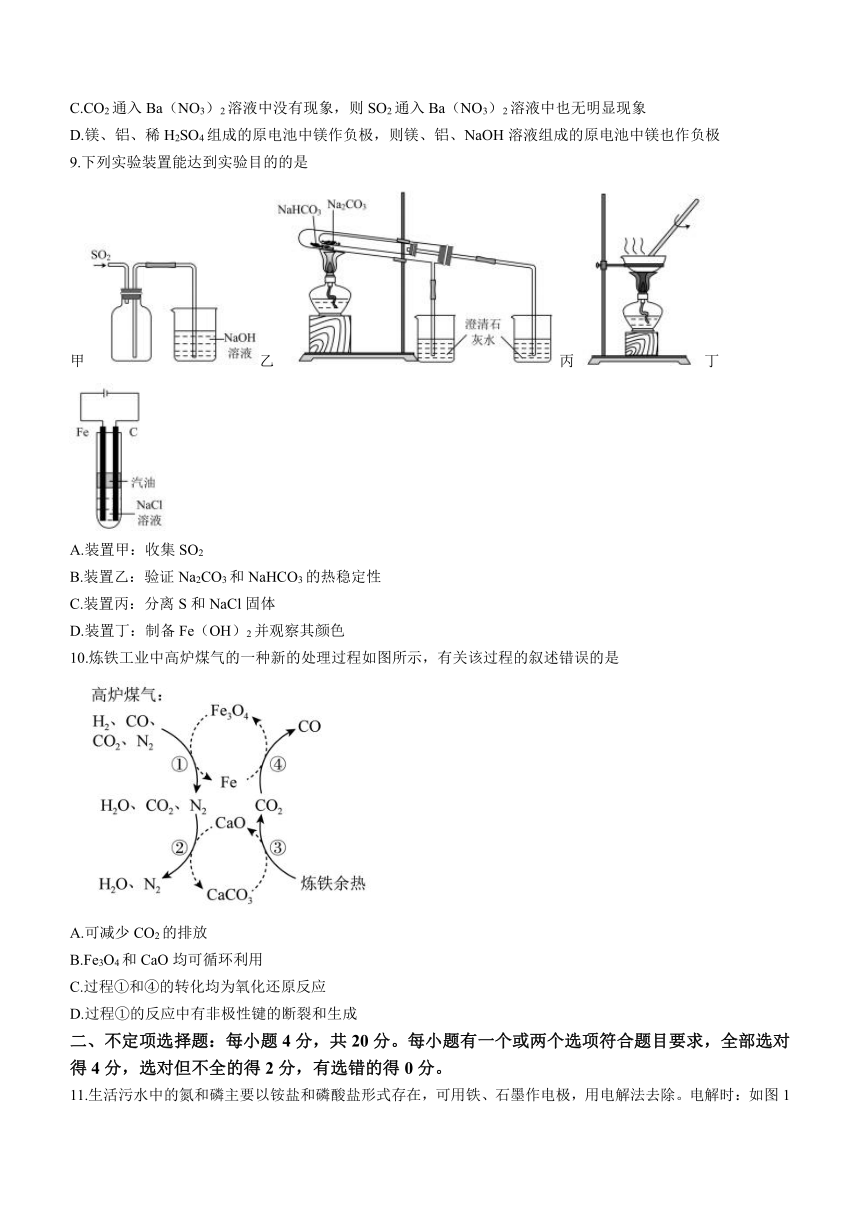
图片预览


文档简介
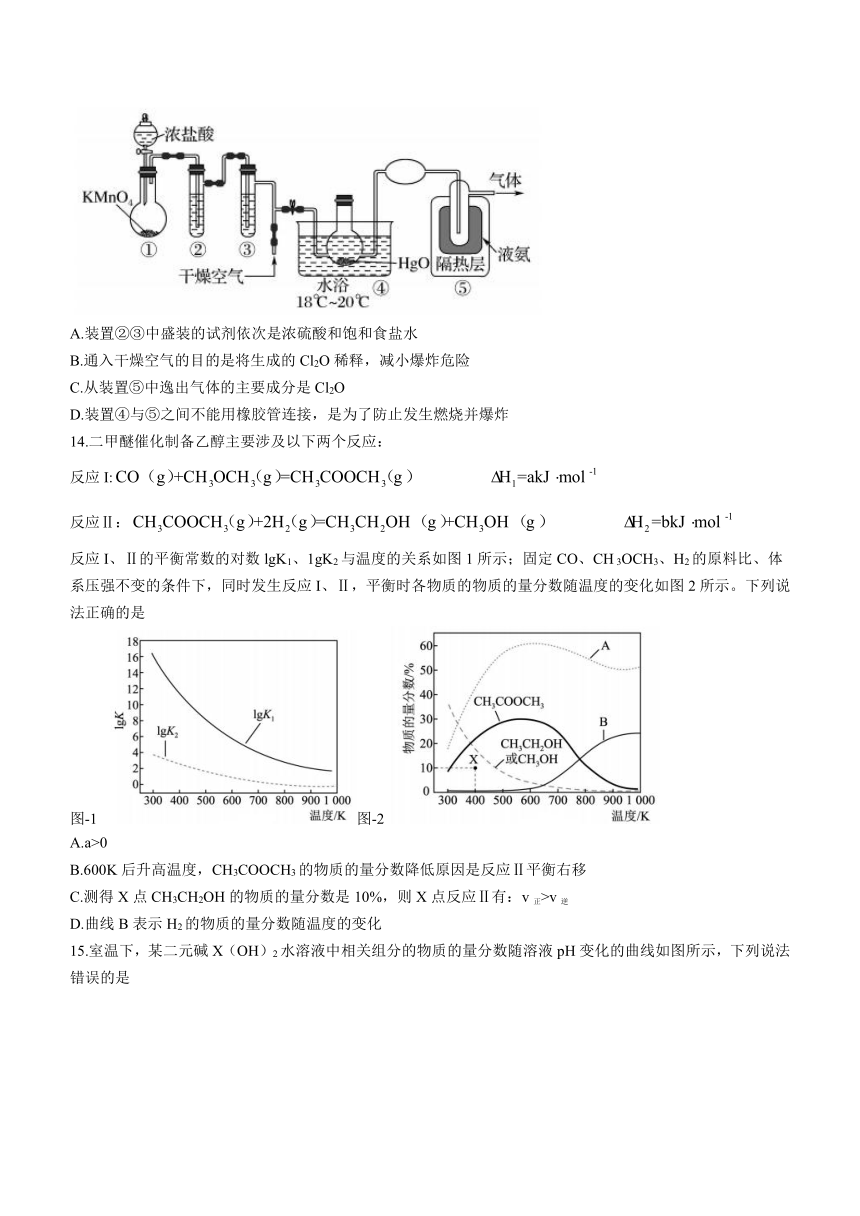
泗水县2023-2024学年高三上学期期中考试
化学试题
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写。保持卡面清洁,不折叠、不破损。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 V-51 Sr-88
一、单项选择题:每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学让生活更美好。以下说法错误的是
A.用CO2合成淀粉,有利于实现碳达峰、碳中和的战略
B.2022年北京冬奥会火炬的燃料是丙烷,属于清洁能源
C.Ge的单晶可以作为光电转换材料用于太阳能电池
D.我国首次实现As2O3“仿生递送”治疗白血病,As2O3是碱性氧化物
2.下列物质的性质与用途均正确,且具有对应关系的是
A.Al2O3熔点高,可用于电解冶炼铝
B.钠具有很强的还原性,可用钠与TiCl4溶液反应制取钛
C.NH4HCO3受热易分解,可用作氮肥
D.CO2具有氧化性,可用于自来水的杀菌消毒
3.主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂的结构如图所示。下列说法正确的是
A.原子半径:WB.X与Y形成的化合物可用作食品干燥剂
C.W与Z形成的化合物中既含有离子键又含有共价键
D.X形成的简单氢化物的沸点和热稳定性均是同族中最高的
4.用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①1molNa与足量氧气完全反应后生成的物质中阴、阳离子总数一定为1.5NA
②所有物质中均存在化学键
③常温常压下,28g的乙烯和丙烯混合气体含有的原子数为6NA
④100g质量分数为46%的乙醇水溶液中氧原子数为4NA
⑤用1Ll.0mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目可能为NA
⑥1 molSO2与足量O2在一定条件下充分反应生成SO3,一共转移2NA个电子
⑦常温常压下,17g-OH中所含的中子数为9NA
A.2 B.3 C.4 D.5
5.部分含N及C1物质的分类与相应化合价关系如图所示,下列推断不合理的是
A.可以通过a的催化氧化反应制备c
B.工业上通过a→b→c→d→e来制备
C.浓的a'溶液和浓的c'溶液反应可以得到b'
D.加热d'的固态钾盐可以产生
6.下列实验现象以及结论都正确且两者具有因果关系的是
实验操作 现象 结论
A 将过量铁粉加入到稀硝酸中,充分反应后滴加KSCN溶液 有气体生成,溶液呈红色 Fe被氧化为Fe3+
B 将氨水滴加到红色石蕊试纸上 试纸变蓝 氨气是显碱性的电解质
C 将浓硫酸与蔗糖混合搅拌,并用湿润的品红试纸检验产生的气体 蔗糖变黑,品红试纸褪色 浓硫酸具有脱水性和氧化性
D 常温下,取相同物质的量浓度的两种溶液:①CH3COONa、②CH3COONH4,分别测其 pH 测得pH:①>② CH3 COO-的水解程度:①>②
7.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
8.类比法是化学上研究物质的重要方法之一,下列类比结果合理的是
A.Fe和S反应生成FeS,则Cu和S反应生成Cu2S
B.工业上电解熔融的MgCl2冶炼镁,则电解熔融的AlC13可以冶炼铝
C.CO2通入Ba(NO3)2溶液中没有现象,则SO2通入Ba(NO3)2溶液中也无明显现象
D.镁、铝、稀H2SO4组成的原电池中镁作负极,则镁、铝、NaOH溶液组成的原电池中镁也作负极
9.下列实验装置能达到实验目的的是
甲乙丙丁
A.装置甲:收集SO2
B.装置乙:验证Na2CO3和NaHCO3的热稳定性
C.装置丙:分离S和NaCl固体
D.装置丁:制备Fe(OH)2并观察其颜色
10.炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述错误的是
A.可减少CO2的排放
B.Fe3O4和CaO均可循环利用
C.过程①和④的转化均为氧化还原反应
D.过程①的反应中有非极性键的断裂和生成
二、不定项选择题:每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用铁、石墨作电极,用电解法去除。电解时:如图1原理所示可进行除氮;翻转电源正负极,可进行除磷,原理是利用Fe2+将PO43-转化为Fe3(PO4)2沉淀。下列说法正确的是
图1 图2
A.图2中0~20min脱除的元素是氮元素,此时石墨作阴极
B.溶液pH越小有效氯浓度越大,氮的去除率越高
C.图2中20~40min脱除的元素是磷元素,此时阴极电极反应式为
D.电解法除氮有效氯ClO-氧化NH3的离子方程式为
12.氯化亚铜(CuCl)是一种微溶于水、难溶于乙醇、易被氧化的白色粉末,以黄铜矿(主要成分为CuFeS2)为原料制取CuCl的流程如图所示:
已知:
下列说法中错误的是
A.“浸取”后所得浸取液可用来腐蚀铜制电路板
B.加入浓盐酸的目的是除去S并溶解CuCl
C.【CuCl3】2-中加水可使平衡逆向移动
D.采用乙醇洗涤和真空干燥有利于提高CuC1的产率和纯度
13.Cl2O是一种强氧化剂,与水反应生成次氯酸,与有机物接触时会发生燃烧并爆炸,浓度过高时易分解爆炸。利用反应制取Cl2O的装置如图所示。已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃。下列说法错误的是
A.装置②③中盛装的试剂依次是浓硫酸和饱和食盐水
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不能用橡胶管连接,是为了防止发生燃烧并爆炸
14.二甲醚催化制备乙醇主要涉及以下两个反应:
反应I:
反应Ⅱ:
反应I、Ⅱ的平衡常数的对数lgK1、1gK2与温度的关系如图1所示;固定CO、CH 3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应I、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是
图-1 图-2
A.a>0
B.600K后升高温度,CH3COOCH3的物质的量分数降低原因是反应Ⅱ平衡右移
C.测得X点CH3CH2OH的物质的量分数是10%,则X点反应Ⅱ有:v正>v逆
D.曲线B表示H2的物质的量分数随温度的变化
15.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
A.K2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c【X(OH)+】
D.在X(OH)NO3水溶液中,
三、非选择题:本题共5小题,共60分。
16.在下列物质转化关系中,反应的条件和部分产物已略去。回答下列问题:
(1)若甲、乙是两种常见金属,且反应Ⅲ是工业制盐酸的反应。
①反应I中甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________________。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置为______________;反应Ⅱ的化学方程式是_______________。
(2)若甲、乙是离子化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是_______________。
②若反应I是实验室制备某气体的反应,该气体分子为14电子结构。则反应I的化学方程式是_______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体,其反应的离子方程式是______________;写出HClO的电子式:_______________。
17.a、b、c、d、e为前四周期元素(除稀有气体),原子序数依次增大。a的基态原子价电子层有3个未成对电子;b元素常见的盐可用于纺织、制皂、制玻璃和焙制糕点;c元素的氧化物为共价晶体,具有硬度高、熔点高、难溶于水、化学性质稳定等特点;d元素原子在同周期元素中原子半径最小;e元素在地壳中的含量排在第四位;回答下列问题:
(1)写出e元素在周期表中位置_______________。a、c、d最高价氧化物水化物的酸性有弱到强的顺序为_______________。(用化学式表示)
(2)将一定量CO2通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为_______________。
(3)c元素与d形成化合物cd4,cd4在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为_______________。
18.氧钒碱式碳酸铵晶体【(NH4)5(VO)6(CO3)4(OH)9·10H2O】可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
pH 4~6 6~8 8~10
主要离子 VO2+ VO3- V2O74-
(1)“焙烧”过程中除了V2O3、Fe2O3、Al2O3、CuO中的某些物质参加反应外,“焙烧”的另一个作用是_______________。
(2)写出“焙烧”过程中生成的化学方程式:_______________。
(3)“调pH”的作用除了沉淀某些金属阳离子外,还有的作用是_______________。
(4)若“净化Ⅱ”加入过量的(NH4)2CO3,可能导致的后果为_______________。
(5)称量ag产品于锥形瓶中,先用20mL蒸馏水与30mL稀硫酸溶解后,再加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为bmL。(已知滴定反应为)
①KMnO4溶液的作用是_______________。
②粗产品中钒的质量分数表达式为_______________(以VO2计)。
19.氮化锶(Sr3N2)是工业上生产荧光粉的原材料。已知:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应产生氨气。
装置A装置B
I.利用装置A和B制备
(1)装置A中仪器b名称为_______________,a导管的作用是_______________;实验时先点燃装置______________处酒精灯(填“A”或“B”),一段时间后,点燃另一只酒精灯。
(2)装置B中广口瓶盛放的试剂是______________(填名称)。碱石灰的作用是_______________。
(3)装置A制备N2的化学方程式为_______________。
Ⅱ.测定产品的纯度
称取6.0g产品,放入干燥的三颈瓶中,然后加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00mL1.0000mol/L的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)从烧杯中量取20.00mL的吸收液放入锥形瓶中,用1.0000mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mLNaOH溶液(图中夹持装置略)
(4)三颈烧瓶中发生反应产生氨气的化学方程式为_______________。
(5)产品纯度为_______________(精确到小数点后1位)。
(6)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的______________(填标号)。
A.锥形瓶洗涤干净后未干燥,直接装入待测液
B.滴定时未用NaOH标准溶液润洗滴定管
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.读数时,滴定前平视,滴定后俯视
20.以CO2、H2为原料合成CH3OH涉及的主要反应如下:
回答下列问题:
(1)反应I、Ⅱ的1nK(K代表化学平衡常数)随(温度的倒数)的变化如图所示。
据图判断,升高温度时,反应的化学平衡常数将____________(填“增大”“减小”或“不变”)。
(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将__________(填“正向”“逆向”或“不”)移动;若将反应体系体积压缩至原来一半,重新达到平衡时两反应所需时间tI_____________tII(填“>”“<”或“=”)。
(3)恒压条件下,将CO2和H2按体积比1:3混合,初始压强为P0,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
已知:
①在上述条件下合成甲醇的工业条件是_______________。
A.210℃ B.230℃
C.催化剂CZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是_______________。
③已知反应Ⅱ的速率方程可表示为v正=k正·p(CO2)·p(H2),v逆=k逆·p(CO)·p(H2O),其中k正、k逆分别为正、逆反应的速率常数,1gk与的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是______________;230℃下,图中A、B、C、D点的纵坐标分别为a+1、a+0.48、a-0.48、a-1,达到平衡时,测得体系中3p(CO2)=2p(H2O),以物质的分压表示的反应I的平衡常数Kp1_______________。(已知:10-0.48=0.33,10-0.52=0.30)
0
泗水县2023-2024学年高三上学期期中考试
化学答案
DDDBB CBADD CD AC AC C BC
16、【共12分】(1)①. C (1分) ②. 第四周期Ⅷ族 (1分)
(2)①. ②.
③.
17、【共8分】(1)第四周期VIII族
(2) (3)
18、【共12分】(1)除去含钒废料中的有机物
(2)
(3)使钒离子在溶液中以VO3- 形式存在;
(4)会生成 沉淀,降低钒的利用率
(5)①. 将产品中的 氧化为 ②.
19、【共14分】(1) 蒸馏烧瓶(1分) 平衡气压,使液体顺利流下(1分) A(1分)
(2) 浓硫酸(1分) 防止空气中的水蒸气进入硬质玻璃管
(3) (4) (5) (6)BC
20、【共14分】(1)减小 (2) 正向 =
(3)①. BD ②. 230 C以上,温度升高,反应Ⅰ为放热反应,平衡逆向移动,而反应Ⅱ为吸热反应,平衡正向移动,二氧化碳的转化率减小,所以总体二氧化碳的转化率增大,但甲醇的产率降低。
③. ④
化学试题
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写。保持卡面清洁,不折叠、不破损。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 V-51 Sr-88
一、单项选择题:每小题2分,共20分。每小题只有一个选项符合题目要求。
1.化学让生活更美好。以下说法错误的是
A.用CO2合成淀粉,有利于实现碳达峰、碳中和的战略
B.2022年北京冬奥会火炬的燃料是丙烷,属于清洁能源
C.Ge的单晶可以作为光电转换材料用于太阳能电池
D.我国首次实现As2O3“仿生递送”治疗白血病,As2O3是碱性氧化物
2.下列物质的性质与用途均正确,且具有对应关系的是
A.Al2O3熔点高,可用于电解冶炼铝
B.钠具有很强的还原性,可用钠与TiCl4溶液反应制取钛
C.NH4HCO3受热易分解,可用作氮肥
D.CO2具有氧化性,可用于自来水的杀菌消毒
3.主族元素W、X、Y、Z的原子序数依次增大,且均不大于20,W与Y原子的最外层电子数之和等于X原子的最外层电子数。这四种元素形成的一种食品添加剂的结构如图所示。下列说法正确的是
A.原子半径:W
C.W与Z形成的化合物中既含有离子键又含有共价键
D.X形成的简单氢化物的沸点和热稳定性均是同族中最高的
4.用NA表示阿伏加德罗常数的值,下列说法中正确的数目是
①1molNa与足量氧气完全反应后生成的物质中阴、阳离子总数一定为1.5NA
②所有物质中均存在化学键
③常温常压下,28g的乙烯和丙烯混合气体含有的原子数为6NA
④100g质量分数为46%的乙醇水溶液中氧原子数为4NA
⑤用1Ll.0mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目可能为NA
⑥1 molSO2与足量O2在一定条件下充分反应生成SO3,一共转移2NA个电子
⑦常温常压下,17g-OH中所含的中子数为9NA
A.2 B.3 C.4 D.5
5.部分含N及C1物质的分类与相应化合价关系如图所示,下列推断不合理的是
A.可以通过a的催化氧化反应制备c
B.工业上通过a→b→c→d→e来制备
C.浓的a'溶液和浓的c'溶液反应可以得到b'
D.加热d'的固态钾盐可以产生
6.下列实验现象以及结论都正确且两者具有因果关系的是
实验操作 现象 结论
A 将过量铁粉加入到稀硝酸中,充分反应后滴加KSCN溶液 有气体生成,溶液呈红色 Fe被氧化为Fe3+
B 将氨水滴加到红色石蕊试纸上 试纸变蓝 氨气是显碱性的电解质
C 将浓硫酸与蔗糖混合搅拌,并用湿润的品红试纸检验产生的气体 蔗糖变黑,品红试纸褪色 浓硫酸具有脱水性和氧化性
D 常温下,取相同物质的量浓度的两种溶液:①CH3COONa、②CH3COONH4,分别测其 pH 测得pH:①>② CH3 COO-的水解程度:①>②
7.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
8.类比法是化学上研究物质的重要方法之一,下列类比结果合理的是
A.Fe和S反应生成FeS,则Cu和S反应生成Cu2S
B.工业上电解熔融的MgCl2冶炼镁,则电解熔融的AlC13可以冶炼铝
C.CO2通入Ba(NO3)2溶液中没有现象,则SO2通入Ba(NO3)2溶液中也无明显现象
D.镁、铝、稀H2SO4组成的原电池中镁作负极,则镁、铝、NaOH溶液组成的原电池中镁也作负极
9.下列实验装置能达到实验目的的是
甲乙丙丁
A.装置甲:收集SO2
B.装置乙:验证Na2CO3和NaHCO3的热稳定性
C.装置丙:分离S和NaCl固体
D.装置丁:制备Fe(OH)2并观察其颜色
10.炼铁工业中高炉煤气的一种新的处理过程如图所示,有关该过程的叙述错误的是
A.可减少CO2的排放
B.Fe3O4和CaO均可循环利用
C.过程①和④的转化均为氧化还原反应
D.过程①的反应中有非极性键的断裂和生成
二、不定项选择题:每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用铁、石墨作电极,用电解法去除。电解时:如图1原理所示可进行除氮;翻转电源正负极,可进行除磷,原理是利用Fe2+将PO43-转化为Fe3(PO4)2沉淀。下列说法正确的是
图1 图2
A.图2中0~20min脱除的元素是氮元素,此时石墨作阴极
B.溶液pH越小有效氯浓度越大,氮的去除率越高
C.图2中20~40min脱除的元素是磷元素,此时阴极电极反应式为
D.电解法除氮有效氯ClO-氧化NH3的离子方程式为
12.氯化亚铜(CuCl)是一种微溶于水、难溶于乙醇、易被氧化的白色粉末,以黄铜矿(主要成分为CuFeS2)为原料制取CuCl的流程如图所示:
已知:
下列说法中错误的是
A.“浸取”后所得浸取液可用来腐蚀铜制电路板
B.加入浓盐酸的目的是除去S并溶解CuCl
C.【CuCl3】2-中加水可使平衡逆向移动
D.采用乙醇洗涤和真空干燥有利于提高CuC1的产率和纯度
13.Cl2O是一种强氧化剂,与水反应生成次氯酸,与有机物接触时会发生燃烧并爆炸,浓度过高时易分解爆炸。利用反应制取Cl2O的装置如图所示。已知:Cl2O的熔点为-116℃,沸点为3.8℃;Cl2的沸点为-34.6℃。下列说法错误的是
A.装置②③中盛装的试剂依次是浓硫酸和饱和食盐水
B.通入干燥空气的目的是将生成的Cl2O稀释,减小爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不能用橡胶管连接,是为了防止发生燃烧并爆炸
14.二甲醚催化制备乙醇主要涉及以下两个反应:
反应I:
反应Ⅱ:
反应I、Ⅱ的平衡常数的对数lgK1、1gK2与温度的关系如图1所示;固定CO、CH 3OCH3、H2的原料比、体系压强不变的条件下,同时发生反应I、Ⅱ,平衡时各物质的物质的量分数随温度的变化如图2所示。下列说法正确的是
图-1 图-2
A.a>0
B.600K后升高温度,CH3COOCH3的物质的量分数降低原因是反应Ⅱ平衡右移
C.测得X点CH3CH2OH的物质的量分数是10%,则X点反应Ⅱ有:v正>v逆
D.曲线B表示H2的物质的量分数随温度的变化
15.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
A.K2的数量级为10-8
B.X(OH)NO3水溶液显酸性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中c(X2+)>c【X(OH)+】
D.在X(OH)NO3水溶液中,
三、非选择题:本题共5小题,共60分。
16.在下列物质转化关系中,反应的条件和部分产物已略去。回答下列问题:
(1)若甲、乙是两种常见金属,且反应Ⅲ是工业制盐酸的反应。
①反应I中甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是________________。
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置为______________;反应Ⅱ的化学方程式是_______________。
(2)若甲、乙是离子化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的化学方程式是_______________。
②若反应I是实验室制备某气体的反应,该气体分子为14电子结构。则反应I的化学方程式是_______________。
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体,其反应的离子方程式是______________;写出HClO的电子式:_______________。
17.a、b、c、d、e为前四周期元素(除稀有气体),原子序数依次增大。a的基态原子价电子层有3个未成对电子;b元素常见的盐可用于纺织、制皂、制玻璃和焙制糕点;c元素的氧化物为共价晶体,具有硬度高、熔点高、难溶于水、化学性质稳定等特点;d元素原子在同周期元素中原子半径最小;e元素在地壳中的含量排在第四位;回答下列问题:
(1)写出e元素在周期表中位置_______________。a、c、d最高价氧化物水化物的酸性有弱到强的顺序为_______________。(用化学式表示)
(2)将一定量CO2通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为_______________。
(3)c元素与d形成化合物cd4,cd4在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为_______________。
18.氧钒碱式碳酸铵晶体【(NH4)5(VO)6(CO3)4(OH)9·10H2O】可用于制备热敏材料。以含钒废料(含有V2O3、Fe2O3、Al2O3、CuO、有机物等)来制备氧钒碱式碳酸铵晶体的一种工艺流程如下:
已知:含钒离子在溶液中的主要存在形式与溶液pH的关系:
pH 4~6 6~8 8~10
主要离子 VO2+ VO3- V2O74-
(1)“焙烧”过程中除了V2O3、Fe2O3、Al2O3、CuO中的某些物质参加反应外,“焙烧”的另一个作用是_______________。
(2)写出“焙烧”过程中生成的化学方程式:_______________。
(3)“调pH”的作用除了沉淀某些金属阳离子外,还有的作用是_______________。
(4)若“净化Ⅱ”加入过量的(NH4)2CO3,可能导致的后果为_______________。
(5)称量ag产品于锥形瓶中,先用20mL蒸馏水与30mL稀硫酸溶解后,再加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为bmL。(已知滴定反应为)
①KMnO4溶液的作用是_______________。
②粗产品中钒的质量分数表达式为_______________(以VO2计)。
19.氮化锶(Sr3N2)是工业上生产荧光粉的原材料。已知:锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应产生氨气。
装置A装置B
I.利用装置A和B制备
(1)装置A中仪器b名称为_______________,a导管的作用是_______________;实验时先点燃装置______________处酒精灯(填“A”或“B”),一段时间后,点燃另一只酒精灯。
(2)装置B中广口瓶盛放的试剂是______________(填名称)。碱石灰的作用是_______________。
(3)装置A制备N2的化学方程式为_______________。
Ⅱ.测定产品的纯度
称取6.0g产品,放入干燥的三颈瓶中,然后加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00mL1.0000mol/L的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)从烧杯中量取20.00mL的吸收液放入锥形瓶中,用1.0000mol/LNaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mLNaOH溶液(图中夹持装置略)
(4)三颈烧瓶中发生反应产生氨气的化学方程式为_______________。
(5)产品纯度为_______________(精确到小数点后1位)。
(6)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的______________(填标号)。
A.锥形瓶洗涤干净后未干燥,直接装入待测液
B.滴定时未用NaOH标准溶液润洗滴定管
C.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
D.读数时,滴定前平视,滴定后俯视
20.以CO2、H2为原料合成CH3OH涉及的主要反应如下:
回答下列问题:
(1)反应I、Ⅱ的1nK(K代表化学平衡常数)随(温度的倒数)的变化如图所示。
据图判断,升高温度时,反应的化学平衡常数将____________(填“增大”“减小”或“不变”)。
(2)上述反应体系在一定条件下建立平衡后,若在恒温恒压下充入氦气,反应Ⅱ的平衡将__________(填“正向”“逆向”或“不”)移动;若将反应体系体积压缩至原来一半,重新达到平衡时两反应所需时间tI_____________tII(填“>”“<”或“=”)。
(3)恒压条件下,将CO2和H2按体积比1:3混合,初始压强为P0,在不同催化剂作用下发生反应I和反应Ⅱ,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。
已知:
①在上述条件下合成甲醇的工业条件是_______________。
A.210℃ B.230℃
C.催化剂CZT D.催化剂CZ(Zr-1)T
②在230℃以上,升高温度CO2的转化率增大,但甲醇的产率降低,原因是_______________。
③已知反应Ⅱ的速率方程可表示为v正=k正·p(CO2)·p(H2),v逆=k逆·p(CO)·p(H2O),其中k正、k逆分别为正、逆反应的速率常数,1gk与的关系如图所示,①、②、③、④四条斜线中,表示1gk正的是______________;230℃下,图中A、B、C、D点的纵坐标分别为a+1、a+0.48、a-0.48、a-1,达到平衡时,测得体系中3p(CO2)=2p(H2O),以物质的分压表示的反应I的平衡常数Kp1_______________。(已知:10-0.48=0.33,10-0.52=0.30)
0
泗水县2023-2024学年高三上学期期中考试
化学答案
DDDBB CBADD CD AC AC C BC
16、【共12分】(1)①. C (1分) ②. 第四周期Ⅷ族 (1分)
(2)①. ②.
③.
17、【共8分】(1)第四周期VIII族
(2) (3)
18、【共12分】(1)除去含钒废料中的有机物
(2)
(3)使钒离子在溶液中以VO3- 形式存在;
(4)会生成 沉淀,降低钒的利用率
(5)①. 将产品中的 氧化为 ②.
19、【共14分】(1) 蒸馏烧瓶(1分) 平衡气压,使液体顺利流下(1分) A(1分)
(2) 浓硫酸(1分) 防止空气中的水蒸气进入硬质玻璃管
(3) (4) (5) (6)BC
20、【共14分】(1)减小 (2) 正向 =
(3)①. BD ②. 230 C以上,温度升高,反应Ⅰ为放热反应,平衡逆向移动,而反应Ⅱ为吸热反应,平衡正向移动,二氧化碳的转化率减小,所以总体二氧化碳的转化率增大,但甲醇的产率降低。
③. ④
同课章节目录
