【人教版】初中化学九下9.3 溶质的质量分数 同步测试题(含答案)
文档属性
| 名称 | 【人教版】初中化学九下9.3 溶质的质量分数 同步测试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 339.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-06 00:00:00 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
课题三 溶质的质量分数 同步测试题
一、选择题
1.下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A.100g水中溶解了10g硝酸钾
B.100g硝酸钾溶液中有10g硝酸钾
C.将10g硝酸钾溶于90g水中所得的溶液
D.将硝酸钾与水按1:9的质量比配制的溶液
2.20℃时,向100g质量分数为26.5%的饱和氯化钠溶液中加入3.5g氯化钠,此时溶液中溶质的质量分数为( )
A.2.5% B.29.1% C.26.5% D.40%
3.实验室将10g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量为( )
A.49g B.88g C.98g D.100g
4.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中错误的是( )
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
5.将100g、10%的蔗糖溶液中溶质的质量分数增大一倍,可采用的方法有( )
A.蒸发掉50g水 B.加入20g蔗糖
C.加入10g蔗糖 D.加入100g、20%的蔗糖溶液
6.如图为氢氧化钙的溶解度曲线,下列说法错误的是( )
A.氢氧化钙的溶解度随温度的升高而减小
B.30℃时,100g水中最多溶解0.15g氢氧化钙
C.30℃恰好饱和的石灰水升温到50℃,溶质的质量分数变小
D.70℃时,饱和石灰水中溶质和溶液的质量比为0.1:100
7.海水淡化可采用膜分离技术.如右下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水.对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
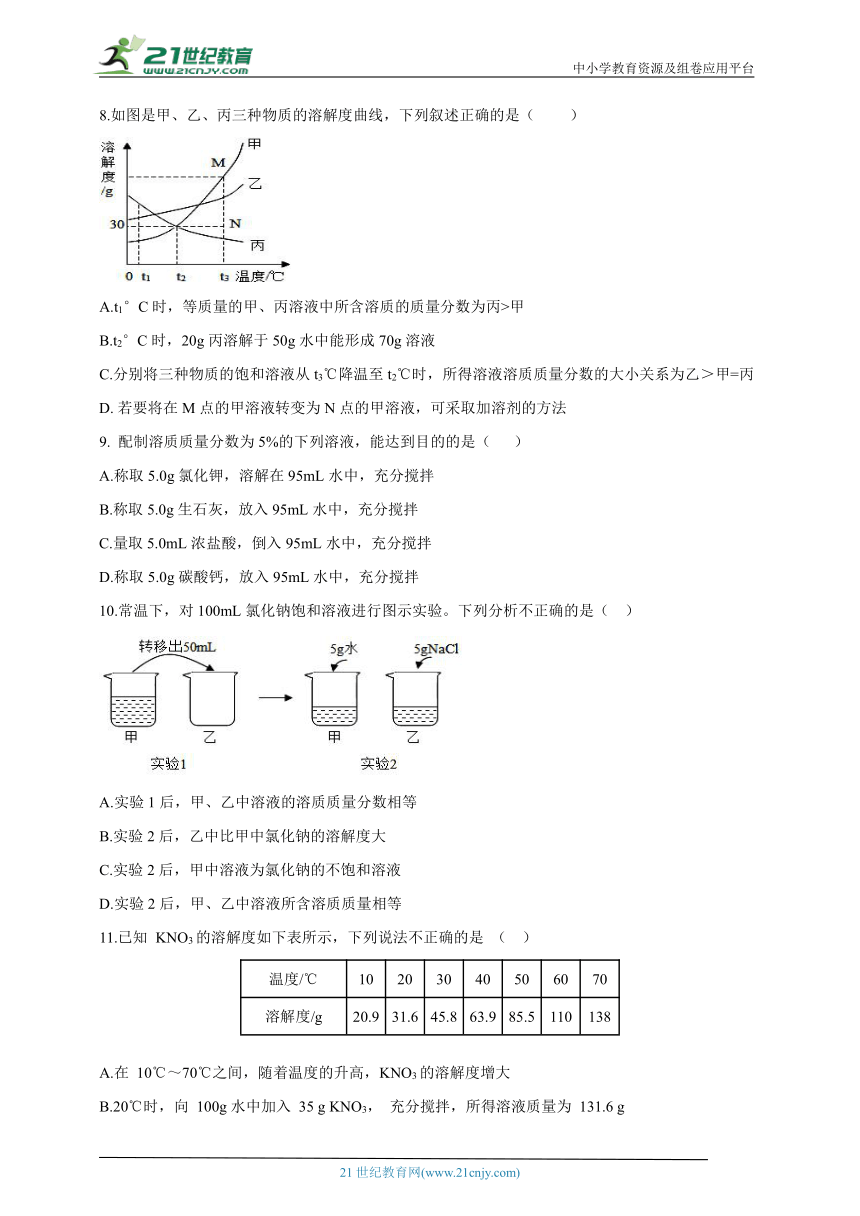
8.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
A.t1°C时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2°C时,20g丙溶解于50g水中能形成70g溶液
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D. 若要将在M点的甲溶液转变为N点的甲溶液,可采取加溶剂的方法
9. 配制溶质质量分数为5%的下列溶液,能达到目的的是( )
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
10.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析不正确的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
11.已知 KNO3的溶解度如下表所示,下列说法不正确的是 ( )
温度/℃ 10 20 30 40 50 60 70
溶解度/g 20.9 31.6 45.8 63.9 85.5 110 138
A.在 10℃~70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100g水中加入 35 g KNO3, 充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%
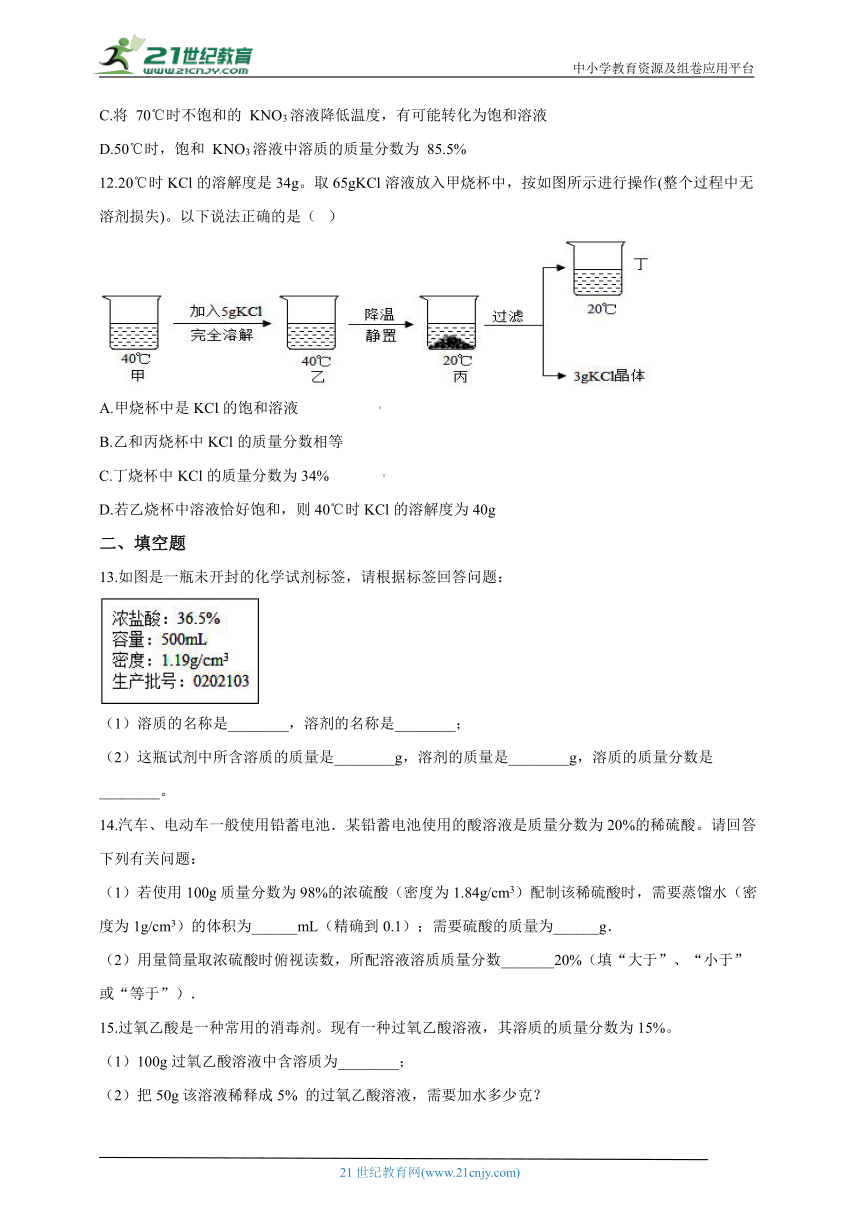
12.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
二、填空题
13.如图是一瓶未开封的化学试剂标签,请根据标签回答问题:
(1)溶质的名称是________,溶剂的名称是________;
(2)这瓶试剂中所含溶质的质量是________g,溶剂的质量是________g,溶质的质量分数是________。
14.汽车、电动车一般使用铅蓄电池.某铅蓄电池使用的酸溶液是质量分数为20%的稀硫酸。请回答下列有关问题:
(1)若使用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为______mL(精确到0.1);需要硫酸的质量为______g.
(2)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数_______20%(填“大于”、“小于”或“等于”).
15.过氧乙酸是一种常用的消毒剂。现有一种过氧乙酸溶液,其溶质的质量分数为15%。
(1)100g过氧乙酸溶液中含溶质为________;
(2)把50g该溶液稀释成5% 的过氧乙酸溶液,需要加水多少克?
(3)将100g该溶液与100g5%的过氧乙酸溶液混合,所得溶液的溶质质量分数?
16.下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、和玻璃棒,其中玻璃棒在此操作中的作用是________。
(2)指出图②中的一处不正确操作________。
(3)计算需要水的质量是________g,配制时应选择________(填10、50或100)mL的量筒量取所需要的水。
(4)下列不正确操作可能导致溶液溶质的质量分数小于7.5%的是________(填序号)
A.②操作中食盐与砝码放置颠倒
B. ①操作中有固体洒落;
C. ⑤操作中有水溅出;
D.读取量筒内液体体积于视线过低;
E.装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数________(填“偏大”“偏小”)
三、计算题
17.过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用。过氧化氢溶液具有强氧化性,3%的过氧化氢溶液就能够有效杀死各类细菌和病毒,同样也可杀死新型冠状病毒,因此在医疗上常用3%的过氧化氢溶液进行消毒。
(1)若配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是________。
(2)若实验室中用68g过氧化氢溶液制取氧气,当分解完全后共收集到3.2g氧气,试求该过氧化氢溶液中溶质的质量分数。
课题三 溶质的质量分数 同步测试题参考答案
一、选择题
1.A 2. C 3. B 4. C 5. A 6. D 7. B 8. D 9. A 10. B 11. D 12. D
二、填空题
13. (1)氯化氢;水(2)217.175;377.825;36.5%
14. (1)390.0;98(2)小于
15. (1)100g过氧乙酸溶液中含溶质为:100g×15%=15g
(2)解:设需要加水的质量为x,根据稀释前后,溶质的质量不变,可得:50g×15%=(50g+x)×5%,x=100g
(3)所得溶液的溶质质量分数为: 。
16. (1)烧杯搅拌,加速溶解 (2)药品与砝码放置不正确
(3)92.5;100(4)ABD (5)偏小
三、计算题
17. (1)50g (2)10%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
课题三 溶质的质量分数 同步测试题
一、选择题
1.下列关于“10%的硝酸钾溶液”含义的说法中,错误的是( )
A.100g水中溶解了10g硝酸钾
B.100g硝酸钾溶液中有10g硝酸钾
C.将10g硝酸钾溶于90g水中所得的溶液
D.将硝酸钾与水按1:9的质量比配制的溶液
2.20℃时,向100g质量分数为26.5%的饱和氯化钠溶液中加入3.5g氯化钠,此时溶液中溶质的质量分数为( )
A.2.5% B.29.1% C.26.5% D.40%
3.实验室将10g质量分数为98%的硫酸稀释成10%的稀硫酸,需要水的质量为( )
A.49g B.88g C.98g D.100g
4.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中错误的是( )
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
5.将100g、10%的蔗糖溶液中溶质的质量分数增大一倍,可采用的方法有( )
A.蒸发掉50g水 B.加入20g蔗糖
C.加入10g蔗糖 D.加入100g、20%的蔗糖溶液
6.如图为氢氧化钙的溶解度曲线,下列说法错误的是( )
A.氢氧化钙的溶解度随温度的升高而减小
B.30℃时,100g水中最多溶解0.15g氢氧化钙
C.30℃恰好饱和的石灰水升温到50℃,溶质的质量分数变小
D.70℃时,饱和石灰水中溶质和溶液的质量比为0.1:100
7.海水淡化可采用膜分离技术.如右下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能通过淡化膜,从而得到淡水.对加压后右侧海水成分变化进行分析,正确的是( )
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
8.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
A.t1°C时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2°C时,20g丙溶解于50g水中能形成70g溶液
C.分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D. 若要将在M点的甲溶液转变为N点的甲溶液,可采取加溶剂的方法
9. 配制溶质质量分数为5%的下列溶液,能达到目的的是( )
A.称取5.0g氯化钾,溶解在95mL水中,充分搅拌
B.称取5.0g生石灰,放入95mL水中,充分搅拌
C.量取5.0mL浓盐酸,倒入95mL水中,充分搅拌
D.称取5.0g碳酸钙,放入95mL水中,充分搅拌
10.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析不正确的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
11.已知 KNO3的溶解度如下表所示,下列说法不正确的是 ( )
温度/℃ 10 20 30 40 50 60 70
溶解度/g 20.9 31.6 45.8 63.9 85.5 110 138
A.在 10℃~70℃之间,随着温度的升高,KNO3的溶解度增大
B.20℃时,向 100g水中加入 35 g KNO3, 充分搅拌,所得溶液质量为 131.6 g
C.将 70℃时不饱和的 KNO3溶液降低温度,有可能转化为饱和溶液
D.50℃时,饱和 KNO3溶液中溶质的质量分数为 85.5%
12.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
二、填空题
13.如图是一瓶未开封的化学试剂标签,请根据标签回答问题:
(1)溶质的名称是________,溶剂的名称是________;
(2)这瓶试剂中所含溶质的质量是________g,溶剂的质量是________g,溶质的质量分数是________。
14.汽车、电动车一般使用铅蓄电池.某铅蓄电池使用的酸溶液是质量分数为20%的稀硫酸。请回答下列有关问题:
(1)若使用100g质量分数为98%的浓硫酸(密度为1.84g/cm3)配制该稀硫酸时,需要蒸馏水(密度为1g/cm3)的体积为______mL(精确到0.1);需要硫酸的质量为______g.
(2)用量筒量取浓硫酸时俯视读数,所配溶液溶质质量分数_______20%(填“大于”、“小于”或“等于”).
15.过氧乙酸是一种常用的消毒剂。现有一种过氧乙酸溶液,其溶质的质量分数为15%。
(1)100g过氧乙酸溶液中含溶质为________;
(2)把50g该溶液稀释成5% 的过氧乙酸溶液,需要加水多少克?
(3)将100g该溶液与100g5%的过氧乙酸溶液混合,所得溶液的溶质质量分数?
16.下图是小华配制100g溶质质量分数为7.5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、和玻璃棒,其中玻璃棒在此操作中的作用是________。
(2)指出图②中的一处不正确操作________。
(3)计算需要水的质量是________g,配制时应选择________(填10、50或100)mL的量筒量取所需要的水。
(4)下列不正确操作可能导致溶液溶质的质量分数小于7.5%的是________(填序号)
A.②操作中食盐与砝码放置颠倒
B. ①操作中有固体洒落;
C. ⑤操作中有水溅出;
D.读取量筒内液体体积于视线过低;
E.装瓶存放操作中溶液洒落。
(5)该同学在称量氯化钠药品前天平的指针偏左,则所配制的溶液的质量分数________(填“偏大”“偏小”)
三、计算题
17.过氧化氢溶液常用于家庭、医疗等方面,它具有杀菌、漂白、防腐和除臭等作用。过氧化氢溶液具有强氧化性,3%的过氧化氢溶液就能够有效杀死各类细菌和病毒,同样也可杀死新型冠状病毒,因此在医疗上常用3%的过氧化氢溶液进行消毒。
(1)若配制500g溶质质量分数为3%的过氧化氢溶液,需溶质质量分数为30%的过氧化氢溶液的质量是________。
(2)若实验室中用68g过氧化氢溶液制取氧气,当分解完全后共收集到3.2g氧气,试求该过氧化氢溶液中溶质的质量分数。
课题三 溶质的质量分数 同步测试题参考答案
一、选择题
1.A 2. C 3. B 4. C 5. A 6. D 7. B 8. D 9. A 10. B 11. D 12. D
二、填空题
13. (1)氯化氢;水(2)217.175;377.825;36.5%
14. (1)390.0;98(2)小于
15. (1)100g过氧乙酸溶液中含溶质为:100g×15%=15g
(2)解:设需要加水的质量为x,根据稀释前后,溶质的质量不变,可得:50g×15%=(50g+x)×5%,x=100g
(3)所得溶液的溶质质量分数为: 。
16. (1)烧杯搅拌,加速溶解 (2)药品与砝码放置不正确
(3)92.5;100(4)ABD (5)偏小
三、计算题
17. (1)50g (2)10%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
