第三单元 溶液—2023-2024学年鲁教版化学九年级上册单元复习学案(含解析)
文档属性
| 名称 | 第三单元 溶液—2023-2024学年鲁教版化学九年级上册单元复习学案(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 516.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-06 17:54:12 | ||
图片预览



文档简介
第三单元 溶液
【单元学习目标】
1.认识溶液的基本特征;知道溶质、溶剂的概念,能够分辨常见溶液中的溶液和溶剂。
2.了解物质溶解的微观实质,了解物质溶解过程中的能量变化及其产生原因。
3.认识乳化剂和乳化作用;知道溶解与乳化的不同,认识常见乳化现象。
4.了解饱和溶液的概念;了解饱和溶液与不饱和溶液的相互转化条件。
5.理解溶液组成的定量表示方法——溶质质量分数的含义,能够进行溶质质量分数的简单计算。
6.学会配制一定溶质质量分数的溶液。
7.学会利用溶质质量分数解决生产和生活中的实际问题。
【单元思维导图】
【单元知识梳理】
溶液的形成
溶液
(1)溶液的定义:一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物。
(2)溶液的特征:均一性、稳定性。
(3)溶液的组成:由溶质和溶剂组成。
(4)质量关系:溶液质量=溶质质量+溶剂质量
(5)体积关系:溶液的体积<溶质的体积+溶剂的体积
2、溶质、溶剂的判断
(1)根据溶液的名称判断。溶液的完整名称是:“溶质名称”的“溶剂的名称”溶液;若溶剂是水,可命名为:“溶质名称”溶液;“个别俗称如石灰水(氢氧化钙的水溶液)、碘酒(碘的酒精溶液)、食盐水(氯化钠的水溶液)、医用酒精(75%的酒精的水溶液)。
(2)
溶液的组成 溶液的形成 溶质 溶剂
固体+液体 固体+液体 固体+液体
固体 固体 固体
液体 液体 液体
气体+液体 气体+液体 气体+液体
3、溶解时的热量变化
(1)有些物质溶于水时会放出热量(溶液温度升高),如氢氧化钠。
(2)有些物质溶于水时会吸收热量(溶液温度降低),如硝酸铵。
大多数物质溶于水时没有明显的温度变化,如氯化钠。
乳化作用
当在植物油中加入洗涤剂后,植物油就被分散成无数细小的液滴,而不能聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象被称为乳化作用。肥皂、洗发水等都具有乳化作用。
【注意】
乳化与溶解不同,乳化是将难溶性液体物质分散成细小的液滴,而溶解是将可溶性物质分散成分子、离子等。
饱和溶液与不饱和溶液
概念
在一定温度下,向一定量溶剂里加人某种溶质,当溶质不能继续溶解时,所得的溶液叫作这种溶质的饱和溶液;还能继续溶解的溶液,叫作这种溶质的不饱和溶液。
【注意】
某种物质的饱和溶液中,不能继续溶解该物质,但还能够溶解其他物质,如在饱和硝酸钾溶液中可以溶解氯化钠。
相互转化
(1)对于大多数溶解度随温度升高而增大的固体物质:
饱和溶液不饱和溶液
(2)对于少数溶解度随温度升高而减小的固体物质[如Ca(OH)2]:
饱和溶液不饱和溶液
溶液的浓度
1、溶质质量分数
(1)定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。
(2)公式
溶质的质量分数=
【注意】
①溶质的质量分数必须用百分数表示,不能用分数或小数表示。
②溶质质量指已溶解在溶剂里的溶质的质量,不一定等于加入的溶质质量(即没有溶解的部分不计入溶质质量)。
③溶液是混合物,必须换成溶质的质量代入化学方程式才能进行计算。
2、溶液的稀释
(1)依据:溶液稀释前后,溶质的质量不变。
(2)公式
浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数
配制一定溶质质量分数的溶液
仪器的选用及各仪器的作用
(1)所用仪器:托盘天平(带砝码)、药匙(溶质为固体时)、量筒、胶头滴管、烧杯、玻璃棒。
(2)玻璃棒的作用:搅拌,加快固体或液体溶质的溶解速率。
(3)量筒的作用:量取一定体积的液体。选取量筒时量程要比量取液体的体积略大,且越接近越好。
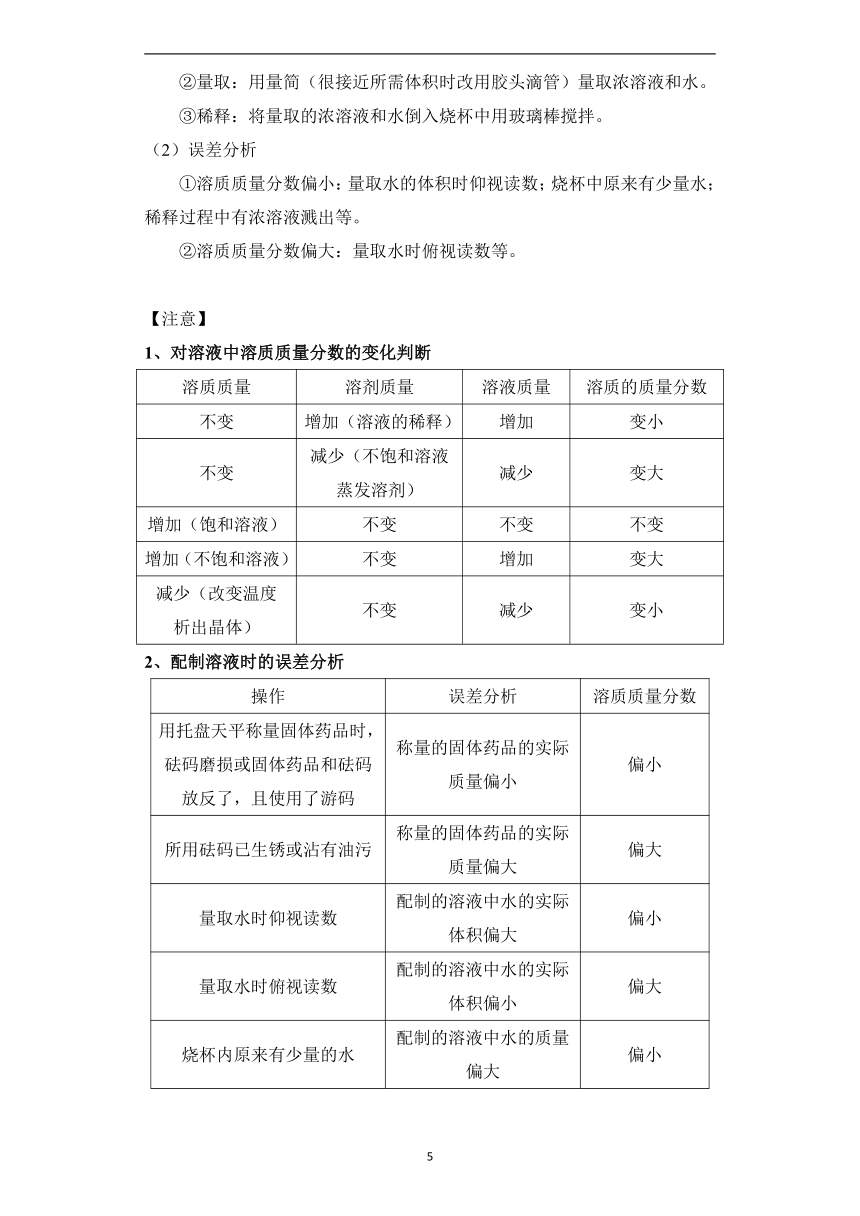
2、操作步骤
所配制溶液的溶质为固体(如图所示)。
(1)计算:计算所需溶质的质量和水的体积。
(2)称量:用托盘天平称取一定质量的固体。
(3)量取:用量筒量取一定体积的水。
(4)溶解:将固体倒入烧杯中,将量取的水倒入烧杯中,用玻璃棒不断搅拌至固体完全溶解。
(5)装瓶、贴标签:将配制好的溶液装入试剂瓶中并贴上标签。
3、注意事项
(1)托盘天平的使用:用托盘天平称量时要遵循“左物右码”的原则,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的药品应放在玻璃器皿中称量。
(2)量筒的使用
①用量简量取液体,读数时视线应与量筒内液体凹液面的最低处相平。
②选取量简的量程要比所要量取液体体积稍大且越接近越好。
用浓溶液配制一定溶质质量分数的溶液
(1)操作步骤
①计算:计算所需浓溶液的体积和所需水的体积。
②量取:用量简(很接近所需体积时改用胶头滴管)量取浓溶液和水。
③稀释:将量取的浓溶液和水倒入烧杯中用玻璃棒搅拌。
(2)误差分析
①溶质质量分数偏小:量取水的体积时仰视读数;烧杯中原来有少量水;稀释过程中有浓溶液溅出等。
②溶质质量分数偏大:量取水时俯视读数等。
【注意】
1、对溶液中溶质质量分数的变化判断
溶质质量 溶剂质量 溶液质量 溶质的质量分数
不变 增加(溶液的稀释) 增加 变小
不变 减少(不饱和溶液 蒸发溶剂) 减少 变大
增加(饱和溶液) 不变 不变 不变
增加(不饱和溶液) 不变 增加 变大
减少(改变温度 析出晶体) 不变 减少 变小
2、配制溶液时的误差分析
操作 误差分析 溶质质量分数
用托盘天平称量固体药品时,砝码磨损或固体药品和砝码放反了,且使用了游码 称量的固体药品的实际质量偏小 偏小
所用砝码已生锈或沾有油污 称量的固体药品的实际质量偏大 偏大
量取水时仰视读数 配制的溶液中水的实际体积偏大 偏小
量取水时俯视读数 配制的溶液中水的实际体积偏小 偏大
烧杯内原来有少量的水 配制的溶液中水的质量偏大 偏小
将固体药品倒入烧杯中时部分撒在外面 配制的溶液中溶质的 质量偏小 偏小
将固体药品倒人烧杯中时,纸片上残留少量固体药品 配制的溶液中溶质的 质量偏小 偏小
固体药品中含有不溶性杂质 配制的溶液中溶质的 质量偏小 偏小
装瓶时有液体溅出 —— 不变
【单元常考题型】
题型1 溶液
1.下列关于溶液的说法正确的是( )
A.能溶解其他物质的物质叫作溶剂
B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的
D.溶液中的溶剂一定是水
题型2 物质溶解时的放热或吸热现象
2.用如图装置(气密性良好)进行试验,将水压入瓶中时,可观察到U型管中红色水柱左高右低,广口瓶中的固体物质可能是( )
A.氢氧化钠 B.硝酸铵 C.氧化钙 D.氯化钠
题型3 乳化现象
3.下列清洗方法中,利用乳化作用的是( )
A.用洗洁精清洗油腻的餐具 B.用汽油清洗油污
C.用自来水清洗手上的泥土 D.用食醋清除水垢
题型4 饱和溶液与不饱和溶液
4.室温时,从100g饱和硝酸钾溶液中取出10g溶液,那么剩余的硝酸钾溶液( )
A.还是饱和溶液 B.变成不饱和溶液了
C.硝酸钾质量没变 D.硝酸钾和水的质量没变
题型5 溶质质量分数的基本计算
5.溶质的质量分数为15%的蔗糖溶液150g
(1)将溶质的质量分数降低到10%,应加水 ,最后所得溶液中溶质的质量为 。
(2)若使溶质的质量分数增加到30%,应加入 蔗糖(保留小数点后一位数)。
题型6 溶液稀释或浓缩问题的计算
6.如要将100g溶质质量分数为20%的氯化钠溶液稀释成溶质质量分数为10%的氯化钠溶液,稀释前后质量不变为
A.溶质的质量 B.溶剂的质量 C.溶液的质量 D.溶液的体积
题型7 配制一定溶质质量分数的溶液
7.要配制一定质量分数的NaOH溶液,正确的操作步骤是( )
A.计算、溶解、量取、装瓶 B.称量、溶解、搅拌、装瓶
C.计算、称量、溶解、装瓶 D.称量、加水、溶解、装瓶
8.兴趣小组需配制50 g质量分数为12%的氯化钠溶液,如图是某同学配制溶液的操作示意图:
(1)配制该溶液需要食盐_____克;
(2)用上述图示的序号表示配制溶液的操作顺序_____,玻璃棒的作用_____;
(3)若步骤② 称量时出现了指针偏左,应进行的操作是_____;
(4)如果配制的氯化钠溶液溶质质量分数小于12%,其原因可能有_____(填序号。
A 所用的氯化钠固体中含有杂质
B 量取水时,仰视读数
C 将水倒入烧杯时,有少量水溅出
D 将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上
【单元对接中考】
1.(2023·湖南湘潭·统考中考真题)下列固体物质加入适量水中,溶液的温度明显降低的是
A. B. C. D.
2.(2023·山东泰安·统考中考真题)如图所示,概念之间存在着包含、并列、交叉等关系。下列概念间的关系正确的是
A.纯净物与化合物属于包含关系 B.饱和溶液与浓溶液属于并列关系
C.分解反应与化合反应属于交叉关系 D.糖类与油脂属于交叉关系
3.(2024春·全国·九年级课堂例题)室温时,取一定质量的氯化钠固体放入烧杯中,如图所示加水搅拌充分溶解,下列分析不正确的是
A.乙和丙烧杯中的氯化钠溶液一定是饱和溶液
B.丁烧杯中的氯化钠溶液一定是不饱和溶液
C.乙→丙的过程中,烧杯中溶质质量分数不变
D.丁→戊的过程中,烧杯中溶液质量增加
4.(2023秋·黑龙江绥化·九年级校考期中)下列有关溶液的认识中,正确的是
A.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
B.饱和溶液一定比不饱和溶液的浓度大
C.同种溶质的饱和溶液,一定比其不饱和溶液的浓度大
D.同温下,同种溶质的饱和溶液,一定比其不饱和溶液浓度大
5.(2024春·全国·九年级课堂例题)某同学要配制50g质量分数为14%的氯化钠溶液,下列关于配制该溶液的说法不正确的是:
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②选用200mL量筒量取所需水的体积
③实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和试剂瓶
④用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A.①③ B.②④ C.①② D.②
6.(2023·湖北十堰·统考中考真题节选)化学与生活息息相关。厨房中常有以下物质:①食盐:②植物油;③食醋;④料酒;⑤小苏打。
(3)厨房中常用洗洁精洗去餐具上的油污,其原理是 作用。
7.(2023·山东淄博·中考真题)某实验小组利用如下仪器配制500g10%的氯化钠溶液。回答下列问题:
(1)上图中缺少一种必须用到的玻璃仪器,它是 。
(2)配制500g10%的氯化钠溶液需要氯化钠的质量为 g。氯化钠溶液中的微观粒子有 (填粒子符号)。
(3)配制好的氯化钠溶液取用一半后,剩余溶液中溶质的质量分数是 。
8.(2024春·全国·九年级课堂例题)下图是小亮同学配制100g溶质质量分数为18%的氯化钠溶液的实验。
(1)上图中的玻璃仪器有广口瓶、 、 、和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)用上述图示中的序号表示配制溶液的操作的顺序 ;
(3)通过计算确定需要水的体积是 mL(水的密度为1g/mL),配制时应选择 (填“10”、“50”或“100”)mL的量筒取所需要的水;
(4)图②中错误是 ,称取氯化钠实际质量为 ,如果配制的其余操作准确规范,则实际所得溶液溶质质量分数为 (精确到0.1%);
(5)在定量实验中,不精细或操作不规范就会导致实验结果有误差。如果配制的溶液的溶质质量分数大于18%,可能的原因是: 、 。试卷第1页,共3页
2
答案以及解析
【单元常考题型】
1.答案:A
解析:溶液是均一、稳定的混合物,但均一稳定的液体不一定是溶液,如蒸馏水,B错;溶液可以有颜色,如硫酸铜溶液的颜色为蓝色,C错;溶剂不一定是水,如汽油、酒精等都可以作为溶剂,D错。故选B。
2.答案:B
解析:A、氢氧化钠溶于水温度升高,会使瓶内的压强增大,故错误;B、硝酸铵固体溶于水吸收热量,温度降低,使瓶内的压强降低,故正确;C、氧化钙和水反应,放出大量的热,水温度升高,会使瓶内的压强增大,故错误;D、氯化钠固体溶于水无能量变化,温度不变,压强不变,故错误.故选B。
3.答案:A
解析:A、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,故选项是利用乳化作用。
B、用汽油洗去油污是利用汽油能溶解油污来达到目的,利用的是溶解原理,故选项不是利用乳化作用。
C、用自来水清洗手上的泥土,是利用水流把手上的泥土冲走,故选项不是利用乳化作用。
D、用食醋洗去热水瓶中的水垢是因为水垢的主要成分碳酸钙能和食醋反应,从而把水垢除去,故选项不是利用乳化作用。故选:A。
4.答案:A
解析:A、室温时,从100g饱和硝酸钾溶液中取出10g溶液,那么剩余的硝酸钾溶液还是饱和溶液,该选项说法正确;
B、仍然是饱和溶液,该选项说法不正确;
C、剩余的硝酸钾溶液中硝酸钾的质量减小了,该选项说法不正确;
D、剩余的硝酸钾溶液中硝酸钾和水的质量都减小,该选项说法不正确。
故选:A。
5.答案:(1)75g ;22.5g (2)32.1g
解析:溶质的质量分数为15%的蔗糖溶液150g,蔗糖的质量为150×15%=22.5,将溶质的质量分数降低到10%的溶液质量为22.5÷10%=225g应加水225-150=75;将质量分数增加到30%,设需增加的蔗糖为X,则(22.5+X)/(150+X)=30%,需增加的蔗糖32.1g。
6.答案:A
解析:溶液稀释前后溶质的质量不变。故选A。
7.答案:C
解析:先计算出需氢氧化钠的质量和所需水的体积,用托盘天平称量出溶质加入烧杯内,再用量筒量取水倒入烧杯内,用玻璃棒搅拌至氢氧化钠完全溶解。故选C。
答案:(1)6 (2)④②①⑤③;搅拌(加速溶解)
(3)减少氯化钠的质量(4) ABD
解析:(1)配制该溶液需要食盐的质量为
(2)配制溶液的操作顺序为取食盐、称量、倒入烧杯中(食盐和水),溶解,故顺序为④②①⑤③,玻璃棒的作用搅拌(加速溶解)。
(3)若步骤B 称量时出现了指针偏左,说明食盐加多了,应进行的操作是取下少量的食盐。
(4)A、所用的氯化钠固体中含有杂质会导致氯化钠偏少,会导致配制的氯化钠溶液溶质质量分数小于12%,故A正确;
B、量取水时,仰视读数会导致水多,会导致配制的氯化钠溶液溶质质量分数小于12%,故B正确;
C、将水倒入烧杯时,有少量水溅出会导致水少,溶质质量分数偏大,故C不正确;
D、将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上会导致盐少,会导致配制的氯化钠溶液溶质质量分数小于12%,故D正确。
故选ABD。
【单元对接中考】
1.答案:A
【详解】A、硝酸铵溶解在水中时吸热,溶液温度降低,符合题意;
B、氧化钙和水反应生成氢氧化钙,放热,溶液温度升高,不符合题意;
C、氯化钠溶解在水中时无明显吸放热,溶液温度不变,不符合题意;
D、氢氧化钠溶解在水中时放热,溶液温度升高,不符合题意;
故选A。
2.答案:A
【详解】A、由同一种物质组成的是纯净物,组成中含有不同种元素的纯净物是化合物,纯浄物与化合物属于包含关系,故A符合题意;
B、某物质的饱和溶液不一定是浓溶液,浓溶液也不一定是饱和溶液,不饱和溶液不一定是稀溶液,而稀溶液也不一定是不饱和溶液,即饱和溶液与浓溶液属于交叉关系,故B不符合题意;
C、分解反应的定义:由一种分解生成两种或两种以上物质的反应;化合反应的定义:由两种或两种以上的物质反应生成一种物质的反应,分解反应与化合反应都属于基本反应类型,二者属于并列关系,故C不符合题意;
D、糖类和油脂不属于同一种物质类别,二者属于并列关系,故D不符合题意;
故选A。
3.答案:B
【详解】A、乙和丙烧杯中的氯化钠溶液有未溶溶质,故一定是饱和溶液,选项正确;
B、丁烧杯加水后,烧杯没有未溶氯化钠,故无法判断是否饱和,选项错误;
C、乙→丙的过程中,由于都是该温度下的饱和溶液,溶解度不变,故烧杯中溶质质量分数不变,选项正确;
D、丁→戊的过程中,由于加入了20g水,因此烧杯中溶液质量增加,选项正确;
故选:B。
4.答案:D
【详解】A.溶液的饱和、不饱和与溶液的浓、稀没有必然的联系,即饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故A错误;
B.在相同温度下,同种溶剂、同种溶质的饱和溶液比其不饱和溶液的浓度大,其他情况不一定,故B错误;
C.同种溶质的饱和溶液,温度不同,不一定比其不饱和溶液的浓度大,故C错误;
D.同温下,同种溶质的饱和溶液,一定比其不饱和溶液浓度大,故D正确。
故选:D。
5.答案:B
【详解】①溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为14%的氯化钠溶液,需氯化钠的质量=50g×14%=7.0g,①说法正确;
②溶剂质量=溶液质量-溶质质量,所需溶剂的质量为50g-7g=43g(合43mL),应用规格为50mL的量筒量取水的体积,②说法错误;
③配制50g质量分数为14%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、贴签装瓶;在这些操作中需要的仪器:托盘天平、药匙、量筒、烧杯和玻璃棒,其中属于玻璃仪器的是烧杯、量筒、玻璃棒和试剂瓶。③说法正确;
④用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大。④说法错误。故②④说法错误。
综上所述:选择B。
6.答案:(3)乳化
【详解】(3)用洗洁精除去油污,是由于洗洁精对油污有乳化作用,能将大的油滴分散成细小的油滴随水冲走,故填:乳化。
7.答案:(1)烧杯
(2)50 Na+、Cl-、H2O
(3)10%
【详解】(1)用固体配制一定溶质质量分数的溶液,实验步骤及所需仪器为:计算、称量(托盘天平、药匙)、量取(量筒、胶头滴管)、溶解(烧杯、玻璃棒)、装瓶贴标签,故上图中缺少一种必须用到的玻璃仪器,它是烧杯;
(2)需要氯化钠的质量为:;
氯化钠溶液中含钠离子、氯离子、水分子,离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故钠离子、氯离子表示为:Na+、Cl-,分子用化学式表示,故水分子表示为:H2O;
(3)溶液具有均一性,配制好的氯化钠溶液取用一半后,剩余溶液中溶质的质量分数是10%。
8.答案:(1) 烧杯 量筒 搅拌、加速溶解
(2)④②①⑤③
(3) 82 100
(4) 砝码和氯化钠的位置放反了 12g 12.8%
(5) 量取水时俯视读数(合理即可) 往烧杯中加水时,水溅出
【详解】(1)上图中的玻璃仪器有:广口瓶、烧杯、量筒、玻璃棒;
溶解时,玻璃棒的作用是:搅拌、加速溶解;
(2)用固体配制一定溶质质量分数的溶液,实验步骤为:计算、称量、量取、溶解、装瓶贴标签,故顺序为:④②①⑤③;
(3)所需氯化钠的质量为:100g×18%=18g,所需水的质量为:100g-18g=82g,即82mL;
量筒量程的选择,应遵循“大而近”的原则,故应选择100mL的量筒量取所需的水;
(4)用托盘天平称量物品时,应遵循“左物右码”的原则,图②中错误是砝码和氯化钠的位置放反了;
左盘质量=右盘质量+游码质量,故实际称取氯化钠的质量为:10g+5g-3g=12g;
如果配制的其余操作准确规范,则实际所得溶液溶质质量分数为:;
(5)如果量取水时俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,则配制的溶液的溶质质量分数大于18%;如果往烧杯中加水时,水溅出,会导致溶剂质量减小,溶质质量分数偏大。
2
【单元学习目标】
1.认识溶液的基本特征;知道溶质、溶剂的概念,能够分辨常见溶液中的溶液和溶剂。
2.了解物质溶解的微观实质,了解物质溶解过程中的能量变化及其产生原因。
3.认识乳化剂和乳化作用;知道溶解与乳化的不同,认识常见乳化现象。
4.了解饱和溶液的概念;了解饱和溶液与不饱和溶液的相互转化条件。
5.理解溶液组成的定量表示方法——溶质质量分数的含义,能够进行溶质质量分数的简单计算。
6.学会配制一定溶质质量分数的溶液。
7.学会利用溶质质量分数解决生产和生活中的实际问题。
【单元思维导图】
【单元知识梳理】
溶液的形成
溶液
(1)溶液的定义:一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物。
(2)溶液的特征:均一性、稳定性。
(3)溶液的组成:由溶质和溶剂组成。
(4)质量关系:溶液质量=溶质质量+溶剂质量
(5)体积关系:溶液的体积<溶质的体积+溶剂的体积
2、溶质、溶剂的判断
(1)根据溶液的名称判断。溶液的完整名称是:“溶质名称”的“溶剂的名称”溶液;若溶剂是水,可命名为:“溶质名称”溶液;“个别俗称如石灰水(氢氧化钙的水溶液)、碘酒(碘的酒精溶液)、食盐水(氯化钠的水溶液)、医用酒精(75%的酒精的水溶液)。
(2)
溶液的组成 溶液的形成 溶质 溶剂
固体+液体 固体+液体 固体+液体
固体 固体 固体
液体 液体 液体
气体+液体 气体+液体 气体+液体
3、溶解时的热量变化
(1)有些物质溶于水时会放出热量(溶液温度升高),如氢氧化钠。
(2)有些物质溶于水时会吸收热量(溶液温度降低),如硝酸铵。
大多数物质溶于水时没有明显的温度变化,如氯化钠。
乳化作用
当在植物油中加入洗涤剂后,植物油就被分散成无数细小的液滴,而不能聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象被称为乳化作用。肥皂、洗发水等都具有乳化作用。
【注意】
乳化与溶解不同,乳化是将难溶性液体物质分散成细小的液滴,而溶解是将可溶性物质分散成分子、离子等。
饱和溶液与不饱和溶液
概念
在一定温度下,向一定量溶剂里加人某种溶质,当溶质不能继续溶解时,所得的溶液叫作这种溶质的饱和溶液;还能继续溶解的溶液,叫作这种溶质的不饱和溶液。
【注意】
某种物质的饱和溶液中,不能继续溶解该物质,但还能够溶解其他物质,如在饱和硝酸钾溶液中可以溶解氯化钠。
相互转化
(1)对于大多数溶解度随温度升高而增大的固体物质:
饱和溶液不饱和溶液
(2)对于少数溶解度随温度升高而减小的固体物质[如Ca(OH)2]:
饱和溶液不饱和溶液
溶液的浓度
1、溶质质量分数
(1)定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。
(2)公式
溶质的质量分数=
【注意】
①溶质的质量分数必须用百分数表示,不能用分数或小数表示。
②溶质质量指已溶解在溶剂里的溶质的质量,不一定等于加入的溶质质量(即没有溶解的部分不计入溶质质量)。
③溶液是混合物,必须换成溶质的质量代入化学方程式才能进行计算。
2、溶液的稀释
(1)依据:溶液稀释前后,溶质的质量不变。
(2)公式
浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数
配制一定溶质质量分数的溶液
仪器的选用及各仪器的作用
(1)所用仪器:托盘天平(带砝码)、药匙(溶质为固体时)、量筒、胶头滴管、烧杯、玻璃棒。
(2)玻璃棒的作用:搅拌,加快固体或液体溶质的溶解速率。
(3)量筒的作用:量取一定体积的液体。选取量筒时量程要比量取液体的体积略大,且越接近越好。
2、操作步骤
所配制溶液的溶质为固体(如图所示)。
(1)计算:计算所需溶质的质量和水的体积。
(2)称量:用托盘天平称取一定质量的固体。
(3)量取:用量筒量取一定体积的水。
(4)溶解:将固体倒入烧杯中,将量取的水倒入烧杯中,用玻璃棒不断搅拌至固体完全溶解。
(5)装瓶、贴标签:将配制好的溶液装入试剂瓶中并贴上标签。
3、注意事项
(1)托盘天平的使用:用托盘天平称量时要遵循“左物右码”的原则,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的药品应放在玻璃器皿中称量。
(2)量筒的使用
①用量简量取液体,读数时视线应与量筒内液体凹液面的最低处相平。
②选取量简的量程要比所要量取液体体积稍大且越接近越好。
用浓溶液配制一定溶质质量分数的溶液
(1)操作步骤
①计算:计算所需浓溶液的体积和所需水的体积。
②量取:用量简(很接近所需体积时改用胶头滴管)量取浓溶液和水。
③稀释:将量取的浓溶液和水倒入烧杯中用玻璃棒搅拌。
(2)误差分析
①溶质质量分数偏小:量取水的体积时仰视读数;烧杯中原来有少量水;稀释过程中有浓溶液溅出等。
②溶质质量分数偏大:量取水时俯视读数等。
【注意】
1、对溶液中溶质质量分数的变化判断
溶质质量 溶剂质量 溶液质量 溶质的质量分数
不变 增加(溶液的稀释) 增加 变小
不变 减少(不饱和溶液 蒸发溶剂) 减少 变大
增加(饱和溶液) 不变 不变 不变
增加(不饱和溶液) 不变 增加 变大
减少(改变温度 析出晶体) 不变 减少 变小
2、配制溶液时的误差分析
操作 误差分析 溶质质量分数
用托盘天平称量固体药品时,砝码磨损或固体药品和砝码放反了,且使用了游码 称量的固体药品的实际质量偏小 偏小
所用砝码已生锈或沾有油污 称量的固体药品的实际质量偏大 偏大
量取水时仰视读数 配制的溶液中水的实际体积偏大 偏小
量取水时俯视读数 配制的溶液中水的实际体积偏小 偏大
烧杯内原来有少量的水 配制的溶液中水的质量偏大 偏小
将固体药品倒入烧杯中时部分撒在外面 配制的溶液中溶质的 质量偏小 偏小
将固体药品倒人烧杯中时,纸片上残留少量固体药品 配制的溶液中溶质的 质量偏小 偏小
固体药品中含有不溶性杂质 配制的溶液中溶质的 质量偏小 偏小
装瓶时有液体溅出 —— 不变
【单元常考题型】
题型1 溶液
1.下列关于溶液的说法正确的是( )
A.能溶解其他物质的物质叫作溶剂
B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的
D.溶液中的溶剂一定是水
题型2 物质溶解时的放热或吸热现象
2.用如图装置(气密性良好)进行试验,将水压入瓶中时,可观察到U型管中红色水柱左高右低,广口瓶中的固体物质可能是( )
A.氢氧化钠 B.硝酸铵 C.氧化钙 D.氯化钠
题型3 乳化现象
3.下列清洗方法中,利用乳化作用的是( )
A.用洗洁精清洗油腻的餐具 B.用汽油清洗油污
C.用自来水清洗手上的泥土 D.用食醋清除水垢
题型4 饱和溶液与不饱和溶液
4.室温时,从100g饱和硝酸钾溶液中取出10g溶液,那么剩余的硝酸钾溶液( )
A.还是饱和溶液 B.变成不饱和溶液了
C.硝酸钾质量没变 D.硝酸钾和水的质量没变
题型5 溶质质量分数的基本计算
5.溶质的质量分数为15%的蔗糖溶液150g
(1)将溶质的质量分数降低到10%,应加水 ,最后所得溶液中溶质的质量为 。
(2)若使溶质的质量分数增加到30%,应加入 蔗糖(保留小数点后一位数)。
题型6 溶液稀释或浓缩问题的计算
6.如要将100g溶质质量分数为20%的氯化钠溶液稀释成溶质质量分数为10%的氯化钠溶液,稀释前后质量不变为
A.溶质的质量 B.溶剂的质量 C.溶液的质量 D.溶液的体积
题型7 配制一定溶质质量分数的溶液
7.要配制一定质量分数的NaOH溶液,正确的操作步骤是( )
A.计算、溶解、量取、装瓶 B.称量、溶解、搅拌、装瓶
C.计算、称量、溶解、装瓶 D.称量、加水、溶解、装瓶
8.兴趣小组需配制50 g质量分数为12%的氯化钠溶液,如图是某同学配制溶液的操作示意图:
(1)配制该溶液需要食盐_____克;
(2)用上述图示的序号表示配制溶液的操作顺序_____,玻璃棒的作用_____;
(3)若步骤② 称量时出现了指针偏左,应进行的操作是_____;
(4)如果配制的氯化钠溶液溶质质量分数小于12%,其原因可能有_____(填序号。
A 所用的氯化钠固体中含有杂质
B 量取水时,仰视读数
C 将水倒入烧杯时,有少量水溅出
D 将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上
【单元对接中考】
1.(2023·湖南湘潭·统考中考真题)下列固体物质加入适量水中,溶液的温度明显降低的是
A. B. C. D.
2.(2023·山东泰安·统考中考真题)如图所示,概念之间存在着包含、并列、交叉等关系。下列概念间的关系正确的是
A.纯净物与化合物属于包含关系 B.饱和溶液与浓溶液属于并列关系
C.分解反应与化合反应属于交叉关系 D.糖类与油脂属于交叉关系
3.(2024春·全国·九年级课堂例题)室温时,取一定质量的氯化钠固体放入烧杯中,如图所示加水搅拌充分溶解,下列分析不正确的是
A.乙和丙烧杯中的氯化钠溶液一定是饱和溶液
B.丁烧杯中的氯化钠溶液一定是不饱和溶液
C.乙→丙的过程中,烧杯中溶质质量分数不变
D.丁→戊的过程中,烧杯中溶液质量增加
4.(2023秋·黑龙江绥化·九年级校考期中)下列有关溶液的认识中,正确的是
A.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
B.饱和溶液一定比不饱和溶液的浓度大
C.同种溶质的饱和溶液,一定比其不饱和溶液的浓度大
D.同温下,同种溶质的饱和溶液,一定比其不饱和溶液浓度大
5.(2024春·全国·九年级课堂例题)某同学要配制50g质量分数为14%的氯化钠溶液,下列关于配制该溶液的说法不正确的是:
①若用氯化钠固体配制,需称取氯化钠固体7.0g
②选用200mL量筒量取所需水的体积
③实验中用到的玻璃仪器有烧杯、量筒、玻璃棒和试剂瓶
④用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小
A.①③ B.②④ C.①② D.②
6.(2023·湖北十堰·统考中考真题节选)化学与生活息息相关。厨房中常有以下物质:①食盐:②植物油;③食醋;④料酒;⑤小苏打。
(3)厨房中常用洗洁精洗去餐具上的油污,其原理是 作用。
7.(2023·山东淄博·中考真题)某实验小组利用如下仪器配制500g10%的氯化钠溶液。回答下列问题:
(1)上图中缺少一种必须用到的玻璃仪器,它是 。
(2)配制500g10%的氯化钠溶液需要氯化钠的质量为 g。氯化钠溶液中的微观粒子有 (填粒子符号)。
(3)配制好的氯化钠溶液取用一半后,剩余溶液中溶质的质量分数是 。
8.(2024春·全国·九年级课堂例题)下图是小亮同学配制100g溶质质量分数为18%的氯化钠溶液的实验。
(1)上图中的玻璃仪器有广口瓶、 、 、和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)用上述图示中的序号表示配制溶液的操作的顺序 ;
(3)通过计算确定需要水的体积是 mL(水的密度为1g/mL),配制时应选择 (填“10”、“50”或“100”)mL的量筒取所需要的水;
(4)图②中错误是 ,称取氯化钠实际质量为 ,如果配制的其余操作准确规范,则实际所得溶液溶质质量分数为 (精确到0.1%);
(5)在定量实验中,不精细或操作不规范就会导致实验结果有误差。如果配制的溶液的溶质质量分数大于18%,可能的原因是: 、 。试卷第1页,共3页
2
答案以及解析
【单元常考题型】
1.答案:A
解析:溶液是均一、稳定的混合物,但均一稳定的液体不一定是溶液,如蒸馏水,B错;溶液可以有颜色,如硫酸铜溶液的颜色为蓝色,C错;溶剂不一定是水,如汽油、酒精等都可以作为溶剂,D错。故选B。
2.答案:B
解析:A、氢氧化钠溶于水温度升高,会使瓶内的压强增大,故错误;B、硝酸铵固体溶于水吸收热量,温度降低,使瓶内的压强降低,故正确;C、氧化钙和水反应,放出大量的热,水温度升高,会使瓶内的压强增大,故错误;D、氯化钠固体溶于水无能量变化,温度不变,压强不变,故错误.故选B。
3.答案:A
解析:A、洗洁精是洗涤剂,有乳化作用,能将大的油滴分散成细小的油滴随水冲走,故选项是利用乳化作用。
B、用汽油洗去油污是利用汽油能溶解油污来达到目的,利用的是溶解原理,故选项不是利用乳化作用。
C、用自来水清洗手上的泥土,是利用水流把手上的泥土冲走,故选项不是利用乳化作用。
D、用食醋洗去热水瓶中的水垢是因为水垢的主要成分碳酸钙能和食醋反应,从而把水垢除去,故选项不是利用乳化作用。故选:A。
4.答案:A
解析:A、室温时,从100g饱和硝酸钾溶液中取出10g溶液,那么剩余的硝酸钾溶液还是饱和溶液,该选项说法正确;
B、仍然是饱和溶液,该选项说法不正确;
C、剩余的硝酸钾溶液中硝酸钾的质量减小了,该选项说法不正确;
D、剩余的硝酸钾溶液中硝酸钾和水的质量都减小,该选项说法不正确。
故选:A。
5.答案:(1)75g ;22.5g (2)32.1g
解析:溶质的质量分数为15%的蔗糖溶液150g,蔗糖的质量为150×15%=22.5,将溶质的质量分数降低到10%的溶液质量为22.5÷10%=225g应加水225-150=75;将质量分数增加到30%,设需增加的蔗糖为X,则(22.5+X)/(150+X)=30%,需增加的蔗糖32.1g。
6.答案:A
解析:溶液稀释前后溶质的质量不变。故选A。
7.答案:C
解析:先计算出需氢氧化钠的质量和所需水的体积,用托盘天平称量出溶质加入烧杯内,再用量筒量取水倒入烧杯内,用玻璃棒搅拌至氢氧化钠完全溶解。故选C。
答案:(1)6 (2)④②①⑤③;搅拌(加速溶解)
(3)减少氯化钠的质量(4) ABD
解析:(1)配制该溶液需要食盐的质量为
(2)配制溶液的操作顺序为取食盐、称量、倒入烧杯中(食盐和水),溶解,故顺序为④②①⑤③,玻璃棒的作用搅拌(加速溶解)。
(3)若步骤B 称量时出现了指针偏左,说明食盐加多了,应进行的操作是取下少量的食盐。
(4)A、所用的氯化钠固体中含有杂质会导致氯化钠偏少,会导致配制的氯化钠溶液溶质质量分数小于12%,故A正确;
B、量取水时,仰视读数会导致水多,会导致配制的氯化钠溶液溶质质量分数小于12%,故B正确;
C、将水倒入烧杯时,有少量水溅出会导致水少,溶质质量分数偏大,故C不正确;
D、将氯化钠固体倒入烧杯时,还有部分氯化钠固体粘在纸上会导致盐少,会导致配制的氯化钠溶液溶质质量分数小于12%,故D正确。
故选ABD。
【单元对接中考】
1.答案:A
【详解】A、硝酸铵溶解在水中时吸热,溶液温度降低,符合题意;
B、氧化钙和水反应生成氢氧化钙,放热,溶液温度升高,不符合题意;
C、氯化钠溶解在水中时无明显吸放热,溶液温度不变,不符合题意;
D、氢氧化钠溶解在水中时放热,溶液温度升高,不符合题意;
故选A。
2.答案:A
【详解】A、由同一种物质组成的是纯净物,组成中含有不同种元素的纯净物是化合物,纯浄物与化合物属于包含关系,故A符合题意;
B、某物质的饱和溶液不一定是浓溶液,浓溶液也不一定是饱和溶液,不饱和溶液不一定是稀溶液,而稀溶液也不一定是不饱和溶液,即饱和溶液与浓溶液属于交叉关系,故B不符合题意;
C、分解反应的定义:由一种分解生成两种或两种以上物质的反应;化合反应的定义:由两种或两种以上的物质反应生成一种物质的反应,分解反应与化合反应都属于基本反应类型,二者属于并列关系,故C不符合题意;
D、糖类和油脂不属于同一种物质类别,二者属于并列关系,故D不符合题意;
故选A。
3.答案:B
【详解】A、乙和丙烧杯中的氯化钠溶液有未溶溶质,故一定是饱和溶液,选项正确;
B、丁烧杯加水后,烧杯没有未溶氯化钠,故无法判断是否饱和,选项错误;
C、乙→丙的过程中,由于都是该温度下的饱和溶液,溶解度不变,故烧杯中溶质质量分数不变,选项正确;
D、丁→戊的过程中,由于加入了20g水,因此烧杯中溶液质量增加,选项正确;
故选:B。
4.答案:D
【详解】A.溶液的饱和、不饱和与溶液的浓、稀没有必然的联系,即饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故A错误;
B.在相同温度下,同种溶剂、同种溶质的饱和溶液比其不饱和溶液的浓度大,其他情况不一定,故B错误;
C.同种溶质的饱和溶液,温度不同,不一定比其不饱和溶液的浓度大,故C错误;
D.同温下,同种溶质的饱和溶液,一定比其不饱和溶液浓度大,故D正确。
故选:D。
5.答案:B
【详解】①溶质质量=溶液质量×溶质的质量分数,配制50g质量分数为14%的氯化钠溶液,需氯化钠的质量=50g×14%=7.0g,①说法正确;
②溶剂质量=溶液质量-溶质质量,所需溶剂的质量为50g-7g=43g(合43mL),应用规格为50mL的量筒量取水的体积,②说法错误;
③配制50g质量分数为14%的氯化钠溶液,首先计算配制溶液所需氯化钠和水的质量,再称量所需的氯化钠和量取水,最后进行溶解、贴签装瓶;在这些操作中需要的仪器:托盘天平、药匙、量筒、烧杯和玻璃棒,其中属于玻璃仪器的是烧杯、量筒、玻璃棒和试剂瓶。③说法正确;
④用量筒量取水时,俯视液面,读数比实际液体体积大,会造成实际量取的水的体积偏小,则使溶质质量分数偏大。④说法错误。故②④说法错误。
综上所述:选择B。
6.答案:(3)乳化
【详解】(3)用洗洁精除去油污,是由于洗洁精对油污有乳化作用,能将大的油滴分散成细小的油滴随水冲走,故填:乳化。
7.答案:(1)烧杯
(2)50 Na+、Cl-、H2O
(3)10%
【详解】(1)用固体配制一定溶质质量分数的溶液,实验步骤及所需仪器为:计算、称量(托盘天平、药匙)、量取(量筒、胶头滴管)、溶解(烧杯、玻璃棒)、装瓶贴标签,故上图中缺少一种必须用到的玻璃仪器,它是烧杯;
(2)需要氯化钠的质量为:;
氯化钠溶液中含钠离子、氯离子、水分子,离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,多个离子,就是在元素符号前面加上相应的数字;故钠离子、氯离子表示为:Na+、Cl-,分子用化学式表示,故水分子表示为:H2O;
(3)溶液具有均一性,配制好的氯化钠溶液取用一半后,剩余溶液中溶质的质量分数是10%。
8.答案:(1) 烧杯 量筒 搅拌、加速溶解
(2)④②①⑤③
(3) 82 100
(4) 砝码和氯化钠的位置放反了 12g 12.8%
(5) 量取水时俯视读数(合理即可) 往烧杯中加水时,水溅出
【详解】(1)上图中的玻璃仪器有:广口瓶、烧杯、量筒、玻璃棒;
溶解时,玻璃棒的作用是:搅拌、加速溶解;
(2)用固体配制一定溶质质量分数的溶液,实验步骤为:计算、称量、量取、溶解、装瓶贴标签,故顺序为:④②①⑤③;
(3)所需氯化钠的质量为:100g×18%=18g,所需水的质量为:100g-18g=82g,即82mL;
量筒量程的选择,应遵循“大而近”的原则,故应选择100mL的量筒量取所需的水;
(4)用托盘天平称量物品时,应遵循“左物右码”的原则,图②中错误是砝码和氯化钠的位置放反了;
左盘质量=右盘质量+游码质量,故实际称取氯化钠的质量为:10g+5g-3g=12g;
如果配制的其余操作准确规范,则实际所得溶液溶质质量分数为:;
(5)如果量取水时俯视读数,读取数值大于实际数值,会导致量取水的体积偏小,则配制的溶液的溶质质量分数大于18%;如果往烧杯中加水时,水溅出,会导致溶剂质量减小,溶质质量分数偏大。
2
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
