3.2水的电离和溶液的PH 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2水的电离和溶液的PH 同步练习题 (含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 147.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-06 21:03:59 | ||
图片预览


文档简介
3.2水的电离和溶液的PH同步练习题
一、选择题
1.如图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。如果刻度A和D都是4,则两处液面的读数是
A.Ⅰ中是3.20 mL,Ⅱ中是5.40 mL
B.Ⅰ中是3.2 mL, Ⅱ中是5.40mL
C.Ⅰ中是3.2 mL, Ⅱ中是4.60 mL
D.Ⅰ中是3.2 mL, Ⅱ中是4.6 mL
2.下列实验操作不会引起误差的是
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
3.下列选用的相关仪器符合实验要求的是
A B C D
分离水和乙酸乙酯 实验室存放浓硝酸 准确量取9.50mLNaOH溶液 实验室制取乙烯
A.A B.B C.C D.D
4.水是生命之源,生产生活都离不开水。下列有关说法正确的是
A.水是一种非电解质 B.水的电离是放热过程
C.纯水的pH一定等于7 D.纯水中c(H+)=c(OH-)
5.下列关于酸碱中和滴定实验的说法错误的是
A.指示剂变色点必须在滴定突跃范围内
B.酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
C.若装标准溶液的滴定管在滴定前尖嘴处有气泡,则测得结果不可靠
D.滴定管用蒸馏水洗净后,不能使用高温烘箱进行快速烘干
6.用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时
A.醋酸和氢氧化钠物质的量相等 B.醋酸和氢氧化钠恰好中和
C.氢氧化钠过量 D.醋酸有剩余
7.一些食物的近似如下:其中显碱性的是
A.苹果汁: B.葡萄汁:
C.牛奶: D.鸡蛋清:
8.根据生活经验,判断下列物质按碱性减弱顺序排列的是
A.厨房洗洁净、肥皂、食用白醋、厕所洁厕精、食盐
B.厨房洗洁净、肥皂、食盐、食用白醋、厕所洁厕精
C.厨房洗洁净、肥皂、食用白醋、食盐、厕所洁厕精
D.厕所洁厕精、肥皂、食用白醋、厨房洗洁净、食盐
二、非选择题
9.水是生命的源泉,水溶液中的离子平衡与我们的生产生活密切相关。
(1)25℃时,pH为2的硫酸溶液与pH为12的氢氧化钠溶液,由水电离出的c(OH-)之比为___________。
(2)t℃时,测得纯水中c(OH-)=1×10-7mol/L,则t___________25℃(填“>”“<”或“=”),该温度下,0.5mol/L Ba(OH)2溶液的pH=___________。
(3)25℃时,pH=a的某强酸和pH=b的某强碱按体积比1:100混合后,溶液恰呈中性,则a+b=___________。
(4)现有以下五种电解质溶液,回答下列问题:
①CH3COOH ②NaOH ③NH3·H2O ④H2SO4 ⑤CH3COONa
①浓度均为0.1mol·L-1的五种溶液中导电能力最强的是___________(填序号)。
②浓度均为0.1mol·L-1的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为___________(填序号)。
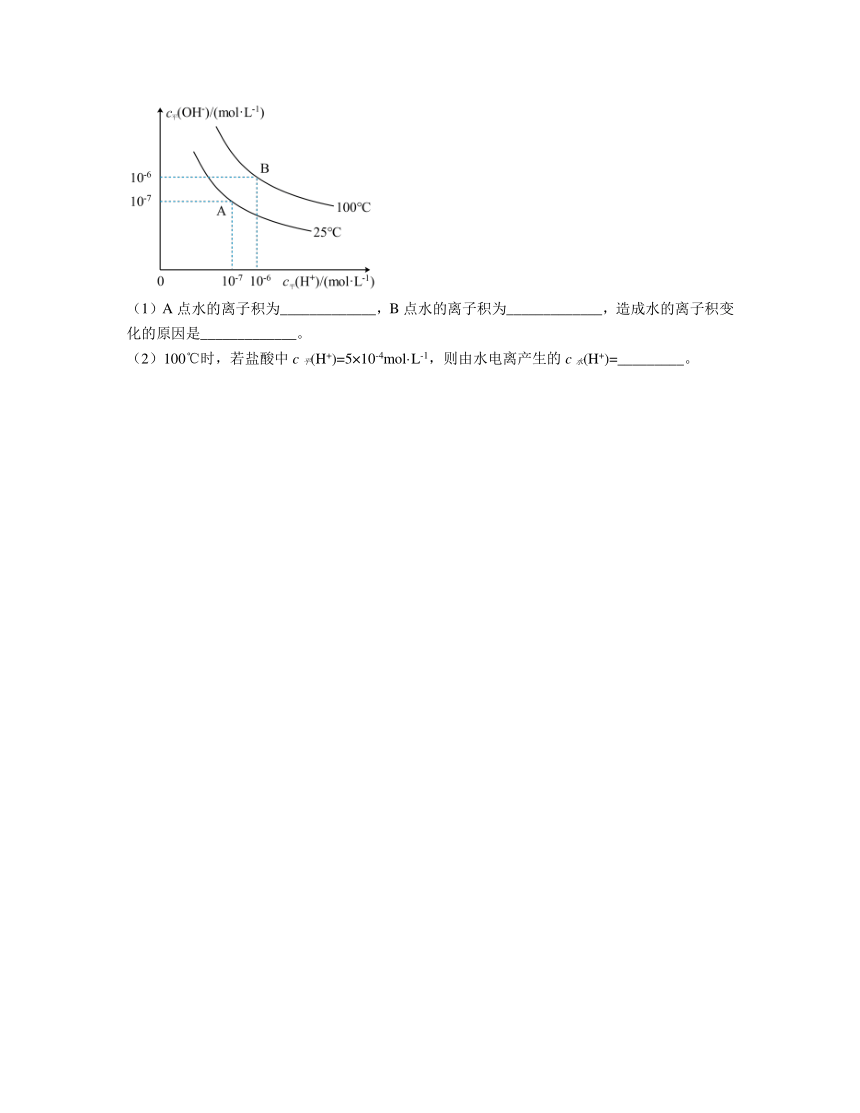
10.一定条件下,在水的电离平衡中,c平(H+)和c平(OH-)的关系如图所示:
(1)A点水的离子积为_____________,B点水的离子积为_____________,造成水的离子积变化的原因是_____________。
(2)100℃时,若盐酸中c平(H+)=5×10-4mol·L-1,则由水电离产生的c水(H+)=_________。
【参考答案】
一、选择题
1.C
解析:量筒的小刻度在下,大刻度在上,精确度为0.1mL,故Ⅰ中是3.2mL;滴定管的小刻度在上,大刻度在下,精确度为0.01mL,故Ⅱ中是4.60mL,故选C。
2.C
【分析】用公式c(待测)=分析误差,主要是对标准液所用体积的影响进行分析。
解析:A.锥形瓶用蒸馏水洗后,不能用待测润洗,否则待测液的物质的量增加,滴定时标准液所用体积增加,导致测定结果偏大,A项错误;
B.酸碱中和滴定时,滴定管水洗后,直接盛装标准液,标准液的浓度会稀释而降低,为达到终点将待测液反应完毕,滴定时标准液所用体积增加,导致测定结果偏大,故需要先用标准液润洗滴定管,然后再盛装标准溶液,B项错误;
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,由于反应产物为NaCl,滴定终点时溶液呈中性,因此指示剂即可选酚酞,也可以选甲基橙,C项正确;
D.滴定终点时酸式滴定管尖嘴部分有气泡,开始实验时无气泡,可以理解成滴定终点时气泡将使滴定管里的液面上升,标准液的体积减小,导致测定浓度偏低,D项错误;
答案选C。
【点睛】本题考查酸碱中和滴定误差的判断,根据公式c(待测)=进行中和滴定的误差分析是最基本的方法,使用中应注意由于操作的失误导致公式中的某些数据发生变化,从而导致最终结果出现误差。
3.A
解析:A.乙酸乙酯不溶于水,分层,可用分液漏斗进行分液,A正确;
B.浓硝酸见光分解,用棕色试剂瓶,有强氧化性,能氧化橡胶塞,需用玻璃塞,B错误;
C.NaOH应该使用碱式滴定管,而图示为酸式滴定管,C错误;
D.实验室用加热浓硫酸至170°C的方法制取乙烯,温度计量程为100℃无法测量和控制反应温度,D错误;
答案选A。
4.D
解析:A.水是一种极弱的电解质,故A错误;
B.水的电离过程是水分子共价键被破坏的断键过程,断键吸热,则水的电离是吸热过程,故B错误;
C.常温下,纯水的pH等于7,100℃时,纯水的pH等于6,故C错误;
D.纯水为中性,则c(H+)=c(OH-),故D正确;
答案选D。
5.B
解析:A.为了及时判断滴定终点,指示剂变色点必须在滴定突跃范围内,A正确;
B.若用待测液润洗锥形瓶,会造成待测液物质的量偏大,测得的浓度偏高,实验误差变大,B错误;
C.若装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失,会使最终测得的待测液浓度偏高,结果不可靠,C正确;
D.滴定管用蒸馏水洗净后,不能使用高温烘箱进行快速烘干,否则会使滴定管刻度不准确,D正确;
答案选B。
6.D
解析:试题分析:当醋酸和氢氧化钠完全中和时发生反应CH3COOH+NaOH===CH3COONa+H2O,此时溶质为CH3COONa溶液呈碱性,若中和后pH为7,加碱量不足,溶质为CH3COONa和CH3COOH,因此答案选D。
考点:考查酸碱中和滴定的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
7.D
解析:常温下>7显碱性,鸡蛋清的在,所以鸡蛋清显碱性,故答案为D
8.B
解析:厨房洗洁净和肥皂均为碱性,但是由于肥皂会长时间接触皮肤,故碱性应弱于厨房洗洁净,食盐为中性,白醋和厕所洁厕精为酸性,为使厕所保持清洁,洁厕精为强酸性,故B选项正确。
二、非选择题
9.(1)1:1
(2) = 14
(3)12
(4) ④ ①②④
解析:(1)硫酸溶液是强酸,抑制水的电离,pH为2的硫酸溶液由水电离出的c(OH-)=1×10-12 mol/L;氢氧化钠溶液是强碱,抑制水的电离,pH为12的氢氧化钠溶液由水电离出的c(OH-)=1×10-12 mol/L,二者的比为1:1;
(2)纯水中c(OH-)=c(H+)=1×10-7mol/L,则水的离子积常数Kw= c(OH-)·c(H+)=1×10-14,说明此时温度t=25℃;该温度下,0.5mol/L Ba(OH)2溶液中,c(OH-)=1 mol/L,则c(H+)==1×10-14,则pH=-lgc(H+)=14;
(3)25℃时,pH=a的某强酸,c(H+)=1×10-amol/L,pH=b的某强碱,c(OH-)=1×10b-14mol/L,按体积比1:100混合后,溶液恰呈中性,即1×10-a=100×10b-14,则a+b=12;
(4)离子浓度越大,离子所带的电荷越高,溶液的导电能力越强,①CH3COOH和③NH3·H2O均为弱电解质,部分电离,②NaOH、④H2SO4、⑤CH3COONa为强电解质完全电离,H2SO4电离出3个离子,且硫酸根带两个单位负电荷,故浓度均为0.1mol/L的五种溶液中导电能力最强的是:④H2SO4;0.1mol/LCH3COOH为弱酸,部分电离,c(H+)<0.1 mol/L,0.1mol/LNaOH强碱,完全电离,溶液中c(OH-)=0.1 mol/L,0.1mol/L H2SO4强酸,完全电离,溶液中c(H+)=0.2 mol/L三者均抑制水的电离且H+或者OH-离子浓度越大,抑制程度越大,由水电离出的氢离子浓度越小,故浓度均为0.1mol/L的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为:①②④。
10. 1×10-14mol2·L-2 1×10-12mol2·L-2 水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大 2×10-9mol·L-1
解析:(1)由A点的H+、OH-的浓度可得Kw=c平(H+)·c平(OH-)=1×10-14mol2·L-2,同理可知B点的Kw=c平(H+)·c平(OH-)=1×10-12mol2·L-2,水的离子积变大的原因是水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大;
(2)若盐酸中c平(H+)=5×10-4mol·L-1,则c水(H+)=c平(OH-)==2×10-9mol·L-1
一、选择题
1.如图,图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,图II表示50mL滴定管中液面的位置,D与E刻度间相差1 mL。如果刻度A和D都是4,则两处液面的读数是
A.Ⅰ中是3.20 mL,Ⅱ中是5.40 mL
B.Ⅰ中是3.2 mL, Ⅱ中是5.40mL
C.Ⅰ中是3.2 mL, Ⅱ中是4.60 mL
D.Ⅰ中是3.2 mL, Ⅱ中是4.6 mL
2.下列实验操作不会引起误差的是
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
3.下列选用的相关仪器符合实验要求的是
A B C D
分离水和乙酸乙酯 实验室存放浓硝酸 准确量取9.50mLNaOH溶液 实验室制取乙烯
A.A B.B C.C D.D
4.水是生命之源,生产生活都离不开水。下列有关说法正确的是
A.水是一种非电解质 B.水的电离是放热过程
C.纯水的pH一定等于7 D.纯水中c(H+)=c(OH-)
5.下列关于酸碱中和滴定实验的说法错误的是
A.指示剂变色点必须在滴定突跃范围内
B.酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
C.若装标准溶液的滴定管在滴定前尖嘴处有气泡,则测得结果不可靠
D.滴定管用蒸馏水洗净后,不能使用高温烘箱进行快速烘干
6.用标准氢氧化钠溶液中和醋酸溶液,当溶液的pH值等于7,则此时
A.醋酸和氢氧化钠物质的量相等 B.醋酸和氢氧化钠恰好中和
C.氢氧化钠过量 D.醋酸有剩余
7.一些食物的近似如下:其中显碱性的是
A.苹果汁: B.葡萄汁:
C.牛奶: D.鸡蛋清:
8.根据生活经验,判断下列物质按碱性减弱顺序排列的是
A.厨房洗洁净、肥皂、食用白醋、厕所洁厕精、食盐
B.厨房洗洁净、肥皂、食盐、食用白醋、厕所洁厕精
C.厨房洗洁净、肥皂、食用白醋、食盐、厕所洁厕精
D.厕所洁厕精、肥皂、食用白醋、厨房洗洁净、食盐
二、非选择题
9.水是生命的源泉,水溶液中的离子平衡与我们的生产生活密切相关。
(1)25℃时,pH为2的硫酸溶液与pH为12的氢氧化钠溶液,由水电离出的c(OH-)之比为___________。
(2)t℃时,测得纯水中c(OH-)=1×10-7mol/L,则t___________25℃(填“>”“<”或“=”),该温度下,0.5mol/L Ba(OH)2溶液的pH=___________。
(3)25℃时,pH=a的某强酸和pH=b的某强碱按体积比1:100混合后,溶液恰呈中性,则a+b=___________。
(4)现有以下五种电解质溶液,回答下列问题:
①CH3COOH ②NaOH ③NH3·H2O ④H2SO4 ⑤CH3COONa
①浓度均为0.1mol·L-1的五种溶液中导电能力最强的是___________(填序号)。
②浓度均为0.1mol·L-1的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为___________(填序号)。
10.一定条件下,在水的电离平衡中,c平(H+)和c平(OH-)的关系如图所示:
(1)A点水的离子积为_____________,B点水的离子积为_____________,造成水的离子积变化的原因是_____________。
(2)100℃时,若盐酸中c平(H+)=5×10-4mol·L-1,则由水电离产生的c水(H+)=_________。
【参考答案】
一、选择题
1.C
解析:量筒的小刻度在下,大刻度在上,精确度为0.1mL,故Ⅰ中是3.2mL;滴定管的小刻度在上,大刻度在下,精确度为0.01mL,故Ⅱ中是4.60mL,故选C。
2.C
【分析】用公式c(待测)=分析误差,主要是对标准液所用体积的影响进行分析。
解析:A.锥形瓶用蒸馏水洗后,不能用待测润洗,否则待测液的物质的量增加,滴定时标准液所用体积增加,导致测定结果偏大,A项错误;
B.酸碱中和滴定时,滴定管水洗后,直接盛装标准液,标准液的浓度会稀释而降低,为达到终点将待测液反应完毕,滴定时标准液所用体积增加,导致测定结果偏大,故需要先用标准液润洗滴定管,然后再盛装标准溶液,B项错误;
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,由于反应产物为NaCl,滴定终点时溶液呈中性,因此指示剂即可选酚酞,也可以选甲基橙,C项正确;
D.滴定终点时酸式滴定管尖嘴部分有气泡,开始实验时无气泡,可以理解成滴定终点时气泡将使滴定管里的液面上升,标准液的体积减小,导致测定浓度偏低,D项错误;
答案选C。
【点睛】本题考查酸碱中和滴定误差的判断,根据公式c(待测)=进行中和滴定的误差分析是最基本的方法,使用中应注意由于操作的失误导致公式中的某些数据发生变化,从而导致最终结果出现误差。
3.A
解析:A.乙酸乙酯不溶于水,分层,可用分液漏斗进行分液,A正确;
B.浓硝酸见光分解,用棕色试剂瓶,有强氧化性,能氧化橡胶塞,需用玻璃塞,B错误;
C.NaOH应该使用碱式滴定管,而图示为酸式滴定管,C错误;
D.实验室用加热浓硫酸至170°C的方法制取乙烯,温度计量程为100℃无法测量和控制反应温度,D错误;
答案选A。
4.D
解析:A.水是一种极弱的电解质,故A错误;
B.水的电离过程是水分子共价键被破坏的断键过程,断键吸热,则水的电离是吸热过程,故B错误;
C.常温下,纯水的pH等于7,100℃时,纯水的pH等于6,故C错误;
D.纯水为中性,则c(H+)=c(OH-),故D正确;
答案选D。
5.B
解析:A.为了及时判断滴定终点,指示剂变色点必须在滴定突跃范围内,A正确;
B.若用待测液润洗锥形瓶,会造成待测液物质的量偏大,测得的浓度偏高,实验误差变大,B错误;
C.若装标准溶液的滴定管在滴定前尖嘴处有气泡,滴定后气泡消失,会使最终测得的待测液浓度偏高,结果不可靠,C正确;
D.滴定管用蒸馏水洗净后,不能使用高温烘箱进行快速烘干,否则会使滴定管刻度不准确,D正确;
答案选B。
6.D
解析:试题分析:当醋酸和氢氧化钠完全中和时发生反应CH3COOH+NaOH===CH3COONa+H2O,此时溶质为CH3COONa溶液呈碱性,若中和后pH为7,加碱量不足,溶质为CH3COONa和CH3COOH,因此答案选D。
考点:考查酸碱中和滴定的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
7.D
解析:常温下>7显碱性,鸡蛋清的在,所以鸡蛋清显碱性,故答案为D
8.B
解析:厨房洗洁净和肥皂均为碱性,但是由于肥皂会长时间接触皮肤,故碱性应弱于厨房洗洁净,食盐为中性,白醋和厕所洁厕精为酸性,为使厕所保持清洁,洁厕精为强酸性,故B选项正确。
二、非选择题
9.(1)1:1
(2) = 14
(3)12
(4) ④ ①②④
解析:(1)硫酸溶液是强酸,抑制水的电离,pH为2的硫酸溶液由水电离出的c(OH-)=1×10-12 mol/L;氢氧化钠溶液是强碱,抑制水的电离,pH为12的氢氧化钠溶液由水电离出的c(OH-)=1×10-12 mol/L,二者的比为1:1;
(2)纯水中c(OH-)=c(H+)=1×10-7mol/L,则水的离子积常数Kw= c(OH-)·c(H+)=1×10-14,说明此时温度t=25℃;该温度下,0.5mol/L Ba(OH)2溶液中,c(OH-)=1 mol/L,则c(H+)==1×10-14,则pH=-lgc(H+)=14;
(3)25℃时,pH=a的某强酸,c(H+)=1×10-amol/L,pH=b的某强碱,c(OH-)=1×10b-14mol/L,按体积比1:100混合后,溶液恰呈中性,即1×10-a=100×10b-14,则a+b=12;
(4)离子浓度越大,离子所带的电荷越高,溶液的导电能力越强,①CH3COOH和③NH3·H2O均为弱电解质,部分电离,②NaOH、④H2SO4、⑤CH3COONa为强电解质完全电离,H2SO4电离出3个离子,且硫酸根带两个单位负电荷,故浓度均为0.1mol/L的五种溶液中导电能力最强的是:④H2SO4;0.1mol/LCH3COOH为弱酸,部分电离,c(H+)<0.1 mol/L,0.1mol/LNaOH强碱,完全电离,溶液中c(OH-)=0.1 mol/L,0.1mol/L H2SO4强酸,完全电离,溶液中c(H+)=0.2 mol/L三者均抑制水的电离且H+或者OH-离子浓度越大,抑制程度越大,由水电离出的氢离子浓度越小,故浓度均为0.1mol/L的①②④三种溶液中由水电离出的氢离子浓度由大到小的排列顺序为:①②④。
10. 1×10-14mol2·L-2 1×10-12mol2·L-2 水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大 2×10-9mol·L-1
解析:(1)由A点的H+、OH-的浓度可得Kw=c平(H+)·c平(OH-)=1×10-14mol2·L-2,同理可知B点的Kw=c平(H+)·c平(OH-)=1×10-12mol2·L-2,水的离子积变大的原因是水的电离为吸热过程,温度升高,水的电离平衡正向移动,Kw增大;
(2)若盐酸中c平(H+)=5×10-4mol·L-1,则c水(H+)=c平(OH-)==2×10-9mol·L-1
