3.1.3氧化还原反应 课件(共35张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 3.1.3氧化还原反应 课件(共35张PPT) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-06 21:24:38 | ||
图片预览








文档简介
(共35张PPT)
第1课时 氧化还原反应
复习旧课
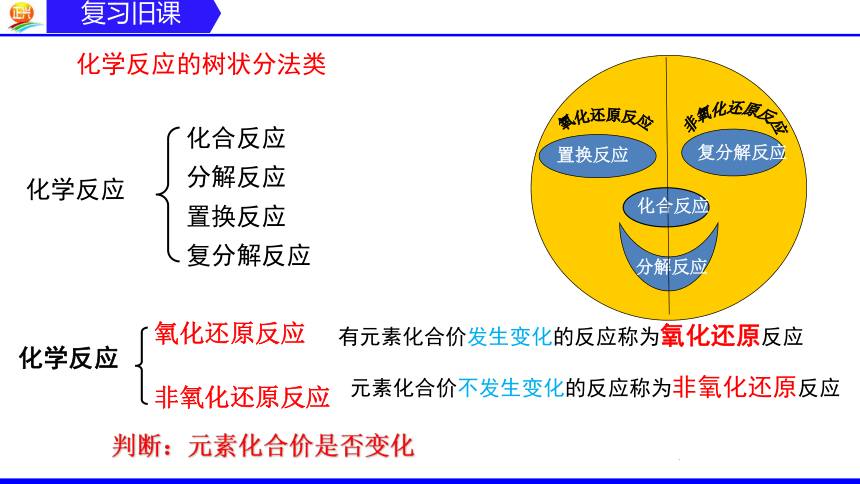
化学反应的树状分法类
化学反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
化学反应
判断:元素化合价是否变化
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
有元素化合价发生变化的反应称为氧化还原反应
元素化合价不发生变化的反应称为非氧化还原反应
预习检测
【思考1】 从化合价变化角度判断以下反应是不是氧化还原反应?
⑤Na2SO4+BaCl2===2NaCl+BaSO4↓
⑥H2O2+H2S===S↓+2H2O
(1)既是氧化还原反应又是化合反应的为_______(填序号,下同)。
(2)属于非氧化还原反应的为______。
(3)不属于四种基本反应类型的为______。(4)属于置换反应的为______。
①②
⑤
⑥
③
火箭产生的巨大推力来自氧化还原反应
刚削好的苹果
放置30分钟
后的苹果
刚泡好的绿茶
放置2小时
后的绿茶
金属生锈
新课引入
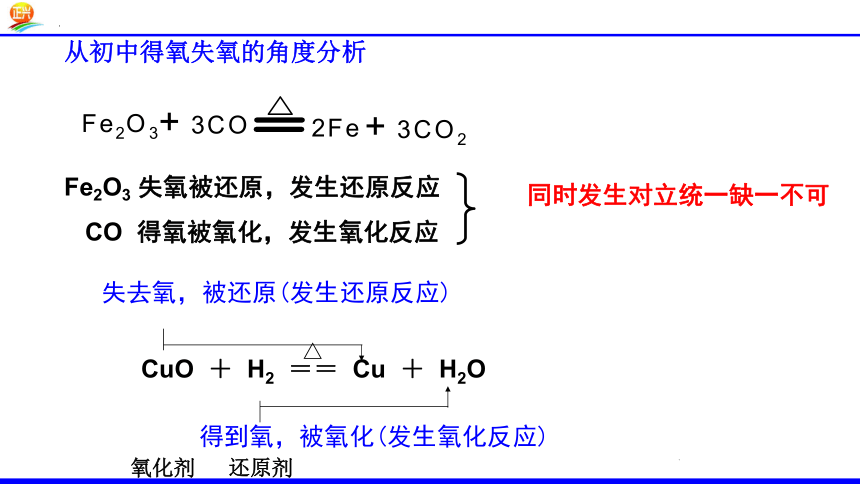
从初中得氧失氧的角度分析
Fe2O3 失氧被还原,发生还原反应
CO 得氧被氧化,发生氧化反应
同时发生对立统一缺一不可
得到氧,被氧化(发生氧化反应)
△
CuO + H2 == Cu + H2O
失去氧,被还原(发生还原反应)
还原剂
氧化剂
+3
+2
0
+4
Fe2O3 + 3 CO === 2Fe + 3CO2
高温
+2
0
0
+1
化合价升高 (得氧) 被氧化(氧化反应)
△
CuO + H2 === Cu + H2O
化合价降低(失氧) 被还原(还原反应)
化合价升高 (得氧) 被氧化(氧化反应)
化合价降低(失氧) 被还原(还原反应)
还原剂
氧化剂
还原剂
氧化剂
新课导入
【判断】 从化合价变化角度判断以下反应是不是氧化还原反应,并分析化合价的变化。
深度思考
完成下列填空,巩固基本概念。
(1)C+H2O(g) CO+H2中发生氧化反应的物质是____,被还原的元素是____,氧化剂:______,还原剂:____。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是_____,被还原的
元素是____,氧化产物:_____,还原产物:_____。
(3)2NaOH+Cl2===NaCl+NaClO+H2O中被氧化的元素是____,被还原的元素是_____,氧化剂是_____,还原剂是______,氧化产物是________,还原产物是_______。
(5)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
C
H
H2O
C
O
Cl
O2
KCl
Cl
Cl
Cl2
Cl2
NaClO
NaCl
(4)2H2S+SO2===3S↓+2H2O
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0
0
+1
-1
2e-
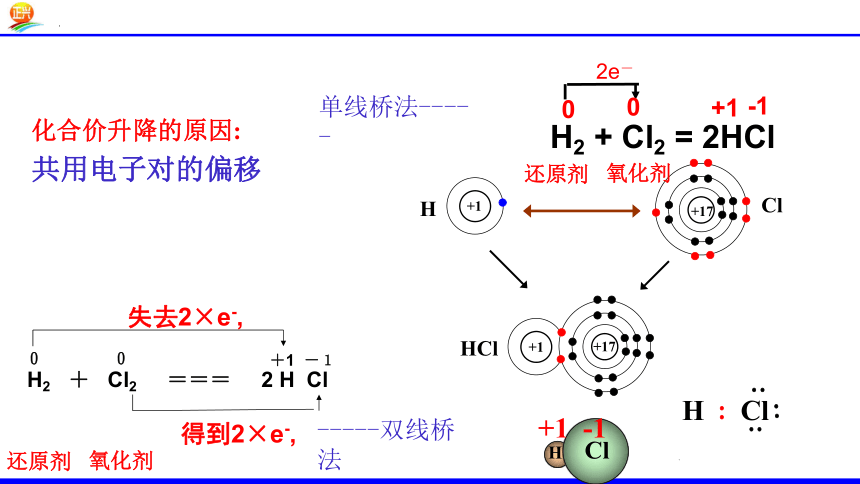
化合价升降的原因:
电子的得失
还原剂
氧化剂
2Na+Cl2 == 2Na Cl
0
0
+1 -1
失去2×e-,
得到2×e-,
还原剂
氧化剂
【思考1】元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
单线桥法-----
【思考2】在化学反应种如何表示电子的得失?
-----双线桥法
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价升降的原因:
共用电子对的偏移
H2 + Cl2 = 2HCl
0
0
+1
-1
2e-
还原剂
氧化剂
H2 + Cl2 === 2 H Cl
0
0
+1 -1
失去2×e-,
得到2×e-,
还原剂
氧化剂
单线桥法-----
-----双线桥法
课堂小结
失电子
化合价升高
被氧化
得电子
化合价降低
被还原
(本质判据)
( 特征判据)
氧化反应(还原剂)
还原反应(氧化剂)
即:氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
氧化还原反应
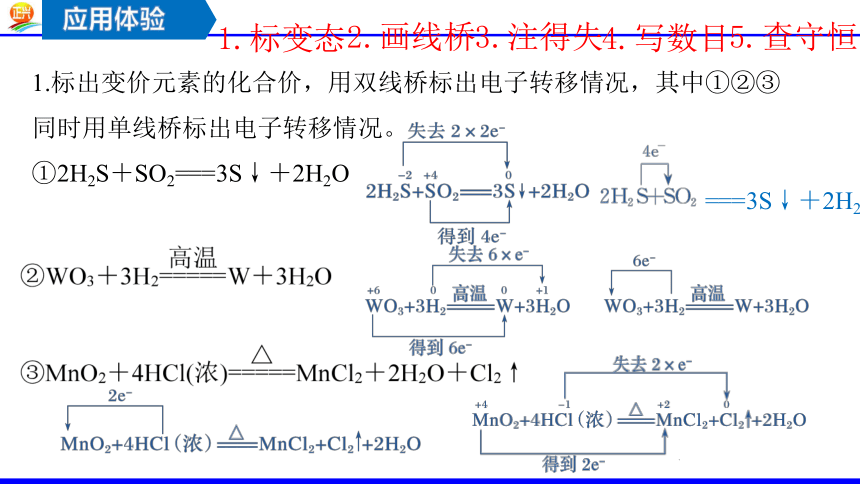
1.标出变价元素的化合价,用双线桥标出电子转移情况,其中①②③同时用单线桥标出电子转移情况。
①2H2S+SO2===3S↓+2H2O
应用体验
===3S↓+2H2O
1.标变态
2.画线桥
3.注得失
4.写数目
5.查守恒
应用体验
④Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
答案
⑤Cl2+2NaOH===NaCl+NaClO+H2O
答案
课堂总结
概念
氧化还原反应
电子转移表示方式
双线桥法
单线桥法
特征:有元素发生化合价改变
本质:电子的转移(得失或偏移)
相关概念
还原剂——失去电子——化合价升高——被氧化——发生氧化反应
氧化剂——得到电子——化合价降低——被还原——发生还原反应
2Na + Cl2 = 2NaCl
0
0
2e-
2Na+Cl2 == 2Na Cl
0
0
+1 -1
失去2×e-,
得到2×e-,
第2课时 氧化还原反应
练一练.用双线桥法标明电子得失,并指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
① CuO + CO Cu + CO2
③ Cu + 2H2SO4 (浓) CuSO4 + SO2↑+2H2O
1.标变态
2.画线桥
3.注得失
4.写数目
5.查守恒
复习旧课
② MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
失去2e-
得到2e-
失去2 × e-
得到2e-
失去2e-
得到2e-
(发生还原反应)
(氧化反应)
还原剂
还原剂
氧化剂
氧化产物
还原产物
一、基本概念
氧化产物:还原剂失电子被氧化对应生成物
还原产物:氧化剂得电子被还原对应生成物
氧化剂:得到电子(或电子对偏向)的反应物,表现氧化性,具有氧化能力。得电子能力越强,氧化性就越强,发生还原反应,本身被还原。
还原剂:失去电子(或电子对偏离)的反应物,表现还原性,具有还原能力。失电子能力越强,还原性就越强,发生氧化反应,本身被氧化,
新课讲授
同一氧化还原反应中
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
应用体验
【例3】.分析下列反应并按要求填空。
氧化剂是______(填化学式,下同),还原剂是____;发生氧化反应的是_____,发生还原反应的是_____。
氧化剂是________,还原剂是________;被氧化的元素是___(填元素符号,下同),被还原的元素是_____。
Cl2
Fe
Fe
Cl2
KMnO4
KMnO4
O
Mn
(3)H2O2+2HCl+2FeCl2===2FeCl3+2H2O
氧化剂是________,还原剂是_______;氧化产物是_______,还原产物是___。
(4)5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
氧化剂是________,还原剂是______;氧化产物是_____,还原产物是____。
H2O2
FeCl2
FeCl3
H2O
KMnO4
H2O2
O2
MnSO4
课堂小结
氧化性:物质 电子的性质,氧化剂具有 。
还原性:物质 电子的性质,还原剂具有 。
得到
失去
氧化性
还原性
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化性
还原反应
还原产物
氧化性
氧化性
还原性
还原性
核心元素化合价 实例 性质
最高价 只有_______
中间价 既有 又有______
最低价 H2 Na2S 只有_______
元素价态与氧化性还原性的关系
二、氧化性、还原性强弱比较
特别提示:
氧化性、还原性的强弱取决于物质得失电子的难易程度而与得失电子数目的多少无关。
1. 根据氧化还原反应方程式判断
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
化合价降低,得ne-,被还原
化合价升高,失ne-,被氧化
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
【例1】.已知常温下在溶液中可发生如下两个离子反应:
① Ce4++Fe2+ == Fe3++Ce3+
② Sn2++2Fe3+== 2Fe2++Sn4+
由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是_______
Sn2+>Fe2+>Ce3+
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
在金属活动性顺序表中,金属的位置越靠前,其还原性就越强;金属的位置越靠后,其阳离子的氧化性就越强。
2.根据金属活动性顺序表
(2)氧化性、还原性强弱的判断
还原性逐渐增强
氧化性逐渐增强
【例】多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含FeCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是
A.Fe B.H2 C.Mg D.不能确定
√
【例1】已知下列反应:
①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2
③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是_______________
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是________________。
S2->I->Br->Cl-
Cl2>Br2>I2>S
应用体验
【例2】.①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②SO2+Br2+2H2O===H2SO4+2HBr③Cl2+2NaBr===Br2+2NaCl
由此推断下列说法错误的是
A.反应Cl2+SO2+2H2O===H2SO4+2HCl可以进行
B.氯元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是KMnO4、Cl2、Br2、SO2
D.MnCl2是KMnO4的氧化产物
√
氧化还原反应的4种常见类型
1、自身氧化还原反应
2、歧化反应
NH4NO3 ==== 2H2O + N2O↑
2KClO3 2KCl+3O2
Cl2 + 2NaOH === NaCl + NaClO +H2O
3NO2 + H2O === 2HNO3 + NO↑
3、归中反应
4、部分氧化还原反应
① SO2+2H2S=3S↓+2H2O ② H2S + 3H2SO4(浓) = 4SO2+4H2O
③ 2Fe3++Fe=3Fe2+
Cu + 4HNO3(浓) == Cu(NO3)2 + NO2↑ + 2H2O
3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ + 4H2O MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
课堂总结
1.几个概念间的关系:
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
反应物
性 质
实 质
特征
反应产物
反应
二.氧化性、还原性强弱的判断
①根据氧化还原反应方程式判断
氧化性:氧化剂 > 氧化产物;还原性:还原剂 > 还原产物。
②根据金属活动性顺序表
第2课时 氧化还原反应
第3课时 氧化还原反应中的四种规律
复习旧课
1.几个概念间的关系:
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
反应物
性 质
实 质
特征
反应产物
反应
2.常见的氧化剂还原剂
①氧化剂: O2 、 Cl2 、 HNO3、 KMnO4 、KClO3、浓H2SO4等
②还原剂: Zn、Al、Fe 、 H2、C 、 SO2 、Na2S 、KI
3.氧化性、还原性强弱的判断
①根据氧化还原反应方程式判断
氧化性:氧化剂 > 氧化产物;还原性:还原剂 > 还原产物。
②根据金属活动性顺序表
1.标变态
化合价升降法
2.注升降
3.求总数
4.配系数
5.查守恒
0 +1 +3 0
化合价升高
化合价降低
得2e-
失3e-
一、氧化还原反应方程式的配平
Al+ H2SO4 Al2(SO4)3 + H2↑
×2
×3
2
3
3
1
新课讲授
NO+NH3 — N2+H2O
练一练:配平下列方程式:
NO2+ H2O — HNO3 + NO
二、氧化还原反应中的四种规律
1.电子守恒规律
还原剂失电子总数=氧化剂得电子总数
元素化合价降低总数=元素化合价升高总数。
(1)在一定条件下,PbO2与Cr3+反应,产物是 和Pb2+,则Cr3+与PbO2反应的化学计量数之比为______。
(2)已知Na2SO3溶液能与K2Cr2O7溶液发生氧化还原反应,且Na2SO3被氧化为Na2SO4,Na2SO3与K2Cr2O7反应的化学计量数之比为3∶1,则铬元素在还原产物中的化合价为_____价。
2∶3
+3
4.价态归中规律
同种元素不同价态之间发生氧化还原反应时只靠近,不交叉,相邻价态不反应。
【判断】下列化学方程式的双线桥正确的是?
√
√
(2)KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
A.+2 B.+3
C.+4 D.+5
√
【例3】(2022·吉林一中高一期中)已知还原性:SO2>I->Fe2+,下列离子反应不正确的是
B.I2+2Fe2+===2I-+2Fe3+
D.少量Cl2通入FeI2溶液中:Cl2+2I-===2Cl-+I2
√
【例2】
2.性质强弱规律
在一个氧化还原反应中,各物质的氧化还原性强弱为:
还原剂 + 氧化剂 === 氧化产物 + 还原产物
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
已知下列反应:
①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2
③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是_______________
S2->I->Br->Cl-
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是________________。
Cl2>Br2>I2>S
5.多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含FeCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是
A.Fe B.H2 C.Mg D.不能确定
√
因为氧化性:H+>Fe2+>Zn2+>Mg2
3.反应先后规律
多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;
多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化。
例如:把氯气通入FeBr2溶液时,还原性Fe2+>Br-,若氯气量不足时首先氧化Fe2+;
把氯气通入FeI2溶液时,还原性I->Fe2+,若氯气量不足时首先氧化 I-。
A.+1价 B.+2价 C.+3价 D.+4价
氧化剂
还原剂
氧化产物
2(6-n)
2
6
应用体验
【例1】
二、氧化还原反应的4大规律
1.电子守恒规律 还原剂失电子总数=氧化剂得电子总数
2.性质强弱规律
在一个氧化还原反应中,各物质的氧化还原性强弱为:
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
3.反应先后规律
多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;
多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化。
4.价态归中规律
同种元素不同价态之间发生氧化还原反应时只靠近,不交叉,相邻价态不反应。
一、氧化还原反应方程式的配平
1.标变态
2.注升降
3.求总数
4.配系数
5.查守恒
课堂总结
第1课时 氧化还原反应
复习旧课
化学反应的树状分法类
化学反应
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
化学反应
判断:元素化合价是否变化
置换反应
复分解反应
化合反应
分解反应
氧化还原反应
非氧化还原反应
有元素化合价发生变化的反应称为氧化还原反应
元素化合价不发生变化的反应称为非氧化还原反应
预习检测
【思考1】 从化合价变化角度判断以下反应是不是氧化还原反应?
⑤Na2SO4+BaCl2===2NaCl+BaSO4↓
⑥H2O2+H2S===S↓+2H2O
(1)既是氧化还原反应又是化合反应的为_______(填序号,下同)。
(2)属于非氧化还原反应的为______。
(3)不属于四种基本反应类型的为______。(4)属于置换反应的为______。
①②
⑤
⑥
③
火箭产生的巨大推力来自氧化还原反应
刚削好的苹果
放置30分钟
后的苹果
刚泡好的绿茶
放置2小时
后的绿茶
金属生锈
新课引入
从初中得氧失氧的角度分析
Fe2O3 失氧被还原,发生还原反应
CO 得氧被氧化,发生氧化反应
同时发生对立统一缺一不可
得到氧,被氧化(发生氧化反应)
△
CuO + H2 == Cu + H2O
失去氧,被还原(发生还原反应)
还原剂
氧化剂
+3
+2
0
+4
Fe2O3 + 3 CO === 2Fe + 3CO2
高温
+2
0
0
+1
化合价升高 (得氧) 被氧化(氧化反应)
△
CuO + H2 === Cu + H2O
化合价降低(失氧) 被还原(还原反应)
化合价升高 (得氧) 被氧化(氧化反应)
化合价降低(失氧) 被还原(还原反应)
还原剂
氧化剂
还原剂
氧化剂
新课导入
【判断】 从化合价变化角度判断以下反应是不是氧化还原反应,并分析化合价的变化。
深度思考
完成下列填空,巩固基本概念。
(1)C+H2O(g) CO+H2中发生氧化反应的物质是____,被还原的元素是____,氧化剂:______,还原剂:____。
(2)2KClO3 2KCl+3O2↑中被氧化的元素是_____,被还原的
元素是____,氧化产物:_____,还原产物:_____。
(3)2NaOH+Cl2===NaCl+NaClO+H2O中被氧化的元素是____,被还原的元素是_____,氧化剂是_____,还原剂是______,氧化产物是________,还原产物是_______。
(5)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
C
H
H2O
C
O
Cl
O2
KCl
Cl
Cl
Cl2
Cl2
NaClO
NaCl
(4)2H2S+SO2===3S↓+2H2O
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
0
0
+1
-1
2e-
化合价升降的原因:
电子的得失
还原剂
氧化剂
2Na+Cl2 == 2Na Cl
0
0
+1 -1
失去2×e-,
得到2×e-,
还原剂
氧化剂
【思考1】元素为什么会发生化合价变化?化合价的升降是什么原因引起的?
单线桥法-----
【思考2】在化学反应种如何表示电子的得失?
-----双线桥法
H Cl
+17
+1
+1
+17
H Cl
+1 -1
H
Cl
HCl
化合价升降的原因:
共用电子对的偏移
H2 + Cl2 = 2HCl
0
0
+1
-1
2e-
还原剂
氧化剂
H2 + Cl2 === 2 H Cl
0
0
+1 -1
失去2×e-,
得到2×e-,
还原剂
氧化剂
单线桥法-----
-----双线桥法
课堂小结
失电子
化合价升高
被氧化
得电子
化合价降低
被还原
(本质判据)
( 特征判据)
氧化反应(还原剂)
还原反应(氧化剂)
即:氧化还原反应的本质是电子的转移
电子的转移包括电子的得失和共用电子对的偏移
氧化还原反应
1.标出变价元素的化合价,用双线桥标出电子转移情况,其中①②③同时用单线桥标出电子转移情况。
①2H2S+SO2===3S↓+2H2O
应用体验
===3S↓+2H2O
1.标变态
2.画线桥
3.注得失
4.写数目
5.查守恒
应用体验
④Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
答案
⑤Cl2+2NaOH===NaCl+NaClO+H2O
答案
课堂总结
概念
氧化还原反应
电子转移表示方式
双线桥法
单线桥法
特征:有元素发生化合价改变
本质:电子的转移(得失或偏移)
相关概念
还原剂——失去电子——化合价升高——被氧化——发生氧化反应
氧化剂——得到电子——化合价降低——被还原——发生还原反应
2Na + Cl2 = 2NaCl
0
0
2e-
2Na+Cl2 == 2Na Cl
0
0
+1 -1
失去2×e-,
得到2×e-,
第2课时 氧化还原反应
练一练.用双线桥法标明电子得失,并指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
① CuO + CO Cu + CO2
③ Cu + 2H2SO4 (浓) CuSO4 + SO2↑+2H2O
1.标变态
2.画线桥
3.注得失
4.写数目
5.查守恒
复习旧课
② MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
失去2e-
得到2e-
失去2 × e-
得到2e-
失去2e-
得到2e-
(发生还原反应)
(氧化反应)
还原剂
还原剂
氧化剂
氧化产物
还原产物
一、基本概念
氧化产物:还原剂失电子被氧化对应生成物
还原产物:氧化剂得电子被还原对应生成物
氧化剂:得到电子(或电子对偏向)的反应物,表现氧化性,具有氧化能力。得电子能力越强,氧化性就越强,发生还原反应,本身被还原。
还原剂:失去电子(或电子对偏离)的反应物,表现还原性,具有还原能力。失电子能力越强,还原性就越强,发生氧化反应,本身被氧化,
新课讲授
同一氧化还原反应中
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
应用体验
【例3】.分析下列反应并按要求填空。
氧化剂是______(填化学式,下同),还原剂是____;发生氧化反应的是_____,发生还原反应的是_____。
氧化剂是________,还原剂是________;被氧化的元素是___(填元素符号,下同),被还原的元素是_____。
Cl2
Fe
Fe
Cl2
KMnO4
KMnO4
O
Mn
(3)H2O2+2HCl+2FeCl2===2FeCl3+2H2O
氧化剂是________,还原剂是_______;氧化产物是_______,还原产物是___。
(4)5H2O2+2KMnO4+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
氧化剂是________,还原剂是______;氧化产物是_____,还原产物是____。
H2O2
FeCl2
FeCl3
H2O
KMnO4
H2O2
O2
MnSO4
课堂小结
氧化性:物质 电子的性质,氧化剂具有 。
还原性:物质 电子的性质,还原剂具有 。
得到
失去
氧化性
还原性
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化性
还原反应
还原产物
氧化性
氧化性
还原性
还原性
核心元素化合价 实例 性质
最高价 只有_______
中间价 既有 又有______
最低价 H2 Na2S 只有_______
元素价态与氧化性还原性的关系
二、氧化性、还原性强弱比较
特别提示:
氧化性、还原性的强弱取决于物质得失电子的难易程度而与得失电子数目的多少无关。
1. 根据氧化还原反应方程式判断
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
(强氧化性) (强还原性) (弱还原性) (弱氧化性)
化合价降低,得ne-,被还原
化合价升高,失ne-,被氧化
氧化性:氧化剂>氧化产物;
还原性:还原剂>还原产物。
【例1】.已知常温下在溶液中可发生如下两个离子反应:
① Ce4++Fe2+ == Fe3++Ce3+
② Sn2++2Fe3+== 2Fe2++Sn4+
由此可以确定Fe3+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是_______
Sn2+>Fe2+>Ce3+
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ H+ Cu2+ Ag+
在金属活动性顺序表中,金属的位置越靠前,其还原性就越强;金属的位置越靠后,其阳离子的氧化性就越强。
2.根据金属活动性顺序表
(2)氧化性、还原性强弱的判断
还原性逐渐增强
氧化性逐渐增强
【例】多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含FeCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是
A.Fe B.H2 C.Mg D.不能确定
√
【例1】已知下列反应:
①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2
③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是_______________
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是________________。
S2->I->Br->Cl-
Cl2>Br2>I2>S
应用体验
【例2】.①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②SO2+Br2+2H2O===H2SO4+2HBr③Cl2+2NaBr===Br2+2NaCl
由此推断下列说法错误的是
A.反应Cl2+SO2+2H2O===H2SO4+2HCl可以进行
B.氯元素在反应③中被还原,在反应①中被氧化
C.氧化性由强到弱的顺序是KMnO4、Cl2、Br2、SO2
D.MnCl2是KMnO4的氧化产物
√
氧化还原反应的4种常见类型
1、自身氧化还原反应
2、歧化反应
NH4NO3 ==== 2H2O + N2O↑
2KClO3 2KCl+3O2
Cl2 + 2NaOH === NaCl + NaClO +H2O
3NO2 + H2O === 2HNO3 + NO↑
3、归中反应
4、部分氧化还原反应
① SO2+2H2S=3S↓+2H2O ② H2S + 3H2SO4(浓) = 4SO2+4H2O
③ 2Fe3++Fe=3Fe2+
Cu + 4HNO3(浓) == Cu(NO3)2 + NO2↑ + 2H2O
3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ + 4H2O MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
课堂总结
1.几个概念间的关系:
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
反应物
性 质
实 质
特征
反应产物
反应
二.氧化性、还原性强弱的判断
①根据氧化还原反应方程式判断
氧化性:氧化剂 > 氧化产物;还原性:还原剂 > 还原产物。
②根据金属活动性顺序表
第2课时 氧化还原反应
第3课时 氧化还原反应中的四种规律
复习旧课
1.几个概念间的关系:
还原产物
氧化剂
具有氧化性
得电子
化合价降低
发生还原反应(被还原)
还原剂
具有还原性
失电子
化合价升高
发生氧化反应(被氧化)
氧化产物
反应物
性 质
实 质
特征
反应产物
反应
2.常见的氧化剂还原剂
①氧化剂: O2 、 Cl2 、 HNO3、 KMnO4 、KClO3、浓H2SO4等
②还原剂: Zn、Al、Fe 、 H2、C 、 SO2 、Na2S 、KI
3.氧化性、还原性强弱的判断
①根据氧化还原反应方程式判断
氧化性:氧化剂 > 氧化产物;还原性:还原剂 > 还原产物。
②根据金属活动性顺序表
1.标变态
化合价升降法
2.注升降
3.求总数
4.配系数
5.查守恒
0 +1 +3 0
化合价升高
化合价降低
得2e-
失3e-
一、氧化还原反应方程式的配平
Al+ H2SO4 Al2(SO4)3 + H2↑
×2
×3
2
3
3
1
新课讲授
NO+NH3 — N2+H2O
练一练:配平下列方程式:
NO2+ H2O — HNO3 + NO
二、氧化还原反应中的四种规律
1.电子守恒规律
还原剂失电子总数=氧化剂得电子总数
元素化合价降低总数=元素化合价升高总数。
(1)在一定条件下,PbO2与Cr3+反应,产物是 和Pb2+,则Cr3+与PbO2反应的化学计量数之比为______。
(2)已知Na2SO3溶液能与K2Cr2O7溶液发生氧化还原反应,且Na2SO3被氧化为Na2SO4,Na2SO3与K2Cr2O7反应的化学计量数之比为3∶1,则铬元素在还原产物中的化合价为_____价。
2∶3
+3
4.价态归中规律
同种元素不同价态之间发生氧化还原反应时只靠近,不交叉,相邻价态不反应。
【判断】下列化学方程式的双线桥正确的是?
√
√
(2)KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
A.+2 B.+3
C.+4 D.+5
√
【例3】(2022·吉林一中高一期中)已知还原性:SO2>I->Fe2+,下列离子反应不正确的是
B.I2+2Fe2+===2I-+2Fe3+
D.少量Cl2通入FeI2溶液中:Cl2+2I-===2Cl-+I2
√
【例2】
2.性质强弱规律
在一个氧化还原反应中,各物质的氧化还原性强弱为:
还原剂 + 氧化剂 === 氧化产物 + 还原产物
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
已知下列反应:
①Cl2+2NaBr===2NaCl+Br2
②2KI+Br2===2KBr+I2
③Na2S+I2===2NaI+S↓
(1)Cl-、Br-、I-、S2-的还原性由强到弱的顺序是_______________
S2->I->Br->Cl-
(2)Cl2、Br2、I2、S的氧化性由强到弱的顺序是________________。
Cl2>Br2>I2>S
5.多种氧化剂和还原剂相遇时,存在“争先恐后,强者优先”的现象。请预测,在含FeCl2、MgCl2和HCl的溶液中加入适量Zn粉,首先置换出来的是
A.Fe B.H2 C.Mg D.不能确定
√
因为氧化性:H+>Fe2+>Zn2+>Mg2
3.反应先后规律
多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;
多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化。
例如:把氯气通入FeBr2溶液时,还原性Fe2+>Br-,若氯气量不足时首先氧化Fe2+;
把氯气通入FeI2溶液时,还原性I->Fe2+,若氯气量不足时首先氧化 I-。
A.+1价 B.+2价 C.+3价 D.+4价
氧化剂
还原剂
氧化产物
2(6-n)
2
6
应用体验
【例1】
二、氧化还原反应的4大规律
1.电子守恒规律 还原剂失电子总数=氧化剂得电子总数
2.性质强弱规律
在一个氧化还原反应中,各物质的氧化还原性强弱为:
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
3.反应先后规律
多种氧化剂与一种还原剂相遇,氧化性强的首先得电子被还原;
多种还原剂与一种氧化剂相遇,还原性强的首先失电子被氧化。
4.价态归中规律
同种元素不同价态之间发生氧化还原反应时只靠近,不交叉,相邻价态不反应。
一、氧化还原反应方程式的配平
1.标变态
2.注升降
3.求总数
4.配系数
5.查守恒
课堂总结
