第2章 元素与物质世界 测试卷(含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第2章 元素与物质世界 测试卷(含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 418.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-07 00:00:00 | ||
图片预览



文档简介
第2章《元素与物质世界》测试卷
一、单选题
1.目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.Fe B.蔗糖 C.MgSO4 D.CO2
2.下列叙述正确的是
A.碱是除水外电离出的阴离子全部是OH-的化合物
B.电解质在水溶液和熔融状态下都能发生电离
C.石墨会导电,所以石墨是电解质
D.液态HCl不能导电,故HCl不是电解质
3.当光束通过下列分散系时,能观察到丁达尔效应的是
A.KCl溶液 B.胶体 C.NaOH溶液 D.溶液
4.下列变化必须另加入氧化剂才能实现的是
A. B. C. D.
5.下列叙述正确的是
A.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液
C.Fe(OH)3胶体的电泳现象证明此胶体带正电荷
D.胶体区别于其他分散系的根本原因是胶体有丁达尔效应
6.下列变化,必须另加适当的氧化剂才能完成的是( )
A.H2O → O2 B.CuO→Cu
C.H2SO4→CuSO4 D.Fe→FeCl2
7.下列反应的离子方程式正确的是
A.小苏打治疗胃酸过多:
B.Na2O2与水反应:
C.CH3COOH 去除水垢中的 CaCO3:
D.湿法治铜:
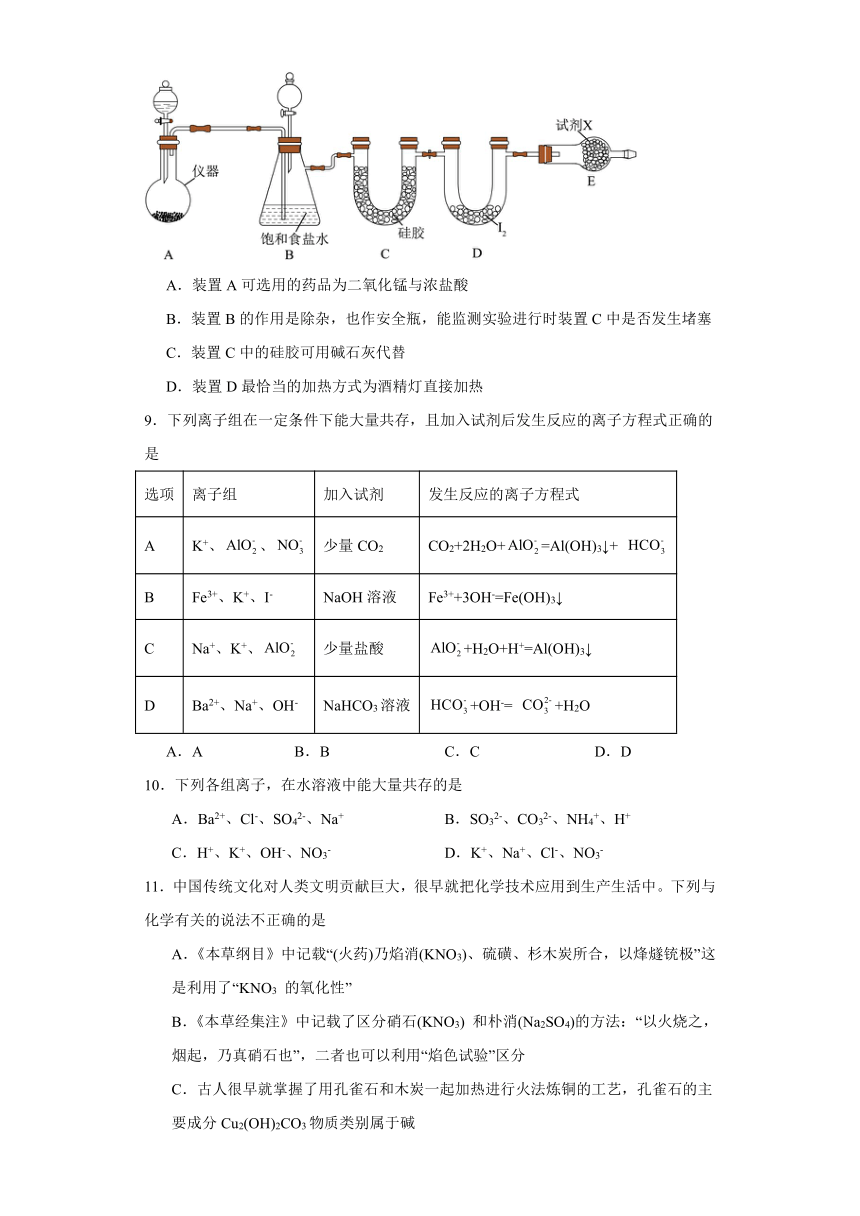
8.三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,氯气与单质碘需在温度稍低于70℃下反应制备ICl3。实验室可用如图装置制取ICl3。下列说法正确的是( )
A.装置A可选用的药品为二氧化锰与浓盐酸
B.装置B的作用是除杂,也作安全瓶,能监测实验进行时装置C中是否发生堵塞
C.装置C中的硅胶可用碱石灰代替
D.装置D最恰当的加热方式为酒精灯直接加热
9.下列离子组在一定条件下能大量共存,且加入试剂后发生反应的离子方程式正确的是
选项 离子组 加入试剂 发生反应的离子方程式
A K+、、 少量CO2 CO2+2H2O+=Al(OH)3↓+
B Fe3+、K+、I- NaOH溶液 Fe3++3OH-=Fe(OH)3↓
C Na+、K+、 少量盐酸 +H2O+H+=Al(OH)3↓
D Ba2+、Na+、OH- NaHCO3溶液 +OH-= +H2O
A.A B.B C.C D.D
10.下列各组离子,在水溶液中能大量共存的是
A.Ba2+、Cl-、SO42-、Na+ B.SO32-、CO32-、NH4+、H+
C.H+、K+、OH-、NO3- D.K+、Na+、Cl-、NO3-
11.中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是
A.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了“KNO3 的氧化性”
B.《本草经集注》中记载了区分硝石(KNO3) 和朴消(Na2SO4)的方法:“以火烧之, 烟起,乃真硝石也”,二者也可以利用“焰色试验”区分
C.古人很早就掌握了用孔雀石和木炭一起加热进行火法炼铜的工艺,孔雀石的主要成分Cu2(OH)2CO3物质类别属于碱
D.夏天晒盐,冬天捞碱,是古人巧妙运用温度变化和溶解度差异获得资源的方法
12.常温下,某无色溶液含有Cl-、Mg2+、Fe3+、OH-、NO、SO、CO离子中的三种,且这三种离子的浓度相等。向该溶液中滴加酚酞,溶液不变色。则该溶液中一定没有
A.SO B.NO C.Mg2+ D.Cl-
13.下列说法正确的是( )
A.硫酸钡不溶于水,所以 硫酸钡是非电解质
B.氨气溶于水可以导电,所以氨气是电解质
C.固态醋酸是电解质,所以醋酸在熔融时和溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
14.下列属于碱的是
A.NaHCO3 B.Na2CO3 C.Ca(OH)2 D.Cu2(OH)2CO3
15.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.BrCl+H2O=HCl+HBrO
D.2Na2O2+2H2O=4NaOH+O2↑
二、填空题
16.按要求完成下列问题。
(1)写出下列物质在水溶液中的电离方程式:
H2SO4: Ba(OH)2:
Al2(SO4)3: NaHSO4:
NaHCO3:
(2)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①用“双线桥法”标出下列氧化还原反应电子转移情况。 。
②还原剂是 ,氧化产物是 。
③氧化剂与还原产物的物质的量之比为 。当生成2mol的NO2时,转移电子物质的量为 。
17.Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于 (填“纯净物”或者“混合物”)。将其加入适量盐酸,反应的化学方程式: ,该溶液呈 色;
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现 色,即可制得Fe(OH)3胶体;
(3)写出制备氢氧化铁胶体的化学方程式 ;
(4)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯的液体中产生了丁达尔效应,则胶体区别于溶液最本质的特征是 。
18.以下为中学化学中常见的几种物质;①;②熔融NaCl;③固体:④;⑤;⑥75%的酒精;⑦溶液;⑧NaOH溶液;⑨稀盐酸;⑩Fe。回答下列问题:
(1)上述物质中属于电解质的有 (填序号,下同);上述条件下能导电的有 。
(2)写出溶液和⑧反应的离子方程式: 。
(3)写出⑦与⑧反应的离子方程式 。
(4)已知还原性,氧化性,有一混合溶液,其中只含有、、,向该溶液中通入少量氯气,一定会发生的反应的离子方程式是 。
三、实验题
19.氢氧化铁胶体的制备实验如图所示。取一小烧杯,加入25 mL蒸馏水,加热至沸腾,向沸水中逐滴加入1~2 mL饱和氯化铁溶液,继续煮沸至透明的红褐色液体,停止加热。
请回答下列问题。
(1)氢氧化铁胶体中分散质微粒直径的范围是 。
(2)写出制备氢氧化铁胶体的化学方程式: 。
(3)证明有氢氧化铁胶体生成的实验操作是 。
(4)除去氢氧化铁胶体中的氯化铁采用的方法是 (填写字母)。
a.过滤 b.渗析 c.蒸发
(5)下列关于Fe(OH)3胶体的制备和性质的叙述中,正确的是 (填写字母)。
a.Fe(OH)3胶体与FeCl3溶液、Fe(OH)3沉淀的本质区别是:Fe(OH)3胶体具有丁达尔效应
b.可用饱和FeCl3溶液与浓NaOH溶液反应制备氢氧化铁胶体
c.Fe(OH)3胶体属于纯净物,而FeCl3溶液属于混合物
d.本题实验中,若向沸水中加入的饱和氯化铁溶液中含有1mol FeCl3,得不到NA个Fe(OH)3胶体微粒
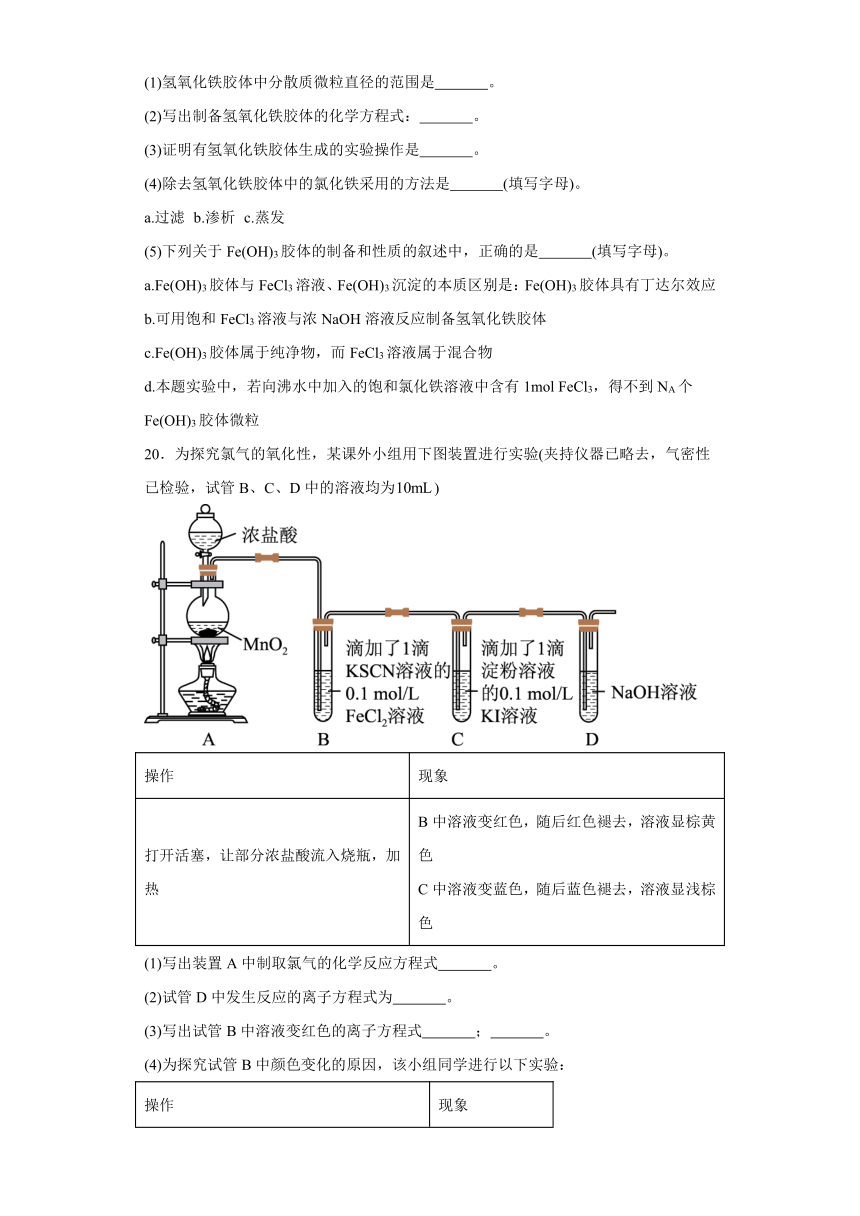
20.为探究氯气的氧化性,某课外小组用下图装置进行实验(夹持仪器已略去,气密性已检验,试管B、C、D中的溶液均为)
操作 现象
打开活塞,让部分浓盐酸流入烧瓶,加热 B中溶液变红色,随后红色褪去,溶液显棕黄色 C中溶液变蓝色,随后蓝色褪去,溶液显浅棕色
(1)写出装置A中制取氯气的化学反应方程式 。
(2)试管D中发生反应的离子方程式为 。
(3)写出试管B中溶液变红色的离子方程式 ; 。
(4)为探究试管B中颜色变化的原因,该小组同学进行以下实验:
操作 现象
取B中的溶液,滴加2滴溶液 溶液仍为棕黄色
取B中的溶液,滴加2滴溶液 溶液变红
结论:试管B中红色褪去的原因是 。
(5)为探究试管C中溶液显浅棕色的原因,该小组同学查阅资料并进行实验:
查阅资料:,在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为(红色)和(黄色),两种离子可被氧化成(无色)。
该小组同学进行实验:
操作 现象
a. 取C中的溶液,滴入1滴碘水 溶液变蓝色
取C中的溶液,滴入1滴淀粉 溶液没有明显变化
b. 取碘水,滴加1浦淀粉溶液 溶液变蓝色
持续通入氯气 蓝色褪去,溶液变为浅棕色,随后溶液变无色,最后溶液略显浅黄绿色。
①操作a的实验目的是 。
②实验证明,溶液与氯气反应的最终产物是。写出氯气与的水溶液反应生成的离子方程式 。
③实验结论:试管C中溶液显浅棕色的原因是 。
试卷第2页,共6页
参考答案:
1.C
【详解】电解质是指在水溶液里或熔融状态下能导电的化合物,
A. 铁是单质,不是电解质,也不是非电解质,故A错误;
B. 蔗糖是在水溶液里和熔融状态下均不能导电的化合物,是非电解质,故B错误;
C. 硫酸镁是在水溶液里或熔融状态下能导电的化合物,属于电解质,故C正确;
D.CO2的水溶液虽然可以导电,但是溶液中的离子是由碳酸电离产生的,并非CO2自身电离产生的,因此CO2属于非电解质,故D错误;
答案选C。
2.A
【详解】A.碱是电离出的阴离子全部是氢氧根离子的化合物,故A正确;
B.电解质是指在水溶液或熔融状态下能导电的化合物,只要水溶液或者熔融状态具备一个就可以,故B错误;
C.电解质是化合物,石墨不是化合物,不是电解质,故C错误;
D.氯化氢是共价化合物,液态不能导电,但氯化氢在水溶液中可以电离出离子,属于电解质,故D错误;
故选A。
3.B
【详解】当光束通过胶体时能观察到丁达尔效应,A、C、D为溶液,B为胶体,故通过B时能观察到丁达尔效应;
故选B。
4.C
【详解】A. 中铁元素的化合价降低,被还原,需加入还原剂,故A错误;
B. 中无元素化合价的变化,故B错误;
C. 中氮元素的化合价升高,被氧化,需加入氧化剂,故C正确;
D. 中碳元素的化合价降低,被还原,需加入还原剂,故D错误;
答案选C。
5.B
【分析】
【详解】A.实验室制备氢氧化铁胶体,是把饱和氯化铁溶液滴入沸水中加热到呈红褐色液体,故A错误;
B.溶液的微粒直径小于1nm,胶体微粒直径在1nm与100nm之间,而浊液的微粒直径大于100nm,因此分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液,故B正确;
C.胶体本身呈电中性,带电的是胶粒吸附带电离子,故C错误;
D.胶体具有丁达尔效应,能区别胶体和溶液,但是胶体与其他分散系的根本区别并不在于丁达尔效应,而在于分散系微粒直径的大小,故D错误;
故选B。
6.D
【详解】A.H2O能够自身发生分解反应,不需要加氧化剂和还原剂,故A错误;
B.Cu元素化合价降低,被还原,应加入还原剂才能实现,故B错误;
C.没有元素化合价的变化,不是氧化还原反应,可经过复分解反应实现,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故D正确;
故选D。
【点睛】本题的易错点为A,要注意H2O → O2可以通过水的电解实现,水本身既是氧化剂,又是还原剂。
7.A
【详解】A.小苏打的主要成分为NaHCO3,与胃酸(HCl)反应,生成NaCl、H2O和CO2气体,离子方程式为:,A正确;
B.Na2O2与水反应,生成NaOH和O2,离子方程式为:,B不正确;
C.CH3COOH 与水垢中的 CaCO3发生复分解反应,生成醋酸钙、二氧化碳和水,离子方程式为:,C不正确;
D.湿法治铜,就是用铁粉与铜盐发生置换反应,离子方程式为:,D不正确;
故选A。
8.B
【详解】A.装置A未加热,不可选用二氧化锰与浓盐酸,不加热二氧化锰与浓盐酸不反应,故A错误;
B.装置B的作用是除出中HCl杂质,也能作安全瓶,能监测实验进行时装置C中是否发生堵塞,故B正确;
C.装置C中的硅胶是干燥氯气的,不可用碱石灰代替,因为碱石灰与氯气反应,能吸收氯气,故C错误;
D.装置D需要在温度稍低于下反应,最恰当的加热方式为水浴加热,故D错误;
故选:B。
【点睛】实验室用二氧化锰与浓盐酸加热反应制备氯气,稀盐酸、不加热不能制备氯气;可以用高锰酸钾和浓盐酸直接反应制备氯气,不用加热;氯气能够与碱反应,不能用碱石灰干燥。
9.C
【详解】A.K+、、相互不反应,可以大量共存,加入少量二氧化碳,偏铝酸根离子与二氧化碳、水反应生成氢氧化铝和碳酸根离子,离子方程式CO2+3H2O+2AlO=2Al(OH)3↓+,选项A错误;
B.三价铁离子能氧化碘离子,则铁离子与氢氧根离子反应产生沉淀,不能大量共存,选项B错误;
C.加入少量盐酸反应产生氢氧化铝沉淀,反应的离子方程式为+H2O+H+=Al(OH)3↓,选项C正确;
D.Ba2+、Na+、OH-相互不反应,能大量共存,加入碳酸氢钠,碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,碳酸根离子与钡离子反应生成碳酸钡沉淀,离子方程式:+OH-+Ba2+=BaCO3↓+H2O,选项D错误;
答案选C。
10.D
【详解】A.钡离子和硫酸根生成硫酸钡沉淀,不能大量共存,故A错误;
B.大量氢离子和SO32-、CO32-会生成SO2和CO2气体,不能大量共存,故B错误;
C.氢离子和氢氧根反应生成水,不能大量共存,故C错误;
D.四种离子相互之间不反应,可以大量共存,故D正确;
故答案为D。
11.C
【详解】A.火药发生化学反应的时候,KNO3中氮元素的化合价降低,被还原,做氧化剂,体现氧化性,A正确;
B.鉴别硝石KNO3和朴消Na2SO4,利用钾元素和钠元素的焰色反应不同,钠元素焰色反应为黄色,钾元素焰色反应为隔着钴玻璃为紫色,B正确;
C.孔雀石的主要成分Cu2(OH)2CO3物质类别属于盐,C错误;
D.夏天晒盐,冬天捞碱,是古人巧妙运用温度变化和溶解度受温度影响变化而获得资源的方法,D正确;
故选C。
12.A
【详解】无色溶液,一定不含Fe3+,向其中滴加酚酞试液不变红色,则溶液显酸性或中性,不能存在OH-,溶液必须要有阳离子,则一定含有Mg2+,由三种离子的物质的量相等及溶液为电中性可以知道,溶液中存在Cl-、Mg2+、NO遵循电荷守恒,则该溶液中一定没有SO,故选A。
13.D
【分析】A.物质是否属于电解质与物质溶解性无关;
B.氨气与水反应产生一水合氨,一水合氨电离产生离子,氨气本身不能电离;
C.醋酸由分子构成,在熔融状态时只有分子,不能导电;
D.HCl由分子构成,在水中发生电离作用,存在自由移动的离子。
【详解】A.硫酸钡难溶于水,但少量溶于水的硫酸钡会完全电离产生Ba2+、SO42-,所以硫酸钡是强电解质,A错误;
B.氨气溶于水可以导电,是由于氨气与水反应产生一水合氨电离产生NH4+、OH-,氨气本身没有发生电离,所以氨气是非电解质,B错误;
C.醋酸是由醋酸分子构成的物质,在水溶液中,在水分子作用下电离产生CH3COO-、H+,所以醋酸溶液能导电,所以醋酸是电解质,但醋酸在熔融时仍然以分子存在,无自由移动的离子,因此在熔融状态下不能导电,C错误;
D.氯化氢是由HCl分子构成的物质,在液态氯化氢中没有发生电离作用,所以不能导电,但由于氯化氢溶于水,在水分子作用下电离产生了自由移动的H+、Cl-,所以HCl是电解质,D正确;
故合理选项是D。
【点睛】本题考查了电解质、非电解质的判断。掌握电解质、非电解质的概念是解题关键。电解质不一定能够导电,电解质只有发生电离作用才能导电,能够导电的物质不一定是电解质,电解质必须是化合物,不能是单质,也不能是混合物,且能够导电的离子必须是电解质本身电离产生,与物质的溶解度大小无关。
14.C
【解析】化合物电离出的阴离子全部为氢氧根离子的化合物为碱。
【详解】NaHCO3属于酸式盐,Na2CO3属于盐,Ca(OH)2属于碱;Cu2(OH)2CO3属于碱式盐,综上所述,答案为C。
15.A
【详解】在Br2+SO2+2H2O=H2SO4+2HBr反应中,水既非氧化剂又非还原剂。
A. 在2Al+2NaOH+2H2O=2NaAlO2+3H2↑中,铝的化合价升高,水中氢的化合价降低,水是氧化剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用不相同,故A选;
B. 在4Fe(OH)2+O2+2H2O=4Fe(OH)3中,Fe(OH)2中的铁的化合价升高,O2中氧的化合价降低,水既非氧化剂又非还原剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故B不选;
C. 在BrCl+H2O=HCl+HBrO中,水中的氢元素和氧元素化合价没有改变,水既非氧化剂又非还原剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故C不选;
D. 在2Na2O2+2H2O=4NaOH+O2↑中,Na2O2中的氧的化合价既升高又降低,水既非氧化剂又非还原剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故D不选;
故选A。
16. H2SO4=2H++SO42- Ba(OH)2=Ba2++2OH- Al2(SO4)3=2Al3++SO42- NaHSO4=Na++H++SO42- NaHCO3=Na++HCO3- Cu Cu(NO3)2 1:1 2mol
【详解】(1)这些物质都是强电解质,它们的电离方程式为:
H2SO4=2H++SO42-;Ba(OH)2=Ba2++2OH-;Al2(SO4)3=2Al3++SO42-;NaHSO4=Na++H++SO42-;NaHCO3=Na++HCO3-;
(2)①该反应的电子转移方程式为:;
②该反应中,Cu的化合价升高,HNO3中N的化合价降低,故Cu作还原剂,HNO3作氧化剂;
③该反应中,HNO3作氧化剂,还原产物为NO2,由于HNO3中部分起酸性的作用,部分起氧化剂的作用,根据化学方程式可知2分HNO3氧化Cu,生成2份NO2,故氧化剂与还原产物的物质的量之比为1:1;由于→转移1个电子,故生成2mol的NO2,转移2mol电子。
【点睛】①NaHSO4是强酸的酸式盐,其酸根部分在水中完全电离,而NaHCO3是弱酸的酸式盐,其酸根部分在水中部分电离;②HNO3在反应中起氧化剂和酸的作用,在计算时要注意题目的问法。
17.(1) 纯净物 Fe2O3 + 6HCl = 2FeCl3 + 3H2O 黄
(2)红褐色
(3)FeCl3 + 3H2OFe (OH)3 (胶体)+ 3HCl
(4) 乙 胶体的分散质粒子直径为1~100nm之间,而溶液的分散质粒子小于1nm
【解析】(1)
Fe2O3固体(红棕色)只含一种物质,属于纯净物;氧化铁属于碱性氧化物,和酸反应生成铁盐和水,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,该溶液呈黄色,故答案为:纯净物;Fe2O3+6HCl=2FeCl3+3H2O;黄;
(2)
将蒸馏水加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现红褐色,得到氢氧化铁胶体,故答案为:红褐色;
(3)
由(2)叙述得制备氢氧化铁胶体的化学方程式为FeCl3 + 3H2OFe (OH)3 (胶体)+ 3HCl,故答案为:FeCl3 + 3H2OFe (OH)3 (胶体)+ 3HCl;
(4)
甲烧杯中液体为溶液、乙烧杯中液体为胶体,胶体中分散质粒子直径在1﹣100nm之间,溶液中分散质粒子直径小于1nm,胶体能产生丁达尔效应,所以乙中能够产生丁达尔效应,胶体区别于溶液最本质的特征是胶体的分散质粒子直径为1~100nm之间,而溶液的分散质粒子小于1nm,故答案为:乙;胶体的分散质粒子直径为1~100nm之间,而溶液的分散质粒子小于1nm。
18.(1) ②③⑤ ②⑦⑧⑨⑩
(2)
(3)
(4)
【详解】(1)电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;
①属于单质,不能导电;②熔融NaCl为熔融盐,属于电解质,能导电;③固体,属于电解质,不能导电;④属于非电解质,不能导电;⑤属于电解质,不能导电;⑥75%的酒精属于混合物,不导电;⑦溶液属于混合物,导电;⑧NaOH溶液属于混合物,导电;⑨稀盐酸属于混合物,导电;⑩Fe属于金属单质,能导电。
故属于电解质的有②③⑤;上述条件下能导电的有②⑦⑧⑨⑩;
(2)溶液和⑧反应生成氢氧化铜沉淀和硫酸钠,;
(3)⑦溶液与⑧NaOH溶液反应生成碳酸钠和碳酸钾、水,离子方程式为:;
(4)已知还原性,氧化性,向只含有、、溶液中通入少量氯气,氯气先氧化I-,离子方程式为;
19.(1)1~100nm
(2)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3)让一束可见光通过制得的液体,从侧面观察到一条光亮的“通路”,说明制得的是胶体
(4)b
(5)d
【分析】向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,利用胶体的丁达尔效应可以区别胶体和溶液。
【详解】(1)胶体是分散质粒子大小在 1nm~100nm 的分散系;故氢氧化铁胶体中分散质微粒直径的范围是1~100nm;
(2)制备氢氧化铁胶体是向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,化学方程式:FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(3)光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应;胶体的丁达尔效应可以区别胶体和溶液,故操作为:让一束可见光通过制得的液体,从侧面观察到一条光亮的“通路”,说明制得的是胶体;
(4)胶体不能透过半透膜,溶液中粒子能透过半透膜,故除去氢氧化铁胶体中的氯化铁采用的方法是b.渗析。
(5)a.Fe(OH)3胶体与FeCl3溶液、Fe(OH)3沉淀的本质区别是分散质直径大小不同,a错误;
b.饱和FeCl3溶液与浓NaOH溶液反应生成氢氧化铁沉淀,不能制备氢氧化铁胶体,b错误;
c.Fe(OH)3胶体、FeCl3溶液均属于分散系,都属于混合物,c错误;
d.本题实验中,若向沸水中加入的饱和氯化铁溶液中含有1mol FeCl3,由于胶体中存在胶粒,故得不到NA个Fe(OH)3胶体微粒,d正确;
故选d。
20.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3) 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3
(4)Fe3+与Cl-发生络合,使得c(Fe3+)减小,平衡Fe3++3SCN-Fe(SCN)3逆向移动,c[Fe(SCN)3]减小
(5) 证明反应后的C溶液中有淀粉,无,说明溶液的浅棕色不是造成的 5Cl2+I2+6H2O=10Cl-+12H++2 I-先被氯气氧化成I2,Cl2+2I-=I2+2Cl-,I2又被氯气氧化成(红色)和(黄色),两者混合呈浅棕色溶液
【分析】A装置为实验室制备Cl2,即用浓盐酸和二氧化锰加热制取氯气,反应原理为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,B装置中盛放FeCl2溶液,探究Cl2的氧化性,Cl2可氧化Fe2+为Fe3+,C装置中盛放淀粉碘化钾溶液,探究氯气与KI溶液的反应,氯气有毒,不能直接排放到空气中,用盛有NaOH溶液的D装置吸收氯气,据此分析解答。
【详解】(1)A装置为实验室制备Cl2,即用浓盐酸和二氧化锰加热制取氯气,反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)氯气有毒,不能直接排放到空气中,用盛有NaOH溶液的D装置吸收氯气,发生的反应为Cl2+2OH-=Cl-+ClO-+H2O;
(3)B装置中盛放FeCl2溶液,探究Cl2的氧化性,Cl2可氧化Fe2+为Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Fe3+与KSCN溶液可生成红色的Fe(SCN)3,因此溶液变成红色,反应的离子方程式为:Fe3++3SCN-Fe(SCN)3;
(4)结合实验现象,滴加2滴溶液后,溶液颜色无变化,滴加2滴KSCN溶液,溶液变成红色,说明通入浓盐酸加热后,Fe3+与Cl-发生络合,使得c(Fe3+)减小,平衡Fe3++3SCN-Fe(SCN)3逆向移动,c[Fe(SCN)3]减小,溶液红色褪去;
(5)①第一份滴入1滴碘水,碘单质与淀粉作用显示蓝色,证明反应后的C溶液中有淀粉,显棕黄色且遇淀粉变蓝,第二份滴入淀粉溶液,溶液颜色没有变化,说明溶液的浅棕色不是造成的,无;
②溶液与氯气反应的最终产物是,结合得失电子守恒可得反应的离子方程式为:5Cl2+I2+6H2O=10Cl-+12H++2;
③向Ⅱ所得溶液继续通入氯气,溶液几乎变为无色,被氧化成(无色),C中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,Cl2+2I-=I2+2Cl-,I2又被氯气氧化成(红色)和(黄色),两者混合呈浅棕色溶液
一、单选题
1.目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.Fe B.蔗糖 C.MgSO4 D.CO2
2.下列叙述正确的是
A.碱是除水外电离出的阴离子全部是OH-的化合物
B.电解质在水溶液和熔融状态下都能发生电离
C.石墨会导电,所以石墨是电解质
D.液态HCl不能导电,故HCl不是电解质
3.当光束通过下列分散系时,能观察到丁达尔效应的是
A.KCl溶液 B.胶体 C.NaOH溶液 D.溶液
4.下列变化必须另加入氧化剂才能实现的是
A. B. C. D.
5.下列叙述正确的是
A.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体
B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液
C.Fe(OH)3胶体的电泳现象证明此胶体带正电荷
D.胶体区别于其他分散系的根本原因是胶体有丁达尔效应
6.下列变化,必须另加适当的氧化剂才能完成的是( )
A.H2O → O2 B.CuO→Cu
C.H2SO4→CuSO4 D.Fe→FeCl2
7.下列反应的离子方程式正确的是
A.小苏打治疗胃酸过多:
B.Na2O2与水反应:
C.CH3COOH 去除水垢中的 CaCO3:
D.湿法治铜:
8.三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,氯气与单质碘需在温度稍低于70℃下反应制备ICl3。实验室可用如图装置制取ICl3。下列说法正确的是( )
A.装置A可选用的药品为二氧化锰与浓盐酸
B.装置B的作用是除杂,也作安全瓶,能监测实验进行时装置C中是否发生堵塞
C.装置C中的硅胶可用碱石灰代替
D.装置D最恰当的加热方式为酒精灯直接加热
9.下列离子组在一定条件下能大量共存,且加入试剂后发生反应的离子方程式正确的是
选项 离子组 加入试剂 发生反应的离子方程式
A K+、、 少量CO2 CO2+2H2O+=Al(OH)3↓+
B Fe3+、K+、I- NaOH溶液 Fe3++3OH-=Fe(OH)3↓
C Na+、K+、 少量盐酸 +H2O+H+=Al(OH)3↓
D Ba2+、Na+、OH- NaHCO3溶液 +OH-= +H2O
A.A B.B C.C D.D
10.下列各组离子,在水溶液中能大量共存的是
A.Ba2+、Cl-、SO42-、Na+ B.SO32-、CO32-、NH4+、H+
C.H+、K+、OH-、NO3- D.K+、Na+、Cl-、NO3-
11.中国传统文化对人类文明贡献巨大,很早就把化学技术应用到生产生活中。下列与化学有关的说法不正确的是
A.《本草纲目》中记载“(火药)乃焰消(KNO3)、硫磺、杉木炭所合,以烽燧铳极”这是利用了“KNO3 的氧化性”
B.《本草经集注》中记载了区分硝石(KNO3) 和朴消(Na2SO4)的方法:“以火烧之, 烟起,乃真硝石也”,二者也可以利用“焰色试验”区分
C.古人很早就掌握了用孔雀石和木炭一起加热进行火法炼铜的工艺,孔雀石的主要成分Cu2(OH)2CO3物质类别属于碱
D.夏天晒盐,冬天捞碱,是古人巧妙运用温度变化和溶解度差异获得资源的方法
12.常温下,某无色溶液含有Cl-、Mg2+、Fe3+、OH-、NO、SO、CO离子中的三种,且这三种离子的浓度相等。向该溶液中滴加酚酞,溶液不变色。则该溶液中一定没有
A.SO B.NO C.Mg2+ D.Cl-
13.下列说法正确的是( )
A.硫酸钡不溶于水,所以 硫酸钡是非电解质
B.氨气溶于水可以导电,所以氨气是电解质
C.固态醋酸是电解质,所以醋酸在熔融时和溶于水时都能导电
D.液态氯化氢不能导电,但氯化氢是电解质
14.下列属于碱的是
A.NaHCO3 B.Na2CO3 C.Ca(OH)2 D.Cu2(OH)2CO3
15.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.BrCl+H2O=HCl+HBrO
D.2Na2O2+2H2O=4NaOH+O2↑
二、填空题
16.按要求完成下列问题。
(1)写出下列物质在水溶液中的电离方程式:
H2SO4: Ba(OH)2:
Al2(SO4)3: NaHSO4:
NaHCO3:
(2)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①用“双线桥法”标出下列氧化还原反应电子转移情况。 。
②还原剂是 ,氧化产物是 。
③氧化剂与还原产物的物质的量之比为 。当生成2mol的NO2时,转移电子物质的量为 。
17.Fe2O3又称铁红,请根据要求完成下列问题。
(1)Fe2O3固体(红棕色)属于 (填“纯净物”或者“混合物”)。将其加入适量盐酸,反应的化学方程式: ,该溶液呈 色;
(2)在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现 色,即可制得Fe(OH)3胶体;
(3)写出制备氢氧化铁胶体的化学方程式 ;
(4)另取一小烧杯也加入20 mL蒸馏水,向烧杯中加入1 mL FeCl3溶液,振荡摇匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到 烧杯的液体中产生了丁达尔效应,则胶体区别于溶液最本质的特征是 。
18.以下为中学化学中常见的几种物质;①;②熔融NaCl;③固体:④;⑤;⑥75%的酒精;⑦溶液;⑧NaOH溶液;⑨稀盐酸;⑩Fe。回答下列问题:
(1)上述物质中属于电解质的有 (填序号,下同);上述条件下能导电的有 。
(2)写出溶液和⑧反应的离子方程式: 。
(3)写出⑦与⑧反应的离子方程式 。
(4)已知还原性,氧化性,有一混合溶液,其中只含有、、,向该溶液中通入少量氯气,一定会发生的反应的离子方程式是 。
三、实验题
19.氢氧化铁胶体的制备实验如图所示。取一小烧杯,加入25 mL蒸馏水,加热至沸腾,向沸水中逐滴加入1~2 mL饱和氯化铁溶液,继续煮沸至透明的红褐色液体,停止加热。
请回答下列问题。
(1)氢氧化铁胶体中分散质微粒直径的范围是 。
(2)写出制备氢氧化铁胶体的化学方程式: 。
(3)证明有氢氧化铁胶体生成的实验操作是 。
(4)除去氢氧化铁胶体中的氯化铁采用的方法是 (填写字母)。
a.过滤 b.渗析 c.蒸发
(5)下列关于Fe(OH)3胶体的制备和性质的叙述中,正确的是 (填写字母)。
a.Fe(OH)3胶体与FeCl3溶液、Fe(OH)3沉淀的本质区别是:Fe(OH)3胶体具有丁达尔效应
b.可用饱和FeCl3溶液与浓NaOH溶液反应制备氢氧化铁胶体
c.Fe(OH)3胶体属于纯净物,而FeCl3溶液属于混合物
d.本题实验中,若向沸水中加入的饱和氯化铁溶液中含有1mol FeCl3,得不到NA个Fe(OH)3胶体微粒
20.为探究氯气的氧化性,某课外小组用下图装置进行实验(夹持仪器已略去,气密性已检验,试管B、C、D中的溶液均为)
操作 现象
打开活塞,让部分浓盐酸流入烧瓶,加热 B中溶液变红色,随后红色褪去,溶液显棕黄色 C中溶液变蓝色,随后蓝色褪去,溶液显浅棕色
(1)写出装置A中制取氯气的化学反应方程式 。
(2)试管D中发生反应的离子方程式为 。
(3)写出试管B中溶液变红色的离子方程式 ; 。
(4)为探究试管B中颜色变化的原因,该小组同学进行以下实验:
操作 现象
取B中的溶液,滴加2滴溶液 溶液仍为棕黄色
取B中的溶液,滴加2滴溶液 溶液变红
结论:试管B中红色褪去的原因是 。
(5)为探究试管C中溶液显浅棕色的原因,该小组同学查阅资料并进行实验:
查阅资料:,在溶液中显棕黄色,能使淀粉变蓝色;碘单质可以被氯气氧化为(红色)和(黄色),两种离子可被氧化成(无色)。
该小组同学进行实验:
操作 现象
a. 取C中的溶液,滴入1滴碘水 溶液变蓝色
取C中的溶液,滴入1滴淀粉 溶液没有明显变化
b. 取碘水,滴加1浦淀粉溶液 溶液变蓝色
持续通入氯气 蓝色褪去,溶液变为浅棕色,随后溶液变无色,最后溶液略显浅黄绿色。
①操作a的实验目的是 。
②实验证明,溶液与氯气反应的最终产物是。写出氯气与的水溶液反应生成的离子方程式 。
③实验结论:试管C中溶液显浅棕色的原因是 。
试卷第2页,共6页
参考答案:
1.C
【详解】电解质是指在水溶液里或熔融状态下能导电的化合物,
A. 铁是单质,不是电解质,也不是非电解质,故A错误;
B. 蔗糖是在水溶液里和熔融状态下均不能导电的化合物,是非电解质,故B错误;
C. 硫酸镁是在水溶液里或熔融状态下能导电的化合物,属于电解质,故C正确;
D.CO2的水溶液虽然可以导电,但是溶液中的离子是由碳酸电离产生的,并非CO2自身电离产生的,因此CO2属于非电解质,故D错误;
答案选C。
2.A
【详解】A.碱是电离出的阴离子全部是氢氧根离子的化合物,故A正确;
B.电解质是指在水溶液或熔融状态下能导电的化合物,只要水溶液或者熔融状态具备一个就可以,故B错误;
C.电解质是化合物,石墨不是化合物,不是电解质,故C错误;
D.氯化氢是共价化合物,液态不能导电,但氯化氢在水溶液中可以电离出离子,属于电解质,故D错误;
故选A。
3.B
【详解】当光束通过胶体时能观察到丁达尔效应,A、C、D为溶液,B为胶体,故通过B时能观察到丁达尔效应;
故选B。
4.C
【详解】A. 中铁元素的化合价降低,被还原,需加入还原剂,故A错误;
B. 中无元素化合价的变化,故B错误;
C. 中氮元素的化合价升高,被氧化,需加入氧化剂,故C正确;
D. 中碳元素的化合价降低,被还原,需加入还原剂,故D错误;
答案选C。
5.B
【分析】
【详解】A.实验室制备氢氧化铁胶体,是把饱和氯化铁溶液滴入沸水中加热到呈红褐色液体,故A错误;
B.溶液的微粒直径小于1nm,胶体微粒直径在1nm与100nm之间,而浊液的微粒直径大于100nm,因此分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液,故B正确;
C.胶体本身呈电中性,带电的是胶粒吸附带电离子,故C错误;
D.胶体具有丁达尔效应,能区别胶体和溶液,但是胶体与其他分散系的根本区别并不在于丁达尔效应,而在于分散系微粒直径的大小,故D错误;
故选B。
6.D
【详解】A.H2O能够自身发生分解反应,不需要加氧化剂和还原剂,故A错误;
B.Cu元素化合价降低,被还原,应加入还原剂才能实现,故B错误;
C.没有元素化合价的变化,不是氧化还原反应,可经过复分解反应实现,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故D正确;
故选D。
【点睛】本题的易错点为A,要注意H2O → O2可以通过水的电解实现,水本身既是氧化剂,又是还原剂。
7.A
【详解】A.小苏打的主要成分为NaHCO3,与胃酸(HCl)反应,生成NaCl、H2O和CO2气体,离子方程式为:,A正确;
B.Na2O2与水反应,生成NaOH和O2,离子方程式为:,B不正确;
C.CH3COOH 与水垢中的 CaCO3发生复分解反应,生成醋酸钙、二氧化碳和水,离子方程式为:,C不正确;
D.湿法治铜,就是用铁粉与铜盐发生置换反应,离子方程式为:,D不正确;
故选A。
8.B
【详解】A.装置A未加热,不可选用二氧化锰与浓盐酸,不加热二氧化锰与浓盐酸不反应,故A错误;
B.装置B的作用是除出中HCl杂质,也能作安全瓶,能监测实验进行时装置C中是否发生堵塞,故B正确;
C.装置C中的硅胶是干燥氯气的,不可用碱石灰代替,因为碱石灰与氯气反应,能吸收氯气,故C错误;
D.装置D需要在温度稍低于下反应,最恰当的加热方式为水浴加热,故D错误;
故选:B。
【点睛】实验室用二氧化锰与浓盐酸加热反应制备氯气,稀盐酸、不加热不能制备氯气;可以用高锰酸钾和浓盐酸直接反应制备氯气,不用加热;氯气能够与碱反应,不能用碱石灰干燥。
9.C
【详解】A.K+、、相互不反应,可以大量共存,加入少量二氧化碳,偏铝酸根离子与二氧化碳、水反应生成氢氧化铝和碳酸根离子,离子方程式CO2+3H2O+2AlO=2Al(OH)3↓+,选项A错误;
B.三价铁离子能氧化碘离子,则铁离子与氢氧根离子反应产生沉淀,不能大量共存,选项B错误;
C.加入少量盐酸反应产生氢氧化铝沉淀,反应的离子方程式为+H2O+H+=Al(OH)3↓,选项C正确;
D.Ba2+、Na+、OH-相互不反应,能大量共存,加入碳酸氢钠,碳酸氢根离子与氢氧根离子反应生成碳酸根离子和水,碳酸根离子与钡离子反应生成碳酸钡沉淀,离子方程式:+OH-+Ba2+=BaCO3↓+H2O,选项D错误;
答案选C。
10.D
【详解】A.钡离子和硫酸根生成硫酸钡沉淀,不能大量共存,故A错误;
B.大量氢离子和SO32-、CO32-会生成SO2和CO2气体,不能大量共存,故B错误;
C.氢离子和氢氧根反应生成水,不能大量共存,故C错误;
D.四种离子相互之间不反应,可以大量共存,故D正确;
故答案为D。
11.C
【详解】A.火药发生化学反应的时候,KNO3中氮元素的化合价降低,被还原,做氧化剂,体现氧化性,A正确;
B.鉴别硝石KNO3和朴消Na2SO4,利用钾元素和钠元素的焰色反应不同,钠元素焰色反应为黄色,钾元素焰色反应为隔着钴玻璃为紫色,B正确;
C.孔雀石的主要成分Cu2(OH)2CO3物质类别属于盐,C错误;
D.夏天晒盐,冬天捞碱,是古人巧妙运用温度变化和溶解度受温度影响变化而获得资源的方法,D正确;
故选C。
12.A
【详解】无色溶液,一定不含Fe3+,向其中滴加酚酞试液不变红色,则溶液显酸性或中性,不能存在OH-,溶液必须要有阳离子,则一定含有Mg2+,由三种离子的物质的量相等及溶液为电中性可以知道,溶液中存在Cl-、Mg2+、NO遵循电荷守恒,则该溶液中一定没有SO,故选A。
13.D
【分析】A.物质是否属于电解质与物质溶解性无关;
B.氨气与水反应产生一水合氨,一水合氨电离产生离子,氨气本身不能电离;
C.醋酸由分子构成,在熔融状态时只有分子,不能导电;
D.HCl由分子构成,在水中发生电离作用,存在自由移动的离子。
【详解】A.硫酸钡难溶于水,但少量溶于水的硫酸钡会完全电离产生Ba2+、SO42-,所以硫酸钡是强电解质,A错误;
B.氨气溶于水可以导电,是由于氨气与水反应产生一水合氨电离产生NH4+、OH-,氨气本身没有发生电离,所以氨气是非电解质,B错误;
C.醋酸是由醋酸分子构成的物质,在水溶液中,在水分子作用下电离产生CH3COO-、H+,所以醋酸溶液能导电,所以醋酸是电解质,但醋酸在熔融时仍然以分子存在,无自由移动的离子,因此在熔融状态下不能导电,C错误;
D.氯化氢是由HCl分子构成的物质,在液态氯化氢中没有发生电离作用,所以不能导电,但由于氯化氢溶于水,在水分子作用下电离产生了自由移动的H+、Cl-,所以HCl是电解质,D正确;
故合理选项是D。
【点睛】本题考查了电解质、非电解质的判断。掌握电解质、非电解质的概念是解题关键。电解质不一定能够导电,电解质只有发生电离作用才能导电,能够导电的物质不一定是电解质,电解质必须是化合物,不能是单质,也不能是混合物,且能够导电的离子必须是电解质本身电离产生,与物质的溶解度大小无关。
14.C
【解析】化合物电离出的阴离子全部为氢氧根离子的化合物为碱。
【详解】NaHCO3属于酸式盐,Na2CO3属于盐,Ca(OH)2属于碱;Cu2(OH)2CO3属于碱式盐,综上所述,答案为C。
15.A
【详解】在Br2+SO2+2H2O=H2SO4+2HBr反应中,水既非氧化剂又非还原剂。
A. 在2Al+2NaOH+2H2O=2NaAlO2+3H2↑中,铝的化合价升高,水中氢的化合价降低,水是氧化剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用不相同,故A选;
B. 在4Fe(OH)2+O2+2H2O=4Fe(OH)3中,Fe(OH)2中的铁的化合价升高,O2中氧的化合价降低,水既非氧化剂又非还原剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故B不选;
C. 在BrCl+H2O=HCl+HBrO中,水中的氢元素和氧元素化合价没有改变,水既非氧化剂又非还原剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故C不选;
D. 在2Na2O2+2H2O=4NaOH+O2↑中,Na2O2中的氧的化合价既升高又降低,水既非氧化剂又非还原剂,和Br2+SO2+2H2O=H2SO4+2HBr中水的作用相同,故D不选;
故选A。
16. H2SO4=2H++SO42- Ba(OH)2=Ba2++2OH- Al2(SO4)3=2Al3++SO42- NaHSO4=Na++H++SO42- NaHCO3=Na++HCO3- Cu Cu(NO3)2 1:1 2mol
【详解】(1)这些物质都是强电解质,它们的电离方程式为:
H2SO4=2H++SO42-;Ba(OH)2=Ba2++2OH-;Al2(SO4)3=2Al3++SO42-;NaHSO4=Na++H++SO42-;NaHCO3=Na++HCO3-;
(2)①该反应的电子转移方程式为:;
②该反应中,Cu的化合价升高,HNO3中N的化合价降低,故Cu作还原剂,HNO3作氧化剂;
③该反应中,HNO3作氧化剂,还原产物为NO2,由于HNO3中部分起酸性的作用,部分起氧化剂的作用,根据化学方程式可知2分HNO3氧化Cu,生成2份NO2,故氧化剂与还原产物的物质的量之比为1:1;由于→转移1个电子,故生成2mol的NO2,转移2mol电子。
【点睛】①NaHSO4是强酸的酸式盐,其酸根部分在水中完全电离,而NaHCO3是弱酸的酸式盐,其酸根部分在水中部分电离;②HNO3在反应中起氧化剂和酸的作用,在计算时要注意题目的问法。
17.(1) 纯净物 Fe2O3 + 6HCl = 2FeCl3 + 3H2O 黄
(2)红褐色
(3)FeCl3 + 3H2OFe (OH)3 (胶体)+ 3HCl
(4) 乙 胶体的分散质粒子直径为1~100nm之间,而溶液的分散质粒子小于1nm
【解析】(1)
Fe2O3固体(红棕色)只含一种物质,属于纯净物;氧化铁属于碱性氧化物,和酸反应生成铁盐和水,反应方程式为Fe2O3+6HCl=2FeCl3+3H2O,该溶液呈黄色,故答案为:纯净物;Fe2O3+6HCl=2FeCl3+3H2O;黄;
(2)
将蒸馏水加热至沸腾后,向烧杯中加入几滴FeCl3溶液,继续煮沸至出现红褐色,得到氢氧化铁胶体,故答案为:红褐色;
(3)
由(2)叙述得制备氢氧化铁胶体的化学方程式为FeCl3 + 3H2OFe (OH)3 (胶体)+ 3HCl,故答案为:FeCl3 + 3H2OFe (OH)3 (胶体)+ 3HCl;
(4)
甲烧杯中液体为溶液、乙烧杯中液体为胶体,胶体中分散质粒子直径在1﹣100nm之间,溶液中分散质粒子直径小于1nm,胶体能产生丁达尔效应,所以乙中能够产生丁达尔效应,胶体区别于溶液最本质的特征是胶体的分散质粒子直径为1~100nm之间,而溶液的分散质粒子小于1nm,故答案为:乙;胶体的分散质粒子直径为1~100nm之间,而溶液的分散质粒子小于1nm。
18.(1) ②③⑤ ②⑦⑧⑨⑩
(2)
(3)
(4)
【详解】(1)电解质是溶于水或在熔融状态下能够导电的化合物;非电解质是溶于水或在熔融状态下不能够导电的化合物;溶液导电的原因是存在自由移动的离子,金属导电的原因是存在自由移动的电子;
①属于单质,不能导电;②熔融NaCl为熔融盐,属于电解质,能导电;③固体,属于电解质,不能导电;④属于非电解质,不能导电;⑤属于电解质,不能导电;⑥75%的酒精属于混合物,不导电;⑦溶液属于混合物,导电;⑧NaOH溶液属于混合物,导电;⑨稀盐酸属于混合物,导电;⑩Fe属于金属单质,能导电。
故属于电解质的有②③⑤;上述条件下能导电的有②⑦⑧⑨⑩;
(2)溶液和⑧反应生成氢氧化铜沉淀和硫酸钠,;
(3)⑦溶液与⑧NaOH溶液反应生成碳酸钠和碳酸钾、水,离子方程式为:;
(4)已知还原性,氧化性,向只含有、、溶液中通入少量氯气,氯气先氧化I-,离子方程式为;
19.(1)1~100nm
(2)FeCl3+3H2OFe(OH)3(胶体)+3HCl
(3)让一束可见光通过制得的液体,从侧面观察到一条光亮的“通路”,说明制得的是胶体
(4)b
(5)d
【分析】向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,利用胶体的丁达尔效应可以区别胶体和溶液。
【详解】(1)胶体是分散质粒子大小在 1nm~100nm 的分散系;故氢氧化铁胶体中分散质微粒直径的范围是1~100nm;
(2)制备氢氧化铁胶体是向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,化学方程式:FeCl3+3H2OFe(OH)3(胶体)+3HCl;
(3)光束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应;胶体的丁达尔效应可以区别胶体和溶液,故操作为:让一束可见光通过制得的液体,从侧面观察到一条光亮的“通路”,说明制得的是胶体;
(4)胶体不能透过半透膜,溶液中粒子能透过半透膜,故除去氢氧化铁胶体中的氯化铁采用的方法是b.渗析。
(5)a.Fe(OH)3胶体与FeCl3溶液、Fe(OH)3沉淀的本质区别是分散质直径大小不同,a错误;
b.饱和FeCl3溶液与浓NaOH溶液反应生成氢氧化铁沉淀,不能制备氢氧化铁胶体,b错误;
c.Fe(OH)3胶体、FeCl3溶液均属于分散系,都属于混合物,c错误;
d.本题实验中,若向沸水中加入的饱和氯化铁溶液中含有1mol FeCl3,由于胶体中存在胶粒,故得不到NA个Fe(OH)3胶体微粒,d正确;
故选d。
20.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(2)Cl2+2OH-=Cl-+ClO-+H2O
(3) 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-Fe(SCN)3
(4)Fe3+与Cl-发生络合,使得c(Fe3+)减小,平衡Fe3++3SCN-Fe(SCN)3逆向移动,c[Fe(SCN)3]减小
(5) 证明反应后的C溶液中有淀粉,无,说明溶液的浅棕色不是造成的 5Cl2+I2+6H2O=10Cl-+12H++2 I-先被氯气氧化成I2,Cl2+2I-=I2+2Cl-,I2又被氯气氧化成(红色)和(黄色),两者混合呈浅棕色溶液
【分析】A装置为实验室制备Cl2,即用浓盐酸和二氧化锰加热制取氯气,反应原理为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,B装置中盛放FeCl2溶液,探究Cl2的氧化性,Cl2可氧化Fe2+为Fe3+,C装置中盛放淀粉碘化钾溶液,探究氯气与KI溶液的反应,氯气有毒,不能直接排放到空气中,用盛有NaOH溶液的D装置吸收氯气,据此分析解答。
【详解】(1)A装置为实验室制备Cl2,即用浓盐酸和二氧化锰加热制取氯气,反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;
(2)氯气有毒,不能直接排放到空气中,用盛有NaOH溶液的D装置吸收氯气,发生的反应为Cl2+2OH-=Cl-+ClO-+H2O;
(3)B装置中盛放FeCl2溶液,探究Cl2的氧化性,Cl2可氧化Fe2+为Fe3+,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,Fe3+与KSCN溶液可生成红色的Fe(SCN)3,因此溶液变成红色,反应的离子方程式为:Fe3++3SCN-Fe(SCN)3;
(4)结合实验现象,滴加2滴溶液后,溶液颜色无变化,滴加2滴KSCN溶液,溶液变成红色,说明通入浓盐酸加热后,Fe3+与Cl-发生络合,使得c(Fe3+)减小,平衡Fe3++3SCN-Fe(SCN)3逆向移动,c[Fe(SCN)3]减小,溶液红色褪去;
(5)①第一份滴入1滴碘水,碘单质与淀粉作用显示蓝色,证明反应后的C溶液中有淀粉,显棕黄色且遇淀粉变蓝,第二份滴入淀粉溶液,溶液颜色没有变化,说明溶液的浅棕色不是造成的,无;
②溶液与氯气反应的最终产物是,结合得失电子守恒可得反应的离子方程式为:5Cl2+I2+6H2O=10Cl-+12H++2;
③向Ⅱ所得溶液继续通入氯气,溶液几乎变为无色,被氧化成(无色),C中溶液颜色变成浅棕色的原因是I-先被氯气氧化成I2,Cl2+2I-=I2+2Cl-,I2又被氯气氧化成(红色)和(黄色),两者混合呈浅棕色溶液
