2.1.2物质的检验物质性质和变化的探究课件(共35张PPT)2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.1.2物质的检验物质性质和变化的探究课件(共35张PPT)2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 18.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-07 11:15:53 | ||
图片预览











文档简介
(共35张PPT)
第2课时 物质的检验 物质性质和变化的探究
第一单元 研究物质的基本方法
白醋?
白酒?
水?
酱油?
Na2CO3?
CaCO3?
O2?
CO2?
真毛线?
了解常见物质的检验方法。
02.
03.
学 习
目 标
01.
了解常见的仪器分析法,会用焰色反应检验金属或金属离子的存在
能设计简单的实验方案,确定常见物质的组成成分
依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断
鉴别:重在别,即区别。根据不同物质具有不同的特性,用物理或化学的方法将两种或两种以上的已知物质一一区别开来。
鉴定:根据物质的某种特性,用实验的方法来确定它是否是某种物质。鉴定某种物质必须分别检验其中的阴离子、阳离子或其他成分
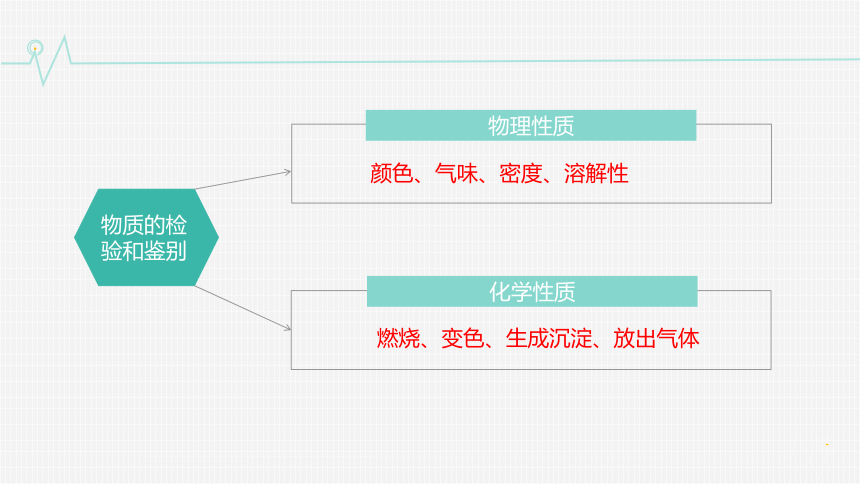
物质的检验
物理性质
物质的检验和鉴别
颜色、气味、密度、溶解性
化学性质
燃烧、变色、生成沉淀、放出气体
同学们在初中阶段的学习中,我们学习了一些物质的检验,你还记得它们的检验方法吗?试完成下面的填空,并和同学交流,看看你们能想几种方法。
物质 检验方法 现象
H2
O2
CO2
溶液的酸碱性
区别纤维与羊毛
木条复燃
烧杯上生成水珠
带火星的木条
点燃,火焰上罩冷的烧杯
澄清石灰水
澄清石灰水变浑浊
加稀盐酸,气体通入澄清石灰水
产生气体,澄清石灰水变浑浊
pH试纸
酸:变红 碱:变蓝
点燃
闻气味
取2支试管,分别加入2 mL NH4Cl、(NH4)2SO4溶液,再加2 mL NaOH溶液,加热试管,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察试纸的颜色变化。
观看视频,回答问题:
观察思考
1.实验现象是什么?
2.生成的气体是什么?试写该反应的方程式。
有刺激性气味的气体产生,产生的气体能使湿润的红色石蕊试纸变蓝
NH4Cl+NaOH === NH3↑+H2O+NaCl
(NH4)2SO4+2NaOH === 2NH3↑+2H2O+Na2SO4
氨气(NH3)
4.为什么要用湿润的红色的石蕊试纸,如果我直接用红色石蕊试纸,还会出现变色的情况吗?为什么?
不会。因为气体虽然是碱性的,但直接无法使之变色,只有遇水,生成碱,才会使之变色
3.加热试管的目的是什么?
因为铵根离子和氢氧根离子首先结合生成一水合氨,一水合氨分解才产生氨气和水。两步反应都是可逆反应。为了让可逆反应向产生氨气的方向移动,用浓氢氧化钠溶液提高氢氧根离子浓度,同时加热促进一水合氨的分解和氨气的逸出。
检验的方法是:
取样,加入强碱,加热,若生成能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则该样品中含。
取2支试管,分别加入少量的NH4Cl、KCl溶液,再各加入几滴AgNO3溶液和稀硝酸,观察实验现象,思考并回答下面的问题。
观察思考
1.实验现象是什么?
2.写出该反应的方程式
试管内有__________生成,滴入稀硝酸, _______________。
白色沉淀
白色沉淀不溶解
NH4Cl+AgNO3 === AgCl↓+NH4NO3
KCl+AgNO3 === AgCl↓+KNO3
3.为什么加稀硝酸,不加可以吗?如果需要加酸的话用稀硫酸、稀盐酸代替稀硝酸可以吗?为什么?
不行,由于检验氯离子用的是硝酸银,银离子和许多离子结合都可以形成白色沉淀,加入稀硝酸就是为了排除、 、 等离子的干扰。
不可以,盐酸自身带有氯离子,硫酸中的硫酸根离子与银离子结合生成硫酸银,硫酸银又是微溶的,会干扰氯离子检出。
检验Cl-的方法是:
取样(溶解),加入硝酸银溶液,如生成不溶于稀硝酸的白色沉淀,则样品中含Cl-。
取2支试管,分别加入少量(NH4)2SO4、K2SO4溶液,再各滴加几滴BaCl2溶液和稀盐酸,观察实验现象,并回答下面的问题。
观察思考
1.实验现象是什么?
2.写出该反应的方程式
3.为什么加稀盐酸,不加可以吗?如果需要加酸的话用稀硫酸、稀硝酸代替可以吗?为什么?
试管内有_________生成,加入稀盐酸____________________。
白色沉淀
白色沉淀不溶解
(NH4)2SO4+BaCl2 === BaSO4↓+2NH4Cl K2SO4+BaCl2 === BaSO4↓+2KCl
不可以,加稀盐酸的目的是排除、等离子的干扰。稀硫酸自身带有硫酸根,不可以,稀硝酸可以。
检验的方法是:
取样(溶解),加入氯化钡溶液,如生成不溶于稀硝酸的白色沉淀,则样品中含。
取一根铂丝(或细铁丝),放在酒精灯(或煤气灯)火焰上灼烧至无色,用铂丝蘸取少量KCl溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色。再用稀盐酸洗净铂丝,并在火焰上灼烧至无色,蘸取少量NaCl溶液,重复以上实验,观察实验现象并回答下面的问题
观察思考
1.实验现象是什么?
3.为什么用铂丝呢?又为什么用稀盐酸清洗?
不是,没有新物质生成。
透过蓝色钴玻璃, KCl、K2SO4观察到为紫色
2.该反应是否属于化学反应?
铂丝极不活泼,较稳定,适合做焰色反应。盐酸清洗是为了除去残余杂液。
焰色反应
1.用来检验金属元素(单质或金属离子)
2.与状态(固态、液态、单质、化合物)无关,只与金属元素有关
注意:
3. 焰色反应是物理变化(颜色),不是化学变化
4.在焰色反应中,如果要检验溶液中是否含有钾离子,就必须透过蓝色钴玻璃才能看到钾离子的火焰呈蓝色。如果没有透过蓝色钴玻璃,就不能看到钾离子的火焰呈蓝色。
待检验的物质 检 验 方 法 和 现 象
碳酸盐()
硫酸盐()
铵盐 ()
氯离子(Cl-)
钠盐(Na+)
钾盐(K+)
加入稀盐酸生成使澄清石灰水变浑浊的无色、无味的气体
加入稀盐酸后无现象,再加入BaCl2溶液产生白色沉淀
加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝(湿润的pH试纸变蓝)
加入AgNO3溶液产生白色沉淀再加入稀硝酸白色沉淀不溶解
用洁净的铂丝蘸取样品,在火焰上灼烧,火焰呈黄色
用洁净的铂丝蘸取少量样品,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色呈紫色
仪器检验
元素分析仪
检验C、H、O、N、S、Cl、Br等元素。
红外光谱仪
确定物质中是否存在有机原子团。
物质性质和变化的探究
温故知新
将二氧化碳气体通入水中,向其中滴入几滴紫色石蕊试液,溶液变成红色。
加热该红色液体,发现有气泡从溶液中逸出,溶液重新变成紫色。
二氧化碳具有哪些性质?我们是通过什么实验得知二氧化碳的这些性质的?
物质性质和变化的探究
温故知新
二氧化碳具有哪些性质?我们是通过什么实验得知二氧化碳的这些性质的?
1.通过探究过程,说明二氧化碳有哪些性质?发生了哪些变化?
①二氧化碳可溶于水;②二氧化碳与水反应生成了H2CO3;③H2CO3不稳定,受热易分解。
实验法、观察法、分析法、归纳法……
2.在探究二氧化碳性质和变化的过程中,采用了研究方法?
实验操作 主要现象 结论
打磨铝片,观察 打磨后为_____色 铝是_____色金属,铝在空气中易被氧化,形成一层氧化膜
___________________
加热未打磨的铝片 铝片内部熔融但不下滴 表层有一层Al2O3,且熔点高于Al单质
银白
银白
4Al+3O2===2Al2O3
化学实验是探究物质性质和变化的主要方法。
观察思考
设计实验探究铝的性质
铝片均溶解,且均有气泡产生 Al既能与盐酸反应又能与NaOH溶液反应
_____________________________、
___________________________________
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
思考:怎样比较铁、铜、银的金属活动性差异?
在常温下利用金属铁、铜、银分别与相同浓度的硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液反应,观察实验现象,依据所发生的置换反应分析得出铁、铜、银的金属活动性差异。
为了研究某个化学问题,我们往往先根据已有知识、经验,对问题作出某种可能的解释,再设计化学实验进行验证。
双氧水的分解实验
实验探究
实验步骤 实验现象 结论
1.取浓度约为15%的双氧水2~3 mL盛放于试管中,观察溶液中气泡产生的快慢
2.把实验1所用的双氧水置于75℃热水中,观察溶液中气泡产生的快慢。
缓慢产生少量气泡
快速产生大量气泡
双氧水不稳定,易分解
温度升高,加快双氧水易分解
思考:怎样研究浓度对过氧化氢溶液分解快慢的影响?
在相同浓度的条件下,对比不同浓度的过氧化氢溶液,在少量二氧化锰粉末催化下放出气体的快慢。
探究
问题
假设
实验
方案
1. 控制因素
2. 选择适宜条件
试剂和仪器
实验
观察、记录现象、
数据
整理分析
结论
归纳
随堂练习
1. 能用来区别BaCl2、Na2CO3、NaCl 溶液的试剂是( )
A. AgNO3
D. 稀盐酸
C. 稀硝酸
B. 稀硫酸
B
2. 判断正误:
(1)加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在。
(2)加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有
3. 某试样的焰色反应呈黄色,下列对该试样成分的说法正确的是( )
A.肯定是钠单质
D.可能含有钾元素
C.肯定含有钠元素
B.肯定是钠的化合物
C
4. 下列实验方案的设计中,不可行的是( )
A.用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3
B.向无色溶液中加入NaOH溶液,加热有NH3生成可确定溶液中含
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的
D.仅用石蕊试液、BaCl2溶液就可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别出来
C
Thank You!
第2课时 物质的检验 物质性质和变化的探究
第一单元 研究物质的基本方法
白醋?
白酒?
水?
酱油?
Na2CO3?
CaCO3?
O2?
CO2?
真毛线?
了解常见物质的检验方法。
02.
03.
学 习
目 标
01.
了解常见的仪器分析法,会用焰色反应检验金属或金属离子的存在
能设计简单的实验方案,确定常见物质的组成成分
依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断
鉴别:重在别,即区别。根据不同物质具有不同的特性,用物理或化学的方法将两种或两种以上的已知物质一一区别开来。
鉴定:根据物质的某种特性,用实验的方法来确定它是否是某种物质。鉴定某种物质必须分别检验其中的阴离子、阳离子或其他成分
物质的检验
物理性质
物质的检验和鉴别
颜色、气味、密度、溶解性
化学性质
燃烧、变色、生成沉淀、放出气体
同学们在初中阶段的学习中,我们学习了一些物质的检验,你还记得它们的检验方法吗?试完成下面的填空,并和同学交流,看看你们能想几种方法。
物质 检验方法 现象
H2
O2
CO2
溶液的酸碱性
区别纤维与羊毛
木条复燃
烧杯上生成水珠
带火星的木条
点燃,火焰上罩冷的烧杯
澄清石灰水
澄清石灰水变浑浊
加稀盐酸,气体通入澄清石灰水
产生气体,澄清石灰水变浑浊
pH试纸
酸:变红 碱:变蓝
点燃
闻气味
取2支试管,分别加入2 mL NH4Cl、(NH4)2SO4溶液,再加2 mL NaOH溶液,加热试管,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察试纸的颜色变化。
观看视频,回答问题:
观察思考
1.实验现象是什么?
2.生成的气体是什么?试写该反应的方程式。
有刺激性气味的气体产生,产生的气体能使湿润的红色石蕊试纸变蓝
NH4Cl+NaOH === NH3↑+H2O+NaCl
(NH4)2SO4+2NaOH === 2NH3↑+2H2O+Na2SO4
氨气(NH3)
4.为什么要用湿润的红色的石蕊试纸,如果我直接用红色石蕊试纸,还会出现变色的情况吗?为什么?
不会。因为气体虽然是碱性的,但直接无法使之变色,只有遇水,生成碱,才会使之变色
3.加热试管的目的是什么?
因为铵根离子和氢氧根离子首先结合生成一水合氨,一水合氨分解才产生氨气和水。两步反应都是可逆反应。为了让可逆反应向产生氨气的方向移动,用浓氢氧化钠溶液提高氢氧根离子浓度,同时加热促进一水合氨的分解和氨气的逸出。
检验的方法是:
取样,加入强碱,加热,若生成能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则该样品中含。
取2支试管,分别加入少量的NH4Cl、KCl溶液,再各加入几滴AgNO3溶液和稀硝酸,观察实验现象,思考并回答下面的问题。
观察思考
1.实验现象是什么?
2.写出该反应的方程式
试管内有__________生成,滴入稀硝酸, _______________。
白色沉淀
白色沉淀不溶解
NH4Cl+AgNO3 === AgCl↓+NH4NO3
KCl+AgNO3 === AgCl↓+KNO3
3.为什么加稀硝酸,不加可以吗?如果需要加酸的话用稀硫酸、稀盐酸代替稀硝酸可以吗?为什么?
不行,由于检验氯离子用的是硝酸银,银离子和许多离子结合都可以形成白色沉淀,加入稀硝酸就是为了排除、 、 等离子的干扰。
不可以,盐酸自身带有氯离子,硫酸中的硫酸根离子与银离子结合生成硫酸银,硫酸银又是微溶的,会干扰氯离子检出。
检验Cl-的方法是:
取样(溶解),加入硝酸银溶液,如生成不溶于稀硝酸的白色沉淀,则样品中含Cl-。
取2支试管,分别加入少量(NH4)2SO4、K2SO4溶液,再各滴加几滴BaCl2溶液和稀盐酸,观察实验现象,并回答下面的问题。
观察思考
1.实验现象是什么?
2.写出该反应的方程式
3.为什么加稀盐酸,不加可以吗?如果需要加酸的话用稀硫酸、稀硝酸代替可以吗?为什么?
试管内有_________生成,加入稀盐酸____________________。
白色沉淀
白色沉淀不溶解
(NH4)2SO4+BaCl2 === BaSO4↓+2NH4Cl K2SO4+BaCl2 === BaSO4↓+2KCl
不可以,加稀盐酸的目的是排除、等离子的干扰。稀硫酸自身带有硫酸根,不可以,稀硝酸可以。
检验的方法是:
取样(溶解),加入氯化钡溶液,如生成不溶于稀硝酸的白色沉淀,则样品中含。
取一根铂丝(或细铁丝),放在酒精灯(或煤气灯)火焰上灼烧至无色,用铂丝蘸取少量KCl溶液,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色。再用稀盐酸洗净铂丝,并在火焰上灼烧至无色,蘸取少量NaCl溶液,重复以上实验,观察实验现象并回答下面的问题
观察思考
1.实验现象是什么?
3.为什么用铂丝呢?又为什么用稀盐酸清洗?
不是,没有新物质生成。
透过蓝色钴玻璃, KCl、K2SO4观察到为紫色
2.该反应是否属于化学反应?
铂丝极不活泼,较稳定,适合做焰色反应。盐酸清洗是为了除去残余杂液。
焰色反应
1.用来检验金属元素(单质或金属离子)
2.与状态(固态、液态、单质、化合物)无关,只与金属元素有关
注意:
3. 焰色反应是物理变化(颜色),不是化学变化
4.在焰色反应中,如果要检验溶液中是否含有钾离子,就必须透过蓝色钴玻璃才能看到钾离子的火焰呈蓝色。如果没有透过蓝色钴玻璃,就不能看到钾离子的火焰呈蓝色。
待检验的物质 检 验 方 法 和 现 象
碳酸盐()
硫酸盐()
铵盐 ()
氯离子(Cl-)
钠盐(Na+)
钾盐(K+)
加入稀盐酸生成使澄清石灰水变浑浊的无色、无味的气体
加入稀盐酸后无现象,再加入BaCl2溶液产生白色沉淀
加入NaOH溶液,加热后产生气体使湿润的红色石蕊试纸变蓝(湿润的pH试纸变蓝)
加入AgNO3溶液产生白色沉淀再加入稀硝酸白色沉淀不溶解
用洁净的铂丝蘸取样品,在火焰上灼烧,火焰呈黄色
用洁净的铂丝蘸取少量样品,置于火焰上灼烧,透过蓝色钴玻璃观察火焰颜色呈紫色
仪器检验
元素分析仪
检验C、H、O、N、S、Cl、Br等元素。
红外光谱仪
确定物质中是否存在有机原子团。
物质性质和变化的探究
温故知新
将二氧化碳气体通入水中,向其中滴入几滴紫色石蕊试液,溶液变成红色。
加热该红色液体,发现有气泡从溶液中逸出,溶液重新变成紫色。
二氧化碳具有哪些性质?我们是通过什么实验得知二氧化碳的这些性质的?
物质性质和变化的探究
温故知新
二氧化碳具有哪些性质?我们是通过什么实验得知二氧化碳的这些性质的?
1.通过探究过程,说明二氧化碳有哪些性质?发生了哪些变化?
①二氧化碳可溶于水;②二氧化碳与水反应生成了H2CO3;③H2CO3不稳定,受热易分解。
实验法、观察法、分析法、归纳法……
2.在探究二氧化碳性质和变化的过程中,采用了研究方法?
实验操作 主要现象 结论
打磨铝片,观察 打磨后为_____色 铝是_____色金属,铝在空气中易被氧化,形成一层氧化膜
___________________
加热未打磨的铝片 铝片内部熔融但不下滴 表层有一层Al2O3,且熔点高于Al单质
银白
银白
4Al+3O2===2Al2O3
化学实验是探究物质性质和变化的主要方法。
观察思考
设计实验探究铝的性质
铝片均溶解,且均有气泡产生 Al既能与盐酸反应又能与NaOH溶液反应
_____________________________、
___________________________________
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
思考:怎样比较铁、铜、银的金属活动性差异?
在常温下利用金属铁、铜、银分别与相同浓度的硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液反应,观察实验现象,依据所发生的置换反应分析得出铁、铜、银的金属活动性差异。
为了研究某个化学问题,我们往往先根据已有知识、经验,对问题作出某种可能的解释,再设计化学实验进行验证。
双氧水的分解实验
实验探究
实验步骤 实验现象 结论
1.取浓度约为15%的双氧水2~3 mL盛放于试管中,观察溶液中气泡产生的快慢
2.把实验1所用的双氧水置于75℃热水中,观察溶液中气泡产生的快慢。
缓慢产生少量气泡
快速产生大量气泡
双氧水不稳定,易分解
温度升高,加快双氧水易分解
思考:怎样研究浓度对过氧化氢溶液分解快慢的影响?
在相同浓度的条件下,对比不同浓度的过氧化氢溶液,在少量二氧化锰粉末催化下放出气体的快慢。
探究
问题
假设
实验
方案
1. 控制因素
2. 选择适宜条件
试剂和仪器
实验
观察、记录现象、
数据
整理分析
结论
归纳
随堂练习
1. 能用来区别BaCl2、Na2CO3、NaCl 溶液的试剂是( )
A. AgNO3
D. 稀盐酸
C. 稀硝酸
B. 稀硫酸
B
2. 判断正误:
(1)加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在。
(2)加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有
3. 某试样的焰色反应呈黄色,下列对该试样成分的说法正确的是( )
A.肯定是钠单质
D.可能含有钾元素
C.肯定含有钠元素
B.肯定是钠的化合物
C
4. 下列实验方案的设计中,不可行的是( )
A.用加入适量铜粉的方法除去Cu(NO3)2溶液中混有的AgNO3
B.向无色溶液中加入NaOH溶液,加热有NH3生成可确定溶液中含
C.向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的
D.仅用石蕊试液、BaCl2溶液就可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别出来
C
Thank You!
