山东省济宁市兖州区2023-2024学年高二上学期期中考试化学试题(含答案)
文档属性
| 名称 | 山东省济宁市兖州区2023-2024学年高二上学期期中考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 709.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-07 12:52:16 | ||
图片预览




文档简介
济宁市兖州区2023-2024学年高二上学期期中考试
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
可能用到的相对原子质量:H1 C12 N14 O16 Cr52
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.元末陶宗仪《辍耕录》中记载:“杭人削松木为小片,其薄为纸,熔硫磺涂木片顶端分
许,名日发烛……,盖以发火及代灯烛用也。”下列有关说法错误的是( )
A.将松木削薄为纸片状有助于发火和燃烧
B.“发烛”发火和燃烧利用了物质的可燃性
C.“发烛”发火和燃烧伴随不同形式的能量转化
D.硫磺是“发烛”发火和燃烧反应的催化剂
2.下列说法错误的是( )
A.已知冰的熔化热为6.0 kJ mol,冰中氢键键能为20 kJ mol,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,若加水稀释,则平衡向右移动,电离程度增大,不变
C.甲烷的燃烧热为890.3 kJ mol,则甲烷燃烧的热化学方程式可表示为 kJ mol
D.500℃、30MPa下,将0.5 mol 和1.5 mol 置于密闭的容器中充分反应生成,放热19.3 kJ,其热化学方程式为 kJ mol
3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. mol L的溶液:、,、
B. mol L的溶液:、、、
C.澄清透明的无色溶液:、、、
D.和Al反应放出的溶液:,,,
4.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:。若经2s后测得C的浓度为0.6 mol L,现有下列
几种说法:
①用物质A表示的反应的平均速率为0.3 mol L s
②用物质B表示的反应的平均速率为0.6 mol L s
③2s末时物质B的浓度为0.7 mol L
④2s末,物质A的转化率为70%
其中正确的是( )
A.①④ B.①③ C.②④ D.③④
5.过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,的反应历程如下,下列有关说法正确的是( )
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
6.有4种混合溶液,分别由等体积0.1 mol L的2种溶液混合而成:
①溶液与溶液 ②溶液与NaCl溶液
③溶液与NaOH溶液 ④溶液与盐酸
排序正确的是( )
A.③>①>②>④ B.③>②>①>④ C.④>②>①>③ D.④>②>③>①
7.用50 mL 0.50 mol L的盐酸与50 mL 0.55 mol L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列关于实验和中和反应的说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25℃、101kPa下,强酸和强碱的稀溶液发生中和反应生成1 mol 时,放出57.3 kJ mol的热量
8.下表是25°C时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是( )
化学式 AgCl
或
A.常温下,相同浓度的①、②、③溶液中,由大到小的顺序是①>②>③
B.向饱和氯水中滴加NaOH溶液至溶液刚好呈中性时,
C.AgCl在盐酸中的大于其在水中的
D.向浓度均为 mol L的KCl和的混合溶液中滴加mol L的溶液,先形成沉淀
9.下列事实中,不能用勒夏特列原理解释的是( )
①溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色加压后颜色先变深后变浅
⑤500℃时比室温更有利于合成氨的反应
⑥由、和组成的平衡体系加压后颜色变深
A.①②⑥ B.①③⑤ C.②⑤⑥ D.②③⑤
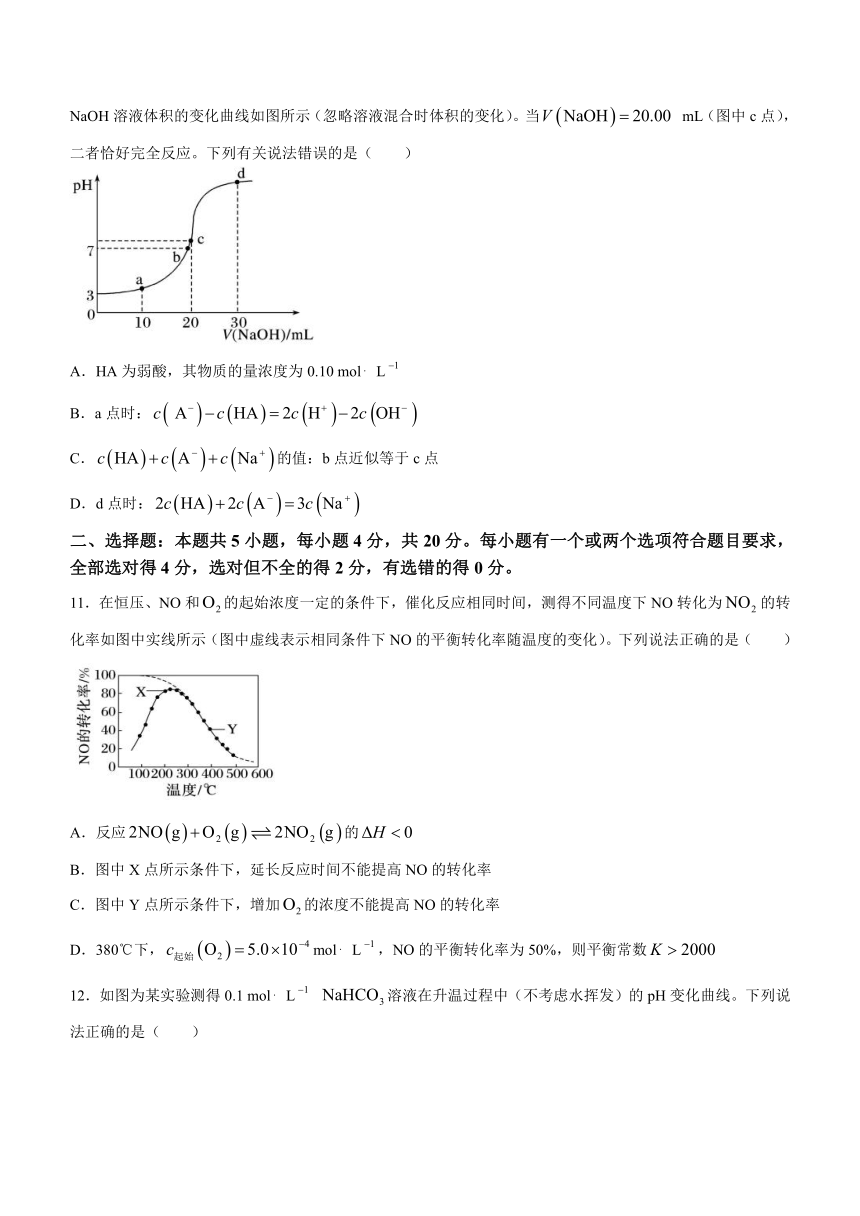
10.室温时,将0.10 mol L NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示(忽略溶液混合时体积的变化)。当 mL(图中c点),二者恰好完全反应。下列有关说法错误的是( )
A.HA为弱酸,其物质的量浓度为0.10 mol L
B.a点时:
C.的值:b点近似等于c点
D.d点时:
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.在恒压、NO和的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应的
B.图中X点所示条件下,延长反应时间不能提高NO的转化率
C.图中Y点所示条件下,增加的浓度不能提高NO的转化率
D.380℃下,mol L,NO的平衡转化率为50%,则平衡常数
12.如图为某实验测得0.1 mol L 溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是( )
A.a点溶液的比c点溶液的小
B.a点时,
C.b点溶液中,
D.ab段,pH减小说明升温抑制了的水解
13.下列实验中,由实验现象不能得到正确结论的是( )
选项 实验 现象 结论
A 将溶液加入悬浊液中,振荡 沉淀由白色变为红褐色 的溶解度小于的溶解度
B 在醋酸钠溶液中滴入酚酞溶液并加热 加热后红色加深 证明盐类水解是吸热反应
C 向1.0 mol·L的溶液中滴加2滴甲基橙 溶液呈黄色 溶液呈碱性
D 相同的铝片分别与同温同体积且 mol·L的盐酸、硫酸反应 铝与盐酸反应产生气泡较快 可能是对该反应起到促进作用
14.我国科学家研究出在S-In催化剂上实现高选择性、高活性电催化还原制甲酸。图1表示不同催化剂及活性位上生成的能量变化,图2表示反应历程,其中吸附在催化剂表面的物种用*标注。下列说法错误的是( )
图1 图2
A.S-In/S表面更容易生成
B.与微粒间的静电作用促进了的活化
C.经两步转化生成
D.相对能量变化越大,越有利于抑制复合成
15.在一体积不变的密闭容器中充入2 mol ,并放入一定量的,发生化学反应: ,实验测得在压强分别为、时,平衡体系中NH 的体积分数随温度的变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×该气体的物质的量分数。下列说法错误的是( )
A.该反应的
B.气体压强:
C.平衡后再加入,的转化率增大
D.M点的平衡常数
三、非选择题:本题共5小题,共60分
16.(12分)Ⅰ.某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将100 mL 0.5 mol L的盐酸与100 mL 0.55 mol L的NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是______。
(2)简易量热计如果不盖杯盖,生成1 mol 时所测得中和反应的反应热()将______(填“偏大”“偏小”或“不变”)。
(3)若用等体积等物质的量浓度的进行上述实验,生成1 mol 时,所测得的中和反应的反应热的绝对值()将______(填“偏大”“偏小”或“无影响”)。
(4)下列说法正确的是______(填字母)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1 mol 时所测得的中和反应的反应热()无影响
Ⅱ.我国国标推荐的食品药品中Ca元素含量的测定方法之一为利用将处理后的样品中的沉淀,过滤洗涤,然后将所得固体溶于过量的强酸,最后使用已知浓度的溶液通过滴定来测定溶液中的含量。针对该实验中的滴定过程,回答以下问题:
(5)溶液应该用______(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有______。
(6)试写出滴定过程中发生反应的离子方程式:__________________。
(7)滴定终点的现象为__________________。
(8)以下操作会导致测定结果偏高的是______(填字母)。
a.装入溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出
17.(12分)Ⅰ.汽车尾气是城市的主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,常温常压下其热化学方程式为 kJ mol。
(1)在一密闭容器中发生上述反应,下列描述能说明反应已达到平衡的是______(填字母)。
A.
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中NO与的物质的量之比为2∶1
D.容器中气体的分子总数不随时间而变化
(2)常温下,在一个容积为2L的恒容密闭容器中充入0.20 mol NO和0.20 mol CO,半分钟后反应达到平衡,测得容器中含 0.08 mol。
①常温下,该反应的平衡常数______,若要使K增大,则改变的条件为______。
②若继续通入0.20 mol NO和0.20 mol CO,则NO的平衡转化率会______(填“增大”“减小”或“不变”)。
Ⅱ.Bodenstein研究了反应: 。在716K时,气体混合物中碘化氢的物质的量分数与反应时间t的关系如表所示:
t/min 0 20 40 60 80 120
1 0.91 0.85 0.815 0.795 0.784
0 0.6 0.73 0.773 0.78 0.784
(3)根据上述实验结果,该反应的平衡常数K的计算式为______。
(4)上述反应中,正反应速率,逆反应速率,其中、为正、逆反应速率常数,则为______(用含K和的代数式表示)。若起始时,, min,则在 min时,______min。
18.(12分)二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
① kJ·mol
② kJ mol
③ kJ mo
回答下列问题:
(1)反应的______kJ mol;该反应的平衡常数______(用、、表示)。
(2)下列措施中,能提高(1)中产率的有______(填字母)。
A.使用过量的CO B.升高温度 C.增大压强 D.加入合适的催化剂
(3)一定温度下,将0.2 mol CO和0.1 mol 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得的体积分数为0.1。则0~5 min内______,,CO的转化率为______。
(4)将合成气以通入1 L的反应器中,一定条件下发生反应: ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是______(填字母)。
A.
B.
C.若在和316℃时,起始时,则平衡时,小于50%
19.(14分)
(1)25℃时,亚碲酸()的,。常温下,溶液的pH______(填“<”“>”或“=”)7。
(2)已知25℃时,要使溶液中沉淀完全[ mol L],则需控制溶液中______。
(3)室温下,测得用氨水吸收时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液,则溶液中______(已知))。
(4)若向浓烧碱溶液中通入气体,使所得溶液,则此时溶液中的______mol L(室温下,的,)。
(5)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体,其产物之一是。已知常温下碳酸的电离常数,,的电离常数,则所得的溶液中______(填“>”“<”或“=”)。
(6)是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出和反应的化学方程式:____________。
②利用制备无水时,可用和混合共热,试解释原因:____________。
20.(10分)软锰矿的主要成分为,还含有、MgO、、CaO,等杂质,工业上用软锰矿制取的流程如图:
已知:部分金属阳离子完全沉淀时的pH如下表
金属阳离子
完全沉淀时的pH 3.2 5.2 10.4 12.4
(1)“浸出”过程中转化为的离子方程式为______。
(2)第1步除杂中形成滤渣1的主要成分为______(填化学式),调pH至5~6所加的试剂,可选择______(填字母)。
a.CaO B.MgO C. D.氨水
(3)第2步除杂,主要是将、转化为相应氟化物沉淀除去,写出除去的离子方程式:______,该反应的平衡常数为______(结果保留一位小数)。
(已知:的;的;的)。
济宁市兖州区2023-2024学年高二上学期期中考试
化学参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.D 2.D 3.B 4.B 5.C 6.A 7.C 8.B 9.C 10.D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.AD 12.A 13.C 14.CD 15.C
16.(14分)
答案 Ⅰ.(1)玻璃搅拌器(2分)(2)偏大(1分)(3)偏小(1分)(4)c(1分)
Ⅱ.答案(5)酸式(1分)烧杯、锥形瓶(2分,漏写扣1分)
(6)(2分)
(7)滴入最后半滴高锰酸钾溶液,溶液由无色变为浅紫红色,且30秒内不褪色(2分)
(8)ac(2分,漏选扣1分,错选不得分)
17.(12分)
答案I.(1)BD(2分漏选扣1分,错选不得分)(2)①1600(2分)降温(1分)②增大(1分)
Ⅱ.(3)(2分)(4)(2分) (2分)
18.(12分)
(1)-246.1(2分) (2分)
(2)AC(2分)(3)0.003 mol·L·min(2分)15%(2分)(4)AB(2分,漏选扣1分,错选不得分)
19.(14分)
(1)<(2) mol·L(3)1∶2(4)(5)>
(6)①②和结晶水反应既能消耗水,生成的酸又能抑制水解
20.(10分)
(1)
(2)、(2分,漏写扣1分) ab(2分,漏选扣1分,错选不得分)
(3)
化学试题
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
可能用到的相对原子质量:H1 C12 N14 O16 Cr52
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.元末陶宗仪《辍耕录》中记载:“杭人削松木为小片,其薄为纸,熔硫磺涂木片顶端分
许,名日发烛……,盖以发火及代灯烛用也。”下列有关说法错误的是( )
A.将松木削薄为纸片状有助于发火和燃烧
B.“发烛”发火和燃烧利用了物质的可燃性
C.“发烛”发火和燃烧伴随不同形式的能量转化
D.硫磺是“发烛”发火和燃烧反应的催化剂
2.下列说法错误的是( )
A.已知冰的熔化热为6.0 kJ mol,冰中氢键键能为20 kJ mol,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,若加水稀释,则平衡向右移动,电离程度增大,不变
C.甲烷的燃烧热为890.3 kJ mol,则甲烷燃烧的热化学方程式可表示为 kJ mol
D.500℃、30MPa下,将0.5 mol 和1.5 mol 置于密闭的容器中充分反应生成,放热19.3 kJ,其热化学方程式为 kJ mol
3.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. mol L的溶液:、,、
B. mol L的溶液:、、、
C.澄清透明的无色溶液:、、、
D.和Al反应放出的溶液:,,,
4.将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:。若经2s后测得C的浓度为0.6 mol L,现有下列
几种说法:
①用物质A表示的反应的平均速率为0.3 mol L s
②用物质B表示的反应的平均速率为0.6 mol L s
③2s末时物质B的浓度为0.7 mol L
④2s末,物质A的转化率为70%
其中正确的是( )
A.①④ B.①③ C.②④ D.③④
5.过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,的反应历程如下,下列有关说法正确的是( )
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
6.有4种混合溶液,分别由等体积0.1 mol L的2种溶液混合而成:
①溶液与溶液 ②溶液与NaCl溶液
③溶液与NaOH溶液 ④溶液与盐酸
排序正确的是( )
A.③>①>②>④ B.③>②>①>④ C.④>②>①>③ D.④>②>③>①
7.用50 mL 0.50 mol L的盐酸与50 mL 0.55 mol L的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算反应热。下列关于实验和中和反应的说法正确的是( )
A.如图条件下实验过程中没有热量损失
B.玻璃搅拌器可用铜质材料代替
C.中和反应的逆反应是吸热反应
D.在25℃、101kPa下,强酸和强碱的稀溶液发生中和反应生成1 mol 时,放出57.3 kJ mol的热量
8.下表是25°C时某些盐的溶度积常数和弱酸的电离平衡常数。下列说法正确的是( )
化学式 AgCl
或
A.常温下,相同浓度的①、②、③溶液中,由大到小的顺序是①>②>③
B.向饱和氯水中滴加NaOH溶液至溶液刚好呈中性时,
C.AgCl在盐酸中的大于其在水中的
D.向浓度均为 mol L的KCl和的混合溶液中滴加mol L的溶液,先形成沉淀
9.下列事实中,不能用勒夏特列原理解释的是( )
①溶液中加入固体KSCN后颜色变深
②向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
③实验室常用排饱和食盐水的方法收集氯气
④棕红色加压后颜色先变深后变浅
⑤500℃时比室温更有利于合成氨的反应
⑥由、和组成的平衡体系加压后颜色变深
A.①②⑥ B.①③⑤ C.②⑤⑥ D.②③⑤
10.室温时,将0.10 mol L NaOH溶液滴入20.00 mL未知浓度的某一元酸HA溶液中,溶液pH随加入NaOH溶液体积的变化曲线如图所示(忽略溶液混合时体积的变化)。当 mL(图中c点),二者恰好完全反应。下列有关说法错误的是( )
A.HA为弱酸,其物质的量浓度为0.10 mol L
B.a点时:
C.的值:b点近似等于c点
D.d点时:
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.在恒压、NO和的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
A.反应的
B.图中X点所示条件下,延长反应时间不能提高NO的转化率
C.图中Y点所示条件下,增加的浓度不能提高NO的转化率
D.380℃下,mol L,NO的平衡转化率为50%,则平衡常数
12.如图为某实验测得0.1 mol L 溶液在升温过程中(不考虑水挥发)的pH变化曲线。下列说法正确的是( )
A.a点溶液的比c点溶液的小
B.a点时,
C.b点溶液中,
D.ab段,pH减小说明升温抑制了的水解
13.下列实验中,由实验现象不能得到正确结论的是( )
选项 实验 现象 结论
A 将溶液加入悬浊液中,振荡 沉淀由白色变为红褐色 的溶解度小于的溶解度
B 在醋酸钠溶液中滴入酚酞溶液并加热 加热后红色加深 证明盐类水解是吸热反应
C 向1.0 mol·L的溶液中滴加2滴甲基橙 溶液呈黄色 溶液呈碱性
D 相同的铝片分别与同温同体积且 mol·L的盐酸、硫酸反应 铝与盐酸反应产生气泡较快 可能是对该反应起到促进作用
14.我国科学家研究出在S-In催化剂上实现高选择性、高活性电催化还原制甲酸。图1表示不同催化剂及活性位上生成的能量变化,图2表示反应历程,其中吸附在催化剂表面的物种用*标注。下列说法错误的是( )
图1 图2
A.S-In/S表面更容易生成
B.与微粒间的静电作用促进了的活化
C.经两步转化生成
D.相对能量变化越大,越有利于抑制复合成
15.在一体积不变的密闭容器中充入2 mol ,并放入一定量的,发生化学反应: ,实验测得在压强分别为、时,平衡体系中NH 的体积分数随温度的变化曲线如图所示。已知:平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×该气体的物质的量分数。下列说法错误的是( )
A.该反应的
B.气体压强:
C.平衡后再加入,的转化率增大
D.M点的平衡常数
三、非选择题:本题共5小题,共60分
16.(12分)Ⅰ.某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将100 mL 0.5 mol L的盐酸与100 mL 0.55 mol L的NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
(1)从实验装置上看,图中缺少的一种玻璃仪器是______。
(2)简易量热计如果不盖杯盖,生成1 mol 时所测得中和反应的反应热()将______(填“偏大”“偏小”或“不变”)。
(3)若用等体积等物质的量浓度的进行上述实验,生成1 mol 时,所测得的中和反应的反应热的绝对值()将______(填“偏大”“偏小”或“无影响”)。
(4)下列说法正确的是______(填字母)。
a.向内筒中加入稀碱时,应当缓慢而匀速地加入
b.将用量筒量取好的稀盐酸加入内筒后,应当快速用水冲洗量筒内壁剩余的稀盐酸至内筒中,以免造成测量误差
c.用量筒量取稀酸或碱时,眼睛必须与液体凹面最低处相平
d.内筒洗净后,未及时烘干,直接用该内筒进行实验,对生成1 mol 时所测得的中和反应的反应热()无影响
Ⅱ.我国国标推荐的食品药品中Ca元素含量的测定方法之一为利用将处理后的样品中的沉淀,过滤洗涤,然后将所得固体溶于过量的强酸,最后使用已知浓度的溶液通过滴定来测定溶液中的含量。针对该实验中的滴定过程,回答以下问题:
(5)溶液应该用______(填“酸式”或“碱式”)滴定管盛装,除滴定管外,还需要的玻璃仪器有______。
(6)试写出滴定过程中发生反应的离子方程式:__________________。
(7)滴定终点的现象为__________________。
(8)以下操作会导致测定结果偏高的是______(填字母)。
a.装入溶液前未润洗滴定管 b.滴定结束后俯视读数
c.滴定结束后,滴定管尖端悬有一滴溶液 d.滴定过程中,振荡时将待测液洒出
17.(12分)Ⅰ.汽车尾气是城市的主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,常温常压下其热化学方程式为 kJ mol。
(1)在一密闭容器中发生上述反应,下列描述能说明反应已达到平衡的是______(填字母)。
A.
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中NO与的物质的量之比为2∶1
D.容器中气体的分子总数不随时间而变化
(2)常温下,在一个容积为2L的恒容密闭容器中充入0.20 mol NO和0.20 mol CO,半分钟后反应达到平衡,测得容器中含 0.08 mol。
①常温下,该反应的平衡常数______,若要使K增大,则改变的条件为______。
②若继续通入0.20 mol NO和0.20 mol CO,则NO的平衡转化率会______(填“增大”“减小”或“不变”)。
Ⅱ.Bodenstein研究了反应: 。在716K时,气体混合物中碘化氢的物质的量分数与反应时间t的关系如表所示:
t/min 0 20 40 60 80 120
1 0.91 0.85 0.815 0.795 0.784
0 0.6 0.73 0.773 0.78 0.784
(3)根据上述实验结果,该反应的平衡常数K的计算式为______。
(4)上述反应中,正反应速率,逆反应速率,其中、为正、逆反应速率常数,则为______(用含K和的代数式表示)。若起始时,, min,则在 min时,______min。
18.(12分)二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
① kJ·mol
② kJ mol
③ kJ mo
回答下列问题:
(1)反应的______kJ mol;该反应的平衡常数______(用、、表示)。
(2)下列措施中,能提高(1)中产率的有______(填字母)。
A.使用过量的CO B.升高温度 C.增大压强 D.加入合适的催化剂
(3)一定温度下,将0.2 mol CO和0.1 mol 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得的体积分数为0.1。则0~5 min内______,,CO的转化率为______。
(4)将合成气以通入1 L的反应器中,一定条件下发生反应: ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是______(填字母)。
A.
B.
C.若在和316℃时,起始时,则平衡时,小于50%
19.(14分)
(1)25℃时,亚碲酸()的,。常温下,溶液的pH______(填“<”“>”或“=”)7。
(2)已知25℃时,要使溶液中沉淀完全[ mol L],则需控制溶液中______。
(3)室温下,测得用氨水吸收时,溶液中含碳(氮)各粒子的物质的量分数和pH的关系如图,若所得溶液,则溶液中______(已知))。
(4)若向浓烧碱溶液中通入气体,使所得溶液,则此时溶液中的______mol L(室温下,的,)。
(5)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体,其产物之一是。已知常温下碳酸的电离常数,,的电离常数,则所得的溶液中______(填“>”“<”或“=”)。
(6)是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出和反应的化学方程式:____________。
②利用制备无水时,可用和混合共热,试解释原因:____________。
20.(10分)软锰矿的主要成分为,还含有、MgO、、CaO,等杂质,工业上用软锰矿制取的流程如图:
已知:部分金属阳离子完全沉淀时的pH如下表
金属阳离子
完全沉淀时的pH 3.2 5.2 10.4 12.4
(1)“浸出”过程中转化为的离子方程式为______。
(2)第1步除杂中形成滤渣1的主要成分为______(填化学式),调pH至5~6所加的试剂,可选择______(填字母)。
a.CaO B.MgO C. D.氨水
(3)第2步除杂,主要是将、转化为相应氟化物沉淀除去,写出除去的离子方程式:______,该反应的平衡常数为______(结果保留一位小数)。
(已知:的;的;的)。
济宁市兖州区2023-2024学年高二上学期期中考试
化学参考答案
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1.D 2.D 3.B 4.B 5.C 6.A 7.C 8.B 9.C 10.D
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.AD 12.A 13.C 14.CD 15.C
16.(14分)
答案 Ⅰ.(1)玻璃搅拌器(2分)(2)偏大(1分)(3)偏小(1分)(4)c(1分)
Ⅱ.答案(5)酸式(1分)烧杯、锥形瓶(2分,漏写扣1分)
(6)(2分)
(7)滴入最后半滴高锰酸钾溶液,溶液由无色变为浅紫红色,且30秒内不褪色(2分)
(8)ac(2分,漏选扣1分,错选不得分)
17.(12分)
答案I.(1)BD(2分漏选扣1分,错选不得分)(2)①1600(2分)降温(1分)②增大(1分)
Ⅱ.(3)(2分)(4)(2分) (2分)
18.(12分)
(1)-246.1(2分) (2分)
(2)AC(2分)(3)0.003 mol·L·min(2分)15%(2分)(4)AB(2分,漏选扣1分,错选不得分)
19.(14分)
(1)<(2) mol·L(3)1∶2(4)(5)>
(6)①②和结晶水反应既能消耗水,生成的酸又能抑制水解
20.(10分)
(1)
(2)、(2分,漏写扣1分) ab(2分,漏选扣1分,错选不得分)
(3)
同课章节目录
