2.3 物质的量 同步检测(含解析)2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3 物质的量 同步检测(含解析)2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 248.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-07 16:00:16 | ||
图片预览



文档简介
2.3 物质的量 同步检测
一、单选题
1.用氢氧化钠固体配置 100 mL 0.1mol/L 的氢氧化钠溶液,有以下仪器:①100 mL 量筒 ②滤纸 ③烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒, 配制过程中需要用到的仪器有( )
A.①③④⑦ B.③④⑤⑥⑦
C.①③④⑤⑥⑦ D.①②③④⑤⑥⑦
2.下列物理量单位不正确的是( )
A.物质的量:mol B.摩尔质量:
C.气体摩尔体积: D.阿伏加德罗常数:
3.下列说法中正确的是( )
A.摩尔是表示物质质量的单位
B.物质的量就是指物质的质量
C.摩尔是表示物质粒子多少的物理量
D.物质的量适用于计量分子、原子、离子等粒子
4.设 为阿伏加德罗常数的值。下列说法正确的是( )
A.工业上电解 制备 时,产生气体的分子数为3
B. 三硫化四磷( ,如图所示)中含有的极性键的数目为6
C.标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2
D. 与足量乙醇在一定条件下反应,生成的酯基的数目为2
5.将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
A.0.3mol/L B.0.04mol/L C.0.03mol/L D.0.05mol/L
6.下列关于“摩尔质量”的描述或应用,正确的是( )
A.二氧化碳的摩尔质量等于它的相对分子质量
B.一个氟原子的质量约等于
C.空气的摩尔质量为29
D.1 mol Cl-的质量为35.5
7.对1 mol·L 1的BaCl2溶液的有关叙述中,正确的是( )
A.该溶液中c(Cl-)=2 mol·L 1
B.该溶液中Ba2+的物质的量是1mol
C.可使用500mL容量瓶配制180mL该浓度的BaCl2溶液
D.将208gBaCl2固体溶解在1L水中,所得溶液的浓度为1 mol·L 1
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1molK3[Fe(CN)6]配合物中含σ键数目为24NA
B.30g质量分数为10%的甲醛水溶液中含氢原子数为3.2NA
C.5.6g铁粉与足量的高温水蒸气反应,转移的电子数为0.3NA
D.标准状况下,4.48LNO与3.2gO2充分反应,产物的分子数为0.2NA
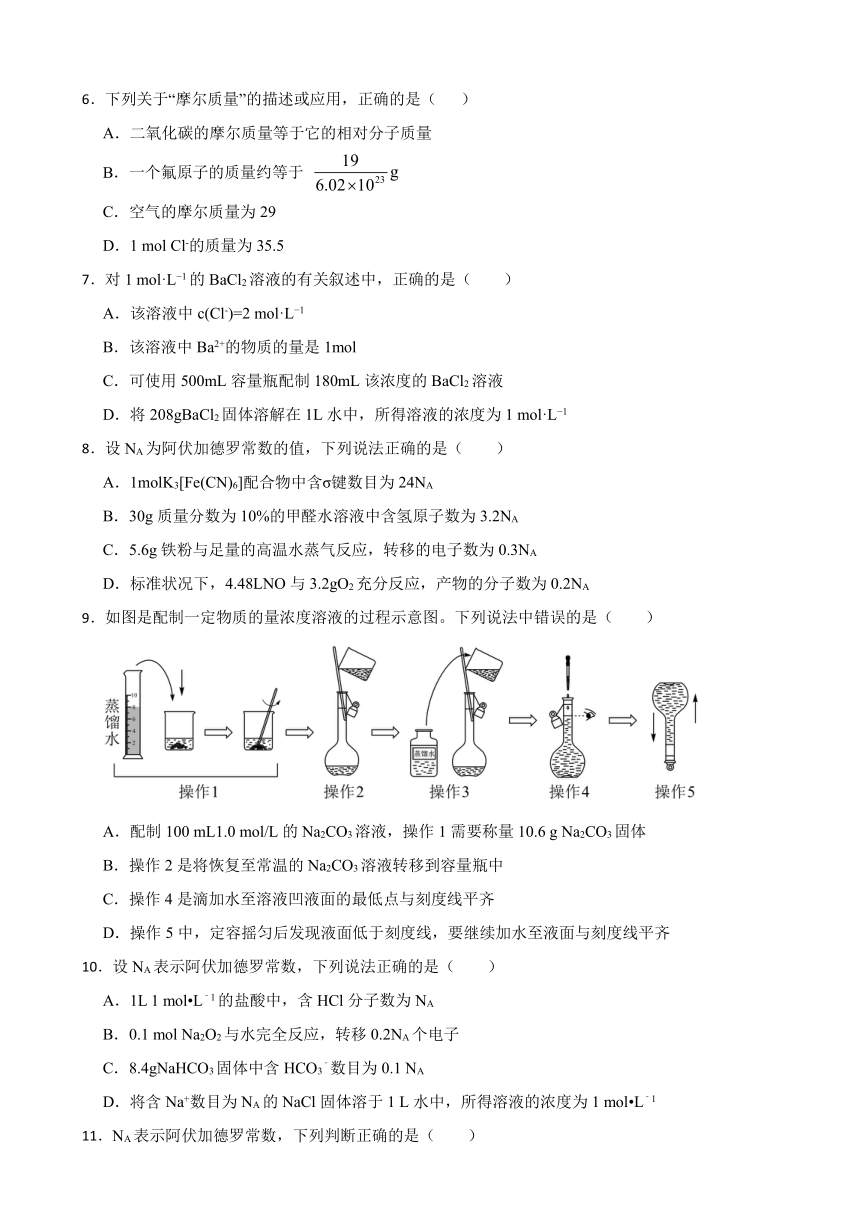
9.如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( )
A.配制100 mL1.0 mol/L的Na2CO3溶液,操作1需要称量10.6 g Na2CO3固体
B.操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中
C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐
D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐
10.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1L 1 mol L﹣1的盐酸中,含HCl分子数为NA
B.0.1 mol Na2O2与水完全反应,转移0.2NA个电子
C.8.4gNaHCO3固体中含HCO3﹣数目为0.1 NA
D.将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol L﹣1
11.NA表示阿伏加德罗常数,下列判断正确的是( )
A.25℃,pH=13的NaOH溶液中含有OH﹣的数目为0.1NA
B.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
C.等物质的量的N2和CO的质量均为28g
D.常温下,1L 0.1mol/LNa2CO3溶液中,含有阴离子的总数小于0.1NA
12.下列叙述中,错误的是( )
A.阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1
B.NA个电子的物质的量是1 mol
C.在同温同压下,相同体积的任何气体单质所含的分子数目相同
D.H2SO4的摩尔质量(M)是98
13.体检时的一些指标常用物质的量浓度表示(可将元素近似折算成相应离子)。根据下图相关数据,下列分析不正确的是( )
A.1mmol/L=1.0×10-3mol/L
B.可用焰色反应测定钾离子的含量
C.该报告中Mg2+指标正常
D.若某人10mL血清样本中含钙离子1.2毫克,则其钙含量略偏高
14.下列有关0.1 mol·L-1NaOH溶液的叙述正确的是( )
A.1L该溶液中含有NaOH 40g
B.100mL该溶液中含有OH- 0.01mol
C.从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1L水中溶解4g NaOH即可配制得0.1 mol·L-1 NaOH溶液
15.某同学参阅了“84”消毒液说明中的成分,欲用 NaClO固体配制480mL含 NaClO2.5%,密度为1.19g·cm-3的消毒液。下列说法正确的是( )
A.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
B.需要称量的 NaClO固体的质量为 14.3g
C.所配得的 NaClO消毒液在空气中光照,久置后溶液中 NaClO的物质的量浓度减小
D.配制过程需要玻璃仪器 500mL容量瓶、烧杯、胶头滴管三种
16.在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是( )
A. B. C. D.
二、综合题
17.某学生需要用烧碱固体配制1mol L-1的NaOH溶液460mL。请回答下列问题:
(1)计算:需要称取NaOH固体 g;
(2)配制时,必须使用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒,还缺少的仪器是 、 (填仪器名称);
(3)在使用容量瓶前必须进行的一步的操作名称是 ;
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是_______(填字母代号)。
A.实验前用蒸馏水洗涤容量瓶后未烘干
B.天平砝码生锈
C.配制过程中溶解氢氧化钠后烧杯没有洗涤
D.氢氧化钠溶液未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时眼睛俯视容量瓶
18.
(1)0.5
mol CH4 的质量为 g,在标准状况下的体积为 L;含 个碳原子。
(2)将标准状况下 22.4 L 的 HCl 溶于水配成 200 mL 的溶液,所得溶液的物质的量浓度为 mol/L;配制 300 mL 0.5 mol/L 氯化钠溶液,需要 1.5 mol/L 的氯化钠溶液的体积为 mL。
(3)1.204×1024
个水分子的物质的量为 mol。
19.化学基本概念、化学用语是中学化学学习的重要内容之一.
I:氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:NO +4H++3e﹣═NO+2H2O.
下列四种物质:KMnO4,Na2CO3,Na2SO3,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生.
(1)写出并配平该氧化还原反应的离子方程式: .
(2)若反应后,还原产物的化合价降低,而其他物质价态保持不变,则反应中氧化剂与还原剂的物质的量之比将 (填“增大”“不变”减小”或“不能确定”).
(3)II:实验室需要用Na2CO3 l0H2O配制0.10mol/L Na2CO3溶液240mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 .
(4)计算.
称量.配制该溶液需称取Na2CO3 10H2O晶体 g.
①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置:
②称量完毕,将药品倒入烧杯中.
(5)溶解、冷却,该步实验中需要使用玻璃棒,目的是
(6)转移、洗涤. 定容,摇匀.
若观察定容时液面情况如图2所示,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”).
20.下表是某位化学教师的肝肾糖脂血液化验单部分内容:
已知:1摩尔(mol)等于1000毫摩尔(mmol),血液中葡萄糖简称血糖,分子式为C6H12O6,请根据以上信息回答下列问题:
项目名称 数据 参考值
尿素氮 2.95 2.00﹣6.10 mmol L﹣1
葡萄糖 4.50 3.89﹣6.11 mmol L﹣1
总胆固醇 3.75 <5.20 mmol L﹣1
甘油三酯 1.80↑ <1.70 mmol L﹣1
(1)这位教师的血糖含量属 (填“正常”、“偏高”或“偏低”)
(2)这位教师的1mL血液中含葡萄糖 g.
21.实验室进行以下实验。请回答下列问题:
(1)实验室配制盐酸,需要量取浓盐酸 ,配制过程中需用的玻璃仪器有量筒、烧杯、玻璃棒、 。配制过程中,多次用到玻璃棒,在此过程中玻璃棒的两个作用分别为 、 。
(2)下列操作会使所配制的盐酸浓度偏低的是____(填标号)。
A.量取浓盐酸时仰视量筒的刻度线
B.转移溶液时,未洗涤烧杯和玻璃棒
C.定容时俯视观察液面
D.定容振荡后,发现液面低于刻度线,然后补加蒸馏水至刻度线
(3)称量,溶于水中,向其中滴加盐酸至恰好完全反应,消耗盐酸的体积为 ,若称量的中含有少量,则消耗盐酸的体积将 (填“偏大”“偏小”或“不变”)。
答案解析部分
1.【答案】B
【解析】【解答】配制100mL0.1mol/L的氢氧化钠溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,量筒(可用可不用),所以配制过程中需要用到的仪器有③④⑤⑥⑦,故B符合题意。
故答案为:B。
【分析】配制一定物质的量浓度的溶液需要使用到的仪器有:烧杯、天平、容量瓶、胶头滴管和玻璃棒。
2.【答案】C
【解析】【解答】A. 物质的量书写为mol ,A不符合题意;
B. 摩尔质量书写为 ,B不符合题意;
C. 气体摩尔体积书写为 ,C符合题意;
D. 阿伏加德罗常数书写为 ,D不符合题意;
故答案为:C。
【分析】熟记常见物理量单位的书写。
3.【答案】D
【解析】【解答】A、质量的单位为g,摩尔是物质的量的单位,故A不符合题意;
B、物质的量用于描述微观粒子的物理量,与物质的质量完全不同,物质的量的单位为mol,而质量的单位为g,二者为完全不同的两个物理量,故B不符合题意;
C、摩尔是物质的量的单位,物质的量是表示物质粒子多少的物理量,故C不符合题意;
D、物质的量适用于计量微观粒子,如分子、原子、离子等微观粒子粒子,不适用于计量宏观物质,故D符合题意。
故答案为:D。
【分析】A.摩尔是物质的量的单位;
B.物质的量是用于描述微观粒子的物理量,不同于质量;
C.物质的量是表示物质粒子多少的物理量;
D.物质的量用于计量微观颗粒;
4.【答案】B
【解析】【解答】A.电解 方程式为2 4Al+3O2↑,生成 的物质的量为 ,则产生1.5mol O2,产生气体的分子数为1.5 ,A不符合题意;
B. 的物质的量为 ,根据图可知含有的极性键P-S的数目为6 ,B符合题意;
C.标准状况下,22.4L氯气物质的量为 ,氯气和NaOH反应生成NaClO和NaCl,氯元素自身发生歧化反应,化合价从0价升到+1价,1mol氯气反应转移电子数为 ,C不符合题意;
D.酯化反应是可逆反应, 与乙醇反应不能完全转化,生成酯基的数目小于2 ,D不符合题意;
故答案为:B。
【分析】A.根据2 4Al+3O2↑,结合计算;
B.该物质含有的极性键为P-S键;
C.氯气与氢氧化钠反应生成次氯酸钠、氯化钠和水;
D.酯化反应为可逆反应,不能进行彻底。
5.【答案】C
【解析】【解答】根据溶液稀释时溶质的物质的量不变,c==0.03mol/L,
故答案为:C。
【分析】根据稀释定律c稀×V稀=c浓×V浓计算可得。
6.【答案】B
【解析】【解答】A.二氧化碳的摩尔质量是以g/mol为单位,在数值上等于它的相对分子质量,A不符合题意;
B.1mol微粒是阿伏加德罗常数个微粒,氟原子的摩尔质量为19g/mol,所以一个氟原子质量= = g,B符合题意;
C.摩尔质量是以g/mol为单位,数值上等于空气的相对分子质量,空气的相对分子质量平均为29,则空气的摩尔质量为29g/mol,C不符合题意;
D.1 mol Cl-的质量是m(Cl-)=35.5g/mol×1mol=35.5g,D不符合题意;
故答案为:B。
【分析】A.摩尔质量在数值上等于物质的相对分子质量;
B.根据m=计算;
C.空气的相对分子质量平均为29,摩尔质量在数值上等于物质的相对分子质量;
D.根据m=nM计算。
7.【答案】A
【解析】【解答】A.1 mol·L 1的BaCl2溶液中c(Cl-)=2 mol·L 1,故A符合题意;
B.没有溶液体积,不能计算Ba2+的物质的量,故B不符合题意;
C.容量瓶常有25,50,100,250,500,1000mL等数种规格,可使用250mL容量瓶配制180mL该浓度的BaCl2溶液,故C不符合题意;
D.将208gBaCl2固体溶解在1L水中,所得溶液的体积不是1L,溶液的浓度不是1 mol·L 1,故D不符合题意;
故答案为:A。
【分析】A、离子浓度=溶质浓度×离子底数;
B、物质的量=浓度×体积;
C、应该采用250mL的容量瓶;
D、公式c=n/V中,V为溶液体积。
8.【答案】B
【解析】【解答】A.CN含有一个σ键和2个π键,其中Fe与CN以σ键连接,所以1molK3[Fe(CN)6]配合物中含σ键数目为12NA,故A不符合题意;
B.30g质量分数为10%的甲醛水溶液中,HCHO质量为3g,物质的量为=0.1mol;水的质量为27g,物质的量为=1.5mol,总的H原子的物质的量为=3.2mol,故B符合题意;
C.5.6g铁粉的物质的量为=0.1mol,铁与水蒸气反应生成四氧化三铁和氢气,即3molFe转移8mol电子,所以0.1mol铁粉完全反应转移mol电子,故C不符合题意;
D.标况下,4.48LNO物质的量为=0.2mol,3.2gO2物质的量为=0.1mol,发生反应:,又存在,所以分子数小于0.2NA,故D不符合题意;
故答案为:B。
【分析】A.单键均为σ键,双键含有1个σ键和1个π键,三键中含有1个σ键和2个π键,配位键为σ键;
C.铁与水蒸气反应生成四氧化三铁和氢气;
D.NO2存在转化。
9.【答案】D
【解析】【解答】A.配制100 mL1.0 mol/L的Na2CO3溶液,需要溶质的物质的量n(Na2CO3)=1.0 mol/L×0.1 L=0.1 mol,则需称量其质量m(Na2CO3)=0.1 mol×106 g/mol=10.6 g,A不符合题意;
B.容量瓶配制溶液要求使用温度是室温,所以操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中,B不符合题意;
C.操作4是定容,向容量瓶中加水至离刻度线1-2 cm时改用胶头滴管滴加水,当滴加水至溶液凹液面的最低点与刻度线平齐,C不符合题意;
D.操作5中,定容摇匀后发现液面低于刻度线,这是由于部分溶液黏在容量瓶刻度线以上的瓶颈上。由于溶液具有均一性,与溶液体积大小无关,所以溶液的浓度就是要配制溶液的浓度,如果此时加水至液面与刻度线平齐,对已经配制的溶液起稀释作用,导致溶液浓度偏低,D符合题意;
故答案为:D。
【分析】A、结合公式n=c·V和n=m/M判断;
B、转移至容量瓶前先冷却;
C、水的凹液面应该和刻线相切;
D、定容后摇匀,此时不能再加水。
10.【答案】C
【解析】【解答】解:A、HCl溶于水后能完全电离,故盐酸溶液中无HCl分子,故A错误;
B、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故B错误;
C、8.4g碳酸氢钠的物质的量为0.1mol,而1mol碳酸氢钠中含1mol碳酸氢根,故0.1mol碳酸氢钠中含0.1mol碳酸氢根即0.1NA个,故C正确;
D、将氯化钠溶于1L水中,溶于体积大于1L,则溶液浓度小于1mol/L,故D错误.
故选C.
【分析】A、HCl溶于水后能完全电离;
B、过氧化钠与水的反应为歧化反应;
C、求出碳酸氢钠的物质的量,然后根据1mol碳酸氢钠中含1mol碳酸氢根来分析;
D、将氯化钠溶于1L水中,溶于体积大于1L.
11.【答案】B
【解析】【解答】解:A.没有告诉氢氧化钠溶液的体积,无法计算溶液中钠离子的物质的量及数目,故A错误;
B.常温常压下,温度高于标况下,所以气体摩尔体积大于22.4L/mol,22.4L二氧化碳的物质的量小于1mol,含有的CO2分子数小于NA个,故B正确;
C.等物质的量的氮气和一氧化碳具有相同的质量,但是没有告诉物质的量,无法计算二者的质量,故C错误;
D.1L 0.1mol/LNa2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致阴离子数目增多,所以溶液中含有阴离子的总数大于0.1NA,故D错误;
故选B.
【分析】A.缺少氢氧化钠溶液的体积,无法计算溶液中钠离子的数目;
B.常温常压下,气体摩尔体积大于22.4/mol,22.4L二氧化碳的物质的量小于1mol;
C.没有告诉氮气和一氧化碳的物质的量,无法计算二者的质量;
D.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致溶液中阴离子数目增加.
12.【答案】D
【解析】【解答】A. 以12g 12C中所含的碳原子数为阿伏加德罗常数,符号为NA,其近似值为6.02×1023 mol-1,A符合题意;
B. 根据N=nNA可知NA个电子的物质的量是1 mol,B符合题意;
C. 根据阿伏加德罗定律可知在同温同压下,相同体积的任何气体单质所含的分子数目相同,C符合题意;
D. H2SO4的摩尔质量(M)是98g/mol,D不符合题意。
故答案为:D。
【分析】A、根据阿伏加德罗常数的概念解答;
B、根据微粒个数N=nNA解答;
C、根据在同温同压下n=,N=nNA解答;
D、摩尔质量的单位为g/mol解答;
13.【答案】B
【解析】【解答】A. 1mmol/L=1.0×10-3mol/L,A正确;
B. 焰色反应只能定性判断元素的存在,不能用焰色反应测定钾离子的含量,B不符合题意;
C. 该报告中Mg2+的浓度介于0.75与1.25之间,因此指标正常,C正确;
D. 若某人10mL血清样本中含钙离子1.2毫克,浓度是 ,所以则其钙含量略偏高,D正确,
故答案为:B。
【分析】A.毫摩尔每升与摩尔每升的关系进行判断;
B.颜色反应只能说明某种金属元素的存在;
C.根据表中数据进行判断;
D.根据物质的量浓度的定义式进行计算、判断即可。
14.【答案】B
【解析】【解答】
A.1L 0.1mol L-1NaOH溶液中含氢氧化钠的质量为:m=c V M=0.1mol L-1×1L×40g mol-1=4.0g,故A不符合题意;
B.100mL 0.1mol L-1NaOH溶液中含OH-的物质的量为:n(OH-)=n(NaOH)=c V=0.1mol L-1×0.1L=0.01mol,故B符合题意;
C.溶液是均一稳定的,取出溶液的浓度与原溶液的浓度相同,故C不符合题意;
D.在1 L水中溶解4g NaOH所得溶液的体积不是1L,无法计算溶液体积,所以无法计算NaOH溶液的物质的量浓度,故D不符合题意。
故答案为:B
【分析】
,溶液为均一的稳定的的混合物,取出的任何一部分的浓度均完全相同。
15.【答案】C
【解析】【解答】A.配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗净后,不用干燥,容量瓶中有无水,对实验结果无影响,故A不符合题意;
B.实验室没有480mL的容量瓶,应用500mL的容量瓶,称量NaClO的质量为500mL×1.19g/cm3×2.5%=14.9g,故B不符合题意;
C.碳酸的酸性强于次氯酸,空气中含有CO2,NaClO+CO2+H2O=NaHCO3+HClO,HClO见光分解,2HClO 2HCl+ O2↑,因此久置后溶液中NaClO的物质的量浓度减小,故C符合题意;
D.配制溶液过程中需要的玻璃仪器是500mL容量瓶、烧杯、胶头滴管、玻璃棒,故D不符合题意;
故答案为C。
【分析】一定物质的量浓度的溶液的配制需要注意容量瓶的选取,需要遵循“大而近”的原则,配制480mL的溶液应该选用500mL的容量瓶;
A.配制一定物质的量浓度的溶液时,是先溶解再转移到容量瓶中,加蒸馏水定容,容量瓶用蒸馏水洗净后,不干燥,对实验结果无影响;
B.容量瓶选取后,计算溶质质量是按照容量瓶的容积算;
C.碳酸的酸性强于次氯酸,NaClO+CO2+H2O=NaHCO3+HClO,HClO不稳定,2HClO 2HCl+ O2↑,因此久置后溶液中NaClO的物质的量浓度减小;
D.根据配制步骤分析每一步需要用到那些仪器;
16.【答案】B
【解析】【解答】考查一定物质的量浓度溶液的配制。定容时液面的最低点与刻度线相切,B符合题意。
故答案为:B
【分析】熟悉配置一定物质的量浓度的溶液的定容操作。
17.【答案】(1)20.0
(2)500 mL容量瓶;胶头滴管
(3)检漏
(4)B;D;F
【解析】【解答】(1) 称取NaOH固体的质量为1×500×10-3×40=20;
故答案为: 第1空、20.0
(2) 缺少的仪器是500mL容量瓶和胶头滴管;
故答案为:
第1空、500 mL容量瓶
第2空、胶头滴管
(3) 使用容量瓶前需要检漏;
故答案为: 第1空、检漏
(4) A.容量瓶有水无影响,A不符合题意;
B.天平砝码生锈,质量增加,浓度偏高,B符合题意;
C. 没有洗涤容量瓶中溶质的物质的量减小,溶液的浓度偏低,C不符合题意;
D.未冷却到室温就注入容量瓶,溶液的体积偏低,溶液浓度偏高,D符合题意;
E.加蒸馏水时不慎超过了刻度线,相当于进行稀释,溶液浓度偏小,E不符合题意;
F.定容时俯视液面,体积偏低,溶液浓度偏高,F符合题意;
故答案为: B D F
【分析】(1) 容量瓶配制溶液;
(2) 配制浓度时,需要的仪器是托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、500mL容量瓶;
(3) 使用容量瓶前需要检漏,检漏的具体操作为向容量瓶中加入适量水,盖上瓶塞,倒立,观察是否漏水;
(4)A.容量瓶有水无影响;
B.天平砝码生锈,质量增加,浓度偏高;
C. 没有洗涤容量瓶中溶质的物质的量减小,溶液的浓度偏低;
D.未冷却到室温就注入容量瓶,溶液的体积偏低,溶液浓度偏高;
E.加蒸馏水时不慎超过了刻度线,相当于进行稀释,溶液浓度偏小;
F.定容时俯视液面,体积偏低,溶液浓度偏高。
18.【答案】(1)8;11.2;3.01×1023
(2)5;100
(3)2
【解析】【解答】(1)0.5 mol CH4 的质量为0.5mol×16g/mol=8g,在标准状况下的体积为0.5mol×22.4L/mol=11.2L;含0.5mol×6.02×1023mol-1=3.01×1023个碳原子。
(2)将标准状况下 22.4 L 的 HCl 的物质的量为1mol,溶于水配成 200 mL 的溶液,所得溶液的物质的量浓度为1mol/0.2L=5mol/L;配制 300 mL 0.5 mol/L 氯化钠溶液,需要 1.5 mol/L 的氯化钠溶液的体积为VmL,有300×0.5=1.5V,解V=100mL。
(3)1.204×1024 个水分子的物质的量为1.204×1024/6.02×1023mol-1=2mol。
【分析】(1)根据甲烷的摩尔质量计算其质量,利用气体摩尔体积计算气体体积,根据甲烷的物质的量基酸碳原子的个数;
(2)根据计算溶液的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算需要1.5mol/LNaCl的体积;
(3)根据阿伏加德罗常数与物质的量的关系进行计算。
19.【答案】(1)2H++2NO3﹣+3SO32﹣=3SO42﹣+2NO↑+H2O
(2)减小
(3)250mL容量瓶;胶头滴管
(4)7.2
(5)搅拌,加速溶解和冷却
(6)偏低
【解析】【解答】解:Ⅰ(1)亚硫酸根离子具有强的还原性,在酸性环境下与硝酸根离子发生反应生成硫酸根离子、二氧化氮和水,离子方程式为:2H++2NO3﹣+3SO32﹣=3SO42﹣+2NO↑+H2O;(2)若反应后,还原产物的化合价降低,而其他物质价态保持不变,需要的氧化剂的物质的量偏小,则反应中氧化剂与还原剂的物质的量之比将减小;故答案为:减小;Ⅱ:(3)配制0.10mol/L Na2CO3溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,需要使用的要求为:烧杯、玻璃棒、胶头滴管、250mL容量瓶,还缺少的仪器为:胶头滴管、250mL容量瓶;故答案为:250mL容量瓶;胶头滴管;(4)配制0.10mol/L Na2CO3溶液240mL,应选择250mL容量瓶,需要Na2CO3 10H2O的质量m=0.10mol/L×0.25L×286g/mol=7.2g,故答案为:7.2;①称量时需放一个5g的砝码,2.2g需调游码,如图所示: ,故答案为: ;(5)为加快溶解和冷却速度,在溶解、冷却时需用玻璃棒不断的搅拌,故答案为:搅拌,加速溶解和冷却;(6)仰视刻度线,导致溶液的体积偏大,依据C= 可知,溶液的体积偏大,溶液的浓度偏低,故答案为:偏低.
【分析】Ⅰ:(1)亚硫酸根离子具有强的还原性,能够被硝酸氧化生成硫酸根离子,硝酸根离子被还原为一氧化氮,S元素由+4价升高到+6价,N元素由+5价降低到+2价,依据化合价升降数相同结合原子个数守恒写出方程式;(2)若反应后,还原产物的化合价降低,而其他物质价态保持不变,需要的氧化剂的物质的量偏小;Ⅱ:(1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;(3)依据m=CVM计算需要溶质的质量;①称量时需放一个5g的砝码,2.2g需调游码;(4)依据玻璃棒在溶解固体时作用解答;(5)仰视刻度线,导致溶液的体积偏大.
20.【答案】(1)正常
(2)8.1×10﹣4
【解析】【解答】解:(1)这位教师的血糖含量4.50,在3.89﹣6.11 mmol L﹣1范围之内,属于正常,故答案为:正常;(2)血液中葡萄糖的浓度为4.50mmol L﹣1,M(C6H12O6)=180g/mol,则1mL血液中含葡萄糖质量为1×10﹣3L×4.50×10﹣3mol L﹣1×180g/mol=8.1×10﹣4g,
故答案为:8.1×10﹣4.
【分析】血液中葡萄糖的浓度为4.50mmol L﹣1,根据参考值判断是否正常,结合M(C6H12O6)=180g/mol,m=nM计算即可.
21.【答案】(1)25.0;容量瓶、胶头滴管;搅拌;引流
(2)B;D
(3)40.0;偏小
【解析】【解答】(1)根据稀释定律,c1V1=c2V2,v2===25.0mL;配制100mL2.5mol/L,盐酸溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管.配制过程中,稀释浓盐酸要用玻璃棒进行搅拌,将稀释后的溶液转移至容量瓶中需要用玻璃棒进行引流;
(2)A.量取浓盐酸时仰视量筒的刻度线会使量取的浓盐酸的量增加,使所配制的盐酸浓度偏高,A不正确;
B.转移溶液时,未洗涤烧杯和玻璃棒,会使容量瓶中的溶质减少,使所配制的盐酸浓度偏低,B正确;
C.定容时俯视观察液面,会使容量瓶中的溶液体积减少,使所配制的盐酸浓度偏高,C不正确;
D.定容振荡后,发现液面低于刻度线,然后补加蒸馏水至刻度线,相当于给所配制的溶液稀释,使盐酸溶液浓度偏低,D正确;
故答案为:BD;
(3)n(NaOH)= =0.1mol,由NaOH+HCl=NaCl+H2O,n(NaOH)=n(HCl)=0.1mol,则V(HCl)===40mL;根据反应NaOH+HCl=NaCl+H2O和Na2CO3+2HCl=NaCl+H2O+CO2,可知相同质量的NaOH和Na2CO3,氢氧化钠消耗盐酸多,碳酸钠消耗盐酸少,则称量的NaOH中含有少量Na2CO3,则消耗盐酸的体积将偏小;
【分析】(1)根据稀释定律c稀×V稀=c浓×V浓计算可得;
(2)结果偏大:砝码生锈,溶解后没有恢复到室温,读数时俯视刻线;
结果偏小:烧杯没有洗涤,读数时仰视刻线,摇匀后发现液面低于刻线继续加水,定容后发现液面超过刻线吸掉多余的部分,转移时由部分液体溅出;
无影响:容量瓶没有干燥;
(3)结合化学计量数之比等于物质的量之比判断。
一、单选题
1.用氢氧化钠固体配置 100 mL 0.1mol/L 的氢氧化钠溶液,有以下仪器:①100 mL 量筒 ②滤纸 ③烧杯 ④托盘天平 ⑤100 mL 容量瓶 ⑥胶头滴管 ⑦玻璃棒, 配制过程中需要用到的仪器有( )
A.①③④⑦ B.③④⑤⑥⑦
C.①③④⑤⑥⑦ D.①②③④⑤⑥⑦
2.下列物理量单位不正确的是( )
A.物质的量:mol B.摩尔质量:
C.气体摩尔体积: D.阿伏加德罗常数:
3.下列说法中正确的是( )
A.摩尔是表示物质质量的单位
B.物质的量就是指物质的质量
C.摩尔是表示物质粒子多少的物理量
D.物质的量适用于计量分子、原子、离子等粒子
4.设 为阿伏加德罗常数的值。下列说法正确的是( )
A.工业上电解 制备 时,产生气体的分子数为3
B. 三硫化四磷( ,如图所示)中含有的极性键的数目为6
C.标准状况下,22.4L氯气与足量烧碱溶液反应,转移的电子数为2
D. 与足量乙醇在一定条件下反应,生成的酯基的数目为2
5.将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
A.0.3mol/L B.0.04mol/L C.0.03mol/L D.0.05mol/L
6.下列关于“摩尔质量”的描述或应用,正确的是( )
A.二氧化碳的摩尔质量等于它的相对分子质量
B.一个氟原子的质量约等于
C.空气的摩尔质量为29
D.1 mol Cl-的质量为35.5
7.对1 mol·L 1的BaCl2溶液的有关叙述中,正确的是( )
A.该溶液中c(Cl-)=2 mol·L 1
B.该溶液中Ba2+的物质的量是1mol
C.可使用500mL容量瓶配制180mL该浓度的BaCl2溶液
D.将208gBaCl2固体溶解在1L水中,所得溶液的浓度为1 mol·L 1
8.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1molK3[Fe(CN)6]配合物中含σ键数目为24NA
B.30g质量分数为10%的甲醛水溶液中含氢原子数为3.2NA
C.5.6g铁粉与足量的高温水蒸气反应,转移的电子数为0.3NA
D.标准状况下,4.48LNO与3.2gO2充分反应,产物的分子数为0.2NA
9.如图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是( )
A.配制100 mL1.0 mol/L的Na2CO3溶液,操作1需要称量10.6 g Na2CO3固体
B.操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中
C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐
D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐
10.设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1L 1 mol L﹣1的盐酸中,含HCl分子数为NA
B.0.1 mol Na2O2与水完全反应,转移0.2NA个电子
C.8.4gNaHCO3固体中含HCO3﹣数目为0.1 NA
D.将含Na+数目为NA的NaCl固体溶于1 L水中,所得溶液的浓度为1 mol L﹣1
11.NA表示阿伏加德罗常数,下列判断正确的是( )
A.25℃,pH=13的NaOH溶液中含有OH﹣的数目为0.1NA
B.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
C.等物质的量的N2和CO的质量均为28g
D.常温下,1L 0.1mol/LNa2CO3溶液中,含有阴离子的总数小于0.1NA
12.下列叙述中,错误的是( )
A.阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1
B.NA个电子的物质的量是1 mol
C.在同温同压下,相同体积的任何气体单质所含的分子数目相同
D.H2SO4的摩尔质量(M)是98
13.体检时的一些指标常用物质的量浓度表示(可将元素近似折算成相应离子)。根据下图相关数据,下列分析不正确的是( )
A.1mmol/L=1.0×10-3mol/L
B.可用焰色反应测定钾离子的含量
C.该报告中Mg2+指标正常
D.若某人10mL血清样本中含钙离子1.2毫克,则其钙含量略偏高
14.下列有关0.1 mol·L-1NaOH溶液的叙述正确的是( )
A.1L该溶液中含有NaOH 40g
B.100mL该溶液中含有OH- 0.01mol
C.从1L该溶液中取出100mL,所取出的NaOH溶液的浓度为0.01 mol·L-1
D.在1L水中溶解4g NaOH即可配制得0.1 mol·L-1 NaOH溶液
15.某同学参阅了“84”消毒液说明中的成分,欲用 NaClO固体配制480mL含 NaClO2.5%,密度为1.19g·cm-3的消毒液。下列说法正确的是( )
A.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
B.需要称量的 NaClO固体的质量为 14.3g
C.所配得的 NaClO消毒液在空气中光照,久置后溶液中 NaClO的物质的量浓度减小
D.配制过程需要玻璃仪器 500mL容量瓶、烧杯、胶头滴管三种
16.在配制物质的量浓度溶液的实验中,最后用胶头滴管定容后,液面正确的是( )
A. B. C. D.
二、综合题
17.某学生需要用烧碱固体配制1mol L-1的NaOH溶液460mL。请回答下列问题:
(1)计算:需要称取NaOH固体 g;
(2)配制时,必须使用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒,还缺少的仪器是 、 (填仪器名称);
(3)在使用容量瓶前必须进行的一步的操作名称是 ;
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是_______(填字母代号)。
A.实验前用蒸馏水洗涤容量瓶后未烘干
B.天平砝码生锈
C.配制过程中溶解氢氧化钠后烧杯没有洗涤
D.氢氧化钠溶液未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时眼睛俯视容量瓶
18.
(1)0.5
mol CH4 的质量为 g,在标准状况下的体积为 L;含 个碳原子。
(2)将标准状况下 22.4 L 的 HCl 溶于水配成 200 mL 的溶液,所得溶液的物质的量浓度为 mol/L;配制 300 mL 0.5 mol/L 氯化钠溶液,需要 1.5 mol/L 的氯化钠溶液的体积为 mL。
(3)1.204×1024
个水分子的物质的量为 mol。
19.化学基本概念、化学用语是中学化学学习的重要内容之一.
I:氧化还原反应实际上包含氧化反应和还原反应两个过程,一个还原反应过程的离子方程式为:NO +4H++3e﹣═NO+2H2O.
下列四种物质:KMnO4,Na2CO3,Na2SO3,Fe2(SO4)3中的一种物质甲,滴加少量稀硝酸,能使上述反应过程发生.
(1)写出并配平该氧化还原反应的离子方程式: .
(2)若反应后,还原产物的化合价降低,而其他物质价态保持不变,则反应中氧化剂与还原剂的物质的量之比将 (填“增大”“不变”减小”或“不能确定”).
(3)II:实验室需要用Na2CO3 l0H2O配制0.10mol/L Na2CO3溶液240mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 .
(4)计算.
称量.配制该溶液需称取Na2CO3 10H2O晶体 g.
①天平调平之后,应将天平的游码调至某个位置,请在图1中用一根竖线标出游码左边缘所处的位置:
②称量完毕,将药品倒入烧杯中.
(5)溶解、冷却,该步实验中需要使用玻璃棒,目的是
(6)转移、洗涤. 定容,摇匀.
若观察定容时液面情况如图2所示,所配溶液的浓度会 (填“偏高”、“偏低”或“无影响”).
20.下表是某位化学教师的肝肾糖脂血液化验单部分内容:
已知:1摩尔(mol)等于1000毫摩尔(mmol),血液中葡萄糖简称血糖,分子式为C6H12O6,请根据以上信息回答下列问题:
项目名称 数据 参考值
尿素氮 2.95 2.00﹣6.10 mmol L﹣1
葡萄糖 4.50 3.89﹣6.11 mmol L﹣1
总胆固醇 3.75 <5.20 mmol L﹣1
甘油三酯 1.80↑ <1.70 mmol L﹣1
(1)这位教师的血糖含量属 (填“正常”、“偏高”或“偏低”)
(2)这位教师的1mL血液中含葡萄糖 g.
21.实验室进行以下实验。请回答下列问题:
(1)实验室配制盐酸,需要量取浓盐酸 ,配制过程中需用的玻璃仪器有量筒、烧杯、玻璃棒、 。配制过程中,多次用到玻璃棒,在此过程中玻璃棒的两个作用分别为 、 。
(2)下列操作会使所配制的盐酸浓度偏低的是____(填标号)。
A.量取浓盐酸时仰视量筒的刻度线
B.转移溶液时,未洗涤烧杯和玻璃棒
C.定容时俯视观察液面
D.定容振荡后,发现液面低于刻度线,然后补加蒸馏水至刻度线
(3)称量,溶于水中,向其中滴加盐酸至恰好完全反应,消耗盐酸的体积为 ,若称量的中含有少量,则消耗盐酸的体积将 (填“偏大”“偏小”或“不变”)。
答案解析部分
1.【答案】B
【解析】【解答】配制100mL0.1mol/L的氢氧化钠溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,量筒(可用可不用),所以配制过程中需要用到的仪器有③④⑤⑥⑦,故B符合题意。
故答案为:B。
【分析】配制一定物质的量浓度的溶液需要使用到的仪器有:烧杯、天平、容量瓶、胶头滴管和玻璃棒。
2.【答案】C
【解析】【解答】A. 物质的量书写为mol ,A不符合题意;
B. 摩尔质量书写为 ,B不符合题意;
C. 气体摩尔体积书写为 ,C符合题意;
D. 阿伏加德罗常数书写为 ,D不符合题意;
故答案为:C。
【分析】熟记常见物理量单位的书写。
3.【答案】D
【解析】【解答】A、质量的单位为g,摩尔是物质的量的单位,故A不符合题意;
B、物质的量用于描述微观粒子的物理量,与物质的质量完全不同,物质的量的单位为mol,而质量的单位为g,二者为完全不同的两个物理量,故B不符合题意;
C、摩尔是物质的量的单位,物质的量是表示物质粒子多少的物理量,故C不符合题意;
D、物质的量适用于计量微观粒子,如分子、原子、离子等微观粒子粒子,不适用于计量宏观物质,故D符合题意。
故答案为:D。
【分析】A.摩尔是物质的量的单位;
B.物质的量是用于描述微观粒子的物理量,不同于质量;
C.物质的量是表示物质粒子多少的物理量;
D.物质的量用于计量微观颗粒;
4.【答案】B
【解析】【解答】A.电解 方程式为2 4Al+3O2↑,生成 的物质的量为 ,则产生1.5mol O2,产生气体的分子数为1.5 ,A不符合题意;
B. 的物质的量为 ,根据图可知含有的极性键P-S的数目为6 ,B符合题意;
C.标准状况下,22.4L氯气物质的量为 ,氯气和NaOH反应生成NaClO和NaCl,氯元素自身发生歧化反应,化合价从0价升到+1价,1mol氯气反应转移电子数为 ,C不符合题意;
D.酯化反应是可逆反应, 与乙醇反应不能完全转化,生成酯基的数目小于2 ,D不符合题意;
故答案为:B。
【分析】A.根据2 4Al+3O2↑,结合计算;
B.该物质含有的极性键为P-S键;
C.氯气与氢氧化钠反应生成次氯酸钠、氯化钠和水;
D.酯化反应为可逆反应,不能进行彻底。
5.【答案】C
【解析】【解答】根据溶液稀释时溶质的物质的量不变,c==0.03mol/L,
故答案为:C。
【分析】根据稀释定律c稀×V稀=c浓×V浓计算可得。
6.【答案】B
【解析】【解答】A.二氧化碳的摩尔质量是以g/mol为单位,在数值上等于它的相对分子质量,A不符合题意;
B.1mol微粒是阿伏加德罗常数个微粒,氟原子的摩尔质量为19g/mol,所以一个氟原子质量= = g,B符合题意;
C.摩尔质量是以g/mol为单位,数值上等于空气的相对分子质量,空气的相对分子质量平均为29,则空气的摩尔质量为29g/mol,C不符合题意;
D.1 mol Cl-的质量是m(Cl-)=35.5g/mol×1mol=35.5g,D不符合题意;
故答案为:B。
【分析】A.摩尔质量在数值上等于物质的相对分子质量;
B.根据m=计算;
C.空气的相对分子质量平均为29,摩尔质量在数值上等于物质的相对分子质量;
D.根据m=nM计算。
7.【答案】A
【解析】【解答】A.1 mol·L 1的BaCl2溶液中c(Cl-)=2 mol·L 1,故A符合题意;
B.没有溶液体积,不能计算Ba2+的物质的量,故B不符合题意;
C.容量瓶常有25,50,100,250,500,1000mL等数种规格,可使用250mL容量瓶配制180mL该浓度的BaCl2溶液,故C不符合题意;
D.将208gBaCl2固体溶解在1L水中,所得溶液的体积不是1L,溶液的浓度不是1 mol·L 1,故D不符合题意;
故答案为:A。
【分析】A、离子浓度=溶质浓度×离子底数;
B、物质的量=浓度×体积;
C、应该采用250mL的容量瓶;
D、公式c=n/V中,V为溶液体积。
8.【答案】B
【解析】【解答】A.CN含有一个σ键和2个π键,其中Fe与CN以σ键连接,所以1molK3[Fe(CN)6]配合物中含σ键数目为12NA,故A不符合题意;
B.30g质量分数为10%的甲醛水溶液中,HCHO质量为3g,物质的量为=0.1mol;水的质量为27g,物质的量为=1.5mol,总的H原子的物质的量为=3.2mol,故B符合题意;
C.5.6g铁粉的物质的量为=0.1mol,铁与水蒸气反应生成四氧化三铁和氢气,即3molFe转移8mol电子,所以0.1mol铁粉完全反应转移mol电子,故C不符合题意;
D.标况下,4.48LNO物质的量为=0.2mol,3.2gO2物质的量为=0.1mol,发生反应:,又存在,所以分子数小于0.2NA,故D不符合题意;
故答案为:B。
【分析】A.单键均为σ键,双键含有1个σ键和1个π键,三键中含有1个σ键和2个π键,配位键为σ键;
C.铁与水蒸气反应生成四氧化三铁和氢气;
D.NO2存在转化。
9.【答案】D
【解析】【解答】A.配制100 mL1.0 mol/L的Na2CO3溶液,需要溶质的物质的量n(Na2CO3)=1.0 mol/L×0.1 L=0.1 mol,则需称量其质量m(Na2CO3)=0.1 mol×106 g/mol=10.6 g,A不符合题意;
B.容量瓶配制溶液要求使用温度是室温,所以操作2是将恢复至常温的Na2CO3溶液转移到容量瓶中,B不符合题意;
C.操作4是定容,向容量瓶中加水至离刻度线1-2 cm时改用胶头滴管滴加水,当滴加水至溶液凹液面的最低点与刻度线平齐,C不符合题意;
D.操作5中,定容摇匀后发现液面低于刻度线,这是由于部分溶液黏在容量瓶刻度线以上的瓶颈上。由于溶液具有均一性,与溶液体积大小无关,所以溶液的浓度就是要配制溶液的浓度,如果此时加水至液面与刻度线平齐,对已经配制的溶液起稀释作用,导致溶液浓度偏低,D符合题意;
故答案为:D。
【分析】A、结合公式n=c·V和n=m/M判断;
B、转移至容量瓶前先冷却;
C、水的凹液面应该和刻线相切;
D、定容后摇匀,此时不能再加水。
10.【答案】C
【解析】【解答】解:A、HCl溶于水后能完全电离,故盐酸溶液中无HCl分子,故A错误;
B、过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故B错误;
C、8.4g碳酸氢钠的物质的量为0.1mol,而1mol碳酸氢钠中含1mol碳酸氢根,故0.1mol碳酸氢钠中含0.1mol碳酸氢根即0.1NA个,故C正确;
D、将氯化钠溶于1L水中,溶于体积大于1L,则溶液浓度小于1mol/L,故D错误.
故选C.
【分析】A、HCl溶于水后能完全电离;
B、过氧化钠与水的反应为歧化反应;
C、求出碳酸氢钠的物质的量,然后根据1mol碳酸氢钠中含1mol碳酸氢根来分析;
D、将氯化钠溶于1L水中,溶于体积大于1L.
11.【答案】B
【解析】【解答】解:A.没有告诉氢氧化钠溶液的体积,无法计算溶液中钠离子的物质的量及数目,故A错误;
B.常温常压下,温度高于标况下,所以气体摩尔体积大于22.4L/mol,22.4L二氧化碳的物质的量小于1mol,含有的CO2分子数小于NA个,故B正确;
C.等物质的量的氮气和一氧化碳具有相同的质量,但是没有告诉物质的量,无法计算二者的质量,故C错误;
D.1L 0.1mol/LNa2CO3溶液中含有溶质碳酸钠0.1mol,由于碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致阴离子数目增多,所以溶液中含有阴离子的总数大于0.1NA,故D错误;
故选B.
【分析】A.缺少氢氧化钠溶液的体积,无法计算溶液中钠离子的数目;
B.常温常压下,气体摩尔体积大于22.4/mol,22.4L二氧化碳的物质的量小于1mol;
C.没有告诉氮气和一氧化碳的物质的量,无法计算二者的质量;
D.碳酸根离子水解生成碳酸氢根离子和氢氧根离子,导致溶液中阴离子数目增加.
12.【答案】D
【解析】【解答】A. 以12g 12C中所含的碳原子数为阿伏加德罗常数,符号为NA,其近似值为6.02×1023 mol-1,A符合题意;
B. 根据N=nNA可知NA个电子的物质的量是1 mol,B符合题意;
C. 根据阿伏加德罗定律可知在同温同压下,相同体积的任何气体单质所含的分子数目相同,C符合题意;
D. H2SO4的摩尔质量(M)是98g/mol,D不符合题意。
故答案为:D。
【分析】A、根据阿伏加德罗常数的概念解答;
B、根据微粒个数N=nNA解答;
C、根据在同温同压下n=,N=nNA解答;
D、摩尔质量的单位为g/mol解答;
13.【答案】B
【解析】【解答】A. 1mmol/L=1.0×10-3mol/L,A正确;
B. 焰色反应只能定性判断元素的存在,不能用焰色反应测定钾离子的含量,B不符合题意;
C. 该报告中Mg2+的浓度介于0.75与1.25之间,因此指标正常,C正确;
D. 若某人10mL血清样本中含钙离子1.2毫克,浓度是 ,所以则其钙含量略偏高,D正确,
故答案为:B。
【分析】A.毫摩尔每升与摩尔每升的关系进行判断;
B.颜色反应只能说明某种金属元素的存在;
C.根据表中数据进行判断;
D.根据物质的量浓度的定义式进行计算、判断即可。
14.【答案】B
【解析】【解答】
A.1L 0.1mol L-1NaOH溶液中含氢氧化钠的质量为:m=c V M=0.1mol L-1×1L×40g mol-1=4.0g,故A不符合题意;
B.100mL 0.1mol L-1NaOH溶液中含OH-的物质的量为:n(OH-)=n(NaOH)=c V=0.1mol L-1×0.1L=0.01mol,故B符合题意;
C.溶液是均一稳定的,取出溶液的浓度与原溶液的浓度相同,故C不符合题意;
D.在1 L水中溶解4g NaOH所得溶液的体积不是1L,无法计算溶液体积,所以无法计算NaOH溶液的物质的量浓度,故D不符合题意。
故答案为:B
【分析】
,溶液为均一的稳定的的混合物,取出的任何一部分的浓度均完全相同。
15.【答案】C
【解析】【解答】A.配制一定物质的量浓度的溶液时,容量瓶用蒸馏水洗净后,不用干燥,容量瓶中有无水,对实验结果无影响,故A不符合题意;
B.实验室没有480mL的容量瓶,应用500mL的容量瓶,称量NaClO的质量为500mL×1.19g/cm3×2.5%=14.9g,故B不符合题意;
C.碳酸的酸性强于次氯酸,空气中含有CO2,NaClO+CO2+H2O=NaHCO3+HClO,HClO见光分解,2HClO 2HCl+ O2↑,因此久置后溶液中NaClO的物质的量浓度减小,故C符合题意;
D.配制溶液过程中需要的玻璃仪器是500mL容量瓶、烧杯、胶头滴管、玻璃棒,故D不符合题意;
故答案为C。
【分析】一定物质的量浓度的溶液的配制需要注意容量瓶的选取,需要遵循“大而近”的原则,配制480mL的溶液应该选用500mL的容量瓶;
A.配制一定物质的量浓度的溶液时,是先溶解再转移到容量瓶中,加蒸馏水定容,容量瓶用蒸馏水洗净后,不干燥,对实验结果无影响;
B.容量瓶选取后,计算溶质质量是按照容量瓶的容积算;
C.碳酸的酸性强于次氯酸,NaClO+CO2+H2O=NaHCO3+HClO,HClO不稳定,2HClO 2HCl+ O2↑,因此久置后溶液中NaClO的物质的量浓度减小;
D.根据配制步骤分析每一步需要用到那些仪器;
16.【答案】B
【解析】【解答】考查一定物质的量浓度溶液的配制。定容时液面的最低点与刻度线相切,B符合题意。
故答案为:B
【分析】熟悉配置一定物质的量浓度的溶液的定容操作。
17.【答案】(1)20.0
(2)500 mL容量瓶;胶头滴管
(3)检漏
(4)B;D;F
【解析】【解答】(1) 称取NaOH固体的质量为1×500×10-3×40=20;
故答案为: 第1空、20.0
(2) 缺少的仪器是500mL容量瓶和胶头滴管;
故答案为:
第1空、500 mL容量瓶
第2空、胶头滴管
(3) 使用容量瓶前需要检漏;
故答案为: 第1空、检漏
(4) A.容量瓶有水无影响,A不符合题意;
B.天平砝码生锈,质量增加,浓度偏高,B符合题意;
C. 没有洗涤容量瓶中溶质的物质的量减小,溶液的浓度偏低,C不符合题意;
D.未冷却到室温就注入容量瓶,溶液的体积偏低,溶液浓度偏高,D符合题意;
E.加蒸馏水时不慎超过了刻度线,相当于进行稀释,溶液浓度偏小,E不符合题意;
F.定容时俯视液面,体积偏低,溶液浓度偏高,F符合题意;
故答案为: B D F
【分析】(1) 容量瓶配制溶液;
(2) 配制浓度时,需要的仪器是托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、500mL容量瓶;
(3) 使用容量瓶前需要检漏,检漏的具体操作为向容量瓶中加入适量水,盖上瓶塞,倒立,观察是否漏水;
(4)A.容量瓶有水无影响;
B.天平砝码生锈,质量增加,浓度偏高;
C. 没有洗涤容量瓶中溶质的物质的量减小,溶液的浓度偏低;
D.未冷却到室温就注入容量瓶,溶液的体积偏低,溶液浓度偏高;
E.加蒸馏水时不慎超过了刻度线,相当于进行稀释,溶液浓度偏小;
F.定容时俯视液面,体积偏低,溶液浓度偏高。
18.【答案】(1)8;11.2;3.01×1023
(2)5;100
(3)2
【解析】【解答】(1)0.5 mol CH4 的质量为0.5mol×16g/mol=8g,在标准状况下的体积为0.5mol×22.4L/mol=11.2L;含0.5mol×6.02×1023mol-1=3.01×1023个碳原子。
(2)将标准状况下 22.4 L 的 HCl 的物质的量为1mol,溶于水配成 200 mL 的溶液,所得溶液的物质的量浓度为1mol/0.2L=5mol/L;配制 300 mL 0.5 mol/L 氯化钠溶液,需要 1.5 mol/L 的氯化钠溶液的体积为VmL,有300×0.5=1.5V,解V=100mL。
(3)1.204×1024 个水分子的物质的量为1.204×1024/6.02×1023mol-1=2mol。
【分析】(1)根据甲烷的摩尔质量计算其质量,利用气体摩尔体积计算气体体积,根据甲烷的物质的量基酸碳原子的个数;
(2)根据计算溶液的物质的量浓度,根据溶液稀释前后溶质的物质的量不变计算需要1.5mol/LNaCl的体积;
(3)根据阿伏加德罗常数与物质的量的关系进行计算。
19.【答案】(1)2H++2NO3﹣+3SO32﹣=3SO42﹣+2NO↑+H2O
(2)减小
(3)250mL容量瓶;胶头滴管
(4)7.2
(5)搅拌,加速溶解和冷却
(6)偏低
【解析】【解答】解:Ⅰ(1)亚硫酸根离子具有强的还原性,在酸性环境下与硝酸根离子发生反应生成硫酸根离子、二氧化氮和水,离子方程式为:2H++2NO3﹣+3SO32﹣=3SO42﹣+2NO↑+H2O;(2)若反应后,还原产物的化合价降低,而其他物质价态保持不变,需要的氧化剂的物质的量偏小,则反应中氧化剂与还原剂的物质的量之比将减小;故答案为:减小;Ⅱ:(3)配制0.10mol/L Na2CO3溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,需要使用的要求为:烧杯、玻璃棒、胶头滴管、250mL容量瓶,还缺少的仪器为:胶头滴管、250mL容量瓶;故答案为:250mL容量瓶;胶头滴管;(4)配制0.10mol/L Na2CO3溶液240mL,应选择250mL容量瓶,需要Na2CO3 10H2O的质量m=0.10mol/L×0.25L×286g/mol=7.2g,故答案为:7.2;①称量时需放一个5g的砝码,2.2g需调游码,如图所示: ,故答案为: ;(5)为加快溶解和冷却速度,在溶解、冷却时需用玻璃棒不断的搅拌,故答案为:搅拌,加速溶解和冷却;(6)仰视刻度线,导致溶液的体积偏大,依据C= 可知,溶液的体积偏大,溶液的浓度偏低,故答案为:偏低.
【分析】Ⅰ:(1)亚硫酸根离子具有强的还原性,能够被硝酸氧化生成硫酸根离子,硝酸根离子被还原为一氧化氮,S元素由+4价升高到+6价,N元素由+5价降低到+2价,依据化合价升降数相同结合原子个数守恒写出方程式;(2)若反应后,还原产物的化合价降低,而其他物质价态保持不变,需要的氧化剂的物质的量偏小;Ⅱ:(1)依据配制一定物质的量浓度溶液的一般步骤选择合适的仪器;(3)依据m=CVM计算需要溶质的质量;①称量时需放一个5g的砝码,2.2g需调游码;(4)依据玻璃棒在溶解固体时作用解答;(5)仰视刻度线,导致溶液的体积偏大.
20.【答案】(1)正常
(2)8.1×10﹣4
【解析】【解答】解:(1)这位教师的血糖含量4.50,在3.89﹣6.11 mmol L﹣1范围之内,属于正常,故答案为:正常;(2)血液中葡萄糖的浓度为4.50mmol L﹣1,M(C6H12O6)=180g/mol,则1mL血液中含葡萄糖质量为1×10﹣3L×4.50×10﹣3mol L﹣1×180g/mol=8.1×10﹣4g,
故答案为:8.1×10﹣4.
【分析】血液中葡萄糖的浓度为4.50mmol L﹣1,根据参考值判断是否正常,结合M(C6H12O6)=180g/mol,m=nM计算即可.
21.【答案】(1)25.0;容量瓶、胶头滴管;搅拌;引流
(2)B;D
(3)40.0;偏小
【解析】【解答】(1)根据稀释定律,c1V1=c2V2,v2===25.0mL;配制100mL2.5mol/L,盐酸溶液需要的玻璃仪器有量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管.配制过程中,稀释浓盐酸要用玻璃棒进行搅拌,将稀释后的溶液转移至容量瓶中需要用玻璃棒进行引流;
(2)A.量取浓盐酸时仰视量筒的刻度线会使量取的浓盐酸的量增加,使所配制的盐酸浓度偏高,A不正确;
B.转移溶液时,未洗涤烧杯和玻璃棒,会使容量瓶中的溶质减少,使所配制的盐酸浓度偏低,B正确;
C.定容时俯视观察液面,会使容量瓶中的溶液体积减少,使所配制的盐酸浓度偏高,C不正确;
D.定容振荡后,发现液面低于刻度线,然后补加蒸馏水至刻度线,相当于给所配制的溶液稀释,使盐酸溶液浓度偏低,D正确;
故答案为:BD;
(3)n(NaOH)= =0.1mol,由NaOH+HCl=NaCl+H2O,n(NaOH)=n(HCl)=0.1mol,则V(HCl)===40mL;根据反应NaOH+HCl=NaCl+H2O和Na2CO3+2HCl=NaCl+H2O+CO2,可知相同质量的NaOH和Na2CO3,氢氧化钠消耗盐酸多,碳酸钠消耗盐酸少,则称量的NaOH中含有少量Na2CO3,则消耗盐酸的体积将偏小;
【分析】(1)根据稀释定律c稀×V稀=c浓×V浓计算可得;
(2)结果偏大:砝码生锈,溶解后没有恢复到室温,读数时俯视刻线;
结果偏小:烧杯没有洗涤,读数时仰视刻线,摇匀后发现液面低于刻线继续加水,定容后发现液面超过刻线吸掉多余的部分,转移时由部分液体溅出;
无影响:容量瓶没有干燥;
(3)结合化学计量数之比等于物质的量之比判断。
