第九单元 溶液 综合复习题(含解析)(辽宁地区适用)2023-2024学年人教版九年级化学下册
文档属性
| 名称 | 第九单元 溶液 综合复习题(含解析)(辽宁地区适用)2023-2024学年人教版九年级化学下册 |  | |
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-07 20:04:10 | ||
图片预览



文档简介
第九单元 溶液 综合复习题
一、单选题
1.(2023·辽宁营口·统考中考真题)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是
A.食盐 B.豆油 C.花椒粉 D.面粉
2.(2023·辽宁·统考中考真题)下列实验方案能达到实验目的的是
选项 实验目的 实验方案
A 除去铜粉中的少量碳粉 在空气中灼烧
B 除去CO2中的少量CO 点燃
C 测定空气中氧气的含量 用铁丝代替红磷在空气中燃烧
D 鉴别硝酸铵和氯化钠固体 分别加适量的水,用手触摸容器外壁
A.A B.B C.C D.D
3.(2022上·重庆·九年级西南大学附中校考期末)下列厨房的物质加入水中能形成溶液的是
A.面粉 B.植物油 C.蔗糖 D.辣椒面
4.(2023上·辽宁沈阳·九年级期末)下列说法正确的是
A.铜丝在火焰上灼烧,灼烧后的“铜丝”质量变小
B.纸张燃烧后有黑色的灰烬残留,说明纸张中含有碳元素
C.二氧化碳通入澄清石灰水中,溶液质量变大
D.加热高锰酸钾完全反应后产生氧气的质量等于高锰酸钾中氧元素的质量
5.(2023上·辽宁葫芦岛·九年级统考期末)为达到实验目的,下列实验方案设计正确的是
选项 实验目的 实验方案
A 鉴别NaCl和NH4NO3固体 加水溶解,并触碰容器壁
B 除去FeCl2溶液中混有的少量CuCl2 加足量的锌粉,过滤
C 鉴别H2、CH4两种气体 分别点燃,观察火焰颜色
D 测定空气中氧气的含量 用碳代替红磷在集气瓶中燃烧
A.A B.B C.C D.D
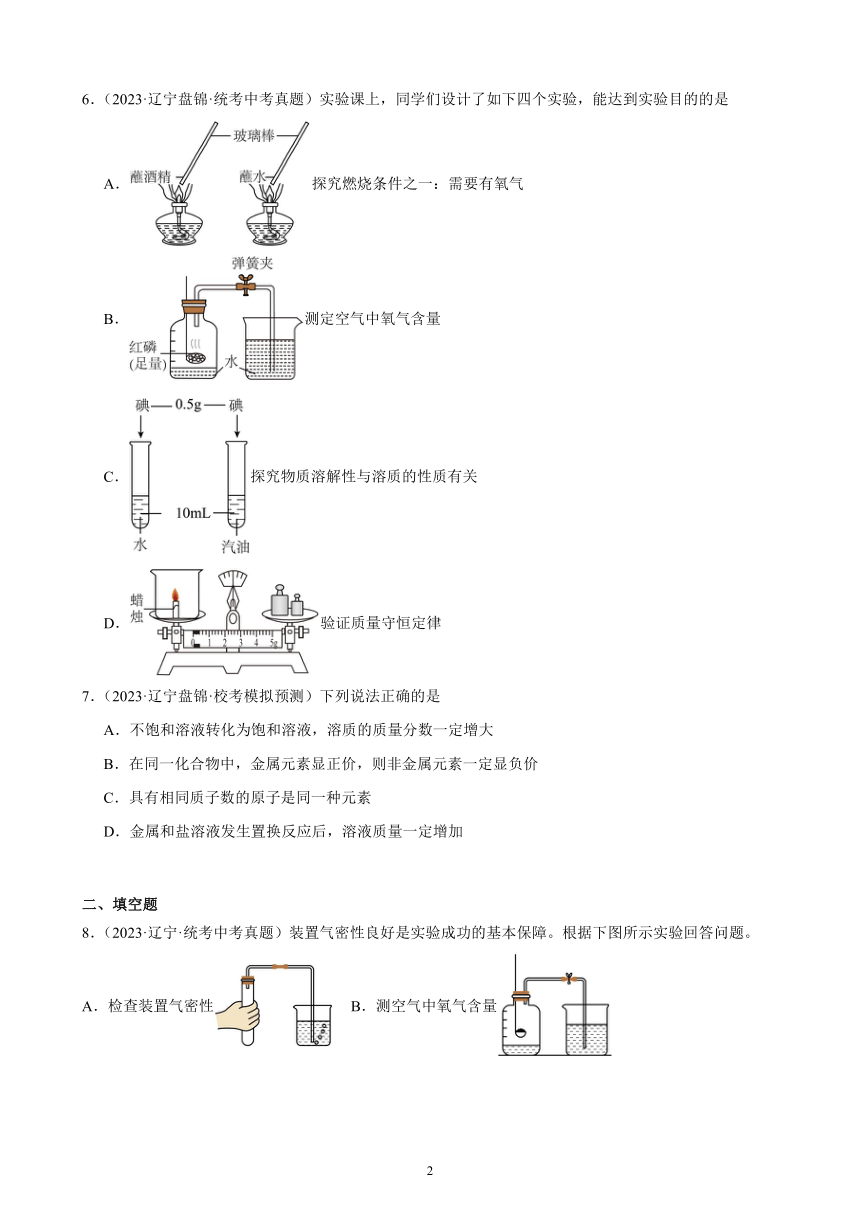
6.(2023·辽宁盘锦·统考中考真题)实验课上,同学们设计了如下四个实验,能达到实验目的的是
A.探究燃烧条件之一:需要有氧气
B.测定空气中氧气含量
C.探究物质溶解性与溶质的性质有关
D.验证质量守恒定律
7.(2023·辽宁盘锦·校考模拟预测)下列说法正确的是
A.不饱和溶液转化为饱和溶液,溶质的质量分数一定增大
B.在同一化合物中,金属元素显正价,则非金属元素一定显负价
C.具有相同质子数的原子是同一种元素
D.金属和盐溶液发生置换反应后,溶液质量一定增加
二、填空题
8.(2023·辽宁·统考中考真题)装置气密性良好是实验成功的基本保障。根据下图所示实验回答问题。
A.检查装置气密性 B.测空气中氧气含量
C.溶解时的吸、放热现象 D.验证质量守恒定律
(1)实验A:观察到水中导管口有气泡冒出,请从分子的角度解释出现此现象的原因 。
(2)实验B:若装置漏气,会使测得的实验结果 (填“偏大”或“偏小”)。
(3)实验C:加入硝酸铵后,液面a处变化情况为 (填“上升”或“下降”)。
(4)实验D:为确保实验成功,必须在 容器中进行实验。
9.(2023上·辽宁葫芦岛·九年级统考期末)化学就在我们身边,它能改善我们的生活。请回答下列问题:
(1)石墨可用于制铅笔芯,是利用其 的性质;
(2)用洗洁精洗去餐具上的油污,这是利用洗洁精的 作用;
(3)生活用水是经过净化处理得到的。可用活性炭除去水中的异味,这是利用其 ;
(4)生活中可以用 的方法,既可以消灭细菌,也可以降低水的硬度。
10.(2023上·辽宁盘锦·九年级校考期末)化学就在我们身边,请回答下列问题:
(1)煤燃烧可能产生的污染物有___________(填标号)。
A.二氧化碳 B.二氧化硫 C.一氧化碳 D.可吸入颗粒物
(2)碘酒是一种家用常备消毒剂,碘酒中的溶剂是 。
(3)可用洗洁精清洗餐盘上的油污,因为洗洁精具有 功能。
(4)“自热米饭”的自加热原理:饭盒夹层中的水与生石灰接触,反应放出大量热。该反应的化学方程式为 。
(5)波尔多液(含硫酸铜)是一种农业上常用的杀菌剂,不能用铁桶盛装的原因是(用化学方程式表示) 。
11.(2023·辽宁阜新·统考一模)周末,小丽和爸爸妈妈一起乘坐CNG(压缩天然气)公共汽车,带上水果等礼物去乡下看望爷爷奶奶。
(1)小丽争着帮奶奶做家务,洗碗时用了洗洁精,碗洗得很干净,这是利用洗洁精对油污的 作用。
(2)妈妈给爷爷奶奶用肥皂洗衣服时,发现肥皂水中出现较多的浮渣,泡沫较少,这说明洗衣服所用的水是 (填“硬水”或“软水”)。
(3)乘坐CNG(压缩天然气)公共汽车出行,可以减少汽车尾气对空气的污染。在践行“低碳”生活的过程中,请写出一种你的做法 。
12.(2023·辽宁大连·二模)水是生命之源,也是常见溶剂。
(1)面粉、红糖、植物油、酒精四种物质分别与水混合,对应形成a、b、c、d四种混合物,能形成溶液的是 (填序号),把其中的有色溶液变成无色溶液,可以加入适量的 (填物质名称),通过 操作可以把浑浊液变成澄清液。
(2)判断河水是否为硬水可用 ,生活中硬水的软化方法是 。
13.(2023·辽宁阜新·统考中考真题)下图是进行有关化学实验的装置或操作。
(1)实验一是“粗盐中难溶性杂质的去除”实验的蒸发操作,当 时停止加热。
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中。由此现象可得出的实验结论是 。
(3)实验三是“测定空气里氧气的含量”实验。若实验中氧气含量测定结果偏小,其原因可能是 (写一点即可)。
14.(2023·辽宁阜新·统考中考真题)如图是硝酸钾和氯化钾两种物质的溶解度曲线,请根据图示回答下列问题。
(1)在t1℃时,若将20 g KNO3晶体放入50 g水中充分溶解后,所得溶液的质量是 g。
(2)现有t2℃时KCl的不饱和溶液,使其转化为该温度下饱和溶液的方法有 (写一种即可)。
(3)若KNO3中混有少量KCl,提纯KNO3的结晶方法是 。
15.(2023·辽宁大连·统考中考真题)如图是硝酸钾和氯化钠的溶解度曲线。
(1)氯化钠的溶解度受温度变化的影响 。
(2)要使硝酸钾饱和溶液变为不饱和溶液,除加水外,还可以采取的一种方法是 。
(3)60℃时,向100g水中加入100g硝酸钾充分溶解,所得溶液的质量为 g。
(4)若硝酸钾中混有少量的氯化钠,提纯硝酸钾的方法是 。
16.(2023·辽宁·统考中考真题)“对比实验”是科学探究的重要方法。根据下图实验回答。
(1)图1实验中,发现碘溶于汽油,而高锰酸钾几乎不溶于汽油,说明物质的溶解性与 有关。
(2)图2实验中,为了比较人体吸入的空气和呼出的气体中所含氧气的多少,应分别向集气瓶中插入 。
(3)图3探究铁钉锈蚀条件实验中,蒸馏水需煮沸并迅速冷却,煮沸的目的是 。几天后观察,能证明铁钉锈蚀与水有关的现象是 。
17.(2023·辽宁·统考中考真题)下表是氯化钠和氯化钾的部分溶解度数据,回答下列问题。
温度/℃ 0 10 20 30 40 50 60
溶解度/g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3
氯化钾 27.6 31.0 34.0 37.0 40.0 42.6 45.5
(1)30℃时,氯化钠的溶解度是 g。
(2)分析表中数据可知,溶解度受温度影响较大的物质是 。
(3)某同学用氯化钾进行了下图所示实验(实验过程中水分损失忽略不计)。
①A~D中为饱和溶液的是 (填字母)。
②D中析出晶体的质量是 g。
18.(2023·辽宁大连·校考模拟预测)下表是NaCl、KNO3在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)根据氯化钠和硝酸钾的溶解度判断,温度大约在 范围时,两种物质的溶解度大小相等。
(2)20℃时,在50 g水中加入25 g硝酸钾固体,充分搅拌后得到 (填 “饱和”或“不饱和”)溶液。从氯化钠溶液中提取氯化钠的方法为
(3)在60℃时,硝酸钾的溶解度是110 g。这句话的含义是 。
19.(2023·辽宁丹东·统考二模)已知A、B、C三种物质的溶解度曲线如图所示。
(1)P点表示的含义为 。
(2)在阴影区域部分,处于不饱和状态的是 (选填“A、B、C”)。
(3)三种物质中 的溶解度随温度变化趋势与气体溶解度的变化相似(选填“A、B、C”)。
(4)若饱和A溶液中含有少量的C,提纯A的方法为 结晶,过滤。
(5)将t3℃时等质量的A、B、C三种物质的饱和溶液同时降温至t1℃,所得溶液中溶剂质量由大到小的顺序为 。
(6)向试管中滴入2mL水后,若X中有固体析出,则X为 (选填“A、B、C”)。
20.(2023·辽宁阜新·统考中考真题)人的生命离不开水,水质检验和水的净化尤为重要。
(1)如图为家庭活性炭净水器示意图,其中粒状活性炭层的作用是 。
(2)检验净化后的水是硬水还是软水,需取少量样品向其中加入 进行验证。
(3)把净化后的水蒸馏后用于配制溶液。用量筒量取水的体积时仰视读数,则得到的溶液中溶质的质量分数 (填“偏大”、“偏小”或“无影响”)。
21.(2023·辽宁·统考中考真题)如图1所示,℃时,将等质量的和KCl分别加入100g水中充分溶解后,升温至℃。图2是和KCl的溶解度曲线。
(1)图1烧杯甲中溶解的物质是 。
(2)℃时,烧杯乙中的溶液是 (填“饱和”或“不饱和”)溶液。
(3)若中混有少量KCl,可采用 的方法提纯。
(4)℃时,将50g固体放入50g水中充分溶解,所得溶液的溶质质量分数为 。
22.(2023·辽宁锦州·统考中考真题)如图是KNO3和KCl的溶解度曲线图,据图回答问题:
(1)40℃时,KC1的溶解度是 g。
(2)KNO3中混有少量KC1,提纯KNO3的方法是 。
(3)40℃时,将KNO3和KC1的固体各20g分别加入到各盛有50g水的两个烧杯中、充分搅拌后。所得两种溶液的质量大小关系是KNO3 KCl(选填“<”、“=”或“>”);欲增大该KCl溶液的溶质质量分数,可采用的方法是 (写出一种即可)。
23.(2023·辽宁盘锦·校考二模)甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由小到大顺序为 ;
(2)t2℃时,乙物质的溶解度为 g
(3)将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为 g,所得甲溶液溶质质量分数为 。
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。
三、简答题
24.(2023·辽宁营口·统考中考真题)根据NaCl和KNO3的溶解度曲线回答下列问题:
(1)两种物质溶解度受温度影响较小的是 。
(2)若不改变溶质质量分数,将KNO3的不饱和溶液转化为饱和溶液的方法是 。
(3)在60℃时,若使55gKNO3完全溶解,则需要水的质量至少是 g;
(4)若NaCl中混有少量KNO3,提纯NaCl可采用的方法是 。
四、实验题
25.(2023·辽宁阜新·统考一模)下图是有关化学实验的装置及操作。
(1)实验一是“粗盐中难溶性杂质的去除”实验中蒸发操作,停止加热的最佳时机是 。
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中。由此现象可得出的实验结论是 。
(3)实验三是“空气中氧气含量测定”的实验图示。实验过程中使用了过量红磷,其目的是 。
26.(2023·辽宁锦州·统考中考真题)下列各图是“除去粗盐中难溶性杂质”和“配制一定溶质质量分数的溶液”两个实验中部分实验操作的示意图,请回答下列问题:
(1)在上图所示的实验操作中,这两个实验都用到的实验操作是 。(填实验操作名称)
(2)图3实验操作中玻璃棒的作用是 。
(3)如果过滤后,滤液仍然浑浊接下来应该进行的操作是 ,然后重新过滤,直到滤液澄清为止。
(4)用提纯得到的氯化钠配制一定溶质质量分数的溶液,经检测配制的溶液溶质质量分数偏小,可能的原因是 。(填字母序号)
a.量取水的体积时,仰视凹液面最低处读数
b.装瓶时有少量溶液洒出
c.往烧杯中加水时有水溅出
d.将称量好的氯化钠固体转移至烧杯时,氯化钠洒落
27.(2023·辽宁阜新·统考一模)配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)溶解过程中玻璃棒的作用是 。
(2)配制50g质量分数为6%的氯化钠溶液完成后,老师对配制的溶液进行检测时发现溶质质量分数偏小,其原因可能有___________(填字母序号)。
A.砝码生锈了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(3)把50g质量分数为6%的氯化钠溶液稀释成3%的氯化钠溶液。实验步骤是计算、 、混匀、装瓶贴标签。
五、计算题
28.(2023·辽宁阜新·统考中考真题)化学活动课中,某组同学利用质量分数为5%的过氧化氢溶液68g和适量的二氧化锰混合制取氧气。试计算最多可制得氧气的质量是多少。
29.(2023·辽宁大连·校考模拟预测)将一定量的氯酸钾、氯化钾和二氧化锰的混合物充分加热,固体质量减少了4.8 g,再将余下固体加入85。lg水中配制成14.9%的氯化钾溶液。
(1)根据化学方程式计算氯酸钾质量。
(2)计算原混合物中氯化钾的质量。
30.(2023上·辽宁丹东·九年级校考期中)利用化学方程式计算:实验室用过氧化氢溶液为原料制取4kg氧气,需要含过氧化氢5%的过氧化氢溶液的质量是多少
参考答案:
1.A
【详解】A、食盐与水混合后可以形成均一、稳定的混合物,则可以得到溶液,故选项符合题意;
B、豆油与水混合后不能形成均一、稳定的混合物,则不可以得到溶液,故选项不符合题意;
C、花椒粉与水混合后不能形成均一、稳定的混合物,则不可以得到溶液,故选项不符合题意;
D、面粉与水混合后不能形成均一、稳定的混合物,则不可以得到溶液,故选项不符合题意。
故选A。
2.D
【详解】A.铜和碳都会与氧气反应,违背除杂原则,不能达到实验目的;
B.二氧化碳不燃烧,也不支持燃烧,所以不能通过点燃的方法除去二氧化碳中的一氧化碳,不能达到实验目的;
C.铁丝在空气中不会燃烧,只会红热,所以不能用铁丝代替红磷在空气中燃烧,不能达到实验目的;
D.硝酸铵溶于水吸热,温度降低,氯化钠溶于水温度不变,所以能够鉴别出来,能达到实验目的。
故选:D。
3.C
【详解】A、面粉不能溶于水,把面粉放入水中充分搅拌只能形成悬浊液,说法错误;
B、植物油不能溶于水,把植物油放入水中充分搅拌只能形成乳浊液,说法错误;
C、蔗糖可以溶于水,形成溶液,说法正确;
D、辣椒面不能溶于水,把面粉放入水中充分搅拌只能形成悬浊液,说法错误。
故选C。
4.B
【详解】A、铜与氧气在加热条件下生成氧化铜,氧化铜的质量等于铜和氧气的质量之和,燃烧后的“铜丝”质量变大,故A错误;
B、反应前后元素的种类不变,纸张燃烧后有黑色的灰烬残留,为碳,说明纸张中含有碳元素,故B正确;
C、二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,溶液质量变小,故C错误;
D、加热高锰酸钾后生成锰酸钾、二氧化锰、氧气,高锰酸钾中氧元素的质量等于锰酸钾、二氧化锰、氧气中氧元素的质量之和,故D错误。
故选:B。
5.A
【详解】A、氯化钠溶于水温度几乎不变,硝酸铵溶于水吸热,温度降低,故加水溶解,并触碰容器壁可以鉴别氯化钠和硝酸铵,正确;
B、锌可以和氯化亚铁、氯化铜反应,把原物质也反应掉了,不符合除杂原则,不正确;
C、氢气和甲烷燃烧都产生蓝色火焰,不能通过观察火焰来鉴别氢气和甲烷,不正确;
D、碳和氧气反应同时会生成二氧化碳气体,不能形成压强差,烧杯中的水无法进入集气瓶,因此不能用碳代替红磷在集气瓶中燃烧来测定空气中氧气的含量,不正确;
故选A。
6.B
【详解】A、图中实验,酒精能燃烧,水不能燃烧,可探究燃烧条件之一是需要有可燃物,故选项实验不能达到实验目的。
B、红磷本身是固体,能与氧气反应,生成五氧化二磷固体,没有生成新的气体,导致集气瓶中气压减小,在外界大气压的作用下,烧杯中的水进入集气瓶中,进入集气瓶中水的体积即为空气中氧气的体积,可测定空气中氧气含量,故选项实验能达到实验目的。
C、图中实验,溶质的种类相同,溶剂的种类不同,可探究物质溶解性与溶剂的性质有关,故选项实验不能达到实验目的。
D、蜡烛在空气中燃烧生成二氧化碳和水,有气体参加反应,生成的二氧化碳和水蒸气逸散到空气中,不能直接用于验证质量守恒定律,故选项实验不能达到实验目的。
故选:B。
7.C
【详解】A、不饱和溶液变为饱和溶液,溶质质量分数不一定变大,如通过改变温度的方法(无溶质析出),溶质和溶剂的质量不变,溶质质量分数不变,故A不符合题意;
B、在同一化合物中,金属元素显正价,非金属元素不一定显负价,如碳酸钙中钙元素显+2价,氧元素显-2价,碳元素显+4价,故B不符合题意;
C、元素是具有相同质子数的原子的总称,故C符合题意;
D、金属和盐溶液发生置换反应后,溶液质量不一定增加,如,溶液质量减少,故D不符合题意。
故选C。
8.(1)分子间有间隔,温度升高分子间隔变大
(2)偏小
(3)上升
(4)密闭
【详解】(1)分子间有间隔,用手握住试管,试管内的气体受热温度升高,分子间的间隔变大,气体膨胀从导管逸出,看到气泡。
(2)若装置漏气,进入水的同时会有部分空气进入,导致进入水的体积偏小,实验结果偏小。
(3)硝酸铵溶于水吸热,集气瓶内气体收缩,大气压将b侧液体压向a侧,所以液面a处变化情况为上升。
(4)实验验证质量守恒定律需要确保反应前后称量的物质的总质量不变,红磷燃烧消耗氧气,为防止外部空气进入集气瓶导致集气瓶内物质质量增大,该实验必须在密闭容器内进行。
9.(1)质软、有滑腻感、有金属光泽
(2)乳化
(3)吸附性
(4)煮沸
【详解】(1)石墨具有质软、有滑腻感、金属光泽的性质,因此可制铅笔芯。
(2)洗洁精洗去餐具上的油污,这是利用洗洁精的乳化作用。
(3)活性炭具有吸附性,能除去水中异味。
(4)生活中降低水硬度的方法是煮沸。
10.(1)BCD
(2)酒精
(3)乳化
(4)CaO+H2O=Ca(OH)2
(5)Fe+CuSO4=FeSO4+Cu
【详解】(1)A 二氧化碳是空气的组成成分,不是空气污染物,选项错误;
B 煤中含有硫元素,燃烧时会生成二氧化硫污染空气,选项正确;
C 煤不充分燃烧会生成一氧化碳污染空气,选项正确;
D 煤燃烧会产生烟尘,选项正确,故填BCD。
(2)碘酒是碘溶于酒精后形成的溶液,其中的溶剂是酒精,故填酒精。
(3)可用洗洁精清洗餐盘上的油污,是因为洗洁精具有乳化功能,能够乳化油污,故填乳化。
(4)生石灰与水反应生成氢氧化钙,故反应的化学方程式写为:CaO+H2O=Ca(OH)2。
(5)波尔多液不能用铁桶盛装的原因是铁能够与其中的硫酸铜反应生成硫酸亚铁和铜,会较低药效,故反应的化学方程式写为:Fe+CuSO4=FeSO4+Cu。
11.(1)乳化
(2)硬水
(3)积极植树造林(或随手关闭用电器电源或一水多用)
【详解】(1)洗洁精对油污有乳化作用,可将油污分散为小液滴,形成乳浊液除去。
(2)硬水中含有较多的可溶性钙、镁离子;利用肥皂水可以鉴别硬水和软水:肥皂水加入到硬水中会产生较多的浮渣,泡沫较少;软水中加入肥皂水,浮渣少,产生的泡沫多;因为肥皂水中出现较多的浮渣,泡沫较少,说明所用的水的硬水,故填硬水;
(3)低碳生活就是指减少二氧化碳的排放,低能量、低消耗、低开支的生活方式,主要是从节电、节气和回收三个环节来改变生活细节;在践行“低碳”生活的过程中,可以积极植树造林、随手关闭用电器电源、一水多用等。
12.(1) b、d 活性炭 过滤
(2) 肥皂水 煮沸
【详解】(1)面粉、植物油难溶于水,红糖和酒精能溶于水形成均一、稳定的溶液,面粉、红糖、植物油、酒精四种物质分别与水混合,对应形成a、b、c、d四种混合物,能形成溶液的是bd;
活性炭具有吸附性,可以吸附色素和异味,所以把其中的有色溶液变成无色溶液,可以加入适量的活性炭。过滤可以分离固体和液体,通过过滤操作可以把浑浊液变成澄清液;
(2)判断河水是否为硬水可用肥皂水,加入肥皂水,产生较少泡沫、较多浮渣的为硬水,产生较多泡沫的为软水;
生活中硬水的软化方法是煮沸,加热煮沸时,水中的钙离子、镁离子能够以碳酸钙沉淀、氢氧化镁沉淀的形式从水中析出,从而降低水的硬度。
13.(1)蒸发皿中出现较多固体
(2)溶剂相同条件下,溶质不同,物质溶解性不同
(3)红磷的量不足
【详解】(1)实验一是“粗盐中难溶性杂质的去除”实验的蒸发操作,当蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热使滤液蒸干;
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中,由此可知,溶剂相同条件下,溶质不同,物质溶解性不同;
(3)实验三是“测定空气里氧气的含量”实验,红磷的量不足,不能将氧气完全耗尽,会导致实验结果偏小。
14.(1)62.5
(2)增加氯化钾(增加溶质)或恒温蒸发溶剂
(3)冷却热的饱和溶液/降温结晶
【详解】(1)据图可知,t1℃时 KNO3的溶解度是25g,即t1℃时100g水最多溶解硝酸钾25g,则50g水最多溶解硝酸钾12.5g,所以在t1℃时,将20 g KNO3晶体放入50 g水中充分溶解后,所得溶液的质量=12.5g+50g=62.5g。故填:62.5。
(2)t2℃时KCl的不饱和溶液,使其转化为该温度下饱和溶液的方法,即增加溶质或减少溶剂。所以具体方法是可以增加氯化钾(增加溶质),或恒温蒸发水(溶剂)。故填:增加氯化钾(增加溶质),或恒温蒸发水(溶剂)。
(3)据图可知,硝酸钾的溶解度受温度变化影响较大,氯化钾的溶解度受温度变化影响不大,所以若KNO3中混有少量KCl,提纯KNO3的结晶方法是冷却热的饱和溶液(或降温结晶)。故填:冷却热的饱和溶液(或降温结晶)。
15.(1)较小
(2)升温
(3)200
(4)冷却热饱和溶液(或其他合理答案)
【详解】(1)据图可以看出,氯化钠的溶解度受温度影响较小;
(2)硝酸钾的溶解度随温度的升高而增大,则要使硝酸钾的饱和溶液变为不饱和溶液,除加水外还可以升高温度;
(3)60℃时,硝酸钾的溶解度为110g,则向100g水中加入100g硝酸钾充分溶解,所得溶液的质量为200g;
(4)硝酸钾的溶解度随温度的升高而增大,氯化钠的溶解度受温度影响较小;若硝酸钾中混有少量的氯化钠,提纯硝酸钾的方法是冷却热饱和溶液(其他合理即可)。
16.(1)溶质的种类
(2)燃着的木条
(3) 除去水中溶有的氧气 A中铁钉生锈,C中铁钉不生锈
【详解】(1)图1实验中,发现碘溶于汽油,而高锰酸钾几乎不溶于汽油,溶质种类不同,溶剂种类相同,说明物质的溶解性与溶质的种类有关;
(2)氧气具有助燃性,应用燃着的木条检验氧气,分别向集气瓶中插入燃着的木条,燃着的木条在空气中继续燃烧,在呼出气体中熄灭,说明空气中氧气的含量比呼出气体中氧气含量多;
(3)气体的溶解度随温度的升高而减小,故蒸馏水需煮沸并迅速冷却,煮沸的目的是:除去水中溶有的氧气,防止影响实验;
试管A中铁钉与氧气和水接触,生锈,试管C中铁钉只与氧气接触,不生锈,对比说明铁锈蚀需要水,故填:A中铁钉生锈,C中铁钉不生锈。
17.(1)36.3
(2)氯化钾/KCl
(3) BCD 4.5
【详解】(1)由表格可知,30℃时,氯化钠的溶解度是36.3g。
(2)由表格可知,溶解度受温度影响较大的物质是KCl。
(3)①BD中明显有未溶解的KCl晶体,故BD一定为饱和溶液,20℃时KCl的溶解度为34g,故50g水可以溶解17gKCl,故A中只溶解了10gKCl,A为不饱和溶液,40℃时KCl的溶解度为40g,故50g水可以溶解20gKCl,C中刚好溶解了20gKCl,故C为饱和溶液。
故BCD为饱和溶液。
②10℃氯化钾的溶解度为31.0g,则50g水中最多溶解15.5g氯化钾;所以D中析出晶体的质量=10g+10g-15.5g=4.5g。
18.(1)20~30℃
(2) 饱和 蒸发结晶
(3)在60℃时,100g水里最多能溶解110g硝酸钾
【详解】(1)根据表格数据可知,20℃时氯化钠的溶解度大于硝酸钾的溶解度,30℃时,硝酸钾的溶解度大于氯化钠的溶解度,所以温度大约在20~30℃范围时,两种物质的溶解度大小相等。
(2)由图可知,20℃时,硝酸钾的溶解度为31.6g,则20℃时,50g水中最多溶解硝酸钾15.8g,所以在50g水中加入25g硝酸钾固体后,充分搅拌后得到饱和溶液,氯化钠的溶解度受温度影响较小,所以从氯化钠溶液中提取氯化钠的方法为蒸发结晶。
(3)在60℃时,硝酸钾的溶解度是110g,这句话的含义是:在60℃时,100g水里最多能溶解110g硝酸钾。
19.(1)t1℃时,B、C物质的溶解度相等
(2)B
(3)C
(4)降温
(5)C>B>A
(6)C
【详解】(1)通过分析溶解度曲线可知,P点表示的含义为:t1℃时,B、C物质的溶解度相等;
(2)在阴影区域部分,B物质的固体质量在溶解度曲线的下方,所以处于不饱和状态的是B;
(3)气体的溶解度随温度升高而减小,通过溶解度曲线可知C与之相似;
(4)若饱和A溶液中含有少量的C,提纯A的方法为降温结晶,降温过程中A溶解度明显减小,会大量析出晶体,而C随着温度的降低溶解度增大,不会析出晶体,从而提纯了A;
(5)在t3℃三者的溶解度A>B>C,故t3℃等量三种物质的饱和溶液中所含溶质A>B>C,所以溶剂量C>B>A,降温过程中溶剂质量不变,故溶剂量仍为C>B>A;
(6)氧化钙与水反应放热,温度升高,若X中有固体析出,说明X的溶解度随温度的升高而减小,故填C。
20.(1)吸附和过滤
(2)肥皂水
(3)偏小
【详解】(1)在水的净化过程中,活性炭疏松多孔的特性,决定了它可以作为吸附和过滤的作用,故填吸附和过滤;
(2)硬软水可以用肥皂水检验,硬水加入肥皂水之后有较多浮渣,软水加入肥皂水之后有较多泡沫,故填肥皂水;
(3)量筒量取水的时候仰视会导致量取的水过多,那么配置溶液的时候,,水量取过多会导致最终配置的溶液质量偏多,但溶质质量不变,故溶质质量分数偏小。
21.(1)氯化钾/KCl
(2)不饱和
(3)降温结晶(或冷却热饱和溶液)
(4)50%
【详解】(1)t1℃时,将等质量的 KNO3和KCl分别加入100g水中充分溶解后,甲溶解完全,乙剩余,说明甲烧杯中的物质在t1℃的溶解度大于乙烧杯中的物质,根据图2可知,t1℃的溶解度:氯化钾大于硝酸钾,则甲中溶解的物质是氯化钾;
(2)氯化钾在t1℃已经溶解完全,升温到t2℃,溶解度增大,则氯化钾的溶液是不饱和溶液;根据图2,t2℃时,硝酸钾的溶解度等于氯化钾的溶解度,是等质量的 KNO3和KCl分别加入100g水中充分溶解,则烧杯乙中(硝酸钾)的溶液是不饱和溶液;
(3)硝酸钾和氯化钾两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钾大,则应采用降温结晶方法提纯KNO3;
(4)t3℃时硝酸钾的溶解度是110g,将50g KNO3固体放入50g水中充分溶解,得到不饱和溶液,则所得溶液的溶质质量分数为。
22.(1)40
(2)降温结晶/冷却热饱和溶液
(3) = 升高温度并增加溶质/升高温度并蒸发溶剂
【详解】(1)根据溶解度曲线可知,40℃时,KC1的溶解度是40g;
(2)根据溶解度曲线可知,硝酸钾物质的溶解度受温度变化影响较大,氯化钾物质的溶解度受温度变化影响较小,所以若硝酸钾中混有少量的氯化钾,最好采用降温结晶的方法提纯硝酸钾;
(3)根据溶解度曲线可知,在40℃时,硝酸钾的溶解度大于40g,氯化钾的溶解度为40g,则将KNO3和KC1的固体各20g分别加入到各盛有50g水的两个烧杯中、充分搅拌后,溶质硝酸钾和氯化钾固体全部溶解,溶质质量均为20g,溶剂质量均为50g,则溶液所得两种溶液的质量大小关系是KNO3等于KCl;
根据溶解度曲线可知,氯化钾的溶解度随温度的升高而增大,且饱和溶液的溶质质量分数随着溶解度增大而增大,在40℃时,氯化钾的溶解度为40g,在该温度下40g的氯化钾溶于100g水中恰好形成饱和溶液,则KC1的固体20g加入到盛有50g水的烧杯中、充分搅拌后,固体全部溶解,形成的氯化钾溶液正好为饱和溶液,则由于欲增大该KCl溶液的溶质质量分数的方法可以增大物质的溶解度,即升高温度并增加溶质(或升高温度并蒸发溶剂)。
23.(1)
(2)80
(3) 55 20%
(4)丙 ﹥ 乙=甲
【详解】(1)通过分析溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度由小到大顺序为:甲 = 丙 < 乙;
(2)根据图示,t2℃时,乙物质的溶解度为80g;
(3)t2℃时,甲物质的溶解度为80g,t1℃时,甲物质的溶解度为25g,所以将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为80g-25g=55g,所得甲溶液溶质质量分数为×100%=20%;
(4)根据图示,t2℃时,丙物质的溶解度最小,甲、乙物质的溶解度相等,所以取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,需要溶剂的质量是丙最多,甲乙少,则所得三种溶液的质量由大到小顺序为丙>甲=乙。
24.(1)氯化钠/NaCl
(2)降温至溶液刚好达到饱和
(3)50
(4)蒸发结晶
【详解】(1)据图可知,硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以两种物质的溶解度受温度的影响较小的是氯化钠。故填:氯化钠。
(2)降温至溶液刚好达到饱和时,溶剂和溶质的质量均不变,溶质的质量分数不变,所以不改变溶质质量分数,将KNO3的不饱和溶液转化为饱和溶液的方法是降温至溶液刚好达到饱和。故填:降温至溶液刚好达到饱和。
(3)据图可知,60℃时,硝酸钾的溶解度为110g,含义是60℃时,100g水中最多溶解硝酸钾110g,溶液达到饱和状态,则若使55g KNO3固体完全溶解,至少需要50g60℃的水。故填:50。
(4)据图可知,硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以若NaCl中混有少量KNO3,提纯NaCl可采用的方法是蒸发结晶、蒸发溶剂等。
25.(1)蒸发皿中出现较多固体时
(2)不同物质在同一溶剂中的溶解性是不同的(或不同物质在同种溶剂中的溶解性是不同的;或同种溶剂中,不同物质的溶解性不同;或高锰酸钾和碘在汽油中的溶解性不同等)
(3)消耗尽集气瓶内的氧气,使实验测定准确
【详解】(1)实验一是“粗盐中难溶性杂质的去除”实验的蒸发操作,当蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热使滤液蒸干,故填:蒸发皿中出现较多固体时;
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中,由此可知,溶剂相同条件下,溶质不同,物质溶解性不同,故填:不同物质在同一溶剂中的溶解性是不同的(或不同物质在同种溶剂中的溶解性是不同的;或同种溶剂中,不同物质的溶解性不同;或高锰酸钾和碘在汽油中的溶解性不同等);
(3)实验中红磷过量,其目的是使集气瓶中的氧气尽量反应完全,提高测定的准确度,故填:消耗尽集气瓶内的氧气,使实验测定准确。
26.(1)溶解
(2)搅拌,防止局部温度过高造成液滴飞溅
(3)更换滤纸,清洗仪器(或换干净仪器)
(4)ad
【详解】(1)“除去粗盐中难溶性杂质”和“配制一定溶质质量分数的溶液”这两个实验都需要加水用玻璃棒溶解,故都用到的实验操作是溶解;
(2)图3是蒸发操作,需用到玻璃来搅拌,故该实验操作中玻璃棒的作用是搅拌,防止局部温度过高造成液滴飞溅;
(3)如果过滤后,滤液仍然浑浊,可能是滤纸破损、仪器不干净等,故应该更换滤纸,清洗仪器(或换干净仪器);
(4)a.量取水的体积时,仰视凹液面最低处读数,导致量取水的体积增大,从而溶液的体积变大,溶质质量分数偏小,符合题意;
b.装瓶时有少量溶液洒出,溶液是均一的,溶质质量分数不变,不符合题意;
c.往烧杯中加水时有水溅出,会造成水的体积变小,溶质质量分数偏大,不符合题意;
d.将称量好的氯化钠固体转移至烧杯时,氯化钠洒落,会造成溶质质量减少,溶质质量分数偏小,符合题意。
故选ad。
27.(1)搅拌,加快固体的溶解
(2)B
(3)量取
【详解】(1)溶解过程中玻璃棒的作用是搅拌,加快固体的溶解。搅拌增加了水的流动,使水和固体充分接触从而加速溶解。
(2)A、砝码生锈了,砝码质量偏大,则称量氯化钠的质量偏大,溶质质量分数偏大。不符合题意;
B、量取水的体积时,仰视读数,读数偏小,量取水体积偏大,溶质质量分数偏小。符合题意;
C、装瓶时,有少量溶液洒出,溶液具有均一性,不会影响配置完成的溶液的溶质质量分数。不符合题意;
故选B。
(3)使用液体稀释配置一定溶质质量分数的溶液,步骤是计算出需要液体药品和水的质量并转化为体积,然后使用量筒和胶头滴管量取所需液体药品和水的体积,之后混匀、装瓶贴标签。
28.解:设最多可制得氧气的质量为x
答: 最多可制得氧气的质量为1.6 g
【分析】根据溶液中,可以计算出消耗掉的过氧化氢质量,然后利用化学反应方程式的计算公式即可计算出产生的氧气质量。
【详解】见答案。
29.(1)设氯酸钾的质量为x,固体质量减少了4.8 g,说明生成氧气的质量为4.8g
x=12.25g
答:氯酸钾质量的质量为12.25g;
(2)生成氯化钾的质量为12.25g-4.8g=7.45g
设原混合物中氯化钾的质量为y
y=7.45g
答:原混合物中氯化钾的质量为7.45g。
【详解】(1)见答案;
(2)见答案。
30.解:设实验室用过氧化氢溶液为原料制取4kg氧气,需要含过氧化氢5%的过氧化氢溶液的质量是x,
答:实验室用过氧化氢溶液为原料制取4kg氧气,需要含过氧化氢5%的过氧化氢溶液的质量是170kg。
【详解】见答案。
一、单选题
1.(2023·辽宁营口·统考中考真题)把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是
A.食盐 B.豆油 C.花椒粉 D.面粉
2.(2023·辽宁·统考中考真题)下列实验方案能达到实验目的的是
选项 实验目的 实验方案
A 除去铜粉中的少量碳粉 在空气中灼烧
B 除去CO2中的少量CO 点燃
C 测定空气中氧气的含量 用铁丝代替红磷在空气中燃烧
D 鉴别硝酸铵和氯化钠固体 分别加适量的水,用手触摸容器外壁
A.A B.B C.C D.D
3.(2022上·重庆·九年级西南大学附中校考期末)下列厨房的物质加入水中能形成溶液的是
A.面粉 B.植物油 C.蔗糖 D.辣椒面
4.(2023上·辽宁沈阳·九年级期末)下列说法正确的是
A.铜丝在火焰上灼烧,灼烧后的“铜丝”质量变小
B.纸张燃烧后有黑色的灰烬残留,说明纸张中含有碳元素
C.二氧化碳通入澄清石灰水中,溶液质量变大
D.加热高锰酸钾完全反应后产生氧气的质量等于高锰酸钾中氧元素的质量
5.(2023上·辽宁葫芦岛·九年级统考期末)为达到实验目的,下列实验方案设计正确的是
选项 实验目的 实验方案
A 鉴别NaCl和NH4NO3固体 加水溶解,并触碰容器壁
B 除去FeCl2溶液中混有的少量CuCl2 加足量的锌粉,过滤
C 鉴别H2、CH4两种气体 分别点燃,观察火焰颜色
D 测定空气中氧气的含量 用碳代替红磷在集气瓶中燃烧
A.A B.B C.C D.D
6.(2023·辽宁盘锦·统考中考真题)实验课上,同学们设计了如下四个实验,能达到实验目的的是
A.探究燃烧条件之一:需要有氧气
B.测定空气中氧气含量
C.探究物质溶解性与溶质的性质有关
D.验证质量守恒定律
7.(2023·辽宁盘锦·校考模拟预测)下列说法正确的是
A.不饱和溶液转化为饱和溶液,溶质的质量分数一定增大
B.在同一化合物中,金属元素显正价,则非金属元素一定显负价
C.具有相同质子数的原子是同一种元素
D.金属和盐溶液发生置换反应后,溶液质量一定增加
二、填空题
8.(2023·辽宁·统考中考真题)装置气密性良好是实验成功的基本保障。根据下图所示实验回答问题。
A.检查装置气密性 B.测空气中氧气含量
C.溶解时的吸、放热现象 D.验证质量守恒定律
(1)实验A:观察到水中导管口有气泡冒出,请从分子的角度解释出现此现象的原因 。
(2)实验B:若装置漏气,会使测得的实验结果 (填“偏大”或“偏小”)。
(3)实验C:加入硝酸铵后,液面a处变化情况为 (填“上升”或“下降”)。
(4)实验D:为确保实验成功,必须在 容器中进行实验。
9.(2023上·辽宁葫芦岛·九年级统考期末)化学就在我们身边,它能改善我们的生活。请回答下列问题:
(1)石墨可用于制铅笔芯,是利用其 的性质;
(2)用洗洁精洗去餐具上的油污,这是利用洗洁精的 作用;
(3)生活用水是经过净化处理得到的。可用活性炭除去水中的异味,这是利用其 ;
(4)生活中可以用 的方法,既可以消灭细菌,也可以降低水的硬度。
10.(2023上·辽宁盘锦·九年级校考期末)化学就在我们身边,请回答下列问题:
(1)煤燃烧可能产生的污染物有___________(填标号)。
A.二氧化碳 B.二氧化硫 C.一氧化碳 D.可吸入颗粒物
(2)碘酒是一种家用常备消毒剂,碘酒中的溶剂是 。
(3)可用洗洁精清洗餐盘上的油污,因为洗洁精具有 功能。
(4)“自热米饭”的自加热原理:饭盒夹层中的水与生石灰接触,反应放出大量热。该反应的化学方程式为 。
(5)波尔多液(含硫酸铜)是一种农业上常用的杀菌剂,不能用铁桶盛装的原因是(用化学方程式表示) 。
11.(2023·辽宁阜新·统考一模)周末,小丽和爸爸妈妈一起乘坐CNG(压缩天然气)公共汽车,带上水果等礼物去乡下看望爷爷奶奶。
(1)小丽争着帮奶奶做家务,洗碗时用了洗洁精,碗洗得很干净,这是利用洗洁精对油污的 作用。
(2)妈妈给爷爷奶奶用肥皂洗衣服时,发现肥皂水中出现较多的浮渣,泡沫较少,这说明洗衣服所用的水是 (填“硬水”或“软水”)。
(3)乘坐CNG(压缩天然气)公共汽车出行,可以减少汽车尾气对空气的污染。在践行“低碳”生活的过程中,请写出一种你的做法 。
12.(2023·辽宁大连·二模)水是生命之源,也是常见溶剂。
(1)面粉、红糖、植物油、酒精四种物质分别与水混合,对应形成a、b、c、d四种混合物,能形成溶液的是 (填序号),把其中的有色溶液变成无色溶液,可以加入适量的 (填物质名称),通过 操作可以把浑浊液变成澄清液。
(2)判断河水是否为硬水可用 ,生活中硬水的软化方法是 。
13.(2023·辽宁阜新·统考中考真题)下图是进行有关化学实验的装置或操作。
(1)实验一是“粗盐中难溶性杂质的去除”实验的蒸发操作,当 时停止加热。
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中。由此现象可得出的实验结论是 。
(3)实验三是“测定空气里氧气的含量”实验。若实验中氧气含量测定结果偏小,其原因可能是 (写一点即可)。
14.(2023·辽宁阜新·统考中考真题)如图是硝酸钾和氯化钾两种物质的溶解度曲线,请根据图示回答下列问题。
(1)在t1℃时,若将20 g KNO3晶体放入50 g水中充分溶解后,所得溶液的质量是 g。
(2)现有t2℃时KCl的不饱和溶液,使其转化为该温度下饱和溶液的方法有 (写一种即可)。
(3)若KNO3中混有少量KCl,提纯KNO3的结晶方法是 。
15.(2023·辽宁大连·统考中考真题)如图是硝酸钾和氯化钠的溶解度曲线。
(1)氯化钠的溶解度受温度变化的影响 。
(2)要使硝酸钾饱和溶液变为不饱和溶液,除加水外,还可以采取的一种方法是 。
(3)60℃时,向100g水中加入100g硝酸钾充分溶解,所得溶液的质量为 g。
(4)若硝酸钾中混有少量的氯化钠,提纯硝酸钾的方法是 。
16.(2023·辽宁·统考中考真题)“对比实验”是科学探究的重要方法。根据下图实验回答。
(1)图1实验中,发现碘溶于汽油,而高锰酸钾几乎不溶于汽油,说明物质的溶解性与 有关。
(2)图2实验中,为了比较人体吸入的空气和呼出的气体中所含氧气的多少,应分别向集气瓶中插入 。
(3)图3探究铁钉锈蚀条件实验中,蒸馏水需煮沸并迅速冷却,煮沸的目的是 。几天后观察,能证明铁钉锈蚀与水有关的现象是 。
17.(2023·辽宁·统考中考真题)下表是氯化钠和氯化钾的部分溶解度数据,回答下列问题。
温度/℃ 0 10 20 30 40 50 60
溶解度/g 氯化钠 35.7 35.8 36.0 36.3 36.6 37.0 37.3
氯化钾 27.6 31.0 34.0 37.0 40.0 42.6 45.5
(1)30℃时,氯化钠的溶解度是 g。
(2)分析表中数据可知,溶解度受温度影响较大的物质是 。
(3)某同学用氯化钾进行了下图所示实验(实验过程中水分损失忽略不计)。
①A~D中为饱和溶液的是 (填字母)。
②D中析出晶体的质量是 g。
18.(2023·辽宁大连·校考模拟预测)下表是NaCl、KNO3在不同温度时的溶解度。
温度/℃ 0 10 20 30 40 50 60
溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3
KNO3 13.3 20.9 31.6 45.8 63.9 85.5 110
(1)根据氯化钠和硝酸钾的溶解度判断,温度大约在 范围时,两种物质的溶解度大小相等。
(2)20℃时,在50 g水中加入25 g硝酸钾固体,充分搅拌后得到 (填 “饱和”或“不饱和”)溶液。从氯化钠溶液中提取氯化钠的方法为
(3)在60℃时,硝酸钾的溶解度是110 g。这句话的含义是 。
19.(2023·辽宁丹东·统考二模)已知A、B、C三种物质的溶解度曲线如图所示。
(1)P点表示的含义为 。
(2)在阴影区域部分,处于不饱和状态的是 (选填“A、B、C”)。
(3)三种物质中 的溶解度随温度变化趋势与气体溶解度的变化相似(选填“A、B、C”)。
(4)若饱和A溶液中含有少量的C,提纯A的方法为 结晶,过滤。
(5)将t3℃时等质量的A、B、C三种物质的饱和溶液同时降温至t1℃,所得溶液中溶剂质量由大到小的顺序为 。
(6)向试管中滴入2mL水后,若X中有固体析出,则X为 (选填“A、B、C”)。
20.(2023·辽宁阜新·统考中考真题)人的生命离不开水,水质检验和水的净化尤为重要。
(1)如图为家庭活性炭净水器示意图,其中粒状活性炭层的作用是 。
(2)检验净化后的水是硬水还是软水,需取少量样品向其中加入 进行验证。
(3)把净化后的水蒸馏后用于配制溶液。用量筒量取水的体积时仰视读数,则得到的溶液中溶质的质量分数 (填“偏大”、“偏小”或“无影响”)。
21.(2023·辽宁·统考中考真题)如图1所示,℃时,将等质量的和KCl分别加入100g水中充分溶解后,升温至℃。图2是和KCl的溶解度曲线。
(1)图1烧杯甲中溶解的物质是 。
(2)℃时,烧杯乙中的溶液是 (填“饱和”或“不饱和”)溶液。
(3)若中混有少量KCl,可采用 的方法提纯。
(4)℃时,将50g固体放入50g水中充分溶解,所得溶液的溶质质量分数为 。
22.(2023·辽宁锦州·统考中考真题)如图是KNO3和KCl的溶解度曲线图,据图回答问题:
(1)40℃时,KC1的溶解度是 g。
(2)KNO3中混有少量KC1,提纯KNO3的方法是 。
(3)40℃时,将KNO3和KC1的固体各20g分别加入到各盛有50g水的两个烧杯中、充分搅拌后。所得两种溶液的质量大小关系是KNO3 KCl(选填“<”、“=”或“>”);欲增大该KCl溶液的溶质质量分数,可采用的方法是 (写出一种即可)。
23.(2023·辽宁盘锦·校考二模)甲、乙、丙三种物质的溶解度曲线如图所示。
(1)t1℃时,甲、乙、丙三种物质的溶解度由小到大顺序为 ;
(2)t2℃时,乙物质的溶解度为 g
(3)将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为 g,所得甲溶液溶质质量分数为 。
(4)取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,所得三种溶液的质量由大到小顺序为 。
三、简答题
24.(2023·辽宁营口·统考中考真题)根据NaCl和KNO3的溶解度曲线回答下列问题:
(1)两种物质溶解度受温度影响较小的是 。
(2)若不改变溶质质量分数,将KNO3的不饱和溶液转化为饱和溶液的方法是 。
(3)在60℃时,若使55gKNO3完全溶解,则需要水的质量至少是 g;
(4)若NaCl中混有少量KNO3,提纯NaCl可采用的方法是 。
四、实验题
25.(2023·辽宁阜新·统考一模)下图是有关化学实验的装置及操作。
(1)实验一是“粗盐中难溶性杂质的去除”实验中蒸发操作,停止加热的最佳时机是 。
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中。由此现象可得出的实验结论是 。
(3)实验三是“空气中氧气含量测定”的实验图示。实验过程中使用了过量红磷,其目的是 。
26.(2023·辽宁锦州·统考中考真题)下列各图是“除去粗盐中难溶性杂质”和“配制一定溶质质量分数的溶液”两个实验中部分实验操作的示意图,请回答下列问题:
(1)在上图所示的实验操作中,这两个实验都用到的实验操作是 。(填实验操作名称)
(2)图3实验操作中玻璃棒的作用是 。
(3)如果过滤后,滤液仍然浑浊接下来应该进行的操作是 ,然后重新过滤,直到滤液澄清为止。
(4)用提纯得到的氯化钠配制一定溶质质量分数的溶液,经检测配制的溶液溶质质量分数偏小,可能的原因是 。(填字母序号)
a.量取水的体积时,仰视凹液面最低处读数
b.装瓶时有少量溶液洒出
c.往烧杯中加水时有水溅出
d.将称量好的氯化钠固体转移至烧杯时,氯化钠洒落
27.(2023·辽宁阜新·统考一模)配制一定溶质质量分数的氯化钠溶液的过程如下图所示:
(1)溶解过程中玻璃棒的作用是 。
(2)配制50g质量分数为6%的氯化钠溶液完成后,老师对配制的溶液进行检测时发现溶质质量分数偏小,其原因可能有___________(填字母序号)。
A.砝码生锈了
B.量取水的体积时,仰视读数
C.装瓶时,有少量溶液洒出
(3)把50g质量分数为6%的氯化钠溶液稀释成3%的氯化钠溶液。实验步骤是计算、 、混匀、装瓶贴标签。
五、计算题
28.(2023·辽宁阜新·统考中考真题)化学活动课中,某组同学利用质量分数为5%的过氧化氢溶液68g和适量的二氧化锰混合制取氧气。试计算最多可制得氧气的质量是多少。
29.(2023·辽宁大连·校考模拟预测)将一定量的氯酸钾、氯化钾和二氧化锰的混合物充分加热,固体质量减少了4.8 g,再将余下固体加入85。lg水中配制成14.9%的氯化钾溶液。
(1)根据化学方程式计算氯酸钾质量。
(2)计算原混合物中氯化钾的质量。
30.(2023上·辽宁丹东·九年级校考期中)利用化学方程式计算:实验室用过氧化氢溶液为原料制取4kg氧气,需要含过氧化氢5%的过氧化氢溶液的质量是多少
参考答案:
1.A
【详解】A、食盐与水混合后可以形成均一、稳定的混合物,则可以得到溶液,故选项符合题意;
B、豆油与水混合后不能形成均一、稳定的混合物,则不可以得到溶液,故选项不符合题意;
C、花椒粉与水混合后不能形成均一、稳定的混合物,则不可以得到溶液,故选项不符合题意;
D、面粉与水混合后不能形成均一、稳定的混合物,则不可以得到溶液,故选项不符合题意。
故选A。
2.D
【详解】A.铜和碳都会与氧气反应,违背除杂原则,不能达到实验目的;
B.二氧化碳不燃烧,也不支持燃烧,所以不能通过点燃的方法除去二氧化碳中的一氧化碳,不能达到实验目的;
C.铁丝在空气中不会燃烧,只会红热,所以不能用铁丝代替红磷在空气中燃烧,不能达到实验目的;
D.硝酸铵溶于水吸热,温度降低,氯化钠溶于水温度不变,所以能够鉴别出来,能达到实验目的。
故选:D。
3.C
【详解】A、面粉不能溶于水,把面粉放入水中充分搅拌只能形成悬浊液,说法错误;
B、植物油不能溶于水,把植物油放入水中充分搅拌只能形成乳浊液,说法错误;
C、蔗糖可以溶于水,形成溶液,说法正确;
D、辣椒面不能溶于水,把面粉放入水中充分搅拌只能形成悬浊液,说法错误。
故选C。
4.B
【详解】A、铜与氧气在加热条件下生成氧化铜,氧化铜的质量等于铜和氧气的质量之和,燃烧后的“铜丝”质量变大,故A错误;
B、反应前后元素的种类不变,纸张燃烧后有黑色的灰烬残留,为碳,说明纸张中含有碳元素,故B正确;
C、二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,溶液质量变小,故C错误;
D、加热高锰酸钾后生成锰酸钾、二氧化锰、氧气,高锰酸钾中氧元素的质量等于锰酸钾、二氧化锰、氧气中氧元素的质量之和,故D错误。
故选:B。
5.A
【详解】A、氯化钠溶于水温度几乎不变,硝酸铵溶于水吸热,温度降低,故加水溶解,并触碰容器壁可以鉴别氯化钠和硝酸铵,正确;
B、锌可以和氯化亚铁、氯化铜反应,把原物质也反应掉了,不符合除杂原则,不正确;
C、氢气和甲烷燃烧都产生蓝色火焰,不能通过观察火焰来鉴别氢气和甲烷,不正确;
D、碳和氧气反应同时会生成二氧化碳气体,不能形成压强差,烧杯中的水无法进入集气瓶,因此不能用碳代替红磷在集气瓶中燃烧来测定空气中氧气的含量,不正确;
故选A。
6.B
【详解】A、图中实验,酒精能燃烧,水不能燃烧,可探究燃烧条件之一是需要有可燃物,故选项实验不能达到实验目的。
B、红磷本身是固体,能与氧气反应,生成五氧化二磷固体,没有生成新的气体,导致集气瓶中气压减小,在外界大气压的作用下,烧杯中的水进入集气瓶中,进入集气瓶中水的体积即为空气中氧气的体积,可测定空气中氧气含量,故选项实验能达到实验目的。
C、图中实验,溶质的种类相同,溶剂的种类不同,可探究物质溶解性与溶剂的性质有关,故选项实验不能达到实验目的。
D、蜡烛在空气中燃烧生成二氧化碳和水,有气体参加反应,生成的二氧化碳和水蒸气逸散到空气中,不能直接用于验证质量守恒定律,故选项实验不能达到实验目的。
故选:B。
7.C
【详解】A、不饱和溶液变为饱和溶液,溶质质量分数不一定变大,如通过改变温度的方法(无溶质析出),溶质和溶剂的质量不变,溶质质量分数不变,故A不符合题意;
B、在同一化合物中,金属元素显正价,非金属元素不一定显负价,如碳酸钙中钙元素显+2价,氧元素显-2价,碳元素显+4价,故B不符合题意;
C、元素是具有相同质子数的原子的总称,故C符合题意;
D、金属和盐溶液发生置换反应后,溶液质量不一定增加,如,溶液质量减少,故D不符合题意。
故选C。
8.(1)分子间有间隔,温度升高分子间隔变大
(2)偏小
(3)上升
(4)密闭
【详解】(1)分子间有间隔,用手握住试管,试管内的气体受热温度升高,分子间的间隔变大,气体膨胀从导管逸出,看到气泡。
(2)若装置漏气,进入水的同时会有部分空气进入,导致进入水的体积偏小,实验结果偏小。
(3)硝酸铵溶于水吸热,集气瓶内气体收缩,大气压将b侧液体压向a侧,所以液面a处变化情况为上升。
(4)实验验证质量守恒定律需要确保反应前后称量的物质的总质量不变,红磷燃烧消耗氧气,为防止外部空气进入集气瓶导致集气瓶内物质质量增大,该实验必须在密闭容器内进行。
9.(1)质软、有滑腻感、有金属光泽
(2)乳化
(3)吸附性
(4)煮沸
【详解】(1)石墨具有质软、有滑腻感、金属光泽的性质,因此可制铅笔芯。
(2)洗洁精洗去餐具上的油污,这是利用洗洁精的乳化作用。
(3)活性炭具有吸附性,能除去水中异味。
(4)生活中降低水硬度的方法是煮沸。
10.(1)BCD
(2)酒精
(3)乳化
(4)CaO+H2O=Ca(OH)2
(5)Fe+CuSO4=FeSO4+Cu
【详解】(1)A 二氧化碳是空气的组成成分,不是空气污染物,选项错误;
B 煤中含有硫元素,燃烧时会生成二氧化硫污染空气,选项正确;
C 煤不充分燃烧会生成一氧化碳污染空气,选项正确;
D 煤燃烧会产生烟尘,选项正确,故填BCD。
(2)碘酒是碘溶于酒精后形成的溶液,其中的溶剂是酒精,故填酒精。
(3)可用洗洁精清洗餐盘上的油污,是因为洗洁精具有乳化功能,能够乳化油污,故填乳化。
(4)生石灰与水反应生成氢氧化钙,故反应的化学方程式写为:CaO+H2O=Ca(OH)2。
(5)波尔多液不能用铁桶盛装的原因是铁能够与其中的硫酸铜反应生成硫酸亚铁和铜,会较低药效,故反应的化学方程式写为:Fe+CuSO4=FeSO4+Cu。
11.(1)乳化
(2)硬水
(3)积极植树造林(或随手关闭用电器电源或一水多用)
【详解】(1)洗洁精对油污有乳化作用,可将油污分散为小液滴,形成乳浊液除去。
(2)硬水中含有较多的可溶性钙、镁离子;利用肥皂水可以鉴别硬水和软水:肥皂水加入到硬水中会产生较多的浮渣,泡沫较少;软水中加入肥皂水,浮渣少,产生的泡沫多;因为肥皂水中出现较多的浮渣,泡沫较少,说明所用的水的硬水,故填硬水;
(3)低碳生活就是指减少二氧化碳的排放,低能量、低消耗、低开支的生活方式,主要是从节电、节气和回收三个环节来改变生活细节;在践行“低碳”生活的过程中,可以积极植树造林、随手关闭用电器电源、一水多用等。
12.(1) b、d 活性炭 过滤
(2) 肥皂水 煮沸
【详解】(1)面粉、植物油难溶于水,红糖和酒精能溶于水形成均一、稳定的溶液,面粉、红糖、植物油、酒精四种物质分别与水混合,对应形成a、b、c、d四种混合物,能形成溶液的是bd;
活性炭具有吸附性,可以吸附色素和异味,所以把其中的有色溶液变成无色溶液,可以加入适量的活性炭。过滤可以分离固体和液体,通过过滤操作可以把浑浊液变成澄清液;
(2)判断河水是否为硬水可用肥皂水,加入肥皂水,产生较少泡沫、较多浮渣的为硬水,产生较多泡沫的为软水;
生活中硬水的软化方法是煮沸,加热煮沸时,水中的钙离子、镁离子能够以碳酸钙沉淀、氢氧化镁沉淀的形式从水中析出,从而降低水的硬度。
13.(1)蒸发皿中出现较多固体
(2)溶剂相同条件下,溶质不同,物质溶解性不同
(3)红磷的量不足
【详解】(1)实验一是“粗盐中难溶性杂质的去除”实验的蒸发操作,当蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热使滤液蒸干;
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中,由此可知,溶剂相同条件下,溶质不同,物质溶解性不同;
(3)实验三是“测定空气里氧气的含量”实验,红磷的量不足,不能将氧气完全耗尽,会导致实验结果偏小。
14.(1)62.5
(2)增加氯化钾(增加溶质)或恒温蒸发溶剂
(3)冷却热的饱和溶液/降温结晶
【详解】(1)据图可知,t1℃时 KNO3的溶解度是25g,即t1℃时100g水最多溶解硝酸钾25g,则50g水最多溶解硝酸钾12.5g,所以在t1℃时,将20 g KNO3晶体放入50 g水中充分溶解后,所得溶液的质量=12.5g+50g=62.5g。故填:62.5。
(2)t2℃时KCl的不饱和溶液,使其转化为该温度下饱和溶液的方法,即增加溶质或减少溶剂。所以具体方法是可以增加氯化钾(增加溶质),或恒温蒸发水(溶剂)。故填:增加氯化钾(增加溶质),或恒温蒸发水(溶剂)。
(3)据图可知,硝酸钾的溶解度受温度变化影响较大,氯化钾的溶解度受温度变化影响不大,所以若KNO3中混有少量KCl,提纯KNO3的结晶方法是冷却热的饱和溶液(或降温结晶)。故填:冷却热的饱和溶液(或降温结晶)。
15.(1)较小
(2)升温
(3)200
(4)冷却热饱和溶液(或其他合理答案)
【详解】(1)据图可以看出,氯化钠的溶解度受温度影响较小;
(2)硝酸钾的溶解度随温度的升高而增大,则要使硝酸钾的饱和溶液变为不饱和溶液,除加水外还可以升高温度;
(3)60℃时,硝酸钾的溶解度为110g,则向100g水中加入100g硝酸钾充分溶解,所得溶液的质量为200g;
(4)硝酸钾的溶解度随温度的升高而增大,氯化钠的溶解度受温度影响较小;若硝酸钾中混有少量的氯化钠,提纯硝酸钾的方法是冷却热饱和溶液(其他合理即可)。
16.(1)溶质的种类
(2)燃着的木条
(3) 除去水中溶有的氧气 A中铁钉生锈,C中铁钉不生锈
【详解】(1)图1实验中,发现碘溶于汽油,而高锰酸钾几乎不溶于汽油,溶质种类不同,溶剂种类相同,说明物质的溶解性与溶质的种类有关;
(2)氧气具有助燃性,应用燃着的木条检验氧气,分别向集气瓶中插入燃着的木条,燃着的木条在空气中继续燃烧,在呼出气体中熄灭,说明空气中氧气的含量比呼出气体中氧气含量多;
(3)气体的溶解度随温度的升高而减小,故蒸馏水需煮沸并迅速冷却,煮沸的目的是:除去水中溶有的氧气,防止影响实验;
试管A中铁钉与氧气和水接触,生锈,试管C中铁钉只与氧气接触,不生锈,对比说明铁锈蚀需要水,故填:A中铁钉生锈,C中铁钉不生锈。
17.(1)36.3
(2)氯化钾/KCl
(3) BCD 4.5
【详解】(1)由表格可知,30℃时,氯化钠的溶解度是36.3g。
(2)由表格可知,溶解度受温度影响较大的物质是KCl。
(3)①BD中明显有未溶解的KCl晶体,故BD一定为饱和溶液,20℃时KCl的溶解度为34g,故50g水可以溶解17gKCl,故A中只溶解了10gKCl,A为不饱和溶液,40℃时KCl的溶解度为40g,故50g水可以溶解20gKCl,C中刚好溶解了20gKCl,故C为饱和溶液。
故BCD为饱和溶液。
②10℃氯化钾的溶解度为31.0g,则50g水中最多溶解15.5g氯化钾;所以D中析出晶体的质量=10g+10g-15.5g=4.5g。
18.(1)20~30℃
(2) 饱和 蒸发结晶
(3)在60℃时,100g水里最多能溶解110g硝酸钾
【详解】(1)根据表格数据可知,20℃时氯化钠的溶解度大于硝酸钾的溶解度,30℃时,硝酸钾的溶解度大于氯化钠的溶解度,所以温度大约在20~30℃范围时,两种物质的溶解度大小相等。
(2)由图可知,20℃时,硝酸钾的溶解度为31.6g,则20℃时,50g水中最多溶解硝酸钾15.8g,所以在50g水中加入25g硝酸钾固体后,充分搅拌后得到饱和溶液,氯化钠的溶解度受温度影响较小,所以从氯化钠溶液中提取氯化钠的方法为蒸发结晶。
(3)在60℃时,硝酸钾的溶解度是110g,这句话的含义是:在60℃时,100g水里最多能溶解110g硝酸钾。
19.(1)t1℃时,B、C物质的溶解度相等
(2)B
(3)C
(4)降温
(5)C>B>A
(6)C
【详解】(1)通过分析溶解度曲线可知,P点表示的含义为:t1℃时,B、C物质的溶解度相等;
(2)在阴影区域部分,B物质的固体质量在溶解度曲线的下方,所以处于不饱和状态的是B;
(3)气体的溶解度随温度升高而减小,通过溶解度曲线可知C与之相似;
(4)若饱和A溶液中含有少量的C,提纯A的方法为降温结晶,降温过程中A溶解度明显减小,会大量析出晶体,而C随着温度的降低溶解度增大,不会析出晶体,从而提纯了A;
(5)在t3℃三者的溶解度A>B>C,故t3℃等量三种物质的饱和溶液中所含溶质A>B>C,所以溶剂量C>B>A,降温过程中溶剂质量不变,故溶剂量仍为C>B>A;
(6)氧化钙与水反应放热,温度升高,若X中有固体析出,说明X的溶解度随温度的升高而减小,故填C。
20.(1)吸附和过滤
(2)肥皂水
(3)偏小
【详解】(1)在水的净化过程中,活性炭疏松多孔的特性,决定了它可以作为吸附和过滤的作用,故填吸附和过滤;
(2)硬软水可以用肥皂水检验,硬水加入肥皂水之后有较多浮渣,软水加入肥皂水之后有较多泡沫,故填肥皂水;
(3)量筒量取水的时候仰视会导致量取的水过多,那么配置溶液的时候,,水量取过多会导致最终配置的溶液质量偏多,但溶质质量不变,故溶质质量分数偏小。
21.(1)氯化钾/KCl
(2)不饱和
(3)降温结晶(或冷却热饱和溶液)
(4)50%
【详解】(1)t1℃时,将等质量的 KNO3和KCl分别加入100g水中充分溶解后,甲溶解完全,乙剩余,说明甲烧杯中的物质在t1℃的溶解度大于乙烧杯中的物质,根据图2可知,t1℃的溶解度:氯化钾大于硝酸钾,则甲中溶解的物质是氯化钾;
(2)氯化钾在t1℃已经溶解完全,升温到t2℃,溶解度增大,则氯化钾的溶液是不饱和溶液;根据图2,t2℃时,硝酸钾的溶解度等于氯化钾的溶解度,是等质量的 KNO3和KCl分别加入100g水中充分溶解,则烧杯乙中(硝酸钾)的溶液是不饱和溶液;
(3)硝酸钾和氯化钾两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钾大,则应采用降温结晶方法提纯KNO3;
(4)t3℃时硝酸钾的溶解度是110g,将50g KNO3固体放入50g水中充分溶解,得到不饱和溶液,则所得溶液的溶质质量分数为。
22.(1)40
(2)降温结晶/冷却热饱和溶液
(3) = 升高温度并增加溶质/升高温度并蒸发溶剂
【详解】(1)根据溶解度曲线可知,40℃时,KC1的溶解度是40g;
(2)根据溶解度曲线可知,硝酸钾物质的溶解度受温度变化影响较大,氯化钾物质的溶解度受温度变化影响较小,所以若硝酸钾中混有少量的氯化钾,最好采用降温结晶的方法提纯硝酸钾;
(3)根据溶解度曲线可知,在40℃时,硝酸钾的溶解度大于40g,氯化钾的溶解度为40g,则将KNO3和KC1的固体各20g分别加入到各盛有50g水的两个烧杯中、充分搅拌后,溶质硝酸钾和氯化钾固体全部溶解,溶质质量均为20g,溶剂质量均为50g,则溶液所得两种溶液的质量大小关系是KNO3等于KCl;
根据溶解度曲线可知,氯化钾的溶解度随温度的升高而增大,且饱和溶液的溶质质量分数随着溶解度增大而增大,在40℃时,氯化钾的溶解度为40g,在该温度下40g的氯化钾溶于100g水中恰好形成饱和溶液,则KC1的固体20g加入到盛有50g水的烧杯中、充分搅拌后,固体全部溶解,形成的氯化钾溶液正好为饱和溶液,则由于欲增大该KCl溶液的溶质质量分数的方法可以增大物质的溶解度,即升高温度并增加溶质(或升高温度并蒸发溶剂)。
23.(1)
(2)80
(3) 55 20%
(4)丙 ﹥ 乙=甲
【详解】(1)通过分析溶解度曲线可知,t1℃时,甲、乙、丙三种物质的溶解度由小到大顺序为:甲 = 丙 < 乙;
(2)根据图示,t2℃时,乙物质的溶解度为80g;
(3)t2℃时,甲物质的溶解度为80g,t1℃时,甲物质的溶解度为25g,所以将t2℃时180g甲的饱和溶液降温到t1℃,析出晶体的质量为80g-25g=55g,所得甲溶液溶质质量分数为×100%=20%;
(4)根据图示,t2℃时,丙物质的溶解度最小,甲、乙物质的溶解度相等,所以取等质量的甲、乙、丙三种物质,分别配制成t2℃时的恰好饱和溶液,需要溶剂的质量是丙最多,甲乙少,则所得三种溶液的质量由大到小顺序为丙>甲=乙。
24.(1)氯化钠/NaCl
(2)降温至溶液刚好达到饱和
(3)50
(4)蒸发结晶
【详解】(1)据图可知,硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以两种物质的溶解度受温度的影响较小的是氯化钠。故填:氯化钠。
(2)降温至溶液刚好达到饱和时,溶剂和溶质的质量均不变,溶质的质量分数不变,所以不改变溶质质量分数,将KNO3的不饱和溶液转化为饱和溶液的方法是降温至溶液刚好达到饱和。故填:降温至溶液刚好达到饱和。
(3)据图可知,60℃时,硝酸钾的溶解度为110g,含义是60℃时,100g水中最多溶解硝酸钾110g,溶液达到饱和状态,则若使55g KNO3固体完全溶解,至少需要50g60℃的水。故填:50。
(4)据图可知,硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以若NaCl中混有少量KNO3,提纯NaCl可采用的方法是蒸发结晶、蒸发溶剂等。
25.(1)蒸发皿中出现较多固体时
(2)不同物质在同一溶剂中的溶解性是不同的(或不同物质在同种溶剂中的溶解性是不同的;或同种溶剂中,不同物质的溶解性不同;或高锰酸钾和碘在汽油中的溶解性不同等)
(3)消耗尽集气瓶内的氧气,使实验测定准确
【详解】(1)实验一是“粗盐中难溶性杂质的去除”实验的蒸发操作,当蒸发皿中出现较多固体时停止加热,利用蒸发皿的余热使滤液蒸干,故填:蒸发皿中出现较多固体时;
(2)实验二中观察到高锰酸钾几乎不溶于汽油,碘却可以溶解在汽油中,由此可知,溶剂相同条件下,溶质不同,物质溶解性不同,故填:不同物质在同一溶剂中的溶解性是不同的(或不同物质在同种溶剂中的溶解性是不同的;或同种溶剂中,不同物质的溶解性不同;或高锰酸钾和碘在汽油中的溶解性不同等);
(3)实验中红磷过量,其目的是使集气瓶中的氧气尽量反应完全,提高测定的准确度,故填:消耗尽集气瓶内的氧气,使实验测定准确。
26.(1)溶解
(2)搅拌,防止局部温度过高造成液滴飞溅
(3)更换滤纸,清洗仪器(或换干净仪器)
(4)ad
【详解】(1)“除去粗盐中难溶性杂质”和“配制一定溶质质量分数的溶液”这两个实验都需要加水用玻璃棒溶解,故都用到的实验操作是溶解;
(2)图3是蒸发操作,需用到玻璃来搅拌,故该实验操作中玻璃棒的作用是搅拌,防止局部温度过高造成液滴飞溅;
(3)如果过滤后,滤液仍然浑浊,可能是滤纸破损、仪器不干净等,故应该更换滤纸,清洗仪器(或换干净仪器);
(4)a.量取水的体积时,仰视凹液面最低处读数,导致量取水的体积增大,从而溶液的体积变大,溶质质量分数偏小,符合题意;
b.装瓶时有少量溶液洒出,溶液是均一的,溶质质量分数不变,不符合题意;
c.往烧杯中加水时有水溅出,会造成水的体积变小,溶质质量分数偏大,不符合题意;
d.将称量好的氯化钠固体转移至烧杯时,氯化钠洒落,会造成溶质质量减少,溶质质量分数偏小,符合题意。
故选ad。
27.(1)搅拌,加快固体的溶解
(2)B
(3)量取
【详解】(1)溶解过程中玻璃棒的作用是搅拌,加快固体的溶解。搅拌增加了水的流动,使水和固体充分接触从而加速溶解。
(2)A、砝码生锈了,砝码质量偏大,则称量氯化钠的质量偏大,溶质质量分数偏大。不符合题意;
B、量取水的体积时,仰视读数,读数偏小,量取水体积偏大,溶质质量分数偏小。符合题意;
C、装瓶时,有少量溶液洒出,溶液具有均一性,不会影响配置完成的溶液的溶质质量分数。不符合题意;
故选B。
(3)使用液体稀释配置一定溶质质量分数的溶液,步骤是计算出需要液体药品和水的质量并转化为体积,然后使用量筒和胶头滴管量取所需液体药品和水的体积,之后混匀、装瓶贴标签。
28.解:设最多可制得氧气的质量为x
答: 最多可制得氧气的质量为1.6 g
【分析】根据溶液中,可以计算出消耗掉的过氧化氢质量,然后利用化学反应方程式的计算公式即可计算出产生的氧气质量。
【详解】见答案。
29.(1)设氯酸钾的质量为x,固体质量减少了4.8 g,说明生成氧气的质量为4.8g
x=12.25g
答:氯酸钾质量的质量为12.25g;
(2)生成氯化钾的质量为12.25g-4.8g=7.45g
设原混合物中氯化钾的质量为y
y=7.45g
答:原混合物中氯化钾的质量为7.45g。
【详解】(1)见答案;
(2)见答案。
30.解:设实验室用过氧化氢溶液为原料制取4kg氧气,需要含过氧化氢5%的过氧化氢溶液的质量是x,
答:实验室用过氧化氢溶液为原料制取4kg氧气,需要含过氧化氢5%的过氧化氢溶液的质量是170kg。
【详解】见答案。
同课章节目录
