第10讲 钠及其化合物 (共36张PPT)-2024年江苏省普通高中学业水平合格性考试化学复习
文档属性
| 名称 | 第10讲 钠及其化合物 (共36张PPT)-2024年江苏省普通高中学业水平合格性考试化学复习 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-07 19:35:32 | ||
图片预览







文档简介
(共36张PPT)
第10讲 钠及其化合物
专题三 常见无机物及其应用
目
录
1
考点填空
2
真题回放
3
过关检测
一、钠
1.钠的物理性质: 银白 色,有金属光泽的固体,热、电的良导体,质 软 ,密度 小于 水、 大于 煤油,熔点 低于 水的沸点。
2.钠的化学性质
银白
软
小于
大于
低于
(1)钠的原子结构示意图为 ,最外层只有一个电子,很容易失去,显强 还原性 ,所以自然界无游离态钠,钠元素以 化合 态(主要是 NaCl )形式存在。
还原性
化合
NaCl
(2)与O2反应:
①常温下: 4Na+O22Na2O 。
②点燃或加热时: 2Na+O2Na2O2 。
4Na+O22Na2O
2Na+O2Na2O2
(3)与H2O反应:现象 浮、熔、游、响、红 。
化学方程式为 2Na+2H2O2NaOH+H2↑ 。
离子方程式为 2Na++2OH-+H2↑ 。(用单线桥法 分析)
浮、熔、游、响、红
2Na+2H2O2NaOH+H2↑
2Na+2H2O 2Na++2OH-+H2↑
2
3.钠的保存:通常保存在 煤油 中。
4.钠的制备:工业制钠的反应为 2NaCl(熔融)2Na+Cl2↑ 。
煤油
2NaCl(熔融)2Na+Cl2↑
5.钠的用途
(1)高压钠灯发出黄光,射程远,透雾能力 强 ;
(2)钠钾合金常温下呈液态,用于原子反应堆的 导热剂 ;
(3)从钛、锆、铌、钽等金属氯化物中 置换 出相应的金属。
强
导热剂
置换
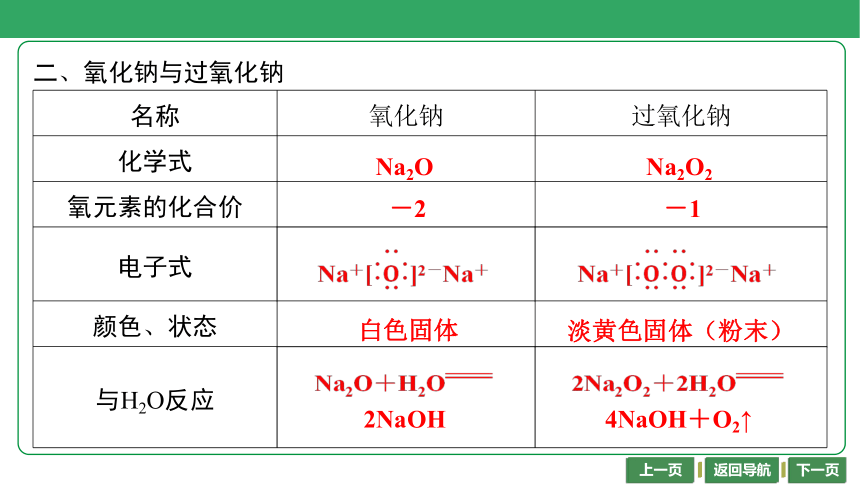
二、氧化钠与过氧化钠
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
氧元素的化合价 -2 -1
电子式 Na+]2-Na+ Na+]2-Na+
颜色、状态 白色固体 淡黄色固体(粉末)
与H2O反应 Na2O+H2O 2NaOH 2Na2O2+2H2O
4NaOH+O2↑
Na2O
Na2O2
-2
-1
Na+]2-Na+
Na+]2-Na+
白色固体
淡黄色固体(粉末)
Na2O+H2O
2NaOH
2Na2O2+2H2O
4NaOH+O2↑
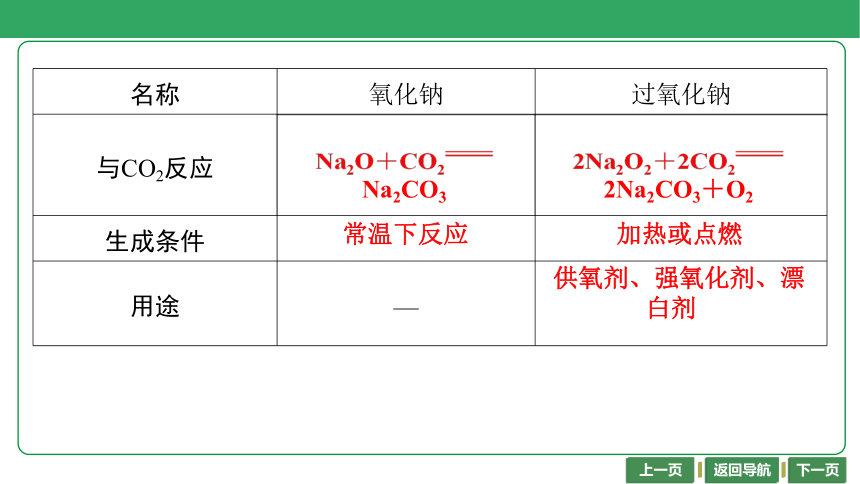
名称 氧化钠 过氧化钠
与CO2反应 Na2O+CO2 Na2CO3 2Na2O2+2CO2
2Na2CO3+O2
生成条件 常温下反应 加热或点燃
用途 — 供氧剂、强氧化剂、漂白剂
Na2O+CO2
Na2CO3
2Na2O2+2CO2
2Na2CO3+O2
常温下反应
加热或点燃
供氧剂、强氧化剂、漂
白剂
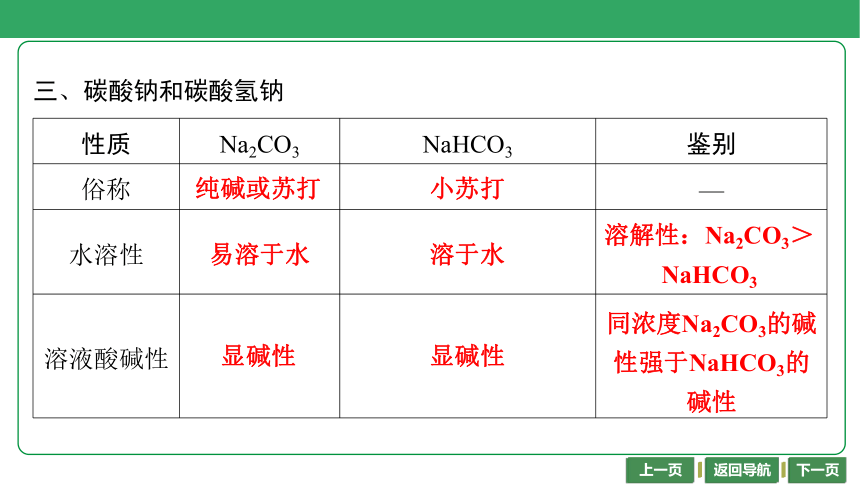
三、碳酸钠和碳酸氢钠
性质 Na2CO3 NaHCO3 鉴别
俗称 纯碱或苏打 小苏打 —
水溶性 易溶于水 溶于水 溶解性:Na2CO3>NaHCO3
溶液酸碱性 显碱性 显碱性 同浓度Na2CO3的碱性强于NaHCO3的碱性
纯碱或苏打
小苏打
易溶于水
溶于水
溶解性:Na2CO3>
NaHCO3
显碱性
显碱性
同浓度Na2CO3的碱
性强于NaHCO3的
碱性
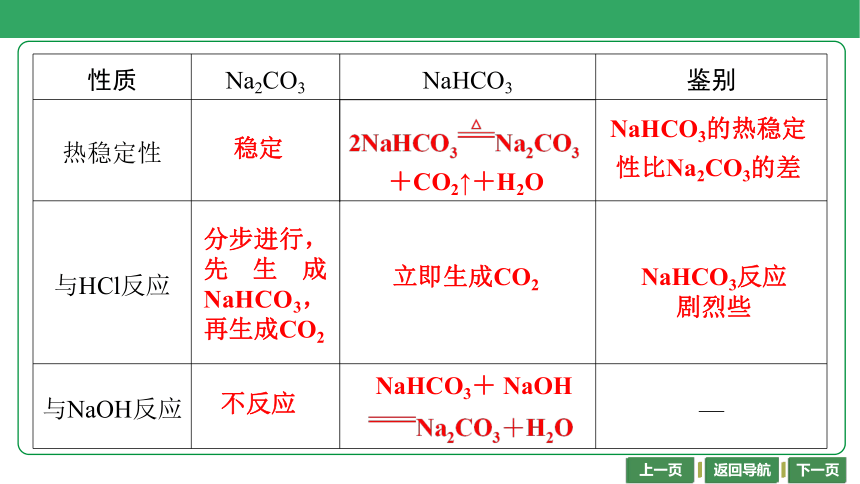
性质 Na2CO3 NaHCO3 鉴别
热稳定性 稳定 2NaHCO3Na2CO3+CO2↑+H2O NaHCO3的热稳定性比Na2CO3的差
与HCl反应 分步进行,先生成NaHCO3,再生成CO2 NaHCO3反应剧烈些
与NaOH反应 不反应 —
稳定
2NaHCO3Na2CO3
+CO2↑+H2O
NaHCO3的热稳定
性比Na2CO3的差
立即生成CO2
NaHCO3反应
剧烈些
不反应
NaHCO3+ NaOH
Na2CO3+H2O
分步进行,先生成NaHCO3,再生成CO2
性质 Na2CO3 NaHCO3 鉴别
与Ca(OH)2反应 生成CaCO3沉淀 生成CaCO3沉淀 不可用澄清石灰水鉴别
与CaCl2反应 生成CaCO3沉淀 不反应 前者有沉淀,后者无现象
与CO2反应 Na2CO3+H2O+CO22NaHCO3 不反应 前者有晶体析出,后者无
不可用澄清石灰水
鉴别
不反应
前者有沉淀,后者
无现象
不反应
前者有晶体析出,
后者无
生成CaCO3沉淀
生成CaCO3沉淀
Na2CO3+H2O+CO2 2NaHCO3
生成CaCO3沉淀
性质 Na2CO3 NaHCO3 鉴别
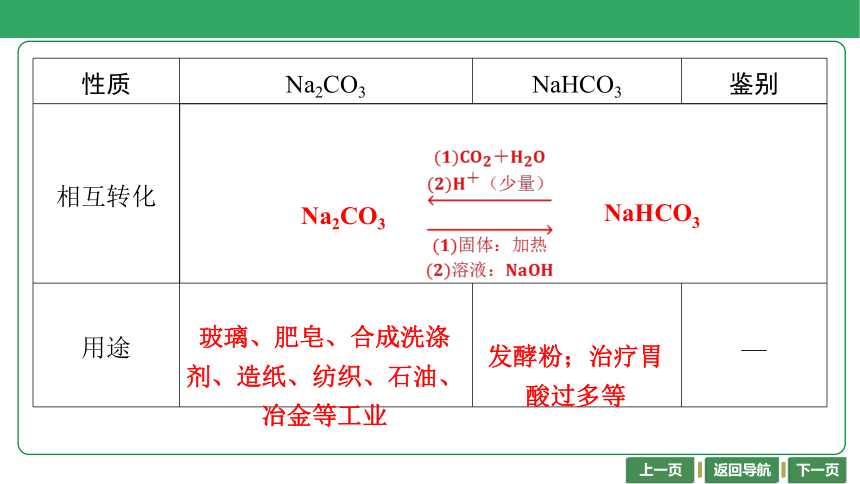
相互转化 Na2CO3NaHCO3 用途 玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业 发酵粉;治疗胃酸过多等 —
玻璃、肥皂、合成洗涤
剂、造纸、纺织、石油、
冶金等工业
发酵粉;治疗胃
酸过多等
Na2CO3
NaHCO3
四、焰色试验
1.操作:用洁净的 铂丝或铁丝 在酒精灯外焰灼烧,直至与原来的火焰颜色相同时为止,蘸取待测溶液,在酒精灯外焰上灼烧,观察火焰颜色。用完后,用 稀盐酸 洗净,在酒精灯外焰上灼烧至与原来火焰颜色相同时即可。
2.常见金属的焰色试验:Na—— 黄 色;K—— 紫 色(透过 蓝 色钴玻璃观察)。
铂丝或铁丝
稀盐酸
黄
紫
蓝
【激活思维】
问题1:钠能否置换出CuSO4溶液中的Cu?
不能。因为钠太活泼,投入水溶液中,先与水反应生成NaOH,生成的NaOH再与CuSO4反应生成Cu(OH)2沉淀,所以得不到Cu。
问题2:如图所示,能否判断出Na2CO3比NaHCO3稳定?
不能。应将Na2CO3和NaHCO3互换位置。
问题3:焰色试验为化学反应吗?
焰色试验属于物理变化。因为灼烧时,没有生成新物质,故属于物理变化。
考点1:钠及其化合物的俗名
【真题1】 (2018·江苏学测改编)下列物质的俗名与化学式对应正确的是( A )
A.食盐——NaCl B.苏打——NaHCO3
C.纯碱——NaOH D.烧碱——Ca(OH)2
解析:B项,苏打为Na2CO3;C项,纯碱为Na2CO3;D项,烧碱为NaOH。
A
考点2:焰色试验
【真题2】 (2020·江苏合格考样题)碳酸钠溶液在火焰上灼烧时,火焰呈现的颜色为( B )
A.紫色 B.黄色 C.绿色 D.红色
解析:钠元素的焰色试验为黄色。
【真题3】 (2016·江苏学测)判断:用焰色试验鉴别Na2SO4和Na2CO3。( 错 )
解析:Na2SO4和Na2CO3均为钠盐,不可以用焰色试验鉴别。
B
错
考点3:碳酸氢钠的性质
【真题4】 (2018·江苏学测)判断:用加热的方法除去NaHCO3固体中的少量NaCl。( 错 )
解析:加热时,NaHCO3会分解,错误。
错
A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D.称取3.80 g固体,加热至恒重,质量减少了0.620 g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880 g气体,说明原固体中仅含有Na2CO3和NaHCO3
考点4:含钠及其化合物的推断
【真题5】 (2015·江苏学测)实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( A )
A
解析:A项,发生反应为Na2CO3+CO2+H2O2NaHCO3↓,NaHCO3的溶解度较小,故以晶体形式析出,故可推断出一定有Na2CO3存在,正确;B项,CaO溶于水生成Ca(OH)2,Ca(OH)2与Na2CO3和NaHCO3均可以生成CaCO3沉淀,错误;C项,Ag+与C、Cl-反应分别生成Ag2CO3和AgCl,均为白色沉淀,错误;D项,
原混合物中NaHCO3为0.02 mol,加HCl溶解加热后的混合物产生 0.880 g CO2,n(CO2)=0.02 mol,分解产生的Na2CO3为0.01 mol,可产生0.01 mol CO2,所以原混合物中Na2CO3为0.01 mol,根据混合物的总质量知,m(Na2CO3)+m(NaHCO3)=0.01 mol×106 g·mol-1+0.02 mol×84 g·mol-1=2.74 g<3.80 g,所以混合物还存在NaCl, 错误。
1.(2023·扬州合格考模拟)下列常见厨房用品中水溶液显碱性的是( A )
A.小苏打 B.蔗糖 C.食盐 D.食醋
解析:小苏打为NaHCO3,水溶液显碱性,A项正确;蔗糖和食盐为中性,食醋为酸性。
A
2.(2023·扬州合格考模拟)焰色试验是一种非常古老的分析方法,《本草经集注》中记载“以火烧之,紫青烟起,云是真硝石(硝酸钾)也”。下列说法不正确的是( C )
A.“以火烧之”是为元素的焰色试验提供能量
B.这里的“紫青烟起”是钾元素的焰色试验
C.同种金属元素在不同的化合物中呈现出的焰色不同
D.向烟花中加入特定元素使焰火绚丽多彩,利用的是不同元素的焰色试验
C
解析:A项,“以火烧之”即为在火焰上灼烧,正确;B项,钾的焰色试验为紫色,正确;C项,焰色试验只针对元素的性质,同种金属元素在不同物质中的焰色相同,错误;D项,不同元素的焰色一般不同,所以焰火绚丽多彩,正确。
3.(2023·盐城合格考模拟)下列说法正确的是( C )
A.通过焰色试验这一化学变化可鉴别低钠盐中是否含有钾元素
B.海水通过蒸发结晶可制得精盐
C.工业上常用电解饱和食盐水的方法制取氢氧化钠
D.加碘低钠盐是在低钠盐中加入了碘单质
解析:A项,焰色试验为物理变化,错误;B项,海水中除了含NaCl外,还有KCl、CaCl2等杂质,只通过蒸发结晶不可能得到精盐,错误;C项,电解NaCl溶液可得NaOH、H2和Cl2,正确;D项,加碘盐中含碘的成分为KIO3,而不是I2,错误。
C
4.(2022·姜堰合格考模拟)侯德榜是我国近代化学工业奠基人之一,他经过数百次试验,改进了原有的制碱方法,确定了新的工艺流程,这就是联合制碱法。该制碱法中“碱”的主要成分是( C )
A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
解析:侯氏制碱法得到纯碱,为Na2CO3。
C
5.(2022·丹阳合格考模拟)下列关于钠及其化合物的叙述中,正确的是( B )
A.金属钠具有很强的氧化性
B.过氧化钠露置于空气中会变成碳酸钠 C.金属钠可保存在酒精中 D.钠可与硫酸铜溶液反应得到铜
解析:A项,Na易失去电子,表现为强还原性,错误;B项,Na2O2遇空气中的CO2会生成Na2CO3,正确;C项,钠应保存在煤油中,Na会与酒精反应,错误;D项,钠与CuSO4溶液中的水反应生成NaOH,CuSO4与NaOH反应生成Cu(OH)2沉淀,不能反应生成Cu,错误。
B
6.(2022·徐州合格考模拟)关于金属钠单质及其化合物的说法中,不正确的是( B )
A.NaCl可用作食品调味剂
B.相同温度下NaHCO3溶解度大于Na2CO3
C.Na2CO3的焰色试验呈黄色
D.工业上Na可用于制备钛、锆等金属
解析:A项,NaCl是最常用的食品调味剂,正确;B项,相同温度下NaHCO3溶解度小于Na2CO3,错误;C项,钠元素的焰色试验呈黄色,正确;D项,工业上可利用Na与熔融TiCl4及锆盐制备钛、锆等金属,正确。
B
7.(2021·扬州合格考模拟)下列关于钠及其化合物的描述中,正确的是( B )
A.钠的硬度很大
B.钠在O2中燃烧可生成Na2O2 C.常温下,钠与O2不反应
D.电解饱和食盐水可以制得钠
解析:钠的硬度小。常温下,Na与O2生成Na2O。电解饱和食盐水得NaOH,得不到Na。
B
8.(2020·昆山合格考模拟)金属钠着火时,可用来灭火的是( B )
A.水 B.沙子 C.煤油 D.泡沫灭火器
解析:钠可以与水反应,煤油遇明火会燃烧,泡沫灭火器产生的CO2,也会与钠反应。钠着火,可以用沙子盖住钠,以隔绝其与空气接触。
B
9.(2020·南京合格考模拟)下列物质与水接触会产生氢气的是( A )
A.Na B.Na2O C.Na2O2 D.NaHCO3
解析:Na与H2O反应:2Na+2H2O2NaOH+H2↑。Na2O与H2O反应:Na2O+H2O2NaOH。Na2O2与H2O反应:2Na2O2+2H2O4NaOH+O2↑。NaHCO3与水不反应。
A
10.(2017·江苏学测)小苏打是常用的食品添加剂,其化学式是( B )
A.Na2CO3 B.NaHCO3
C.Na2SO4 D.NaCl
解析:小苏打的化学式为NaHCO3。
11.(2014·江苏学测)判断:用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体。( 对 )
解析:碳酸氢钠不稳定,受热易分解,质量减轻,而碳酸钠稳定,加热不分解,正确。
B
对
12.(2014·江苏学测)判断:用焰色试验鉴别NaCl固体和NaOH固体。( 错 )
解析:氯化钠、氢氧化钠的焰色试验都一样,不能鉴别,错误。
错
13.(2009·江苏学测)“脚印”“笑脸”“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色试验有关。下列说法错误的是( D )
A.观察K2SO4的焰色试验透过蓝色的钴玻璃
B.Na与NaCl在灼烧时火焰颜色相同
C.可以用焰色试验来区别NaCl和KCl
D.焰色试验一定发生化学变化
解析:A项,K的焰色应通过蓝色的钴玻璃观察,正确;B项,钠及钠的化合物的焰色均为黄色,正确;C项,Na、K的焰色分别为黄色和紫色,正确;D项,焰色试验过程中没有生成新物质,故为物理变化,错误。
D
14.(2018·扬州合格考模拟)下列有关Na2CO3和NaHCO3说法正确的是( C )
A.Na2CO3俗称烧碱,水溶液呈碱性
B.Na2CO3的热稳定性弱于NaHCO3
C.常温下,Na2CO3的溶解度大于NaHCO3
D.用Ca(OH)2溶液可鉴别Na2CO3溶液和NaHCO3溶液
解析:A项,Na2CO3俗称纯碱,错误;B项,NaHCO3加热分解,而Na2CO3加热不分解,故Na2CO3的稳定性强于NaHCO3,错误;C项,NaHCO3是细小晶体,其溶解度较小,正确;D项,Ca(OH)2溶液与Na2CO3溶液和NaHCO3溶液均可以生成CaCO3白色沉淀,错误。
C
15.(2018·镇江合格考模拟)向饱和食盐水中先通入过量NH3,再通入过量的CO2有晶体析出,该晶体是( D )
A.NH4Cl B.NaOH C.Na2CO3 D.NaHCO3
解析:该过程为侯德榜制碱的第一步反应,即NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl,NaHCO3的溶解度较小,可析出。
D
16.(2018·南通合格考模拟)下列关于碳酸钠的说法正确的是( C )
A.受热易分解
B.不能与二氧化碳在水溶液中发生反应
C.水溶液呈碱性,因而被称为“纯碱”
D.将10.6 g Na2CO3固体溶于100 mL水中即可配得1.00 mol·L-1 Na2CO3溶液
解析:A项,Na2CO3受热不分解,错误;B项,Na2CO3+CO2+H2O2NaHCO3,错误;C项,纯碱不是碱,但是显碱性,正确;D项,应配成100 mL溶液,而不是溶于100 mL水,错误。
C
第10讲 钠及其化合物
专题三 常见无机物及其应用
目
录
1
考点填空
2
真题回放
3
过关检测
一、钠
1.钠的物理性质: 银白 色,有金属光泽的固体,热、电的良导体,质 软 ,密度 小于 水、 大于 煤油,熔点 低于 水的沸点。
2.钠的化学性质
银白
软
小于
大于
低于
(1)钠的原子结构示意图为 ,最外层只有一个电子,很容易失去,显强 还原性 ,所以自然界无游离态钠,钠元素以 化合 态(主要是 NaCl )形式存在。
还原性
化合
NaCl
(2)与O2反应:
①常温下: 4Na+O22Na2O 。
②点燃或加热时: 2Na+O2Na2O2 。
4Na+O22Na2O
2Na+O2Na2O2
(3)与H2O反应:现象 浮、熔、游、响、红 。
化学方程式为 2Na+2H2O2NaOH+H2↑ 。
离子方程式为 2Na++2OH-+H2↑ 。(用单线桥法 分析)
浮、熔、游、响、红
2Na+2H2O2NaOH+H2↑
2Na+2H2O 2Na++2OH-+H2↑
2
3.钠的保存:通常保存在 煤油 中。
4.钠的制备:工业制钠的反应为 2NaCl(熔融)2Na+Cl2↑ 。
煤油
2NaCl(熔融)2Na+Cl2↑
5.钠的用途
(1)高压钠灯发出黄光,射程远,透雾能力 强 ;
(2)钠钾合金常温下呈液态,用于原子反应堆的 导热剂 ;
(3)从钛、锆、铌、钽等金属氯化物中 置换 出相应的金属。
强
导热剂
置换
二、氧化钠与过氧化钠
名称 氧化钠 过氧化钠
化学式 Na2O Na2O2
氧元素的化合价 -2 -1
电子式 Na+]2-Na+ Na+]2-Na+
颜色、状态 白色固体 淡黄色固体(粉末)
与H2O反应 Na2O+H2O 2NaOH 2Na2O2+2H2O
4NaOH+O2↑
Na2O
Na2O2
-2
-1
Na+]2-Na+
Na+]2-Na+
白色固体
淡黄色固体(粉末)
Na2O+H2O
2NaOH
2Na2O2+2H2O
4NaOH+O2↑
名称 氧化钠 过氧化钠
与CO2反应 Na2O+CO2 Na2CO3 2Na2O2+2CO2
2Na2CO3+O2
生成条件 常温下反应 加热或点燃
用途 — 供氧剂、强氧化剂、漂白剂
Na2O+CO2
Na2CO3
2Na2O2+2CO2
2Na2CO3+O2
常温下反应
加热或点燃
供氧剂、强氧化剂、漂
白剂
三、碳酸钠和碳酸氢钠
性质 Na2CO3 NaHCO3 鉴别
俗称 纯碱或苏打 小苏打 —
水溶性 易溶于水 溶于水 溶解性:Na2CO3>NaHCO3
溶液酸碱性 显碱性 显碱性 同浓度Na2CO3的碱性强于NaHCO3的碱性
纯碱或苏打
小苏打
易溶于水
溶于水
溶解性:Na2CO3>
NaHCO3
显碱性
显碱性
同浓度Na2CO3的碱
性强于NaHCO3的
碱性
性质 Na2CO3 NaHCO3 鉴别
热稳定性 稳定 2NaHCO3Na2CO3+CO2↑+H2O NaHCO3的热稳定性比Na2CO3的差
与HCl反应 分步进行,先生成NaHCO3,再生成CO2 NaHCO3反应剧烈些
与NaOH反应 不反应 —
稳定
2NaHCO3Na2CO3
+CO2↑+H2O
NaHCO3的热稳定
性比Na2CO3的差
立即生成CO2
NaHCO3反应
剧烈些
不反应
NaHCO3+ NaOH
Na2CO3+H2O
分步进行,先生成NaHCO3,再生成CO2
性质 Na2CO3 NaHCO3 鉴别
与Ca(OH)2反应 生成CaCO3沉淀 生成CaCO3沉淀 不可用澄清石灰水鉴别
与CaCl2反应 生成CaCO3沉淀 不反应 前者有沉淀,后者无现象
与CO2反应 Na2CO3+H2O+CO22NaHCO3 不反应 前者有晶体析出,后者无
不可用澄清石灰水
鉴别
不反应
前者有沉淀,后者
无现象
不反应
前者有晶体析出,
后者无
生成CaCO3沉淀
生成CaCO3沉淀
Na2CO3+H2O+CO2 2NaHCO3
生成CaCO3沉淀
性质 Na2CO3 NaHCO3 鉴别
相互转化 Na2CO3NaHCO3 用途 玻璃、肥皂、合成洗涤剂、造纸、纺织、石油、冶金等工业 发酵粉;治疗胃酸过多等 —
玻璃、肥皂、合成洗涤
剂、造纸、纺织、石油、
冶金等工业
发酵粉;治疗胃
酸过多等
Na2CO3
NaHCO3
四、焰色试验
1.操作:用洁净的 铂丝或铁丝 在酒精灯外焰灼烧,直至与原来的火焰颜色相同时为止,蘸取待测溶液,在酒精灯外焰上灼烧,观察火焰颜色。用完后,用 稀盐酸 洗净,在酒精灯外焰上灼烧至与原来火焰颜色相同时即可。
2.常见金属的焰色试验:Na—— 黄 色;K—— 紫 色(透过 蓝 色钴玻璃观察)。
铂丝或铁丝
稀盐酸
黄
紫
蓝
【激活思维】
问题1:钠能否置换出CuSO4溶液中的Cu?
不能。因为钠太活泼,投入水溶液中,先与水反应生成NaOH,生成的NaOH再与CuSO4反应生成Cu(OH)2沉淀,所以得不到Cu。
问题2:如图所示,能否判断出Na2CO3比NaHCO3稳定?
不能。应将Na2CO3和NaHCO3互换位置。
问题3:焰色试验为化学反应吗?
焰色试验属于物理变化。因为灼烧时,没有生成新物质,故属于物理变化。
考点1:钠及其化合物的俗名
【真题1】 (2018·江苏学测改编)下列物质的俗名与化学式对应正确的是( A )
A.食盐——NaCl B.苏打——NaHCO3
C.纯碱——NaOH D.烧碱——Ca(OH)2
解析:B项,苏打为Na2CO3;C项,纯碱为Na2CO3;D项,烧碱为NaOH。
A
考点2:焰色试验
【真题2】 (2020·江苏合格考样题)碳酸钠溶液在火焰上灼烧时,火焰呈现的颜色为( B )
A.紫色 B.黄色 C.绿色 D.红色
解析:钠元素的焰色试验为黄色。
【真题3】 (2016·江苏学测)判断:用焰色试验鉴别Na2SO4和Na2CO3。( 错 )
解析:Na2SO4和Na2CO3均为钠盐,不可以用焰色试验鉴别。
B
错
考点3:碳酸氢钠的性质
【真题4】 (2018·江苏学测)判断:用加热的方法除去NaHCO3固体中的少量NaCl。( 错 )
解析:加热时,NaHCO3会分解,错误。
错
A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3
C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl
D.称取3.80 g固体,加热至恒重,质量减少了0.620 g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880 g气体,说明原固体中仅含有Na2CO3和NaHCO3
考点4:含钠及其化合物的推断
【真题5】 (2015·江苏学测)实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是( A )
A
解析:A项,发生反应为Na2CO3+CO2+H2O2NaHCO3↓,NaHCO3的溶解度较小,故以晶体形式析出,故可推断出一定有Na2CO3存在,正确;B项,CaO溶于水生成Ca(OH)2,Ca(OH)2与Na2CO3和NaHCO3均可以生成CaCO3沉淀,错误;C项,Ag+与C、Cl-反应分别生成Ag2CO3和AgCl,均为白色沉淀,错误;D项,
原混合物中NaHCO3为0.02 mol,加HCl溶解加热后的混合物产生 0.880 g CO2,n(CO2)=0.02 mol,分解产生的Na2CO3为0.01 mol,可产生0.01 mol CO2,所以原混合物中Na2CO3为0.01 mol,根据混合物的总质量知,m(Na2CO3)+m(NaHCO3)=0.01 mol×106 g·mol-1+0.02 mol×84 g·mol-1=2.74 g<3.80 g,所以混合物还存在NaCl, 错误。
1.(2023·扬州合格考模拟)下列常见厨房用品中水溶液显碱性的是( A )
A.小苏打 B.蔗糖 C.食盐 D.食醋
解析:小苏打为NaHCO3,水溶液显碱性,A项正确;蔗糖和食盐为中性,食醋为酸性。
A
2.(2023·扬州合格考模拟)焰色试验是一种非常古老的分析方法,《本草经集注》中记载“以火烧之,紫青烟起,云是真硝石(硝酸钾)也”。下列说法不正确的是( C )
A.“以火烧之”是为元素的焰色试验提供能量
B.这里的“紫青烟起”是钾元素的焰色试验
C.同种金属元素在不同的化合物中呈现出的焰色不同
D.向烟花中加入特定元素使焰火绚丽多彩,利用的是不同元素的焰色试验
C
解析:A项,“以火烧之”即为在火焰上灼烧,正确;B项,钾的焰色试验为紫色,正确;C项,焰色试验只针对元素的性质,同种金属元素在不同物质中的焰色相同,错误;D项,不同元素的焰色一般不同,所以焰火绚丽多彩,正确。
3.(2023·盐城合格考模拟)下列说法正确的是( C )
A.通过焰色试验这一化学变化可鉴别低钠盐中是否含有钾元素
B.海水通过蒸发结晶可制得精盐
C.工业上常用电解饱和食盐水的方法制取氢氧化钠
D.加碘低钠盐是在低钠盐中加入了碘单质
解析:A项,焰色试验为物理变化,错误;B项,海水中除了含NaCl外,还有KCl、CaCl2等杂质,只通过蒸发结晶不可能得到精盐,错误;C项,电解NaCl溶液可得NaOH、H2和Cl2,正确;D项,加碘盐中含碘的成分为KIO3,而不是I2,错误。
C
4.(2022·姜堰合格考模拟)侯德榜是我国近代化学工业奠基人之一,他经过数百次试验,改进了原有的制碱方法,确定了新的工艺流程,这就是联合制碱法。该制碱法中“碱”的主要成分是( C )
A.Na2O B.NaOH C.Na2CO3 D.NaHCO3
解析:侯氏制碱法得到纯碱,为Na2CO3。
C
5.(2022·丹阳合格考模拟)下列关于钠及其化合物的叙述中,正确的是( B )
A.金属钠具有很强的氧化性
B.过氧化钠露置于空气中会变成碳酸钠 C.金属钠可保存在酒精中 D.钠可与硫酸铜溶液反应得到铜
解析:A项,Na易失去电子,表现为强还原性,错误;B项,Na2O2遇空气中的CO2会生成Na2CO3,正确;C项,钠应保存在煤油中,Na会与酒精反应,错误;D项,钠与CuSO4溶液中的水反应生成NaOH,CuSO4与NaOH反应生成Cu(OH)2沉淀,不能反应生成Cu,错误。
B
6.(2022·徐州合格考模拟)关于金属钠单质及其化合物的说法中,不正确的是( B )
A.NaCl可用作食品调味剂
B.相同温度下NaHCO3溶解度大于Na2CO3
C.Na2CO3的焰色试验呈黄色
D.工业上Na可用于制备钛、锆等金属
解析:A项,NaCl是最常用的食品调味剂,正确;B项,相同温度下NaHCO3溶解度小于Na2CO3,错误;C项,钠元素的焰色试验呈黄色,正确;D项,工业上可利用Na与熔融TiCl4及锆盐制备钛、锆等金属,正确。
B
7.(2021·扬州合格考模拟)下列关于钠及其化合物的描述中,正确的是( B )
A.钠的硬度很大
B.钠在O2中燃烧可生成Na2O2 C.常温下,钠与O2不反应
D.电解饱和食盐水可以制得钠
解析:钠的硬度小。常温下,Na与O2生成Na2O。电解饱和食盐水得NaOH,得不到Na。
B
8.(2020·昆山合格考模拟)金属钠着火时,可用来灭火的是( B )
A.水 B.沙子 C.煤油 D.泡沫灭火器
解析:钠可以与水反应,煤油遇明火会燃烧,泡沫灭火器产生的CO2,也会与钠反应。钠着火,可以用沙子盖住钠,以隔绝其与空气接触。
B
9.(2020·南京合格考模拟)下列物质与水接触会产生氢气的是( A )
A.Na B.Na2O C.Na2O2 D.NaHCO3
解析:Na与H2O反应:2Na+2H2O2NaOH+H2↑。Na2O与H2O反应:Na2O+H2O2NaOH。Na2O2与H2O反应:2Na2O2+2H2O4NaOH+O2↑。NaHCO3与水不反应。
A
10.(2017·江苏学测)小苏打是常用的食品添加剂,其化学式是( B )
A.Na2CO3 B.NaHCO3
C.Na2SO4 D.NaCl
解析:小苏打的化学式为NaHCO3。
11.(2014·江苏学测)判断:用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体。( 对 )
解析:碳酸氢钠不稳定,受热易分解,质量减轻,而碳酸钠稳定,加热不分解,正确。
B
对
12.(2014·江苏学测)判断:用焰色试验鉴别NaCl固体和NaOH固体。( 错 )
解析:氯化钠、氢氧化钠的焰色试验都一样,不能鉴别,错误。
错
13.(2009·江苏学测)“脚印”“笑脸”“五环”等焰火让北京奥运会开幕式更加辉煌壮观,这些五彩缤纷的焰火与元素的焰色试验有关。下列说法错误的是( D )
A.观察K2SO4的焰色试验透过蓝色的钴玻璃
B.Na与NaCl在灼烧时火焰颜色相同
C.可以用焰色试验来区别NaCl和KCl
D.焰色试验一定发生化学变化
解析:A项,K的焰色应通过蓝色的钴玻璃观察,正确;B项,钠及钠的化合物的焰色均为黄色,正确;C项,Na、K的焰色分别为黄色和紫色,正确;D项,焰色试验过程中没有生成新物质,故为物理变化,错误。
D
14.(2018·扬州合格考模拟)下列有关Na2CO3和NaHCO3说法正确的是( C )
A.Na2CO3俗称烧碱,水溶液呈碱性
B.Na2CO3的热稳定性弱于NaHCO3
C.常温下,Na2CO3的溶解度大于NaHCO3
D.用Ca(OH)2溶液可鉴别Na2CO3溶液和NaHCO3溶液
解析:A项,Na2CO3俗称纯碱,错误;B项,NaHCO3加热分解,而Na2CO3加热不分解,故Na2CO3的稳定性强于NaHCO3,错误;C项,NaHCO3是细小晶体,其溶解度较小,正确;D项,Ca(OH)2溶液与Na2CO3溶液和NaHCO3溶液均可以生成CaCO3白色沉淀,错误。
C
15.(2018·镇江合格考模拟)向饱和食盐水中先通入过量NH3,再通入过量的CO2有晶体析出,该晶体是( D )
A.NH4Cl B.NaOH C.Na2CO3 D.NaHCO3
解析:该过程为侯德榜制碱的第一步反应,即NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl,NaHCO3的溶解度较小,可析出。
D
16.(2018·南通合格考模拟)下列关于碳酸钠的说法正确的是( C )
A.受热易分解
B.不能与二氧化碳在水溶液中发生反应
C.水溶液呈碱性,因而被称为“纯碱”
D.将10.6 g Na2CO3固体溶于100 mL水中即可配得1.00 mol·L-1 Na2CO3溶液
解析:A项,Na2CO3受热不分解,错误;B项,Na2CO3+CO2+H2O2NaHCO3,错误;C项,纯碱不是碱,但是显碱性,正确;D项,应配成100 mL溶液,而不是溶于100 mL水,错误。
C
同课章节目录
