3.1.2氯气的性质课件(共22张PPT)2023-2024学年高一上学期化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1.2氯气的性质课件(共22张PPT)2023-2024学年高一上学期化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 11:13:57 | ||
图片预览








文档简介
(共22张PPT)
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第2课时 氯气的性质
学习目标
能正确说出氯气的物理性质。
从氯的原子结构特点和氯气跟金属、非金属的反应认识氯气是一种化学性质非常活泼的非金属。
知道氯气与水反应的产物,能正确列出氯水(新制氯水和久置氯水)的主要成分。
会书写氯气与碱反应的化学方程式,知道漂白粉的成分及其漂白原理。
课程导入
大家夏天去游泳的时候在水里是不是会闻到刺鼻的气味?那是漂白粉的味道,它能杀死水中的细菌。那么大家知道漂白粉是怎么来的吗?制取它的原料就有今天我们所学的氯气。
一、 氯气的物理性质
1. 氯气是 气体;密度比空气 ; 溶于水,1体积水能溶2体积氯气;氯气 毒。
氯气
液氯
-34.6度
固态氯
-101度
易液化:
新知探究
黄绿色
大
能
有
2. 氯气的分子结构
氯气(Cl2)分子是由两个氯原子构成的双原子分子。
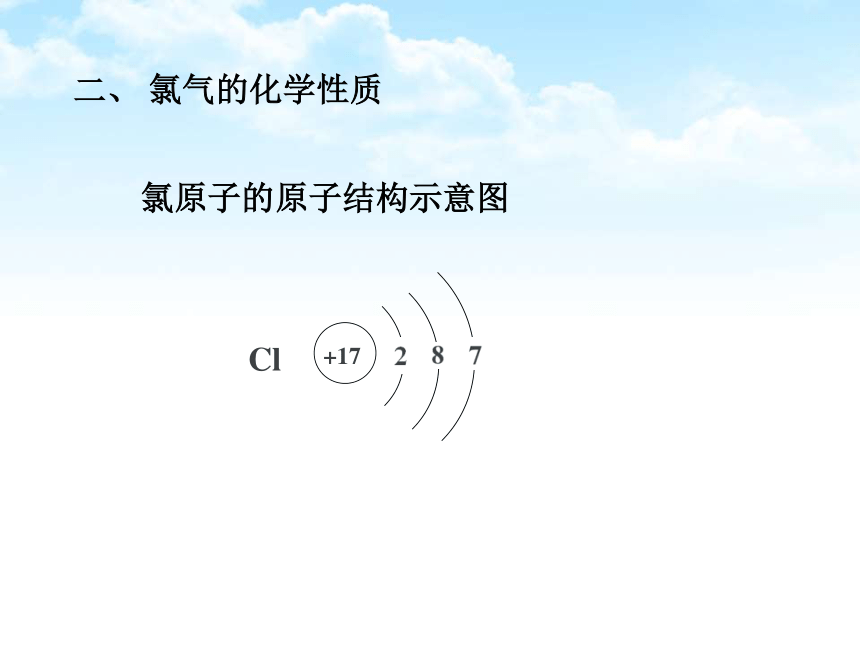
二、 氯气的化学性质
氯原子的原子结构示意图
+17
Cl
3. 氯气可以和水反应。
1. 氯气可以和绝大多数的金属反应;
2. 氯气可以和许多非金属反应;
由于氯原子最外层电子为 7 个,所以它极易从外界获得 1个电子达到最外层 8 电子稳定结构,所以氯气的化学性质极为活泼,可以与许多物质发生反应。具体表现在:
4. 与碱的反应。
现象:
铜丝在氯气里剧烈燃烧,产生 的烟,产物溶于水后,溶液呈 色。
1. 氯气与金属反应
(K、Ca、Na、Mg、Al、Zn、Fe、Cu…)
Cl2+ Cu ==== CuCl 2
点燃
棕黄色
蓝绿
现象:
铁丝剧烈燃烧,产生 。
剧烈燃烧,火焰呈 ,生成 。
反应规律:生成高价的氯化物。
2Na + Cl2 === 2 NaCl
点燃
点燃
3Cl2 + 2Fe==== 2FeCl 3
棕黄色的烟
黄色
白色晶体
2. 氯气与非金属反应
氯气跟氢气的反应
氢气在氯气燃烧,发出 的火焰,同时产生大量的热;生成的氯化氢气体在空气中容易跟水蒸气结合呈现 。
化学方程式:
点燃
H2+Cl2 === 2HCl
安静的燃烧
氯化氢气体 盐酸
溶于水制成
苍白色
雾状
3. 氯气与水的反应
氯气
水
氯水
溶于
形成
部分Cl2和水简单混合
部分Cl2和水发生化学反应
Cl2 + H2O HCl + HClO
盐酸或
氢氯酸
次氯酸
氯水中含有哪些粒子?
分子有 Cl2 、H2O 和 HClO。
离子有 Cl-、H+ 、OH-和 ClO- 。
可逆反应:
在相等条件下该反应既可以向正反应方向进行,又可以向逆反应方向进行。
HClO (次氯酸)
(1)弱酸,不稳定,容易见光分解。
(3)具有强氧化性,能杀死病菌。
(4)具有漂白性。
(2)久制氯水的成分:
HCl 溶液。
2HClO ==== 2HCl + O2
光照
4. 与碱的反应
漂白液的
有效成分
将氯气通入冷的消石灰中可制得漂白粉,请写出
此反应方程式。
2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + 2NaOH === NaCl + NaClO + H2O
在空气中失效的原理:
有效成份:
成份:
漂白粉
使用原理:
CaCl 2 和Ca(ClO) 2
Ca(ClO) 2
Ca(ClO) 2 +CO2+H2O === CaCO3+2HClO
Ca(ClO) 2 +CO2+H2O === CaCO3+2HClO
2HClO === 2HCl+O2↑
三、实验室制取氯气的方法
制取盐酸
Cl2
制取漂白剂
作消毒剂
是合成塑料、橡胶、人造纤维、农药和药品的重要原料
四、氯气的用途
1. 氯气是黄绿色气体;密度比空气大;能溶于水, 1体积水能溶2体积氯气;氯气有毒。
2. 氯气的化学性质极为活泼,氯气可以和绝大多 数的金属反应,也可以和许多非金属反应。
3. 新制氯水成分:
Cl2、HClO 、HCl、 H2O。
4. 久制氯水成分:
稀盐酸。
5. 液氯成分:Cl2 。
学习小结
1. 若一瓶氯水在阳光下放置很久,那么此时氯水的成分是什么?与新制氯水有何区别?
由于氯气与水反应生成次氯酸,而次氯酸见光易分解,Cl2 HClO HCl 这个过程不断进行,使氯水中的氯气以及次氯酸最终全转化为HCl,所以在阳光下久置后的氯水的主要成分应是HCl。
当堂检测
2.用自来水养金鱼时,通常先将自来水经日光晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死细菌
B.提高水温,有利于金鱼生长
C.增加水中氯气的含量
D.促使水中的次氯酸分解
D
3.下列关于氯水的叙述中,正确的是( )
A.新制氯水中只有离子,没有分子
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.向新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水可以使干燥的有色布条褪色
D
Thank You!
专题3 从海水中获得的化学物质
第一单元 氯气及氯的化合物
第2课时 氯气的性质
学习目标
能正确说出氯气的物理性质。
从氯的原子结构特点和氯气跟金属、非金属的反应认识氯气是一种化学性质非常活泼的非金属。
知道氯气与水反应的产物,能正确列出氯水(新制氯水和久置氯水)的主要成分。
会书写氯气与碱反应的化学方程式,知道漂白粉的成分及其漂白原理。
课程导入
大家夏天去游泳的时候在水里是不是会闻到刺鼻的气味?那是漂白粉的味道,它能杀死水中的细菌。那么大家知道漂白粉是怎么来的吗?制取它的原料就有今天我们所学的氯气。
一、 氯气的物理性质
1. 氯气是 气体;密度比空气 ; 溶于水,1体积水能溶2体积氯气;氯气 毒。
氯气
液氯
-34.6度
固态氯
-101度
易液化:
新知探究
黄绿色
大
能
有
2. 氯气的分子结构
氯气(Cl2)分子是由两个氯原子构成的双原子分子。
二、 氯气的化学性质
氯原子的原子结构示意图
+17
Cl
3. 氯气可以和水反应。
1. 氯气可以和绝大多数的金属反应;
2. 氯气可以和许多非金属反应;
由于氯原子最外层电子为 7 个,所以它极易从外界获得 1个电子达到最外层 8 电子稳定结构,所以氯气的化学性质极为活泼,可以与许多物质发生反应。具体表现在:
4. 与碱的反应。
现象:
铜丝在氯气里剧烈燃烧,产生 的烟,产物溶于水后,溶液呈 色。
1. 氯气与金属反应
(K、Ca、Na、Mg、Al、Zn、Fe、Cu…)
Cl2+ Cu ==== CuCl 2
点燃
棕黄色
蓝绿
现象:
铁丝剧烈燃烧,产生 。
剧烈燃烧,火焰呈 ,生成 。
反应规律:生成高价的氯化物。
2Na + Cl2 === 2 NaCl
点燃
点燃
3Cl2 + 2Fe==== 2FeCl 3
棕黄色的烟
黄色
白色晶体
2. 氯气与非金属反应
氯气跟氢气的反应
氢气在氯气燃烧,发出 的火焰,同时产生大量的热;生成的氯化氢气体在空气中容易跟水蒸气结合呈现 。
化学方程式:
点燃
H2+Cl2 === 2HCl
安静的燃烧
氯化氢气体 盐酸
溶于水制成
苍白色
雾状
3. 氯气与水的反应
氯气
水
氯水
溶于
形成
部分Cl2和水简单混合
部分Cl2和水发生化学反应
Cl2 + H2O HCl + HClO
盐酸或
氢氯酸
次氯酸
氯水中含有哪些粒子?
分子有 Cl2 、H2O 和 HClO。
离子有 Cl-、H+ 、OH-和 ClO- 。
可逆反应:
在相等条件下该反应既可以向正反应方向进行,又可以向逆反应方向进行。
HClO (次氯酸)
(1)弱酸,不稳定,容易见光分解。
(3)具有强氧化性,能杀死病菌。
(4)具有漂白性。
(2)久制氯水的成分:
HCl 溶液。
2HClO ==== 2HCl + O2
光照
4. 与碱的反应
漂白液的
有效成分
将氯气通入冷的消石灰中可制得漂白粉,请写出
此反应方程式。
2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2 + 2H2O
Cl2 + 2NaOH === NaCl + NaClO + H2O
在空气中失效的原理:
有效成份:
成份:
漂白粉
使用原理:
CaCl 2 和Ca(ClO) 2
Ca(ClO) 2
Ca(ClO) 2 +CO2+H2O === CaCO3+2HClO
Ca(ClO) 2 +CO2+H2O === CaCO3+2HClO
2HClO === 2HCl+O2↑
三、实验室制取氯气的方法
制取盐酸
Cl2
制取漂白剂
作消毒剂
是合成塑料、橡胶、人造纤维、农药和药品的重要原料
四、氯气的用途
1. 氯气是黄绿色气体;密度比空气大;能溶于水, 1体积水能溶2体积氯气;氯气有毒。
2. 氯气的化学性质极为活泼,氯气可以和绝大多 数的金属反应,也可以和许多非金属反应。
3. 新制氯水成分:
Cl2、HClO 、HCl、 H2O。
4. 久制氯水成分:
稀盐酸。
5. 液氯成分:Cl2 。
学习小结
1. 若一瓶氯水在阳光下放置很久,那么此时氯水的成分是什么?与新制氯水有何区别?
由于氯气与水反应生成次氯酸,而次氯酸见光易分解,Cl2 HClO HCl 这个过程不断进行,使氯水中的氯气以及次氯酸最终全转化为HCl,所以在阳光下久置后的氯水的主要成分应是HCl。
当堂检测
2.用自来水养金鱼时,通常先将自来水经日光晒一段时间后,再注入鱼缸,其目的是( )
A.利用紫外线杀死细菌
B.提高水温,有利于金鱼生长
C.增加水中氯气的含量
D.促使水中的次氯酸分解
D
3.下列关于氯水的叙述中,正确的是( )
A.新制氯水中只有离子,没有分子
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.向新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水可以使干燥的有色布条褪色
D
Thank You!
