第三十九原子结构与性质(课件)(共54张PPT)2024年高考化学复习
文档属性
| 名称 | 第三十九原子结构与性质(课件)(共54张PPT)2024年高考化学复习 |  | |
| 格式 | pptx | ||
| 文件大小 | 66.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 11:39:56 | ||
图片预览









文档简介
(共54张PPT)
第三十九讲 原子结构与性质
学 习 目 标
1.了解原子核外电子运动状态、能级分布和排布原理。
2.能正确书写1~36号元素原子核外电子排布式、价层电子排布式和电子排布图。
3.理解原子结构与元素周期表的关系。
4.了解电离能、电负性的含义,并能正确说明元素的某些性质。
考点一 原子核外电子排布
考点二 元素周期表与元素的性质
目
录
CONTENTS
///////
真题验收 制胜高考
///////
知能训练 素养落实
///////
///////
1
原子核外电子排布
处于一定空间运动状态的电子在原子核外空间的______________的形象化描述。
原子核外电子是分层排布的,根据电子的______不同,可将核外电子分成不同的能层。
能量
概率密度分布
1.能层(电子层)与能级
2.电子云与原子轨道
同一能层电子的能量也可能不同,又将其分成不同的能级,通常用________________表示。能级种类数等于所在能层的能层序数。
s、p、d、f
(1)电子云:
(1)能层:
(2)能级:
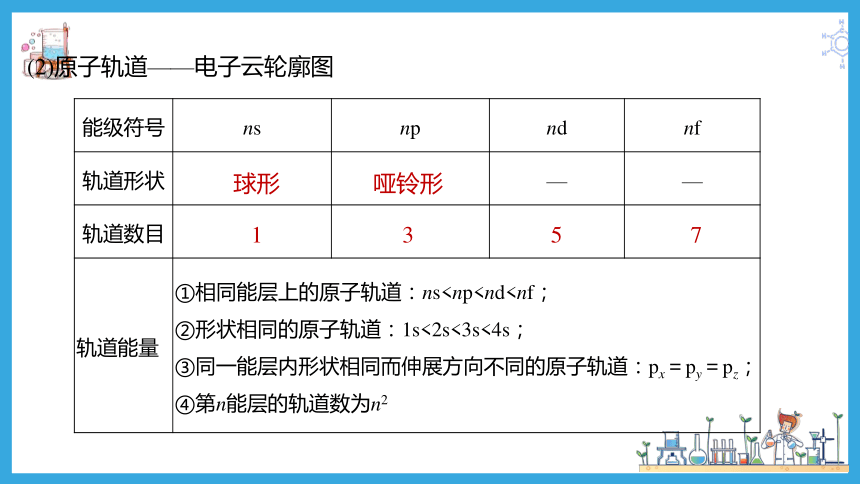
(2)原子轨道——电子云轮廓图
能级符号 ns np nd nf
轨道形状 — —
轨道数目
轨道能量 ①相同能层上的原子轨道:ns球形
哑铃形
1
3
5
7
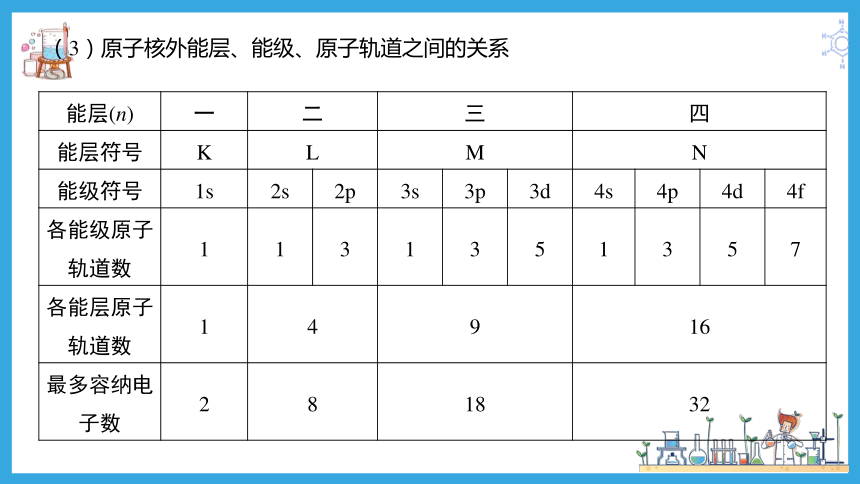
(3)原子核外能层、能级、原子轨道之间的关系
能层(n) 一 二 三 四
能层符号 K L M N
能级符号 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
各能级原子轨道数 1 1 3 1 3 5 1 3 5 7
各能层原子轨道数 1 4 9 16
最多容纳电子数 2 8 18 32
3.电子自旋
(1)电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋______的电子。
(2)能量相同的原子轨道(简并轨道),箭头表示一种__________的电子,“↑↓”称电子对,“↑”或“↓”称单电子(或称未成对电子)。箭头同向的单电子称自旋______。
相反
自旋状态
平行
② :在一个原子轨道里,最多只能容纳2个电子,它们的自旋 。
如2s轨道上的电子排布为 ,不能表示为 。
4.基态原子的核外电子排布
(1)排布原则
① :在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
能量最低原理
泡利原理
相反
③ :基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
如2p3的电子排布为____________,不能表示为 或 。
洪特规则
当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空(p0、d0、f0)时原子的能量最低.
如24Cr的电子排布式为[Ar]3d54s1
29Cu的电子排布式为[Ar]3d104s1。
(2)特例:
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
(3)填充顺序——构造原理
(4)表示方法
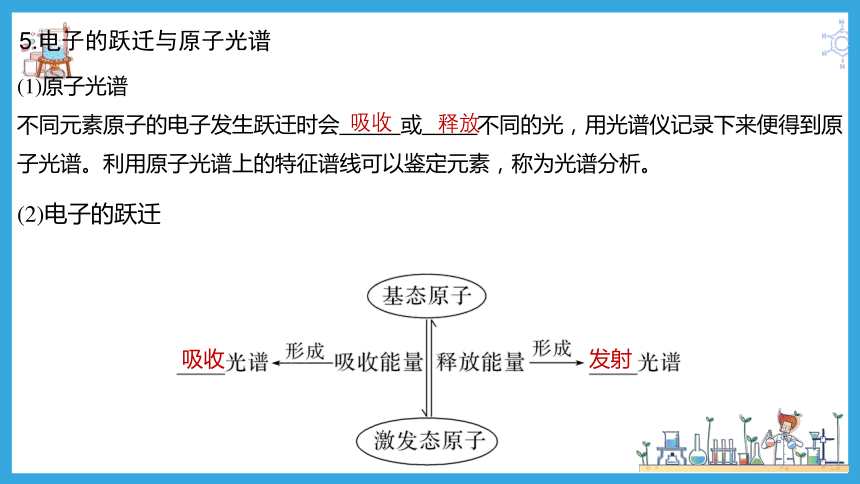
5.电子的跃迁与原子光谱
吸收
发射
(1)原子光谱
不同元素原子的电子发生跃迁时会 或 不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱上的特征谱线可以鉴定元素,称为光谱分析。
(2)电子的跃迁
吸收
释放
思想在线
【判一判】 正误判断(正确打“√”,错误打“×”)。
×
×
×
×
×
×
2.下列电子排布式或电子排布图正确的是( )
D
3.回答下列问题:
(1)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。元素K的焰色反应呈紫色,其中紫色对应的辐射波长为________(填字母)nm。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)钾发生焰色反应的原因是________________________________________________
_____________________________。
A
电子由较高能量的激发态跃迁到较低能量的激发态或基态时,以光的形式释放能量
4.(1)基态F原子核外电子的运动状态有 种。
(2)基态硅原子最外层的电子排布图为______________________。
(3) 在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
(4)Zn原子核外电子排布式为 。
(5)Co基态原子核外电子排布式为 。
(6)基态Ge原子的核外电子排布式为[Ar]_____________,有 个未成对电子。
(7)镍元素基态原子的电子排布式为 ,3d能级上的未成对电子数为 。
(8)写出基态As原子的核外电子排布式: 。
9
K+和P3-
1s22s22p63s23p63d74s2或[Ar]3d74s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
3d104s24p2
2
1s22s22p63s23p63d84s2或[Ar]3d84s2
2
1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
【课堂点拨】
(1)原子的电子排布式
①简单原子:
按照构造原理将电子依次填充到能量逐渐升高的能级中。
如:14Si:1s22s22p63s23p2。
②复杂原子:
先按构造原理从低到高排列,然后将同能层的能级移到一起。
如26Fe,先排列为:1s22s22p63s23p64s23d6,然后将同一能层的能级排到一起,
即该原子的电子排布式为1s22s22p63s23p63d64s2。
(2)离子的电子排布式
①判断该原子变成离子时会得到或失去多少个电子。
②原子失去电子时,总是从能量高的能级失去电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族和第Ⅷ族元素可能还会进一步向里失去内层电子。
③原子得到电子而形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
(3)简化电子排布式
如K:1s22s22p63s23p64s1,其简化电子排布式可表示为[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。
(4)价层电子排布式
如K:1s22s22p63s23p64s1,其价层电子排布式可表示为4s1。
(5)电子的运动状态与原子核外电子数目相等;空间运动状态与核外电子填充原子轨道的数目相等。
2
原子结构与元素的性质
主族 ⅠA ⅡA ⅢA ⅣA
排布特点 __________ _________ ______________ ______________
主族 ⅤA ⅥA ⅦA
排布特点 _______________ _______________ ________________
1.原子结构与元素周期表的关系
(1)原子结构与周期的关系
原子的最大能层数=周期序数。
(2)原子结构与族的关系
①主族元素的价层电子排布特点
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
②0族元素的价层电子排布:
He为1s2;其他为ns2np6。
③过渡元素(镧系、锕系元素除外)的价层电子排布:
(n-1)d1~10ns1~2。
(3)原子结构与元素周期表分区的关系
①元素周期表分区
(4)各区元素原子外围电子排布及性质特点
分区 元素分布 外围电子排布 元素性质特点
s区 ⅠA、ⅡA族 ns1~2 除氢外都是活泼金属元素;通常是最外层电子参与反应
p区 ⅢA族~Ⅶ族、0族 ns2np1~6(除He外) 通常是最外层电子参与反应
d区 ⅢB族~ⅦB族(除镧系、锕系外)、Ⅷ族 (n-1)d1-9ns1~2 除钯外 d轨道可以不同程度地参与化学键的形成
ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2 金属元素
f区 镧系、锕系 (n-2)f0~14 (n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近
2.原子半径
(1)影响因素:①能层数越多,原子半径______;②同周期核电荷数越大,原子半径______。
(2)变化规律:①同周期主族元素从左到右,原子半径逐渐______;
②同主族元素从上到下,原子半径逐渐______。
越大
越小
减小
增大
3.电离能
(1)含义
第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的
,符号: ,单位: 。
(2)规律
①同周期元素:从左往右,元素第一电离能呈 的趋势,其中第ⅡA族、第ⅤA族元素的第一电离能出现反常。
②同族元素:
从上到下第一电离能逐渐 。
③同种原子:
逐级电离能越来越大。
最低能量
I1
kJ·mol-1
增大
变小
(3)应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。
②判断元素的化合价
如果某元素的In+1 In,则该元素的常见化合价为+n,如钠元素的I2 I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
4.电负性
(1)含义:不同元素的原子 的标度。元素的电负性越大,表示其原子 越 。
(2)标准:以氟的电负性为 和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体元素未计)。
(3)变化规律
①在元素周期表中,同周期元素从左至右,元素的电负性逐渐 ,同主族元素从上至下,元素的电负性逐渐 。
②金属元素的电负性一般 ,非金属元素的电负性一般 ,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
对键合电子吸引力
对键合电子的吸引力
大
4.0
变大
变小
小于1.8
大于1.8
(4)应用
小
大
负
正
离子
共价
5.对角线规则
右下方
1.最外层电子数是ns2的元素,都是第ⅡA族元素( )
2.价层电子排布式为4s24p3的元素位于第四周期第ⅤA族,是p区元素( )
3.最外层有2个未成对电子的可能是ns2np2或ns2np4,短周期元素中分别为C、Si和O、S
( )
4.NH4H2PO4中,电负性最高的元素是氧( )
5.元素Mn与O中,第一电离能较大的是Mn( )
6.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能( )
7.C、N、O、F四种元素第一电离能从大到小的顺序是N>O>F>C( )
8.元素的电负性越大,非金属性越强,第一电离能也越大( )
×
√
√
√
×
×
×
×
思想在线
【判一判】 正误判断(正确打“√”,错误打“×”)。
2.(2023·宝鸡模拟)如图所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,T的单质常温下为液体。下列说法错误的是
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.Y、Z、W元素简单阴离子的半径:Y>Z>W
D
3.(2022·常州模拟)x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
A.x的原子半径大于y的原子半径
B.x的电负性小于y的电负性
C.x的氧化性大于y的氧化性
D.x的第一电离能小于y的第一电离能
C
4.(2022·苏州模拟)前四周期主族元素X、Y、Z、W的原子序数依次增大。X与Z同主族,且基态X原子中p能级和s能级上的电子数相同。Y、Z同周期,Y位于第ⅢA族,W最外层有2个电子。下列说法正确的是( )
A.原子半径:r(X)B.最高价氧化物对应水化物的碱性:WC.第一电离能:I1(Z)D.基态W原子内层原子轨道均已充满电子
C
5.(1)C、N、O、S四种元素中,第一电离能最大的是 。
(2)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是
(填元素名称)。
几种镧系元素的电离能(单位: kJ·mol-1)
元素 I1 I2 I3 I4
Yb(镱) 604 1 217 4 494 5 014
Lu(镥) 532 1 390 4 111 4 987
La(镧) 538 1 067 1 850 5 419
Ce(铈) 527 1 047 1 949 3 547
N
镧
(3)铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能/(kJ·mol-1) I1 I2
铜 746 1 958
锌 906 1 733
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是___________________________________________
__________________________________________________________________
__________________________________________________________________。
铜原子失去一个电子后,核外电子排布式
为[Ar]3d10,而锌原子失去一个电子后的核外电子排布式变为[Ar]3d104s1,铜达到了较稳定状态,所以铜的第二电离能相对较大
6.根据信息回答下列问题:
不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
元素符号 Li Be B C O F Na Al Si P S Cl
电负性值 1.0 1.5 2.0 2.5 3.5 4.0 0.9 1.5 1.8 2.1 2.5 3.0
(1)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围:___________。
0.9~1.5
(2)请归纳元素的电负性和金属性、非金属性的关系是________________________
____________________________。
(3)推测AlF3、AlCl3、AlBr3是离子化合物还是共价化合物:
AlF3____________,AlCl3____________,AlBr3__________________。
非金属性越强,电负性越
大;金属性越强,电负性越小
离子化合物
共价化合物
共价化合物
【课堂点拨】
(1)电离能的三大应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。
②判断元素的化合价
如果某元素的In+1 In,则该元素的常见化合价为+n,如钠元素的I2 I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
(2)电负性的三大应用
1.电离能与原子结构
答题策略:从原子核对最外层电子的吸引力来判断。
答题模板:A原子比B原子的半径大,且A原子的核电荷数比B原子的小,所以A原子对最外层电子的吸引力小于B, 故第一电离能A小于B。
2.电离能与半充满、全充满
答题策略:能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)时,比较稳定,难失电子。
答题模板:A原子的价层电子排布式为×××,处于半充满(全充满),比较稳定,难失电子,×××电离能大。
【答题策略】
3
真题验收 制胜高考
1.[2022·全国甲卷]①基态F原子的价层电子排布图(轨道表示式)为_________________。
②图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是__(填标号),判断的根据是_____________________________________________________________________________________________________________________;第三电离能的变化图是______(填标号)。
图a
同周期元素第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高
图b
2(2023.全国乙卷)基态Fe原子的价电子排布式为___________。橄榄石中,各元素电负性大小顺序为_____________________,铁的化合价为_______。
O>Si>Fe>Mg
3d64s2
+2
3.(2021·全国乙卷节选)过渡金属元素铬是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。对于基态Cr原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
AC
4.(高考题组合)电子排布式和电子排布图的书写。
(1)(2021·全国甲卷)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为 。
(2)(2020·全国卷Ⅱ)基态Ti原子的核外电子排布式为 。
(3)(2020·天津卷)Fe、Co、Ni在周期表中的位置为 ,基态Fe原子的电子排布式为__________________________________________。
(4)(2019·全国卷Ⅱ)Fe成为阳离子时首先失去 轨道电子,Sm的价层电子排布式4f66s2,Sm3+价层电子排布式为__________。
3s23p2
1s22s22p63s23p63d24s2或[Ar]3d24s2
第四周期第Ⅷ族
1s22s22p63s23p63d64s2或[Ar]3d64s2
4s
4f5
5.(高考题组合)电离能大小的比较及原因。
I1/(kJ·mol-1)
Li 520 Be 900 B 801
Na 496 Mg 738 Al 578
(1)(2020·全国卷Ⅰ)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是____________________________________________
______________________________________________________________。
I1(Be)>I1(B)>I1(Li),原因是_______________________________________
______________________________________________________________
______________________________________________________________。
Na与Li同主族,Na的电子层数更多,
原子半径更大,故第一电离能更小
Li,Be和B为同周期元素,同周期元素
从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级处于全充满状态,能量更低更稳定,故其第一电离能大于B的
(2)(2018·全国卷Ⅲ)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) I1(Cu)(填“大于”或“小于”)。原因是
_______________________________________________________________。
(3)(2017·全国卷Ⅲ)元素Mn与O中,第一电离能较大的是 。
大于
Zn核外电子排布为全满稳定结构,较难失电子
O
6.(1)[2022·山东,16(1)]基态Ni原子的价层电子排布式为________,在元素周期表中位置为________________。
(2)[2022·河北,17(1)(2)]①基态S原子的价电子中,两种自旋状态的电子数之比为____________。
②Cu与Zn相比,第二电离能与第一电离能差值更大的是________,原因是_______________________________________________________________________________________________________________________________________________________________________。
3d84s2
第四周期第Ⅷ族
1∶2(或2∶1)
Cu
Cu的第二电离能失去的是3d10的电子,第一电离能失去的是4s1电子,Zn的第二电离能失去的是4s1的电子,第一电离能失去的是4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大
4
知能训练 素养落实
1.下列说法正确的是( )
A.p能级电子能量一定比d能级的低
B.某原子核外电子由1s22s22p63s23p1→1s22s22p63s13p2,原子释放能量
C.p能级的原子轨道呈哑铃形,随着电子层数的增加,p能级原子轨道数也在增多
D.按照泡利原理,在同一个原子中不可能存在两个运动状态完全相同的电子
D
2.(2022·海南卷)钠和钾是两种常见金属,下列说法正确的是( )
A
3.(2023·宝鸡模拟)元素周期表完美地将元素的结构、位置与性质结合在一起,根据元素的原子序数就能推断出该元素在周期表中的位置,进而推断出该元素原子的结构和性质。下列关于33号元素的说法正确的是
A.该元素位于d区
B.该元素为金属元素
C.该元素位于第四周期第ⅢA族
D.该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3
D
4.(2022·湖北卷)短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是( )
A.X能与多种元素形成共价键 B.简单氢化物沸点:ZC.第一电离能:Y>Z D.电负性:WB
5.A、B为两短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为
A.A2B3 B.BA2 C.AB4 D.B3A2
D
6.下列四种粒子中,半径按由大到小顺序排列正确的是( )
C
7.(2022·烟台模拟)某种具有高效率电子传输性能的有机发光材料的结构简式如图所示。下列关于该材料组成元素的说法错误的是
A.五种组成元素中有四种元素位于p区且均位于同一周期
B.原子半径:Al>C>N>O>H
C.气态氢化物的稳定性:H2O>NH3>CH4
D.基态N原子核外有7种运动状态不同的电子
A
电离能 元素代号 I1 I2 I3 I4
Q 2 080 4 000 6 100 9 400
R 500 4 600 6 900 9 500
S 740 1 500 7 700 10 500
T 580 1 800 2 700 11 600
U 420 3 100 4 400 5 900
A.T的氯化物最可能的化学式为TCl3
B.氦元素最有可能与Q元素位于同一族
C.U元素最有可能为K,R元素最有可
能为Li
D.在周期表中,最可能处于同一族的
是R和U
C
7.根据下表中五种元素的电离能数据(单位:kJ·mol-1),下列说法不正确的是
8.(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是 ;26号元素价层电子排布式为 ;L原子核外电子占有9个轨道,而且有一个未成对电子,L是 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价电子排布式为_________________________。
②锗、砷、硒三种元素的第一电离能大小排序为 。
C
3d64s2
Cl
4s24p4
As>Se>Ge
(3)①Cu元素基态原子的价层电子排布式为 。
3d104s1
②下列说法正确的是 (填字母)。
A.第一电离能:As>Ga B.电负性:As>Ga C.原子半径:As>Ga
AB
③锗(Ge)是用途很广的半导体材料,基态锗原子的价电子排布式为 。在第二周期中,第一电离能位于硼元素与氮元素之间的元素有 种。
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为 ,B、C、O三种元素的第一电离能由大到小的顺序是 。
4s24p2
3
1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
O>C>B
第三十九讲 原子结构与性质
学 习 目 标
1.了解原子核外电子运动状态、能级分布和排布原理。
2.能正确书写1~36号元素原子核外电子排布式、价层电子排布式和电子排布图。
3.理解原子结构与元素周期表的关系。
4.了解电离能、电负性的含义,并能正确说明元素的某些性质。
考点一 原子核外电子排布
考点二 元素周期表与元素的性质
目
录
CONTENTS
///////
真题验收 制胜高考
///////
知能训练 素养落实
///////
///////
1
原子核外电子排布
处于一定空间运动状态的电子在原子核外空间的______________的形象化描述。
原子核外电子是分层排布的,根据电子的______不同,可将核外电子分成不同的能层。
能量
概率密度分布
1.能层(电子层)与能级
2.电子云与原子轨道
同一能层电子的能量也可能不同,又将其分成不同的能级,通常用________________表示。能级种类数等于所在能层的能层序数。
s、p、d、f
(1)电子云:
(1)能层:
(2)能级:
(2)原子轨道——电子云轮廓图
能级符号 ns np nd nf
轨道形状 — —
轨道数目
轨道能量 ①相同能层上的原子轨道:ns
哑铃形
1
3
5
7
(3)原子核外能层、能级、原子轨道之间的关系
能层(n) 一 二 三 四
能层符号 K L M N
能级符号 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f
各能级原子轨道数 1 1 3 1 3 5 1 3 5 7
各能层原子轨道数 1 4 9 16
最多容纳电子数 2 8 18 32
3.电子自旋
(1)电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋______的电子。
(2)能量相同的原子轨道(简并轨道),箭头表示一种__________的电子,“↑↓”称电子对,“↑”或“↓”称单电子(或称未成对电子)。箭头同向的单电子称自旋______。
相反
自旋状态
平行
② :在一个原子轨道里,最多只能容纳2个电子,它们的自旋 。
如2s轨道上的电子排布为 ,不能表示为 。
4.基态原子的核外电子排布
(1)排布原则
① :在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
能量最低原理
泡利原理
相反
③ :基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
如2p3的电子排布为____________,不能表示为 或 。
洪特规则
当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空(p0、d0、f0)时原子的能量最低.
如24Cr的电子排布式为[Ar]3d54s1
29Cu的电子排布式为[Ar]3d104s1。
(2)特例:
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
(3)填充顺序——构造原理
(4)表示方法
5.电子的跃迁与原子光谱
吸收
发射
(1)原子光谱
不同元素原子的电子发生跃迁时会 或 不同的光,用光谱仪记录下来便得到原子光谱。利用原子光谱上的特征谱线可以鉴定元素,称为光谱分析。
(2)电子的跃迁
吸收
释放
思想在线
【判一判】 正误判断(正确打“√”,错误打“×”)。
×
×
×
×
×
×
2.下列电子排布式或电子排布图正确的是( )
D
3.回答下列问题:
(1)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。元素K的焰色反应呈紫色,其中紫色对应的辐射波长为________(填字母)nm。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)钾发生焰色反应的原因是________________________________________________
_____________________________。
A
电子由较高能量的激发态跃迁到较低能量的激发态或基态时,以光的形式释放能量
4.(1)基态F原子核外电子的运动状态有 种。
(2)基态硅原子最外层的电子排布图为______________________。
(3) 在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
(4)Zn原子核外电子排布式为 。
(5)Co基态原子核外电子排布式为 。
(6)基态Ge原子的核外电子排布式为[Ar]_____________,有 个未成对电子。
(7)镍元素基态原子的电子排布式为 ,3d能级上的未成对电子数为 。
(8)写出基态As原子的核外电子排布式: 。
9
K+和P3-
1s22s22p63s23p63d74s2或[Ar]3d74s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
3d104s24p2
2
1s22s22p63s23p63d84s2或[Ar]3d84s2
2
1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3
【课堂点拨】
(1)原子的电子排布式
①简单原子:
按照构造原理将电子依次填充到能量逐渐升高的能级中。
如:14Si:1s22s22p63s23p2。
②复杂原子:
先按构造原理从低到高排列,然后将同能层的能级移到一起。
如26Fe,先排列为:1s22s22p63s23p64s23d6,然后将同一能层的能级排到一起,
即该原子的电子排布式为1s22s22p63s23p63d64s2。
(2)离子的电子排布式
①判断该原子变成离子时会得到或失去多少个电子。
②原子失去电子时,总是从能量高的能级失去电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族和第Ⅷ族元素可能还会进一步向里失去内层电子。
③原子得到电子而形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
(3)简化电子排布式
如K:1s22s22p63s23p64s1,其简化电子排布式可表示为[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。
(4)价层电子排布式
如K:1s22s22p63s23p64s1,其价层电子排布式可表示为4s1。
(5)电子的运动状态与原子核外电子数目相等;空间运动状态与核外电子填充原子轨道的数目相等。
2
原子结构与元素的性质
主族 ⅠA ⅡA ⅢA ⅣA
排布特点 __________ _________ ______________ ______________
主族 ⅤA ⅥA ⅦA
排布特点 _______________ _______________ ________________
1.原子结构与元素周期表的关系
(1)原子结构与周期的关系
原子的最大能层数=周期序数。
(2)原子结构与族的关系
①主族元素的价层电子排布特点
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
②0族元素的价层电子排布:
He为1s2;其他为ns2np6。
③过渡元素(镧系、锕系元素除外)的价层电子排布:
(n-1)d1~10ns1~2。
(3)原子结构与元素周期表分区的关系
①元素周期表分区
(4)各区元素原子外围电子排布及性质特点
分区 元素分布 外围电子排布 元素性质特点
s区 ⅠA、ⅡA族 ns1~2 除氢外都是活泼金属元素;通常是最外层电子参与反应
p区 ⅢA族~Ⅶ族、0族 ns2np1~6(除He外) 通常是最外层电子参与反应
d区 ⅢB族~ⅦB族(除镧系、锕系外)、Ⅷ族 (n-1)d1-9ns1~2 除钯外 d轨道可以不同程度地参与化学键的形成
ds区 ⅠB族、ⅡB族 (n-1)d10ns1~2 金属元素
f区 镧系、锕系 (n-2)f0~14 (n-1)d0~2ns2 镧系元素化学性质相近,锕系元素化学性质相近
2.原子半径
(1)影响因素:①能层数越多,原子半径______;②同周期核电荷数越大,原子半径______。
(2)变化规律:①同周期主族元素从左到右,原子半径逐渐______;
②同主族元素从上到下,原子半径逐渐______。
越大
越小
减小
增大
3.电离能
(1)含义
第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的
,符号: ,单位: 。
(2)规律
①同周期元素:从左往右,元素第一电离能呈 的趋势,其中第ⅡA族、第ⅤA族元素的第一电离能出现反常。
②同族元素:
从上到下第一电离能逐渐 。
③同种原子:
逐级电离能越来越大。
最低能量
I1
kJ·mol-1
增大
变小
(3)应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。
②判断元素的化合价
如果某元素的In+1 In,则该元素的常见化合价为+n,如钠元素的I2 I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
4.电负性
(1)含义:不同元素的原子 的标度。元素的电负性越大,表示其原子 越 。
(2)标准:以氟的电负性为 和锂的电负性为1.0作为相对标准,计算得出其他元素的电负性(稀有气体元素未计)。
(3)变化规律
①在元素周期表中,同周期元素从左至右,元素的电负性逐渐 ,同主族元素从上至下,元素的电负性逐渐 。
②金属元素的电负性一般 ,非金属元素的电负性一般 ,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
对键合电子吸引力
对键合电子的吸引力
大
4.0
变大
变小
小于1.8
大于1.8
(4)应用
小
大
负
正
离子
共价
5.对角线规则
右下方
1.最外层电子数是ns2的元素,都是第ⅡA族元素( )
2.价层电子排布式为4s24p3的元素位于第四周期第ⅤA族,是p区元素( )
3.最外层有2个未成对电子的可能是ns2np2或ns2np4,短周期元素中分别为C、Si和O、S
( )
4.NH4H2PO4中,电负性最高的元素是氧( )
5.元素Mn与O中,第一电离能较大的是Mn( )
6.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能( )
7.C、N、O、F四种元素第一电离能从大到小的顺序是N>O>F>C( )
8.元素的电负性越大,非金属性越强,第一电离能也越大( )
×
√
√
√
×
×
×
×
思想在线
【判一判】 正误判断(正确打“√”,错误打“×”)。
2.(2023·宝鸡模拟)如图所示为元素周期表的一部分,其中X、Y、Z、W为短周期元素,T的单质常温下为液体。下列说法错误的是
A.X、Y的单质均存在同素异形体
B.Y、Z的简单氢化物的稳定性依次递增
C.R的单质可用于制造半导体材料
D.Y、Z、W元素简单阴离子的半径:Y>Z>W
D
3.(2022·常州模拟)x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
A.x的原子半径大于y的原子半径
B.x的电负性小于y的电负性
C.x的氧化性大于y的氧化性
D.x的第一电离能小于y的第一电离能
C
4.(2022·苏州模拟)前四周期主族元素X、Y、Z、W的原子序数依次增大。X与Z同主族,且基态X原子中p能级和s能级上的电子数相同。Y、Z同周期,Y位于第ⅢA族,W最外层有2个电子。下列说法正确的是( )
A.原子半径:r(X)
C
5.(1)C、N、O、S四种元素中,第一电离能最大的是 。
(2)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是
(填元素名称)。
几种镧系元素的电离能(单位: kJ·mol-1)
元素 I1 I2 I3 I4
Yb(镱) 604 1 217 4 494 5 014
Lu(镥) 532 1 390 4 111 4 987
La(镧) 538 1 067 1 850 5 419
Ce(铈) 527 1 047 1 949 3 547
N
镧
(3)铜、锌两种元素的第一电离能、第二电离能如表所示:
电离能/(kJ·mol-1) I1 I2
铜 746 1 958
锌 906 1 733
铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,其主要原因是___________________________________________
__________________________________________________________________
__________________________________________________________________。
铜原子失去一个电子后,核外电子排布式
为[Ar]3d10,而锌原子失去一个电子后的核外电子排布式变为[Ar]3d104s1,铜达到了较稳定状态,所以铜的第二电离能相对较大
6.根据信息回答下列问题:
不同元素的原子在分子内吸引电子的能力大小可用数值表示,该数值称为电负性。一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。下表是某些元素的电负性值:
元素符号 Li Be B C O F Na Al Si P S Cl
电负性值 1.0 1.5 2.0 2.5 3.5 4.0 0.9 1.5 1.8 2.1 2.5 3.0
(1)通过分析电负性值的变化规律,确定Mg元素的电负性值的最小范围:___________。
0.9~1.5
(2)请归纳元素的电负性和金属性、非金属性的关系是________________________
____________________________。
(3)推测AlF3、AlCl3、AlBr3是离子化合物还是共价化合物:
AlF3____________,AlCl3____________,AlBr3__________________。
非金属性越强,电负性越
大;金属性越强,电负性越小
离子化合物
共价化合物
共价化合物
【课堂点拨】
(1)电离能的三大应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之金属性越弱。
②判断元素的化合价
如果某元素的In+1 In,则该元素的常见化合价为+n,如钠元素的I2 I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐渐增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
(2)电负性的三大应用
1.电离能与原子结构
答题策略:从原子核对最外层电子的吸引力来判断。
答题模板:A原子比B原子的半径大,且A原子的核电荷数比B原子的小,所以A原子对最外层电子的吸引力小于B, 故第一电离能A小于B。
2.电离能与半充满、全充满
答题策略:能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)时,比较稳定,难失电子。
答题模板:A原子的价层电子排布式为×××,处于半充满(全充满),比较稳定,难失电子,×××电离能大。
【答题策略】
3
真题验收 制胜高考
1.[2022·全国甲卷]①基态F原子的价层电子排布图(轨道表示式)为_________________。
②图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是__(填标号),判断的根据是_____________________________________________________________________________________________________________________;第三电离能的变化图是______(填标号)。
图a
同周期元素第一电离能的总体趋势是依次升高的,但由于N元素的2p能级为半充满状态,因此N元素的第一电离能较C、O两种元素高
图b
2(2023.全国乙卷)基态Fe原子的价电子排布式为___________。橄榄石中,各元素电负性大小顺序为_____________________,铁的化合价为_______。
O>Si>Fe>Mg
3d64s2
+2
3.(2021·全国乙卷节选)过渡金属元素铬是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。对于基态Cr原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
AC
4.(高考题组合)电子排布式和电子排布图的书写。
(1)(2021·全国甲卷)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为 。
(2)(2020·全国卷Ⅱ)基态Ti原子的核外电子排布式为 。
(3)(2020·天津卷)Fe、Co、Ni在周期表中的位置为 ,基态Fe原子的电子排布式为__________________________________________。
(4)(2019·全国卷Ⅱ)Fe成为阳离子时首先失去 轨道电子,Sm的价层电子排布式4f66s2,Sm3+价层电子排布式为__________。
3s23p2
1s22s22p63s23p63d24s2或[Ar]3d24s2
第四周期第Ⅷ族
1s22s22p63s23p63d64s2或[Ar]3d64s2
4s
4f5
5.(高考题组合)电离能大小的比较及原因。
I1/(kJ·mol-1)
Li 520 Be 900 B 801
Na 496 Mg 738 Al 578
(1)(2020·全国卷Ⅰ)Li及其周期表中相邻元素的第一电离能(I1)如表所示。I1(Li)>I1(Na),原因是____________________________________________
______________________________________________________________。
I1(Be)>I1(B)>I1(Li),原因是_______________________________________
______________________________________________________________
______________________________________________________________。
Na与Li同主族,Na的电子层数更多,
原子半径更大,故第一电离能更小
Li,Be和B为同周期元素,同周期元素
从左至右,第一电离能呈现增大的趋势;但由于基态Be原子的s能级处于全充满状态,能量更低更稳定,故其第一电离能大于B的
(2)(2018·全国卷Ⅲ)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn) I1(Cu)(填“大于”或“小于”)。原因是
_______________________________________________________________。
(3)(2017·全国卷Ⅲ)元素Mn与O中,第一电离能较大的是 。
大于
Zn核外电子排布为全满稳定结构,较难失电子
O
6.(1)[2022·山东,16(1)]基态Ni原子的价层电子排布式为________,在元素周期表中位置为________________。
(2)[2022·河北,17(1)(2)]①基态S原子的价电子中,两种自旋状态的电子数之比为____________。
②Cu与Zn相比,第二电离能与第一电离能差值更大的是________,原因是_______________________________________________________________________________________________________________________________________________________________________。
3d84s2
第四周期第Ⅷ族
1∶2(或2∶1)
Cu
Cu的第二电离能失去的是3d10的电子,第一电离能失去的是4s1电子,Zn的第二电离能失去的是4s1的电子,第一电离能失去的是4s2电子,3d10电子处于全充满状态,其与4s1电子能量差值更大
4
知能训练 素养落实
1.下列说法正确的是( )
A.p能级电子能量一定比d能级的低
B.某原子核外电子由1s22s22p63s23p1→1s22s22p63s13p2,原子释放能量
C.p能级的原子轨道呈哑铃形,随着电子层数的增加,p能级原子轨道数也在增多
D.按照泡利原理,在同一个原子中不可能存在两个运动状态完全相同的电子
D
2.(2022·海南卷)钠和钾是两种常见金属,下列说法正确的是( )
A
3.(2023·宝鸡模拟)元素周期表完美地将元素的结构、位置与性质结合在一起,根据元素的原子序数就能推断出该元素在周期表中的位置,进而推断出该元素原子的结构和性质。下列关于33号元素的说法正确的是
A.该元素位于d区
B.该元素为金属元素
C.该元素位于第四周期第ⅢA族
D.该元素基态原子的电子排布式为1s22s22p63s23p63d104s24p3
D
4.(2022·湖北卷)短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是( )
A.X能与多种元素形成共价键 B.简单氢化物沸点:Z
5.A、B为两短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为
A.A2B3 B.BA2 C.AB4 D.B3A2
D
6.下列四种粒子中,半径按由大到小顺序排列正确的是( )
C
7.(2022·烟台模拟)某种具有高效率电子传输性能的有机发光材料的结构简式如图所示。下列关于该材料组成元素的说法错误的是
A.五种组成元素中有四种元素位于p区且均位于同一周期
B.原子半径:Al>C>N>O>H
C.气态氢化物的稳定性:H2O>NH3>CH4
D.基态N原子核外有7种运动状态不同的电子
A
电离能 元素代号 I1 I2 I3 I4
Q 2 080 4 000 6 100 9 400
R 500 4 600 6 900 9 500
S 740 1 500 7 700 10 500
T 580 1 800 2 700 11 600
U 420 3 100 4 400 5 900
A.T的氯化物最可能的化学式为TCl3
B.氦元素最有可能与Q元素位于同一族
C.U元素最有可能为K,R元素最有可
能为Li
D.在周期表中,最可能处于同一族的
是R和U
C
7.根据下表中五种元素的电离能数据(单位:kJ·mol-1),下列说法不正确的是
8.(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是 ;26号元素价层电子排布式为 ;L原子核外电子占有9个轨道,而且有一个未成对电子,L是 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价电子排布式为_________________________。
②锗、砷、硒三种元素的第一电离能大小排序为 。
C
3d64s2
Cl
4s24p4
As>Se>Ge
(3)①Cu元素基态原子的价层电子排布式为 。
3d104s1
②下列说法正确的是 (填字母)。
A.第一电离能:As>Ga B.电负性:As>Ga C.原子半径:As>Ga
AB
③锗(Ge)是用途很广的半导体材料,基态锗原子的价电子排布式为 。在第二周期中,第一电离能位于硼元素与氮元素之间的元素有 种。
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为 ,B、C、O三种元素的第一电离能由大到小的顺序是 。
4s24p2
3
1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1)
O>C>B
同课章节目录
