人教版 高中化学 选择必修三 2.1.1 烷烃课件(共38张PPT)
文档属性
| 名称 | 人教版 高中化学 选择必修三 2.1.1 烷烃课件(共38张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 971.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 16:14:43 | ||
图片预览










文档简介
(共38张PPT)
汇报人:XXX
XX月XX日
烷烃
人教版高中化学选择必修三
1、了解有机化合物的成键特点。
2、掌握烃、烷烃的概念、物理性质、化学性质。(重点)
3、烃的燃烧规律。(重点)
4、同分异构体的书写方法及等效氢的判断。(重难点)
【学习目标】
一、有机化合物的结构特点
有机物结构多样性的表现:
碳原子不仅可以通过共价键与其它原子结合成分子,还可以彼此间以共价键构成碳链或碳环,再结合其它原子形成分子;
碳原子可以成单键、双键、三键。
二、烃
又叫碳氢化合物 CxHy
只含有碳、氢两种元素的有机物
+
=
烃
t
īng
q
火
气
àn
烃字的由来:
三、烷烃
只含C、H,碳原子都以碳碳单键相连,
其余的价键均用于与氢原子结合,达到
“饱和”的链状有机化合物。
结构特点:
每个碳形成四个共价键,碳碳之间以单键相连成链状;
C原子剩余价键全部和氢结合达到饱和。
1.烷烃的概念
2、烷烃的通式:
分子式通式: CnH2n+2(n≥1)
烃分子式: CxHy
1 2 3 4 5
CH4 C2H6 C3H8 C4H10 C5H12
6 7 8 9 10
C6H14 C7H16 C8H18 C9H20 C10H22
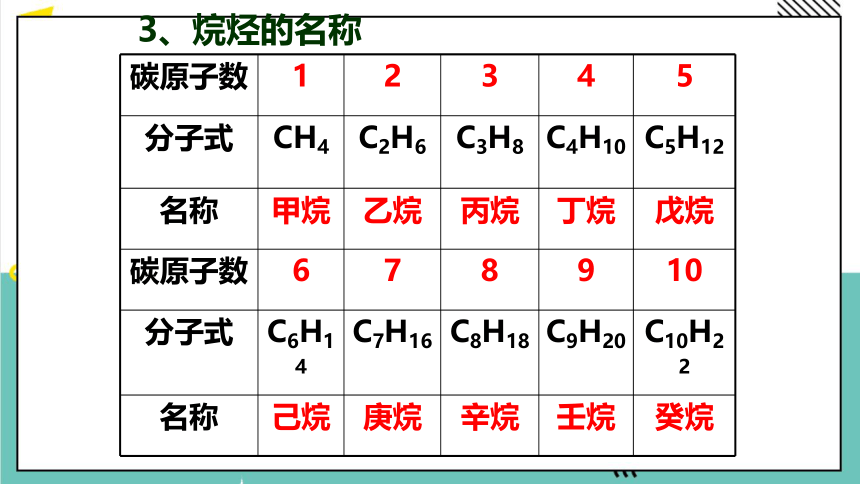
3、烷烃的名称
碳原子数 1 2 3 4 5
分子式 CH4 C2H6 C3H8 C4H10 C5H12
名称 甲烷 乙烷 丙烷 丁烷 戊烷
碳原子数 6 7 8 9 10
分子式 C6H14 C7H16 C8H18 C9H20 C10H22
名称 己烷 庚烷 辛烷 壬烷 癸烷
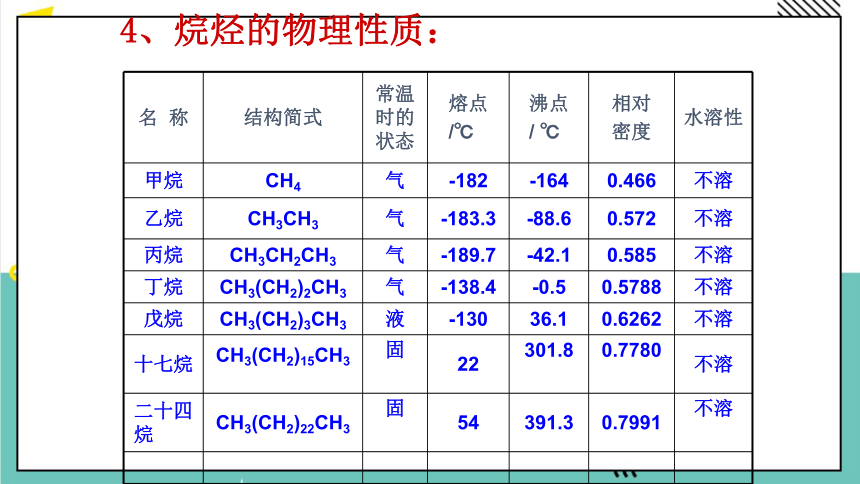
4、烷烃的物理性质:
名 称 结构简式 常温时的状态 熔点 /℃ 沸点 / ℃ 相对 密度 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -189.7 -42.1 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
二十四烷 CH3(CH2)22CH3 固 54 391.3 0.7991 不溶
课堂练习
写出下列各烷烃的分子式。
(1)烷烃C18Hm中,m的值
烷烃CnH18中,n的值
(2)相对分子质量为212的烷烃的分子式
(3)同温同压下烷烃A蒸汽密度是H2的36倍
(4)烷烃B分子中含有200个氢原子
(5)1L烷烃D的蒸汽完全燃烧时,生成同温同压15L水蒸气
(6)分子中含有22条共价键的烷烃
氧化反应
均不能使KMnO4褪色,不与强酸,强碱反应。
(1)取代反应 需光照,需纯卤素,产物复杂
(2)
5. 烷烃的化学性质
CxHy +(x+y/4)O2 →xCO2 + y/2H2O
燃烧通式:
CxHy + (x+y/4) O2 xCO2 + y/2 H2O
烃的燃烧规律
(1)物质的量相同的烃CxHy完全燃烧时,耗氧量多少决定于x+y/4,生成CO2的量多少决定于x的值,生成水量多少决定于y/2的值 。
⑵等质量的烃完全燃烧,y/x(即氢含量)越大,耗氧越多;
x/y(即含碳量)越大,生成的二氧化碳越多;【课时13】
若两种烃x/y相等,则生成的二氧化碳和水均相等。
(3)最简式相同的烃,不论以何种比例混合,只要混合物总质量一定,完全燃烧后生成的CO2和H2O及耗氧量就一定。
(总质量一定时,不论烃以何种比例混合,完全燃烧后耗氧量一定,最简式一定相同。)
(利用差量法确定分子中的含H数)
CxHy +(x+y/4)O2 →xCO2 + y/2H2O ΔV
1 x+y/4 x (液) 减少(1 + y/4)
1 x+y/4 x y/2(气)或增加(y/4 – 1)
H2O为液态:体积总是减小。
H2O为气态:体积不变 y = 4(CH4 C2H4 C3H4)
体积减小 y < 4(C2H2)
体积增大 y > 4(C2H6 C3H8)
烃完全燃烧前后气体体积变化规律:
D
B
将0.1 mol两种气态烃组成的混合气体完全燃烧后得3.36 L(标准状况)CO2和3.6 g H2O。下列说法正确的是( )
A.一定有甲烷 B.一定有乙烷
C.一定没有甲烷 D.可能有乙烷
在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合点燃,完全反应后再恢复到原来的温度时,气体体积缩小,则该烃分子内的氢原子个数________。
A.小于4 B.大于4
C.等于4 D.无法判断
三、同系物:
结构相似、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
碳原子均饱和。
链状
碳原子数不同。
烷烃同系物
结构相似:
分子组成:
{
比较甲烷与乙烷,乙烷与丙烷,
丙烷与丁烷,在分子组成上的差异
思考分析
碳原子数相邻的烷烃之间相差“CH2”原子团
特别提醒:同系物
结构相似(即物质的种类要相同)、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
①结构相似:同类物质
②相差一个或n个CH2原子团
--C原子数不同。
③化学性质相似:
一同两相似
随堂练习
B
下列哪组是同系物( )
A、CH3CH2CH2CH3 CH3CHCH3
CH3
B、CH3CH3 CH3CHCH3
CH3
甲基:-CH3
亚甲基: -CH2 -
次甲基: -CH -
乙基:-CH2CH3 或 -C2H5
丙基:2种
丁基:4种
烷基
烷烃失去一个或几个氢原子所剩余的部分。
烷烃的系统命名
根 基
存在
制备
状态
电性
实例
电解质组成的部分
非电解质组成的部分
原子团“根”与有机物“基”区别
电解质电离的产物
有机物去H的产物
能存在于溶液或熔化状态中
可短时间自由存在,不能长存
电中性
带电
OH
–OH
请你写出二者的电子式。
四、烷烃的命名:系统命名法
1.含1----10个碳原子用“天干”命名:
甲、乙、丙、丁、戊、已、庚、辛、壬、癸。
2.碳原子数超出10的依次用“十一、十二……命名
[例如] CH4 C2H6 C5H12 C9H20
甲烷 乙烷 戊烷 壬烷
C12H26 C20H42
十二烷 二十烷
口诀:选、编、取、名
选:选主链(最长链),称某烷;
编:编号位,定支链(位置和最小);
取:取代基,写在前,注位置,短线连;
名:不同基,简到繁,相同基,合并算。
3.步骤:
(1).选定分子中的最长链(即含C原子数目最多的链)为主链,按主链上碳原子的数目称为某烷;
(2).把主链中离支链最近的一端作为起点进行编号;
(3).把支链作为取代基,将其写在烷烃名称的前边,并在其前边注明其位置,数字与取代基之间用一短线隔开;
(4)如有相同取代基,可进行合并,用二、三等数字隔开;如有几个不同的取代基,则简单在前复杂在后。
练习(1):写出下面烷烃的名称
2,3-二甲基戊烷
取代基位置-取代基数目 取代基名称 主链
阿拉伯数字 中文
(阿拉伯数字之间用“,”隔开;阿拉伯数字与文字之间用“—”隔开。)
(2)
(3)
2,2,4-三甲基戊烷
2-甲基-3-乙基戊烷
(4)
(5)
2,3-二甲基-4-乙基己烷
2,5-二甲基-3-乙基己烷
练习2:下列烷烃命名是否正确?
1、4-甲基己烷
2、3-甲基-2-乙基戊烷
3、5-甲基-3-乙基己烷
3-甲基己烷
3,4-二甲基己烷
2-甲基-4-乙基己烷
CH3CHCH2CH2CHCH3
CH3
CH3
(CH3CH2)2CHCH3
CH3
CH3
CH3-CH-CH-C-CH3
C2H5
CH3
CH3-C -CH3
CH3-CH-CH3
CH3-CH-CH3
2,5 - 二甲基己烷
3 - 甲基戊烷
2,2,4 – 三甲基 – 3 – 乙基戊烷
2,3,3,4 – 四甲基戊烷
请用系统命名法给以下烷烃命名:
CH3CH2CH2CH3
CH3CHCH3
CH3
C4H10 丁烷
四、同分异构现象与同分异构体
性质不同的原因是结构不同
C5H12
四、同分异构现象与同分异构体
1、同分异构现象
化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构现象。
2、同分异构体:
具有相同的分子式而结构不同的化合物互称同分异构体。
3、理解:
例:写出C5H12的同分异构体。
步骤:①写出碳原子依次相连(最长碳链)的分子结构简式。
②逐一缩短碳链(支链数依次增加)支链位置由里向外变化。
CH3-CH-CH2-CH3
CH3
CH3
CH3-C-CH3
CH3
书写规则:主链由长到短,支链由繁到简;
支链位置由里向外,由同到邻到间。
CH3-CH2-CH2-CH2-CH3
碳原子数
同分异构体数
1
1
2
1
3
1
4
2
5
3
6
5
7
9
8
18
9
35
10
75
11
159
12
355
13
802
14
1858
16
10359
20
366319
5、烃的一元取代物的找法
汇报人:XXX
XX月XX日
烷烃
人教版高中化学选择必修三
1、了解有机化合物的成键特点。
2、掌握烃、烷烃的概念、物理性质、化学性质。(重点)
3、烃的燃烧规律。(重点)
4、同分异构体的书写方法及等效氢的判断。(重难点)
【学习目标】
一、有机化合物的结构特点
有机物结构多样性的表现:
碳原子不仅可以通过共价键与其它原子结合成分子,还可以彼此间以共价键构成碳链或碳环,再结合其它原子形成分子;
碳原子可以成单键、双键、三键。
二、烃
又叫碳氢化合物 CxHy
只含有碳、氢两种元素的有机物
+
=
烃
t
īng
q
火
气
àn
烃字的由来:
三、烷烃
只含C、H,碳原子都以碳碳单键相连,
其余的价键均用于与氢原子结合,达到
“饱和”的链状有机化合物。
结构特点:
每个碳形成四个共价键,碳碳之间以单键相连成链状;
C原子剩余价键全部和氢结合达到饱和。
1.烷烃的概念
2、烷烃的通式:
分子式通式: CnH2n+2(n≥1)
烃分子式: CxHy
1 2 3 4 5
CH4 C2H6 C3H8 C4H10 C5H12
6 7 8 9 10
C6H14 C7H16 C8H18 C9H20 C10H22
3、烷烃的名称
碳原子数 1 2 3 4 5
分子式 CH4 C2H6 C3H8 C4H10 C5H12
名称 甲烷 乙烷 丙烷 丁烷 戊烷
碳原子数 6 7 8 9 10
分子式 C6H14 C7H16 C8H18 C9H20 C10H22
名称 己烷 庚烷 辛烷 壬烷 癸烷
4、烷烃的物理性质:
名 称 结构简式 常温时的状态 熔点 /℃ 沸点 / ℃ 相对 密度 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶
乙烷 CH3CH3 气 -183.3 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -189.7 -42.1 0.585 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -130 36.1 0.6262 不溶
十七烷 CH3(CH2)15CH3 固 22 301.8 0.7780 不溶
二十四烷 CH3(CH2)22CH3 固 54 391.3 0.7991 不溶
课堂练习
写出下列各烷烃的分子式。
(1)烷烃C18Hm中,m的值
烷烃CnH18中,n的值
(2)相对分子质量为212的烷烃的分子式
(3)同温同压下烷烃A蒸汽密度是H2的36倍
(4)烷烃B分子中含有200个氢原子
(5)1L烷烃D的蒸汽完全燃烧时,生成同温同压15L水蒸气
(6)分子中含有22条共价键的烷烃
氧化反应
均不能使KMnO4褪色,不与强酸,强碱反应。
(1)取代反应 需光照,需纯卤素,产物复杂
(2)
5. 烷烃的化学性质
CxHy +(x+y/4)O2 →xCO2 + y/2H2O
燃烧通式:
CxHy + (x+y/4) O2 xCO2 + y/2 H2O
烃的燃烧规律
(1)物质的量相同的烃CxHy完全燃烧时,耗氧量多少决定于x+y/4,生成CO2的量多少决定于x的值,生成水量多少决定于y/2的值 。
⑵等质量的烃完全燃烧,y/x(即氢含量)越大,耗氧越多;
x/y(即含碳量)越大,生成的二氧化碳越多;【课时13】
若两种烃x/y相等,则生成的二氧化碳和水均相等。
(3)最简式相同的烃,不论以何种比例混合,只要混合物总质量一定,完全燃烧后生成的CO2和H2O及耗氧量就一定。
(总质量一定时,不论烃以何种比例混合,完全燃烧后耗氧量一定,最简式一定相同。)
(利用差量法确定分子中的含H数)
CxHy +(x+y/4)O2 →xCO2 + y/2H2O ΔV
1 x+y/4 x (液) 减少(1 + y/4)
1 x+y/4 x y/2(气)或增加(y/4 – 1)
H2O为液态:体积总是减小。
H2O为气态:体积不变 y = 4(CH4 C2H4 C3H4)
体积减小 y < 4(C2H2)
体积增大 y > 4(C2H6 C3H8)
烃完全燃烧前后气体体积变化规律:
D
B
将0.1 mol两种气态烃组成的混合气体完全燃烧后得3.36 L(标准状况)CO2和3.6 g H2O。下列说法正确的是( )
A.一定有甲烷 B.一定有乙烷
C.一定没有甲烷 D.可能有乙烷
在120 ℃和101 kPa的条件下,某气态烃和一定质量的氧气混合点燃,完全反应后再恢复到原来的温度时,气体体积缩小,则该烃分子内的氢原子个数________。
A.小于4 B.大于4
C.等于4 D.无法判断
三、同系物:
结构相似、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
碳原子均饱和。
链状
碳原子数不同。
烷烃同系物
结构相似:
分子组成:
{
比较甲烷与乙烷,乙烷与丙烷,
丙烷与丁烷,在分子组成上的差异
思考分析
碳原子数相邻的烷烃之间相差“CH2”原子团
特别提醒:同系物
结构相似(即物质的种类要相同)、分子组成上相差一个或若干个CH2原子团的物质互相称为同系物。
①结构相似:同类物质
②相差一个或n个CH2原子团
--C原子数不同。
③化学性质相似:
一同两相似
随堂练习
B
下列哪组是同系物( )
A、CH3CH2CH2CH3 CH3CHCH3
CH3
B、CH3CH3 CH3CHCH3
CH3
甲基:-CH3
亚甲基: -CH2 -
次甲基: -CH -
乙基:-CH2CH3 或 -C2H5
丙基:2种
丁基:4种
烷基
烷烃失去一个或几个氢原子所剩余的部分。
烷烃的系统命名
根 基
存在
制备
状态
电性
实例
电解质组成的部分
非电解质组成的部分
原子团“根”与有机物“基”区别
电解质电离的产物
有机物去H的产物
能存在于溶液或熔化状态中
可短时间自由存在,不能长存
电中性
带电
OH
–OH
请你写出二者的电子式。
四、烷烃的命名:系统命名法
1.含1----10个碳原子用“天干”命名:
甲、乙、丙、丁、戊、已、庚、辛、壬、癸。
2.碳原子数超出10的依次用“十一、十二……命名
[例如] CH4 C2H6 C5H12 C9H20
甲烷 乙烷 戊烷 壬烷
C12H26 C20H42
十二烷 二十烷
口诀:选、编、取、名
选:选主链(最长链),称某烷;
编:编号位,定支链(位置和最小);
取:取代基,写在前,注位置,短线连;
名:不同基,简到繁,相同基,合并算。
3.步骤:
(1).选定分子中的最长链(即含C原子数目最多的链)为主链,按主链上碳原子的数目称为某烷;
(2).把主链中离支链最近的一端作为起点进行编号;
(3).把支链作为取代基,将其写在烷烃名称的前边,并在其前边注明其位置,数字与取代基之间用一短线隔开;
(4)如有相同取代基,可进行合并,用二、三等数字隔开;如有几个不同的取代基,则简单在前复杂在后。
练习(1):写出下面烷烃的名称
2,3-二甲基戊烷
取代基位置-取代基数目 取代基名称 主链
阿拉伯数字 中文
(阿拉伯数字之间用“,”隔开;阿拉伯数字与文字之间用“—”隔开。)
(2)
(3)
2,2,4-三甲基戊烷
2-甲基-3-乙基戊烷
(4)
(5)
2,3-二甲基-4-乙基己烷
2,5-二甲基-3-乙基己烷
练习2:下列烷烃命名是否正确?
1、4-甲基己烷
2、3-甲基-2-乙基戊烷
3、5-甲基-3-乙基己烷
3-甲基己烷
3,4-二甲基己烷
2-甲基-4-乙基己烷
CH3CHCH2CH2CHCH3
CH3
CH3
(CH3CH2)2CHCH3
CH3
CH3
CH3-CH-CH-C-CH3
C2H5
CH3
CH3-C -CH3
CH3-CH-CH3
CH3-CH-CH3
2,5 - 二甲基己烷
3 - 甲基戊烷
2,2,4 – 三甲基 – 3 – 乙基戊烷
2,3,3,4 – 四甲基戊烷
请用系统命名法给以下烷烃命名:
CH3CH2CH2CH3
CH3CHCH3
CH3
C4H10 丁烷
四、同分异构现象与同分异构体
性质不同的原因是结构不同
C5H12
四、同分异构现象与同分异构体
1、同分异构现象
化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构现象。
2、同分异构体:
具有相同的分子式而结构不同的化合物互称同分异构体。
3、理解:
例:写出C5H12的同分异构体。
步骤:①写出碳原子依次相连(最长碳链)的分子结构简式。
②逐一缩短碳链(支链数依次增加)支链位置由里向外变化。
CH3-CH-CH2-CH3
CH3
CH3
CH3-C-CH3
CH3
书写规则:主链由长到短,支链由繁到简;
支链位置由里向外,由同到邻到间。
CH3-CH2-CH2-CH2-CH3
碳原子数
同分异构体数
1
1
2
1
3
1
4
2
5
3
6
5
7
9
8
18
9
35
10
75
11
159
12
355
13
802
14
1858
16
10359
20
366319
5、烃的一元取代物的找法
