人教版 高中化学 选择必修三 3.4 羧酸及其衍生物课件(共52张PPT)
文档属性
| 名称 | 人教版 高中化学 选择必修三 3.4 羧酸及其衍生物课件(共52张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 760.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 16:23:30 | ||
图片预览





文档简介
(共52张PPT)
汇报人:XXX
XX月XX日
羧酸、羧酸衍生物和取代酸
人教版高中化学选择必修三
1 羧酸(carboxylic acid)
一、 羧酸的分类、命名
二、 羧酸的物理性质
三、 羧酸的化学性质
3-甲基-2-乙基丁酸
1、分类(根据烃基的不同和羧基的数目)
3,5-二甲基-2,4-己二烯酸
主链为含羧基的最长碳链,有双键应包括在内, 用阿拉伯数字标明取代基的位次,羧基的编号最低。较简单的羧酸可用希腊字母表示取代基的位次。
一、 羧酸的分类、命名
饱和脂肪酸 不饱和脂肪酸芳香羧酸
一元酸二元酸多元酸
2、命名
乙二酸(草酸)
丁二酸(琥珀酸)
反-丁烯二酸(富马酸)
邻苯二甲酸
α-萘乙酸
3-硝基苯甲酸
4-甲基苯甲酸
2,4-环戊二烯甲酸
1,2-苯二乙酸
反-1,2-环戊烷二甲酸
3-苯基丙烯酸
苯甲酸 (安息香酸)
羧酸是极性分子,能与水形成氢键。甲酸至丁酸与水互溶。随相对分子质量的增加,羧酸在水中的溶解度减小。
羧酸的沸点比相对分子质量相近的醇的沸点高。
b.p 羧酸 > b.p 醇 > b.p 醛、酮 > b.p 卤代烃 > b.p 烷烃
二、羧酸的物理性质
羧基C的p轨道与O的p轨道形成π键,羟基氧原子上未共用电子对与π键构成p-π共轭体系。
甲酸根负离子2个C-O键完全平均化(0.127nm)。
三、羧酸的化学性质
羧酸结构分析
X光衍射实验证明:
羧基中羰基与羟基C-O键长有平均化的倾向。
发生反应的主要部位及反应
1、酸性
4、脱羧反应
3、还原反应
5、α-H的取代反应
2、羟基被取代的反应
1 、 酸性
用途:1、分离、提纯 2、使不溶性羧酸变成盐,使用方便
甲酸pKa=3.75
碳酸pKa=6.36
羧酸是弱酸,多数无取代基的一元羧酸pKa在4~5之间。向羧酸盐溶液中加入无机酸后,羧酸又可游离出来。
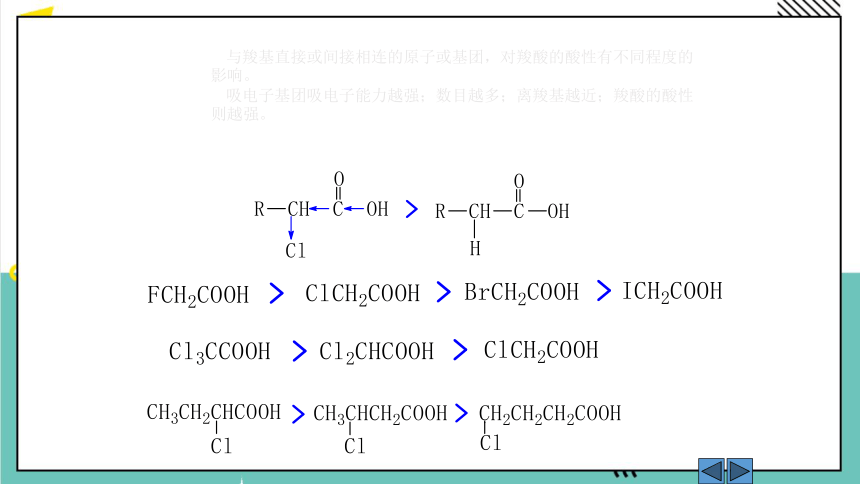
与羧基直接或间接相连的原子或基团,对羧酸的酸性有不同程度的影响。
吸电子基团吸电子能力越强;数目越多;离羧基越近;羧酸的酸性则越强。
酸性由大到小的顺序为: 3 > 2 > 5 >1 > 4
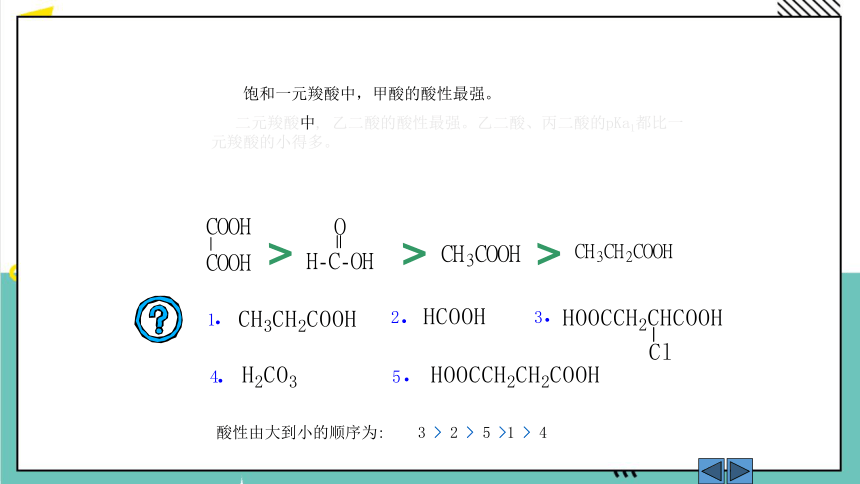
饱和一元羧酸中,甲酸的酸性最强。
二元羧酸中, 乙二酸的酸性最强。乙二酸、丙二酸的pKa1都比一元羧酸的小得多。
<
<
<
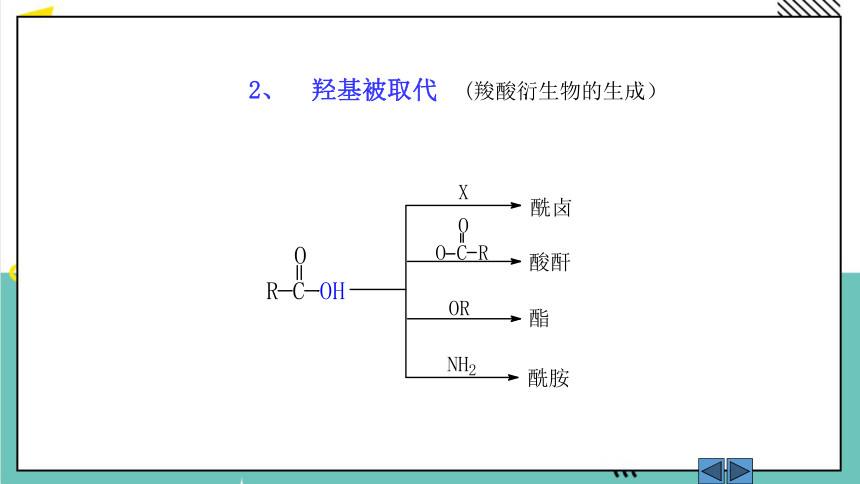
2、 羟基被取代 (羧酸衍生物的生成)
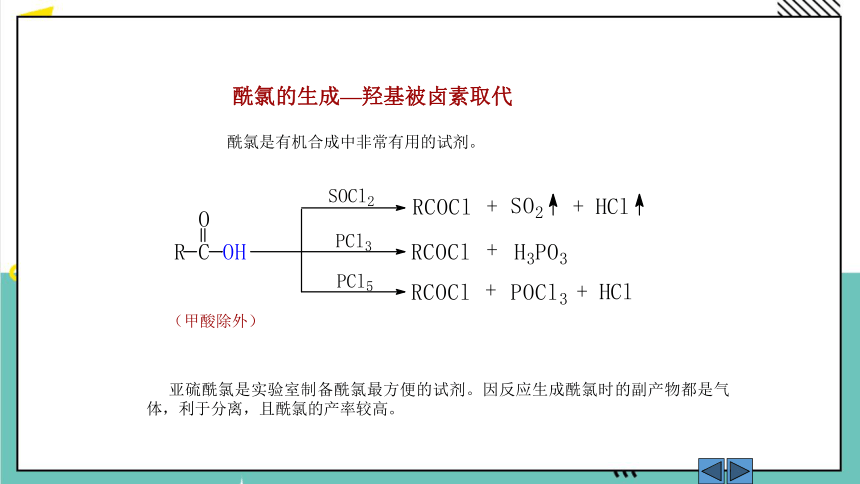
酰氯的生成—羟基被卤素取代
(甲酸除外)
酰氯是有机合成中非常有用的试剂。
亚硫酰氯是实验室制备酰氯最方便的试剂。因反应生成酰氯时的副产物都是气体,利于分离,且酰氯的产率较高。
酸酐的生成—羟基被酰氧基取代
通常用酰卤和无水羧酸盐共热来制备混合酸酐。
甲酸脱水生成一氧化碳,其它一元羧酸在脱水剂作用下两分子间脱水生成酸酐。
二元酸
己二酸
庚二酸
戊二酸
丁二酸
内酐
生成酯—羟基被烷氧基取代
注意 (1) 不是所有的醇都脱氢
(2) 不是所有的酯都是由羧酸与醇反应制得
酰胺的生成—羟基被氨基取代
能与羧酸反的胺----至少含一个氢
胺: RNH2 R2NH R3N
3、羧基的还原(用LiAlH4)
LiAlH4还原羧酸成相应的伯醇,产率较高,还原不饱和酸时不影响碳碳不饱和键。
甲烷的实验室制法
生成内酐
二元羧酸加热 1、脱羧 2、内酐(五或六员环)
4、脱羧反应----- 脱去CO2的反应
饱和一元羧酸加热较难脱羧。α-碳原子上连有吸电子基时,较易脱羧。
5、α-H的反应
Willamson合成
脂肪酸α-C上的H可被卤原子取代而生成α-卤代酸。
工业上生产一氯乙酸的方法。 通过控制反应条件使一种产物为主。
除草剂 2,4-D的合成
2 羧酸衍生物
(carboxylic acid derivatives)
( 酰卤、酸酐、酯和酰胺)
一、命名
二、物理性质
三、化学性质
四、酯化和酯水解的反应机理
五、碳酸的衍生物
一、 羧酸衍生物的命名
酰卤、酰胺
2-丁烯酰氯(胺)
2-甲基丙酰氯(胺)
对-硝基苯甲酰氯(胺)
N-甲基丙酰胺
N,N-二甲基丙酰胺
酰基
酸酐的命名
乙(酸)酐
乙丙(酸)酐
邻苯二甲酸酐
丁二酸酐
顺丁烯二酸酐(顺酐)
N-乙酰苯胺
邻苯二甲酰亚胺
γ-丁内酰胺
酯的命名
2-甲基丙酸乙酯
甲酸乙酯
苯甲酸卞酯
某酸某酯
乙酸苯酯 乙酸异戊酯 (香蕉水) 正戊酸异戊酯 (苹果香味) 丁酸甲酯 (菠萝香味)
多数酯有愉快的香味。许多水果的香味就是由酯引起的。乙酸异戊酯有香蕉香,正戊酸异戊酯有苹果香,许多酯被用来调配食品或做化妆品香精。
二、 羧酸衍生物的物理性质
低级酰氯和酸酐容易水解
酯有香味
分子间没有氢键缔合作用,酰氯、酸酐和酯的沸点比分子质量相近的羧酸低。
酰胺分子间氨基上的氢原子形成氢键,除甲酰胺外,其它酰胺均是固体。
三、 羧酸衍生物的化学性质
1、 酰基上的亲核取代
2、 还原反应
3、 酯缩合反应
4、 酰胺反应
5、 酯化和酯水解反应机理
酯和酰胺的水解需酸,碱催化且加热,反应是可逆反应。
1、酰基上的亲核取代
反应活性依次减弱
(1) 水解 羧酸衍生物水解生成相应的羧酸
(2)醇解
酯的醇解又叫酯交换反应。有些酯不能用高级醇与酸直接反应制得,可用高级醇交换酯中的低级醇。
酚酯和叔醇酯难以用酸制备,常用酰卤或酸酐与酚、叔醇合成。
(Asprin)
反应活性依次减弱
酰氯、酸酐和酯与醇或酚作用,主要产物是酯。
(3) 氨或胺解
以上反应从羧酸衍生物的角度看:是羧酸衍生物发生了水解、醇解或氨解。但对水、醇或氨来说,相当于在分子中引入酰基,是发生了酰基化反应。
酰氯、酸酐和酯都是酰基化试剂。
反应活性依次减弱
酰氯、酸酐和酯与氨或胺作用,主要产物是酰胺。
酰基上的亲核反应机理(加成—消除机理)
第二步:离去基团带一对电子离去,恢复碳氧双键,生成产物。
第一步:亲核试剂进攻羰基碳,形成四面体中间体。
羧酸衍生物水解、醇解、胺解的活性次是:
酰 氯 > 酸酐 > 酯 > 酰胺
羧酸衍生物活性大小取决于离去基团离去的难易。离去基团(L)的碱性愈弱,愈易离去。
L的碱性由弱到强的次序是:
Cl-<RCOO-<RO-<NH-2
离去基团碱性的强弱,可从其共轭酸的酸性强弱得知: 强酸的共轭碱是弱碱。
酸性: HCl>RCOOH>ROH>NH3
酰氯是最活泼的酰基化试剂。酰氯、酸酐是有机合成中常用的酰基化试剂。
2、 还原反应
羧酸衍生物一般都比羧酸容易还原。
制醇的方法 双键不受影响
制醛的方法------Rosenmund反应
3、Claisen酯缩合反应
酯中的α-H较活泼,在醇钠作用下,与另1分子酯缩去1分子醇,生成β-酮酸酯。简称酯缩合。
邻苯二甲酰亚胺钾
4、酰胺的反应
(1) 酰胺的酸碱性
(2) 酰胺脱水
近中性
弱碱性
弱酸性
(3) Hofmann降解反应
酰胺与溴或氯在碱溶液中作用,脱去羰基生成伯胺,
使碳链减少1个C,称为Hofmann降解反应。
5、酯化和酯水解的反应机理
酰氧键断裂
烷氧键断裂
酯化反应机理
实验证明,大部分羧酸与醇的酯化是按酰氧键断裂方式进行。
酯的酸性水解,大部分情况是酰氧键断裂的加成-消除机理,是酸催化酯化反应的逆反应。
酯水解的反应机理
酯的碱性水解,多数情况也是以酰氧键断裂方式进行的。
四、 碳酸衍生物的化学性质
碳酸不稳定,但碳酸的某些衍生物是稳定的,其化学性质与羧酸衍生物相似。
碳酸酰氯
氨基甲酸
脲
N-甲氨基甲酸-1-萘酯
二缩脲反应 :二缩脲 碱性 稀CuSO4 紫红色
N-(3,4-二氯苯基)氨基甲酸甲酯
N-甲氨基甲酸-3-甲苯酯
氨基甲酸不稳定,氨基甲酸酯是稳定的化合物。
二缩脲
3 取代酸
羟基酸 : 醇酸 酚酸
羰基酸: 醛酸 酮酸
一、 醇酸的分类和命名
分类 :α、β、γ… …羟基酸
命名 :
2-羟基丙酸
乳酸
2,3-二羟基丁二酸
酒石酸
苹果酸
2-羟基丁二酸
2-羟基-1,2,3-丙烷三羧酸
柠檬酸
1-羟基-1,2,3-丙烷三羧酸
异柠檬酸
二、 醇酸的物理性质
羟基和羧基都是亲水基,醇酸在水中的溶解度一般都很大。
1. 酸性
2. α-羟基酸的氧化
3. α-羟基酸的分解反应
4. 失水反应
三、 醇酸的化学性质
1、 酸性
酸性: > >
2 、α-羟基酸的氧化
α-羟基酸中的羟基比醇中羟基易氧化。Tollen试剂与醇不反应,但能把α-羟基酸氧化为α-羰基酸。
能发生银镜反应
3 、α-羟基酸的分解反应
4 、失水反应
α-羟基酸
γ-羟基酸
γ-内酯
β-羟基酸
δ-羟基酸
δ-内酯
四、 酚酸
水杨酸甲酯
酚酸有芳香酸和酚的典型反应性能。与与FeCl3显色;羧基和酚羟基能分别成酯、成盐等。
Asprin
五、 羰基酸
丙醛酸(甲酰乙酸)
丙酮酸
3-丁酮酸(乙酰乙酸)
1、分类、命名、性质
?系统命名是选择含羰基和羧基的最长碳链作主链,叫作某醛酸或某酮酸。酮酸需注明羰基的位置。亦可用酰基取代酸来命名,醛基以“甲酰基”表示。
分子中同时含有羰基和羧基的化合物称为羰基酸。
羰基酸分为醛酸和酮酸。酮酸根据羰基和羧基的相对位置分为α-酮酸、β-酮酸、γ-酮酸等。
乙醛酸
丙酮酸
脱羧
脱羰
2、乙酰乙酸及其酯
(1)乙酰乙酸
(2)乙酰乙酸乙酯
酮式分解
酸式分解
乙酰乙酸低温稳定,室温易脱羧。
(3)乙酰乙酸乙酯的互变异构
加Na,有气体
加Br2褪色
加FeCl3呈色
92.5%
7.5%
尿嘧啶
互变异构
酮式分解
甲基酮
取代乙酸
酸式分解
(4)乙酰乙酸乙酯在合成上的应用
酸式分解
酮式分解
汇报人:XXX
XX月XX日
羧酸、羧酸衍生物和取代酸
人教版高中化学选择必修三
1 羧酸(carboxylic acid)
一、 羧酸的分类、命名
二、 羧酸的物理性质
三、 羧酸的化学性质
3-甲基-2-乙基丁酸
1、分类(根据烃基的不同和羧基的数目)
3,5-二甲基-2,4-己二烯酸
主链为含羧基的最长碳链,有双键应包括在内, 用阿拉伯数字标明取代基的位次,羧基的编号最低。较简单的羧酸可用希腊字母表示取代基的位次。
一、 羧酸的分类、命名
饱和脂肪酸 不饱和脂肪酸芳香羧酸
一元酸二元酸多元酸
2、命名
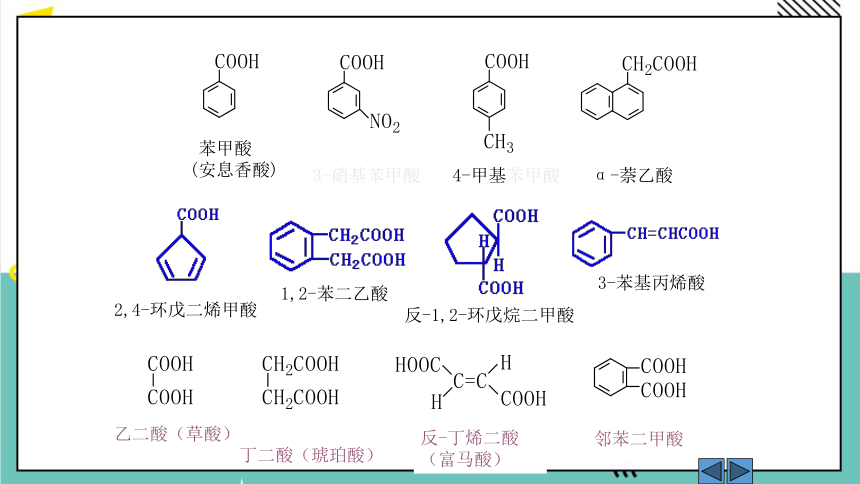
乙二酸(草酸)
丁二酸(琥珀酸)
反-丁烯二酸(富马酸)
邻苯二甲酸
α-萘乙酸
3-硝基苯甲酸
4-甲基苯甲酸
2,4-环戊二烯甲酸
1,2-苯二乙酸
反-1,2-环戊烷二甲酸
3-苯基丙烯酸
苯甲酸 (安息香酸)
羧酸是极性分子,能与水形成氢键。甲酸至丁酸与水互溶。随相对分子质量的增加,羧酸在水中的溶解度减小。
羧酸的沸点比相对分子质量相近的醇的沸点高。
b.p 羧酸 > b.p 醇 > b.p 醛、酮 > b.p 卤代烃 > b.p 烷烃
二、羧酸的物理性质
羧基C的p轨道与O的p轨道形成π键,羟基氧原子上未共用电子对与π键构成p-π共轭体系。
甲酸根负离子2个C-O键完全平均化(0.127nm)。
三、羧酸的化学性质
羧酸结构分析
X光衍射实验证明:
羧基中羰基与羟基C-O键长有平均化的倾向。
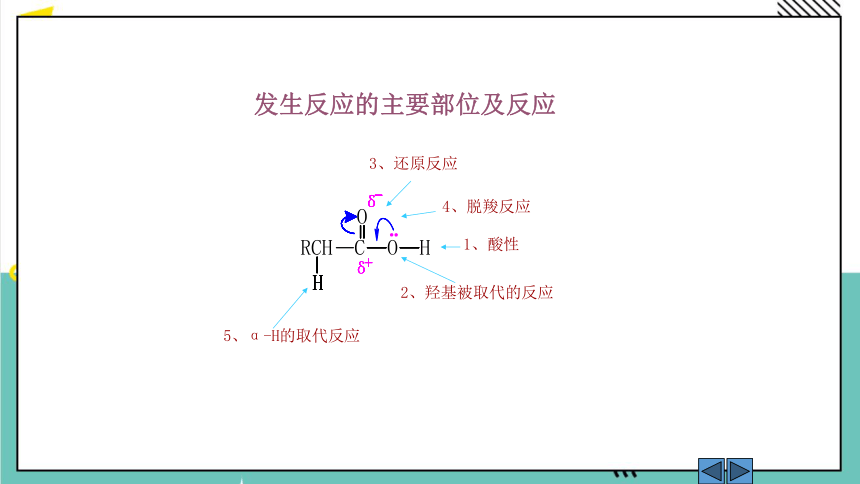
发生反应的主要部位及反应
1、酸性
4、脱羧反应
3、还原反应
5、α-H的取代反应
2、羟基被取代的反应
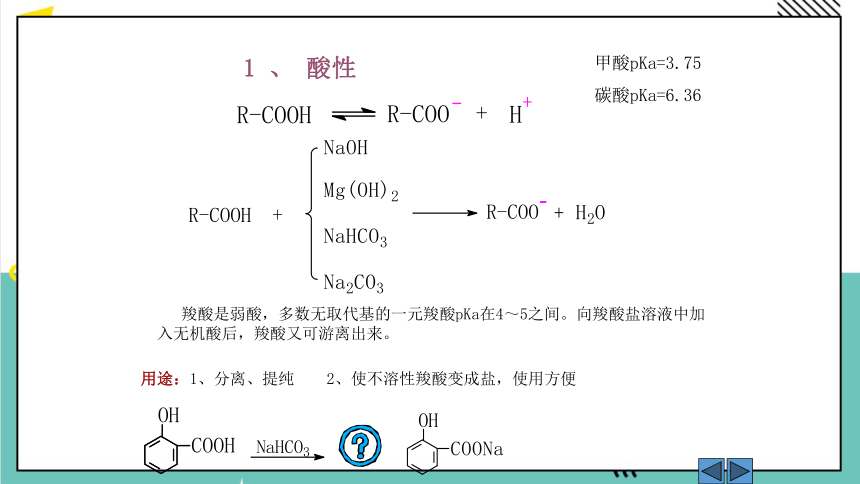
1 、 酸性
用途:1、分离、提纯 2、使不溶性羧酸变成盐,使用方便
甲酸pKa=3.75
碳酸pKa=6.36
羧酸是弱酸,多数无取代基的一元羧酸pKa在4~5之间。向羧酸盐溶液中加入无机酸后,羧酸又可游离出来。
与羧基直接或间接相连的原子或基团,对羧酸的酸性有不同程度的影响。
吸电子基团吸电子能力越强;数目越多;离羧基越近;羧酸的酸性则越强。
酸性由大到小的顺序为: 3 > 2 > 5 >1 > 4
饱和一元羧酸中,甲酸的酸性最强。
二元羧酸中, 乙二酸的酸性最强。乙二酸、丙二酸的pKa1都比一元羧酸的小得多。
<
<
<
2、 羟基被取代 (羧酸衍生物的生成)
酰氯的生成—羟基被卤素取代
(甲酸除外)
酰氯是有机合成中非常有用的试剂。
亚硫酰氯是实验室制备酰氯最方便的试剂。因反应生成酰氯时的副产物都是气体,利于分离,且酰氯的产率较高。
酸酐的生成—羟基被酰氧基取代
通常用酰卤和无水羧酸盐共热来制备混合酸酐。
甲酸脱水生成一氧化碳,其它一元羧酸在脱水剂作用下两分子间脱水生成酸酐。
二元酸
己二酸
庚二酸
戊二酸
丁二酸
内酐
生成酯—羟基被烷氧基取代
注意 (1) 不是所有的醇都脱氢
(2) 不是所有的酯都是由羧酸与醇反应制得
酰胺的生成—羟基被氨基取代
能与羧酸反的胺----至少含一个氢
胺: RNH2 R2NH R3N
3、羧基的还原(用LiAlH4)
LiAlH4还原羧酸成相应的伯醇,产率较高,还原不饱和酸时不影响碳碳不饱和键。
甲烷的实验室制法
生成内酐
二元羧酸加热 1、脱羧 2、内酐(五或六员环)
4、脱羧反应----- 脱去CO2的反应
饱和一元羧酸加热较难脱羧。α-碳原子上连有吸电子基时,较易脱羧。
5、α-H的反应
Willamson合成
脂肪酸α-C上的H可被卤原子取代而生成α-卤代酸。
工业上生产一氯乙酸的方法。 通过控制反应条件使一种产物为主。
除草剂 2,4-D的合成
2 羧酸衍生物
(carboxylic acid derivatives)
( 酰卤、酸酐、酯和酰胺)
一、命名
二、物理性质
三、化学性质
四、酯化和酯水解的反应机理
五、碳酸的衍生物
一、 羧酸衍生物的命名
酰卤、酰胺
2-丁烯酰氯(胺)
2-甲基丙酰氯(胺)
对-硝基苯甲酰氯(胺)
N-甲基丙酰胺
N,N-二甲基丙酰胺
酰基
酸酐的命名
乙(酸)酐
乙丙(酸)酐
邻苯二甲酸酐
丁二酸酐
顺丁烯二酸酐(顺酐)
N-乙酰苯胺
邻苯二甲酰亚胺
γ-丁内酰胺
酯的命名
2-甲基丙酸乙酯
甲酸乙酯
苯甲酸卞酯
某酸某酯
乙酸苯酯 乙酸异戊酯 (香蕉水) 正戊酸异戊酯 (苹果香味) 丁酸甲酯 (菠萝香味)
多数酯有愉快的香味。许多水果的香味就是由酯引起的。乙酸异戊酯有香蕉香,正戊酸异戊酯有苹果香,许多酯被用来调配食品或做化妆品香精。
二、 羧酸衍生物的物理性质
低级酰氯和酸酐容易水解
酯有香味
分子间没有氢键缔合作用,酰氯、酸酐和酯的沸点比分子质量相近的羧酸低。
酰胺分子间氨基上的氢原子形成氢键,除甲酰胺外,其它酰胺均是固体。
三、 羧酸衍生物的化学性质
1、 酰基上的亲核取代
2、 还原反应
3、 酯缩合反应
4、 酰胺反应
5、 酯化和酯水解反应机理
酯和酰胺的水解需酸,碱催化且加热,反应是可逆反应。
1、酰基上的亲核取代
反应活性依次减弱
(1) 水解 羧酸衍生物水解生成相应的羧酸
(2)醇解
酯的醇解又叫酯交换反应。有些酯不能用高级醇与酸直接反应制得,可用高级醇交换酯中的低级醇。
酚酯和叔醇酯难以用酸制备,常用酰卤或酸酐与酚、叔醇合成。
(Asprin)
反应活性依次减弱
酰氯、酸酐和酯与醇或酚作用,主要产物是酯。
(3) 氨或胺解
以上反应从羧酸衍生物的角度看:是羧酸衍生物发生了水解、醇解或氨解。但对水、醇或氨来说,相当于在分子中引入酰基,是发生了酰基化反应。
酰氯、酸酐和酯都是酰基化试剂。
反应活性依次减弱
酰氯、酸酐和酯与氨或胺作用,主要产物是酰胺。
酰基上的亲核反应机理(加成—消除机理)
第二步:离去基团带一对电子离去,恢复碳氧双键,生成产物。
第一步:亲核试剂进攻羰基碳,形成四面体中间体。
羧酸衍生物水解、醇解、胺解的活性次是:
酰 氯 > 酸酐 > 酯 > 酰胺
羧酸衍生物活性大小取决于离去基团离去的难易。离去基团(L)的碱性愈弱,愈易离去。
L的碱性由弱到强的次序是:
Cl-<RCOO-<RO-<NH-2
离去基团碱性的强弱,可从其共轭酸的酸性强弱得知: 强酸的共轭碱是弱碱。
酸性: HCl>RCOOH>ROH>NH3
酰氯是最活泼的酰基化试剂。酰氯、酸酐是有机合成中常用的酰基化试剂。
2、 还原反应
羧酸衍生物一般都比羧酸容易还原。
制醇的方法 双键不受影响
制醛的方法------Rosenmund反应
3、Claisen酯缩合反应
酯中的α-H较活泼,在醇钠作用下,与另1分子酯缩去1分子醇,生成β-酮酸酯。简称酯缩合。
邻苯二甲酰亚胺钾
4、酰胺的反应
(1) 酰胺的酸碱性
(2) 酰胺脱水
近中性
弱碱性
弱酸性
(3) Hofmann降解反应
酰胺与溴或氯在碱溶液中作用,脱去羰基生成伯胺,
使碳链减少1个C,称为Hofmann降解反应。
5、酯化和酯水解的反应机理
酰氧键断裂
烷氧键断裂
酯化反应机理
实验证明,大部分羧酸与醇的酯化是按酰氧键断裂方式进行。
酯的酸性水解,大部分情况是酰氧键断裂的加成-消除机理,是酸催化酯化反应的逆反应。
酯水解的反应机理
酯的碱性水解,多数情况也是以酰氧键断裂方式进行的。
四、 碳酸衍生物的化学性质
碳酸不稳定,但碳酸的某些衍生物是稳定的,其化学性质与羧酸衍生物相似。
碳酸酰氯
氨基甲酸
脲
N-甲氨基甲酸-1-萘酯
二缩脲反应 :二缩脲 碱性 稀CuSO4 紫红色
N-(3,4-二氯苯基)氨基甲酸甲酯
N-甲氨基甲酸-3-甲苯酯
氨基甲酸不稳定,氨基甲酸酯是稳定的化合物。
二缩脲
3 取代酸
羟基酸 : 醇酸 酚酸
羰基酸: 醛酸 酮酸
一、 醇酸的分类和命名
分类 :α、β、γ… …羟基酸
命名 :
2-羟基丙酸
乳酸
2,3-二羟基丁二酸
酒石酸
苹果酸
2-羟基丁二酸
2-羟基-1,2,3-丙烷三羧酸
柠檬酸
1-羟基-1,2,3-丙烷三羧酸
异柠檬酸
二、 醇酸的物理性质
羟基和羧基都是亲水基,醇酸在水中的溶解度一般都很大。
1. 酸性
2. α-羟基酸的氧化
3. α-羟基酸的分解反应
4. 失水反应
三、 醇酸的化学性质
1、 酸性
酸性: > >
2 、α-羟基酸的氧化
α-羟基酸中的羟基比醇中羟基易氧化。Tollen试剂与醇不反应,但能把α-羟基酸氧化为α-羰基酸。
能发生银镜反应
3 、α-羟基酸的分解反应
4 、失水反应
α-羟基酸
γ-羟基酸
γ-内酯
β-羟基酸
δ-羟基酸
δ-内酯
四、 酚酸
水杨酸甲酯
酚酸有芳香酸和酚的典型反应性能。与与FeCl3显色;羧基和酚羟基能分别成酯、成盐等。
Asprin
五、 羰基酸
丙醛酸(甲酰乙酸)
丙酮酸
3-丁酮酸(乙酰乙酸)
1、分类、命名、性质
?系统命名是选择含羰基和羧基的最长碳链作主链,叫作某醛酸或某酮酸。酮酸需注明羰基的位置。亦可用酰基取代酸来命名,醛基以“甲酰基”表示。
分子中同时含有羰基和羧基的化合物称为羰基酸。
羰基酸分为醛酸和酮酸。酮酸根据羰基和羧基的相对位置分为α-酮酸、β-酮酸、γ-酮酸等。
乙醛酸
丙酮酸
脱羧
脱羰
2、乙酰乙酸及其酯
(1)乙酰乙酸
(2)乙酰乙酸乙酯
酮式分解
酸式分解
乙酰乙酸低温稳定,室温易脱羧。
(3)乙酰乙酸乙酯的互变异构
加Na,有气体
加Br2褪色
加FeCl3呈色
92.5%
7.5%
尿嘧啶
互变异构
酮式分解
甲基酮
取代乙酸
酸式分解
(4)乙酰乙酸乙酯在合成上的应用
酸式分解
酮式分解
