福建省泉州市永春第一名校2023-2024学年高一上学期11月期中化学试题(含解析)
文档属性
| 名称 | 福建省泉州市永春第一名校2023-2024学年高一上学期11月期中化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 11:53:24 | ||
图片预览




文档简介
永春 中 年期中考试化学科试卷
考试时间:75 分钟 试卷总分:100 分
H 1 C
12 N
14 O
16 Na
Mg
Cl
35.5 Ba
可能 到的相对原 质量: : : : : : : :
137 S
(
:
):
32 Ca
:
40 He
:
4 Mn 55
:
(
只
) 、 选择题( 有 个选项符合题意,每 题 2 分,共 42 分)
1. 下列古诗词描述的场景中发 的反应不属于氧化还原反应的是
A. —— B. ——
烈 焚烧若等闲
——
灰 分解
蜡炬成灰泪始
D.
蜡的燃烧
——
C. 爆 声中 岁除
药爆炸
化作春泥更护花
花瓣的腐化
2. “ ”
兔 号 球 作为热源材料。关于 的叙述正确的是
A.
质量数是
C.
94 B.
239 D.
电 数是
145
94
中 数为
3. 下列说法正确的是
A.
原 序数是
分散质粒 直径 于 的分散系称为胶体
B.
向 溶液中滴加饱和 溶液可制得 胶体
C. 实验室可 丁达尔效应鉴别胶体与溶液
D. 可 过滤的 法分离胶体与 NaCl 溶液
4. 下列化学 语表示不正确的是
A. 的电离 程式:
B.
漂 粉的有效成分是
C.
、 、 互为同位素
D.
的结构示意图
Cl-
5. 下列溶液中,
浓度最 的是
5.0L 1mol·L-1NaClO
溶液
1.0L 0.2mol·L-1 FeCl3
溶液
2.0L 0.6mol·L-1KClO3
溶液
6. 下列说法正确的是
3.0L 0.15mol·L-1 BaCl2
溶液
A. 铜丝能导电,所以铜是电解质
B. 液态氯化氢、固体氯化钠均不导电,所以 不属于电解质
C. 虽然氯化铵溶液能导电,但氯化铵溶液不是电解质
D. 溶于 后得到的 溶液能导电,故 是电解质
7. NA
设
为阿伏加德罗常数,下列说法正确的是
1.6gO2
和 O3 混合 体中,所含氧原 数 为 0.1NA
1mol/LAl2(SO4)3
溶液中,所含 数 为 3NA
C. 标准状况下,11.2LCCl4 中所含氯原 数 为 2NA
D. 71gCl2 与 量 NaOH 溶液反应,转移电 数 为 2NA
8. 在探究新制饱和氯 成分 实验中,下列实验现象或结论不正确的是( )
(
-
)A. 氯 的颜 呈浅 绿 ,说明氯 中含有 Cl2
B.
向氯 中滴加硝酸酸化的
AgNO3
溶液,产 沉淀,说明氯 中含有 Cl
C.
向氯 中加
D.
NaHCO3
粉末,有 泡产 ,说明氯 中含有 H
(
+
),溶液颜 变成红 ,说明氯 中含有 HClO
向氯 中滴加紫 蕊
9. 下列实验操作正确,并且与选项中实验 的匹配的是
A.
稀释浓硫酸
C.
收集氯
B.
读取液体体积
D. pH
测定饱和氯 的
10.
A.
B.
C.
D.
为检验溶液 的某种离 ,分别取少量待测液进 下列实验,其中结论正确的是
先加适量的盐酸将溶液酸化,再加 溶液,产 了 沉淀,则原溶液中 定含有 量的 往某溶液中加 氢氧化钠溶液,加热后产 使湿润的红 蕊试纸变蓝的 体,则该溶液中含有
洁净的铂丝蘸取溶液进 焰 反应, 焰呈 ,则溶液有 ,
往某溶液中加 盐酸,产 能使澄清 灰 变浑浊的 体,则该溶液中含有
某同学查阅教材得知
NH4Cl
ZnCl2 池内
的 固体并回收利 时,进 如图所示实验,下列有关实验的叙述不正确的是
A.
操作④的 的是为验证滤渣中含
B.
操作③盛放滤渣的仪器是蒸发
MnO2
C.
操作②为过滤
D.
,得到的滤液加强碱并微热,会产 刺激性 味的 体
操作①中玻璃棒能加快固体溶解
12. (ClO2)
种 效消毒剂,通过下列反应可制得 ClO2:
N H2 4 2 +
氧化氯
2Na2SO4+
是
对于该反应
确的是
2NaClO3+
a2SO3+
SO =2ClO
↑
NaClO3
H2O
是还原剂
,下列说法正
Na2SO3
被还原
C. H2SO4 发 氧化反应 D. 成 1 mol ClO2,转移电 数为 NA
13. 种同位素 X 的原 质量数为 A N 个中 ,它与原 组成 HmX 分 。在 a 克 HmX 中
(
含
)某元素的 ,
所含质 的物质的量是
A. B.
D.
14. 某兴趣 组设计如图所示的装置进 氯 与 属钠的反应,先将钠预热,在钠熔化成 球时撤去热源,
并通 氯 即发 反应 氯 可
),下列叙述不正确的是
A.
B.
C.
D.
15.
钠在氯 中燃烧产 焰
反应产 的 量 烟是氯化钠固体 棉球①的作 是吸收过量氯 防 产 污染 棉球②变蓝 则证明氯 已被碱完全吸收 在下列溶液中 定能 量共存的离 组是
Na+ K+ Cl-
A. 在强酸性溶液中:
2+
、
Mg2+
、 、
Cl-
B. 溶液中:Fe 、
Fe3+
、 、
OH- I- K+
Br-
含有 量
的溶液中:
、 、 、
K+ Na+
D. 滴 酚酞变红的溶液中: 、 、 、
16. 下列说法正确的是
A.
将 的 溶液加 稀释到
,稀释后溶液中 的物质的量浓度为
B
溶液中含
,溶液中
C.
配制 稀盐酸需取 浓盐酸
(
),得到溶
D. 将 的 溶液与 的 溶液混合 忽略溶液体积变化
液的物质的量浓度为
17. :
反应①②分别是从海藻灰和某种矿 中提取碘的主要反应
2H2O I2
① MnSO4+ +
H2O I2
② 3NaHSO4+ +
下列说法正确的是
A. 两个反应中硫元素均被氧化
B.
碘元素 反应①中被氧化、在反应②中被还原
MnO2 I2
>
由①②可得氧化性
I2
,转移电 数之 为 2 5
反应①②中 成等质量的 时
18. 25
:
,氯 中部分含氯微粒的物质的量浓度随 pH 的变化关系如
已知 杀菌能 强。 ℃时
图所示。下列叙述正确的是
pH
可
pH
试纸测氯 的
pH
随着
C.
增 ,氯 的杀菌能 逐渐增强
:
D.
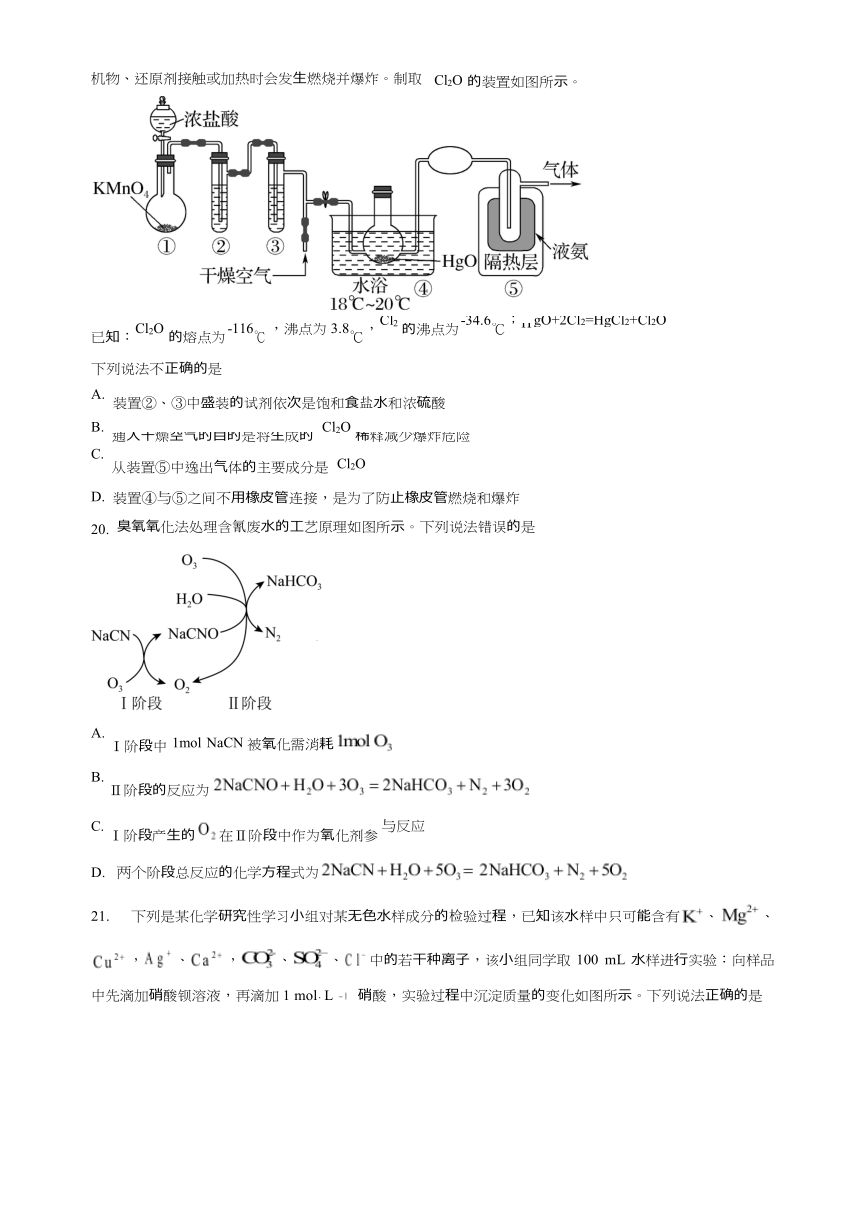
19. Cl2O
的氯 中
时,溶液中的含氯微粒主要为 和 是 棕 具有强烈刺激性 味的 体,是 种强氧化剂,易溶于 且会与 反应 成次氯酸,与有
机物、还原剂接触或加热时会发 燃烧并爆炸。制取
Cl2O
的装置如图所示。
Cl2
-34.6
; gO+2Cl2=HgCl2+Cl2O
Cl2O
-116
,沸点为 3.8 ,
H
的沸点为 ℃
已知: 的熔点为 ℃ ℃
下列说法不正确的是
A.
装置②、③中盛装的试剂依次是饱和 盐 和浓硫酸
Cl2O
通 燥空 的 的是将 成的
C.
从装置⑤中逸出 体的主要成分是
稀释减少爆炸危险
Cl2O
D.
20.
装置④与⑤之间不 橡 管连接,是为了防 橡 管燃烧和爆炸
臭氧氧化法处理含氰废 的 艺原理如图所示。下列说法错误的是
A.
Ⅰ阶段中
1mol NaCN
被氧化需消耗
B.
Ⅱ阶段的反应为
C.
与反应
Ⅰ阶段产 的 在Ⅱ阶段中作为氧化剂参
D. 两个阶段总反应的化学 程式为
21. 下列是某化学研究性学习 组对某 样成分的检验过程,已知该 样中只可能含有、 、
, 、 , 、 、 中的若 种离 ,该 组同学取 100 mL 样进 实验:向样品 中先滴加硝酸钡溶液,再滴加 1 mol L 硝酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是
A. 样中 定不存在、 、 ,可能存在
B. 样中 定存在、 和
B
由
C
点到 点变化过程中消耗硝酸的体积为
40 mL
D. 样中 定存在,且
(
(
、
) 填空题 共
58 )
分
22.
1
按要求填空:
:
( )如图是常 于混合物的分离和提纯的装置
a
①仪器
的名称是
1
。
( 118 )
( 77.1 )
(
,
仪
),还缺少的仪器是
②利 图
装置分离 酸 沸点
℃ 和 酸 酯 沸点
”)
℃ 的混合物
器 中冷凝 应该从
填 ” “下
进。
③从碘的饱和 溶液中提取碘应选择图
(
( )
填序号 装置
)
,该实验要 到萃取剂,下列关于所加萃
取剂的说法不正确的是 填字 。
A 不与碘反应 B.碘在该萃取剂中的溶解度 在 中的溶解度
.该萃取剂
C 与 不互溶 D
该萃取剂的密度必须 的密度
.该萃取剂
2
.
丙三种元素,甲元素 M 层的电 数是其 K 层的电 数的, 元素原 核内 中 ,丙
( )有甲、 、
8 个质 。
元素原 核内有
①写出甲、 、丙三种元素组成的化合物在 中的电离 程式 。
②画出甲元素的离 结构示意图 。
3 V mL
,取 mL 溶液稀释到 4V mL,此时溶液中物质的量浓度 a mol/L
( )从 溶液中 ,
则原溶液中含 的物质的量浓度是 。
22.4 L“
( ) 造空 氧
) 于减轻某些病痛或供深 潜 员,标准状况下,
造空
的质量是
可
(
。
),其中氧
( ) 作催化剂
(TOC)
在酸性条件下, 的加
5
TOC
,在废 中加 可以去除废 中的有机物 。
,则 的浓度为
TOC
中 去除效果最好。
量对
的去除效果如图所示
mol L 时,废
23.
I
回答下列问题:
84
两种消毒剂。
.双氧 和
消毒液是 活中常 的
)
( )某同学设计如
(
序号 。
填
序号 实验 实验现象
5%
1 向 溶液中滴加酸性 .溶液紫 褪去 b 泡产 a ; .有 量
溶液
5%
2 向 溶液中滴加淀粉碘化 c .溶液变蓝
钾溶液
2 ,由于 作 员将 84 消毒液与双氧 两种消毒剂混 ,导致游泳池藻类快速 ,
( )某届奥运会期间
池 变绿。 种原因可能是 NaClO 与反应产 促进藻类快速 。
NaClO
( “>”
“<”)
NaClO
该反应说明氧化性:
填 或 ,当参加反应的
和 的物质的量之
1∶1
为
时,该反应的还原产物为 。
( )(
-2 )
种新型的净 剂,可以通过下述反应制取:
Ⅱ. 铁酸钠 其中氧元素是 价 是
3
( )① 双线桥法在化学 程式中标出电 转移的情况。
②请完成 程式的配平:
Ⅲ.汽 剧烈碰撞时,安全 囊中发 反应 。
4 1.75 mol,则转移的电 数为 ( 为阿伏加德罗常数的值 ,被
( )若氧化产物 还原产物多 _ )
N
氧化的
24.
原 的物质的量为 。
[A :
某化学兴趣 组 如图装置制取并探究氯 的性质。 装置中发 反应的化学 程式
1 A a
( ) 装置中 仪器的名称是 。
2 ( “ ” “ ”)
( )制取氯 反应中 所起的作 是 填 氧化剂 或 还原剂 。
( )实验进
( “B” C”)
或 装置中有 布条褪
(
,
其褪 原因是
)3 段时间后,可观察到 填 “
。
4 D ,可观察到溶液颜 变为
(“ ),写出相关反应的化学
( )当氯 进
装置后
_ ” “ ”
(
红 或
蓝
)填
程式 。
5 E
( ) 装置中发 的反应 程式是 。
( )实验室常
10 mol/L
若已知盐酸浓度 于 时
6 与浓盐酸制氯 ,写出反应 程式 。
则不易被 氧化,现 浓度为 12 mol/L 的浓盐酸与 8.7 g 反应,要使 全部反应掉 成最
?
多氯 ,则 少加 这种盐酸 毫升
25. 下:
某化 出 的漂 粉说明书如
(
使 说明
【主要成份】
次氯
酸钙、
氯
化钙
次氯
酸钙
的
质量分数为
(
35%)
2
3g
1000g
,
将病 具浸泡其中
5
10
分
【 途 量】取漂
粉
,
,
配成溶液
钟。
如需要
,
浓度可提
,
时间可延 。
【注意事项】密封避光保存于阴凉处
,
随配随
,
有
腐
蚀性
,
少
与
接触。
)
( )漂 粉的有效成分为 , 。
2 480 mL
,要使 浓度为 0.1 mol/L
则需称量漂 粉质量为
( )将漂 粉溶于 配成 溶液 ,
)
g ( 位 数
。 保留
( )配制
3 上述溶液玻璃仪器除了要使 烧杯、玻璃棒、胶头滴管外还需要使 的仪器有 。
( )在配制过程中
( “ “
偏 偏 或
4
“ ”)?
,下列实验操作对所配制的 溶液的物质的量浓度有何影响 填 ” ”
影响
a :
.定容时俯视容量瓶刻度线 _ 。
.定容后经振荡、摇匀、静置
b ,发现液 下降,再加适量的蒸馏 : 。
5 HCl
U ,可制得少量漂 粉 该反应为放热反应 ,温
( )将含有少量
的氯 通 盛有潮湿消 灰的
( )
形管中
度较 时氯 与消 灰反应: ,为避免此副反应的发
,可采取的措施是 ;
(m)与反应时间
的关系曲线
)
和 的反应 。
①如图为反应后溶液中 、 离 的物质的量
a
.图中曲线Ⅰ表示
b
离 的物质的量随反应时间变化的关系。
mol
.所 灰乳中含有 的物质的量为 。
c
.另取
份含有等物质的量 的 灰乳,以较 的速率通 量氯 ,反应后测得产物中 的
0.39 mol,则产物中
物质的量为 。
( )
②试判断另 个副反应是 写出此反应 化学 程式 。
永春 中 年期中考试化学科试卷
考试时间:75 分钟 试卷总分:100 分
H 1 C
12 N
14 O
16 Na
Mg
Cl
35.5 Ba
可能 到的相对原 质量: : : : : : : :
137 S
(
:
):
32 Ca
:
40 He
:
4 Mn 55
:
(
只
) 、 选择题( 有 个选项符合题意,每 题 2 分,共 42 分)
1. 下列古诗词描述的场景中发 的反应不属于氧化还原反应的是
A. —— B. ——
烈 焚烧若等闲
——
灰 分解
蜡炬成灰泪始
D.
蜡的燃烧
——
C. 爆 声中 岁除
A
药爆炸
化作春泥更护花
花瓣的腐化
【答案】
【解析】
A ——
,反应中元素化合价不发 变化,属于
【详解】
.烈 焚烧若等闲
灰 分解 成氧化钙和 氧化碳
A
氧化还原反应,
符合;
. 蜡炬成灰泪始
蜡的燃烧 成 氧化碳和
B 不符
合;
. 爆 声中 —
酸钾、 炭和硫磺发 反应 成硫化钾、氮 和 氧化碳等,反
C 不符合;
应过程中元素化加发 变化,是氧化还原反应,
. 化作春泥更护花
D
(
不
) 然环境
D
符合;
A
答案选 。
2. “ ”
—— 下花瓣的腐化通常是氧 参与下的化学反应,属于氧化还原反应,
兔 号 球 作为热源材料。关于 的叙述正确的是
A.
质量数是
C.
94 B.
239 D.
电 数是
145
94
中 数为
D
【答案】
原 序数是
【解析】
= + ,核电荷数
核外电
【分析】原 中元素符号左上 为质量数,最下 为质 数,质量数
质 数
=
中 数
= =
数 原 序数
A.
质 数。
=239 A ;
【详解】
B. =
质量数 ,故 错误
=94 B ;
电 数
质 数
,故 错误
C. =239 94=145 C ;
中 数
D. =
,故 错误
=94 D ;
原 序数
质 数
,故 正确
D
故选 。
3. 下列说法正确的是
A.
分散质粒 直径 于 的分散系称为胶体
B.
向 溶液中滴加饱和 溶液可制得 胶体
C. 实验室可 丁达尔效应鉴别胶体与溶液
D. 可 过滤的 法分离胶体与 NaCl 溶液
C
【答案】
【解析】
A
1nm
,分散质粒 直径在 1nm- 100nm 之间的分散系
【详解】
.分散质粒 直径 于
的分散系称为溶液
称为胶体,故 A 错误;
B
(
胶
体
应该向沸
)FeCl3
NaOH
FeCl3
,故 B 错误;
Fe(OH)3
, e(OH)3 中滴加饱和
溶液 溶液呈透明的红褐
C 丁达尔效应是胶体特有的性质,溶液不具有,所以可以 丁达尔效应鉴别溶液和胶体,故 C 正确;
.
D Fe(OH)3
与 NaCl 溶液都能透过滤纸,不能 过滤的 法分离,可以利 半透膜 渗析的 法分离
. 胶体
胶体和溶液,故 D 错误;
C
故选: 。
4. 下列化学 语表示不正确的是
A. 的电离 程式:
B.
漂 粉的有效成分是
C.
、 、 互为同位素
D.
的结构示意图
C
【答案】
【解析】
【详解】
. 是强电解质
A 确;
A ,电离 程式: , 正
B B
.漂 粉的有效成分是 ,
正确;
C 不同的同 元素的不同原 互称为同位素,即同 元素的不同核素互称
.同位素是指质 数相同 中 数
(
为
同
位
素
,
), 、 、 均为单质 C
错误;
D D
. 的结构示意图 ,
正确;
C
答案选 。
Cl-
5. 下列溶液中,
浓度最 的是
5.0L 1mol·L-1NaClO
溶液
1.0L 0.2mol·L-1 FeCl3
溶液
2.0L 0.6mol·L-1KClO3
溶液
B
【答案】
3.0L 0.15mol·L-1 BaCl2
溶液
【解析】
A
5.0L 1mol·L-1NaClO
Cl-
Cl- 0
【详解】 .
溶液中
, 浓度为 ;
1.0L 0.2mol·L-1 FeCl3
Cl-
0.6mol/L
. 溶液中, 浓度为 ;
2.0L 0.6mol·L-1KClO3
Cl-
Cl- 0
. 溶液中 , 浓度为 ;
3.0L 0.15mol·L-1 BaCl2
Cl-
0.3mol/L
. 溶液中, 浓度为 ;
(
综
,
)上分析 B 中氯离 的物质的量浓度最 ,答案选 B。
6. 下列说法正确的是
A. 铜丝能导电,所以铜是电解质
B. 液态氯化氢、固体氯化钠均不导电,所以 不属于电解质
C. 虽然氯化铵溶液能导电,但氯化铵溶液不是电解质
D. 溶于 后得到的 溶液能导电,故 是电解质
C
【答案】
【解析】
A
,不是电解质,
错误;
【详解】
.铜为单质 A
(
;
).液态氯化氢、固体氯化钠均 B 错误
C ,既不是电解质也不是 电解质,
正确;
D , 本身不能电离产 由移动的离 ,是 电解质,
.电解质必须是本身能电离产 由移动的离
D 错误;
C
答案选 。
7. NA
设
为阿伏加德罗常数,下列说法正确的是
1.6gO2
和 O3 混合 体中,所含氧原 数 为 0.1NA
1mol/LAl2(SO4)3
溶液中,所含 数 3NA
C. 标准状况下,11.2LCCl4 中所含氯原 数 为 2NA
D. 71gCl2 与 量 NaOH 溶液反应,转移电 数 为 2NA
A
【答案】
【解析】
【详解】 .
1.6g O 0.1mol
(
,
所含
氧
原
)该混合物含有 原 物质的量为
数 为
0.1 NA,A 正确;
(
;
).未给出溶液的体积 B 错误
.标准状况 C 错误
(
;
)C 下,CCl4 不是 体,不能 体摩尔体积计算,
.
71gCl 1mol
(
2
,
则转
)物质的量为
移电 数 为
A
NA D
,
错误;
故选 。
8.
,下列实验现象或结论不正确的是( )
在探究新制饱和氯 成分的实验中
A. 氯 的颜 呈浅 绿 ,说明氯 中含有 Cl2
-
B.
向氯 中滴加硝酸酸化的
AgNO3
溶液,产 沉淀,说明氯 中含有 Cl
C.
向氯 中加
D.
NaHCO3
粉末,有 泡产 ,说明氯 中含有 H
(
+
),溶液颜 变成红 ,说明氯 中含有 HClO
向氯 中滴加紫 蕊
D
【答案】
【解析】
【分析】氯 中存在平衡
Cl2+H2O HCl+HClO
,
氯 为 绿 ,因此氯 中因含有 Cl2 呈浅 绿 ,
溶液中含有
Cl-
,与硝酸银反应 成
AgCl
沉淀;氯 呈酸性,含有
H+
,能与
NaHCO3
反应 成
CO2;
氯 中有
HClO
存在,因此具有漂 性。
A
,不符合题意;
A.
【详解】
B.
氯 中因含有
Cl-
Cl2
呈浅 绿 ,
AgCl
项正确
B
氯 中存在
,与硝酸银反应 成
+
沉淀,
项正确,不符合题意;
C
C. 氯 呈酸性,含有 H ,能与 NaHCO3 反应 成 CO2,
项正确,不符合题意;
+
D. 向氯 中滴加紫 蕊,溶液颜 变成红 ,说明溶液呈酸性,含有 H , 因氯 中有 HClO 存在,
具有漂 性
D
D ,符合题意;
答案选 。
【点睛】本题的难点是确定新制氯 的成分。新制氯 中存在三种分 和四种离 即:
9. 下列实验操作正确,并且与选项中实验 的匹配的是
A.
稀释浓硫酸
C.
收集氯
A
B.
读取液体体积
D. pH
测定饱和氯 的
【答案】
【解析】
【详解】
.稀释浓硫酸时 A 正确
(
;
) (
;
).读取液体体积时 B 错误
(
;
).氯 密度 空 C 错误
(
;
)D ,具有漂 性,不能 pH 试纸测定和氯 的 pH D 错误
.氯 中含有次氯酸 ,
A
故答案选 。
10.
,分别取少量待测液进 下列实验,其中结论正确的是
为检验溶液 的某种离
A.
,再加 溶液,产 了 沉淀,则原溶液中 定含有 量的
先加适量的盐酸将溶液酸化
B.
,加热后产 使湿润的红 蕊试纸变蓝的 体,则该溶液中含有
往某溶液中加 氢氧化钠溶液
C. 洁净的铂丝蘸取溶液进 焰 反应, 焰呈 ,则溶液有,
D. 往某溶液中加 盐酸,产 能使澄清 灰 变浑浊的 体,则该溶液中含有
B
【答案】
【解析】
【详解】
.加 盐酸酸化 A 错误
A ,引 氯离 ,对检验原溶液中的氯离 产 扰,
B ,则该溶液中 定含有 ,
(
;
)
正确;
C
. 光遮挡紫光
D
,检验钾离 ,应透过蓝 钴玻璃 C ;
(
,
错误
)H+
. 、 、 、 均能和 反应 成 体 氧化碳或 氧化硫,则溶液中可能含有
D
或 或 或 ,
B
错误;
故选: 。
NH4Cl
ZnCl2 池内
某同学查阅教材得知
的 固体并回收利 时,进 如图所示实验,下列有关实验的叙述不正确的是
A.
操作④的 的是为验证滤渣中含
B.
操作③盛放滤渣的仪器是蒸发
MnO2
C.
操作②为过滤
D.
,得到的滤液加强碱并微热,会产 刺激性 味的 体
操作①中玻璃棒能加快固体溶解
B
【答案】
【解析】
A
,能作过氧化氢分解的催化剂,加快过氧化氢分解产 氧 的速率,所以
【详解】
. 氧化锰是 固体
A
操作④的 的是验证滤渣中含
MnO2,
B
正确。
;
B
(
,
)错误
.操作③是在坩埚内灼烧滤渣
.操作②为过滤
D
C
(
;
)正确
(
,
)D 正确;
.操作①中玻璃棒起到搅拌加速溶解的作
B
故选: 。
12.
(ClO2)
种 效消毒剂,通过下列反应可制得 ClO2:
N H2 4 2 +
氧化氯
2Na2SO4+
是
对于该反应
确的是
2NaClO3+
a2SO3+
SO =2ClO
↑
NaClO3
H2O
是还原剂
,下列说法正
Na2SO3
被还原
H2SO4
发 D. 1 mol ClO2,转移电 数为 NA
(
氧
化反应
成
)D
【答案】
【解析】
Na2SO3+
+ Na2SO4+
(
,
)O aClO3 Cl
中 中 元素从
5
价降低到
【分析】反应
H2SO4=2ClO2↑ 2
H2 N + +
Na2SO3 S +4
价
+6 ,作还原剂,据此结合氧化还原反应的规律分析解答。
【详解】 .
中 元素从
A
价降低到 价 错误
(
;
)A ClO3 Cl +5
+4 ,作氧化剂,
Na2SO3 S
+4
(
价
)升 到
化, 错误;
. 中 元素从 价
+6 ,被氧 B
C H2SO4 , 错误;
. 中元素化合价没有发 变化 C
.根据分析可知
D 确;
D
D
故选 。
, 成 1 mol ClO2,转移电 数为 NA, 正
13. 种同位素 X 的原 质量数为 A N 个中 ,它与原 组成 HmX 分 。在 a 克 HmX 中
(
含
)某元素的 ,
所含质 的物质的量是
A. B.
C. D.
A
【答案】
【解析】
【详解】某元素的 种同位素 X 的原 质量数为 A
N 个中 ,则质 数为( )
个 HmX 分
(
含
), A-N
,则每
A
故选 。
14.
A-N+m), gH mX 的物质的量为 mol,故含有质 物质的量为 ;
与 属钠的反应,先将钠预热,在钠熔化成 球时撤去热源,
某兴趣 组设计如图所示的装置进 氯
并通 氯 即发 反应 氯 可
),下列叙述不正确的是
A.
钠在氯 中燃烧产 焰
B.
反应产 的 量 烟是氯化钠固体
C.
棉球①的作 是吸收过量氯 防 产 污染
D.
棉球②变蓝 则证明氯 已被碱完全吸收
D
【答案】
【解析】
【分析】
A
,产 量 烟, 焰为 ,故 A 正确;
【详解】
B
.钠在氯 中燃烧 成氯化钠
,产 量 烟, 焰为 ,故 B 正确;
.钠在氯 中燃烧 成氯化钠
C 与碱溶液反应 成氯离 、次氯酸根离 和 ,则浸有碱液的棉球 于吸收有毒的氯 ,防 污
.氯 能
染空 ,故 C 正确;
D —碘化钾溶液的棉球变蓝 ,说明与碱液反应时氯 过量,过量氯 与碘化钾溶液发 置换反
.浸有淀粉
应反 成的碘遇淀粉变蓝 ,故 D 错误;
D
故选
15.
。
下列溶液中 定能 量共存的离 组是
在
Na+ K+
Cl-
A. 在强酸性溶液中:
2+
、
Mg2+
、 、
Cl-
B. 溶液中:Fe 、
Fe3+
、 、
OH- I- K+
Br-
含有 量
的溶液中:
、 、 、
K+ Na+
D. 滴 酚酞变红的溶液中: 、 、 、
D
【答案】
【解析】
A
, 与氢离 反应不能 量共存,故 A 不符合题意;
【详解】 .强酸性溶液中存在 量氢离
B 不存在有 离 , Fe
2+
(
B
)为浅绿 ,故 不符合题意;
. 溶液中
Fe3+ I-
Fe3+
OH- C
. 具有氧化性,
具有还原性,两者能发 氧化还原反应,且
与 能形成氢氧化铁沉淀,故
不符合题意;
D
,该组离 均不与氢氧根离 反应,且彼此也不反应可 量共存,
.滴 酚酞变红的溶液中存在氢氧根离
故 D 符合题意;
D
故选: 。
16. 下列说法正确的是
A.
将 的 溶液加 稀释到
,稀释后溶液中 的物质的量浓度为
B.
溶液中含
,溶液中
C.
配制 稀盐酸需取 浓盐酸
(
),得到溶
D. 将 的 溶液与 的 溶液混合 忽略溶液体积变化
液的物质的量浓度为
C
【答案】
【解析】
A
30 mL 0.5 mol·L-1
Na2SO4
500 mL
Na+
【详解】 .将
的 溶液加 稀释到
,稀释后溶液中
的物质的量浓度为
(
,
)A 错误;
B VL Mg(NO3)2
Mg2+ a g
c(NO )= B
. 溶液中含
,溶液中 ,
错误;
C
.配制
220mL6mol/L
稀盐酸需要 到
250mL
容量瓶,需取 12mol/L 浓盐酸的体积为
(
,
)C 正确;
D 100 mL 1.0 mol·L-1
NaCl
200 mL 1.5 mol·L-1
NaCl ( )
.将 的
溶液与
的 溶液混合 忽略溶液体积变化 ,得到溶
D
液的物质的量浓度为 ,
错误;
C
故选 。
17. :
反应①②分别是从海藻灰和某种矿 中提取碘的主要反应
2H2O I2
① MnSO4+ +
H2O I2
② 3NaHSO4+ +
下列说法正确的是
A. 两个反应中硫元素均被氧化
B.
碘元素在反应①中被氧化、在反应②中被还原
MnO2 I2
>
由①②可得氧化性
I2
,转移电 数之 为 2 5
反应①②中 成等质量的 时 :
B
【答案】
【解析】
A
,锰化合价降低,硫化合价未变,反应②中碘化合价降低,硫化合价升
【详解】 .反应①中碘化合价升
,故 A 错误;
B
,被氧化,碘元素在反应②中化合价降低,被还原,故 B 正
.根据前 分析碘元素在反应①中化合价升
确;
MnO2>
,故 C 错误;
.根据氧化剂的氧化性 于氧化产物的氧化性
I2, I2
D
.反应①中 成
1 个 I2,转移 2 个电 ,反应②中 成 1 个 I2,转移 10 个电 ,因此反应①②中 成等
I2 ,转移电 数之 为 1
5 D
故 错误。
质量的 时 : ,
(
。
)综上所述,答案为 B
18.
25 ,氯 中部分含氯微粒的物质的量浓度随 pH 的变化关系如
已知 的杀菌能 强。 ℃时
图所示。下列叙述正确的是
(
10
第
共
) (
/
) (
21
)
pH
可
pH
试纸测氯 的
pH
随着
C.
增 ,氯 的杀菌能 逐渐增强
:
的氯 中
D. 时,溶液中的含氯微粒主要为 和
D
【答案】
【解析】
【分析】
A
,能漂 pH 试纸,故不能 pH试纸测氯 的 pH A 错误
(
;
)【详解】 .氯 有漂 性 ,
pH 6
. 于
之后,随着 pH增 ,次氯酸的浓度下降、 的浓度增 ,已知 的杀菌能
(
强
,
) ,故氯 的杀菌能 逐渐随之逐渐下降 B
. 由图知
错误;
C
错误
(
;
)C , 的氯 中: ,
D , 时,溶液中 乎没有氯分 、次氯酸分 ,有 量 ,氯 转变为 的反应中,
.由图知
D ;
氯元素化合价升 ,则另有 部分氯元素化合价降低转变为 , 正确
D
答案选 。
19. Cl2O
棕 具有强烈刺激性 味的 体,是 种强氧化剂,易溶于 且会与 反应 成次氯酸,与有
是
机物、还原剂接触或加热时会发 燃烧并爆炸。制取
Cl2O
的装置如图所示。
Cl2
-34.6
; gO+2Cl2=HgCl2+Cl2O
Cl2O
-116
,沸点为 3.8 ,
H
的沸点为 ℃
已知: 的熔点为 ℃ ℃
下列说法不正确的是
A.
装置②、③中盛装的试剂依次是饱和 盐 和浓硫酸
B.
通 燥空 的 的是将 成的
Cl2O
稀释减少爆炸危险
C.
从装置⑤中逸出 体的主要成分是
Cl2O
D.
装置④与⑤之间不 橡 管连接,是为了防 橡 管燃烧和爆炸
C
【答案】
【解析】
【分析】本实验的 的是先制得 燥、纯净的氯 ,再与 HgO 反应制取 Cl2O
Cl2O
最后利 液化法实现
与 Cl2 的分离。
A
【详解】 .利
,
KMnO4 与浓盐酸反应制得氯 中混有 HCl 体和 蒸 ,装置② 饱和 盐 吸收 HCl,
A
(
,
从
制得 燥、纯净
的氯
)装置③ 浓硫酸吸收 蒸 ,
正确;
B , 可将装置内的 Cl2O 不断排出,另 可起稀释作 ,降低 Cl2O 的浓度,减
.通 燥的空
B ;
少爆炸危险, 正确
-34.6
, 液氨
中逸出 体的主
Cl2O
3.8
l
(
,
2
)的沸点为 ℃
降温,可将 Cl2O 液化,则从装置⑤
要成分是
C 不正确;
;
D
C
故选 。
20.
, l2O 与有机物接触会发 燃烧并爆炸,所以装置④与⑤之间不 橡 管连接, 正确
下列说法错误的是
臭氧氧化法处理含氰废 的 艺原理如图所示。
A.
Ⅰ阶段中
1mol NaCN
被氧化需消耗
B.
Ⅱ阶段的反应为
C.
与反应
Ⅰ阶段产 的 在Ⅱ阶段中作为氧化剂参
D. 两个阶段总反应的化学 程式为
C
【答案】
【解析】
【分析】由图可知,Ⅰ阶段发 反应为
NaCN 与 O3 反应 成 NaCNO 和 O2,反应的化学 程式为 NaCN
N2 和 O2,反应的化学 程
+O3=NaCNO+O2,Ⅱ阶段发 的反应为 NaCNO 与 H2O O3 反应 成 NaHCO3、
、
式为 2NaCNO+H2O+3O3=2NaHCO3+N2+3O2,整合可知,两个阶段总反应的化学 程式为 2NaCN
+H2O+5O3=2NaHCO3+N2+5O2
。
A NaCN+O =NaCNO+O 1mol O 1molNaCN
(
3
2
,
反应中
3
氧
化
),Ⅰ阶段反应的化学 程式为
【详解】 .由分析可知
,故 A 正确;
2NaCNO+H O+3O =2NaHCO +N +3O B
(
2
3
3
2
2
,
故
正确
;
),Ⅱ阶段反应的化学 程式为
.由分析可知
O C
(
2
,
故
错误
;
),Ⅰ阶段和Ⅱ阶段中 都为 成物
.由分析可知
D
,两个阶段总反应的化学 程式为 2NaCN+H2O+5O3=2NaHCO3+N2+5O2,故 D 正确;
.由分析可知
C
故选 。
21. 下列是某化学研究性学习 组对某 样成分的检验过程,已知该 样中只可能含有 、 、
, 、 , 、 、 中的若 种离 ,该 组同学取 100 mL 样进 实验:向样品 中先滴加硝酸钡溶液,再滴加 1 mol L 硝酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是
A. 样中 定不存在、 、 ,可能存在
B. 样中 定存在、 和
B
由
C
点到 点变化过程中消耗硝酸的体积为
40 mL
D. 样中 定存在,且
C
【答案】
【解析】
【分析】加 硝酸钡溶液后产 沉淀,再加 硝酸沉淀部分溶解,说明溶液中肯定存在碳酸根离 和硫酸 根离 ,肯定不存在镁离 、铜离 、银离 、钙离 ,根据溶液呈电中性肯定存在钾离 ,氯离 法
判断。
A
,溶液中个肯定存在硫酸根离 ,硫酸银微溶,故肯定不存在银离 ,故 A 错误;
【详解】
B
.根据分析
,氯离 法判断,故 B 错误;
.根据分析
BC
,故碳酸钡的质量为 6.27-2.33=3.94g 求得
. 段加 硝酸后是溶解碳酸钡 ,
,故 C 正确;
BC
0.02mol,剩余
. 段溶解钡碳酸钡的物质的量为 则碳酸根的物质的量也为
固体为硫酸钡其物质的量为 则硫酸根的物质的量为
0.01mol,溶液显电中性则溶液
中含有钾离 其浓度 ,
故 D 错误;
C
故选 。
、 (
58 )
22.
1
填空题 共 分
按要求填空:
:
( )如图是常 于混合物的分离和提纯的装置
a
①仪器
的名称是
1
。
( 118 )
( 77.1 )
(
,
仪
),还缺少的仪器是
②利 图
装置分离 酸 沸点
℃ 和 酸 酯 沸点
”)
℃ 的混合物
器 中冷凝 应该从
填 ” “下
进。
③从碘的饱和 溶液中提取碘应选择图
(
( )
填序号 装置
)
,该实验要 到萃取剂,下列关于所加萃
取剂的说法不正确的是 填字 。
A 不与碘反应 B.碘在该萃取剂中的溶解度 在 中的溶解度
.该萃取剂
C 与 不互溶 D
该萃取剂的密度必须 的密度
.该萃取剂
2
.
丙三种元素,甲元素 M 层的电 数是其 K 层的电 数的, 元素原 核内 中 ,丙
( )有甲、 、
8 个质 。
元素原 核内有
①写出甲、 、丙三种元素组成的化合物在 中的电离 程式 。
②画出甲元素 离 结构示意图 。
3 V mL
,取 mL 溶液稀释到 4V mL,此时溶液中物质的量浓度 a mol/L
( )从 溶液中 ,
则原溶液中含 的物质的量浓度是 。
22.4 L“
( ) 造空 氧
) 于减轻某些病痛或供深 潜 员,标准状况下,
造空
的质量是
可
(
。
),其中氧
( ) 作催化剂
(TOC)
在酸性条件下, 的加
5
TOC
,在废 中加 可以去除废 中的有机物 。
,则 的浓度为
TOC
中 去除效果最好。
量对
的去除效果如图所示
mol L 时,废
22.
【答案】
. .
① 冷凝管 ②
温度计 . 下 . 2 . D
(
③
④
) (
⑤
)23. . .
① ②
24.
25. 1 4 26.
:
【解析】
2
丙三种元素,甲元素 M 层的电 数是其 K 层的电 数的,则甲为 Na 元素;
【分析】( )有甲、 、
元素原 核内 中 ,则 为 H 元素;丙元素原 核内有 8 个质 ,则丙为 O 元素;
1
【 问
详解】
a ;
①根据图示,仪器
的名称是冷凝管
1
( 118 )
( 77.1 )
,需要测蒸汽的
②图示为蒸馏装置,利 图
装置分离 酸 沸点
℃ 和 酸 酯 沸点
℃ 的混合物
温度,还缺少的仪器是温度计;为提 冷凝效果,冷凝 应“ 低进 出” ,仪器 a 中冷凝 应该从下 进;
2
③ 萃取法从碘的饱和 溶液中提取碘,应选择图
装置;
.根据萃取剂 选取原则
B
A
(
;
)正确
, 正确;
.该萃取剂
D
C
(
;
)正确
, 错误;
.萃取剂的密度 的密度 、 均可以 D
答案选
【 问
D
;
2
详解】
①甲、 、丙三种元素组成的化合物: ,在 中的电离 程式: ;
(
②
)Na 元素的离 结构示意图: ;
3
【 问
详解】
稀释过程中溶质的浓度不变,从 V mL 溶液中,取 mL 溶液稀释到 4V mL,此时溶液中物
a mol/L : ;
质的量浓度 ,则原溶液中含 的物质的量浓度
4
【 问
详解】
22.4 L“ ”
9.6 g
xmol,氦 物质的量 ymol,则
标准状况下,
造空 的质量是
,设其中氧 物质的量
, ,解得: , ,相同状况下,体积 等于物质的量之 ,则氧 与
1 4
氦 体积 为: : ;
5
【 问 详解】
TOC
40mg/L : ;
如图,
去除率最好时双氧 浓度为
,此时
23.
I
回答下列问题:
84
两种消毒剂。
.双氧 和
消毒液是 活中常 的
)
( )某同学设计如
(
序号 。
填
序号 实验 实验现象
5%
1 向 溶液中滴加酸性 .溶液紫 褪去 b 泡产 a ; .有 量
溶液
5%
2 向 溶液中滴加淀粉碘化 c .溶液变蓝
钾溶液
2 ,由于 作 员将 84 消毒液与双氧 两种消毒剂混 ,导致游泳池藻类快速 ,
( )某届奥运会期间
池 变绿。 种原因可能是 NaClO 与反应产 促进藻类快速 。
NaClO
( “>”
“<”)
NaClO
该反应说明氧化性:
填 或 ,当参加反应的
和 的物质的量之
1∶1
为
时,该反应的还原产物为 。
( )(
-2 )
种新型的净 剂,可以通过下述反应制取:
Ⅱ. 铁酸钠 其中氧元素是 价 是
3
( )① 双线桥法在化学 程式中标出电 转移的情况。
②请完成 程式的配平:
Ⅲ.汽 剧烈碰撞时,安全 囊中发 反应 。
4 1.75 mol,则转移的电 数为 ( 为阿伏加德罗常数的值 ,被
( )若氧化产物 还原产物多 _ )
N
氧化的 原 的物质的量为 。
1 1 ( ) ① > ② NaCl
【答案】( ) 2 . .
3 . .
(
(
)) ① ②
( ) ① . 3.75mol
【解析】
1
【 问
1
详解】
,体现还原性;实验 2 过氧化氢将碘离 氧化为
实验 ,过氧化氢将酸性 锰酸钾还原 身被氧化 成氧
1
碘单质,体现氧化性,故答案为: ;
2
【 问
详解】
-1
0 ,则次氯酸钠做氧化剂,可以得出次氯酸钠的氧化性强
过氧化氢中的氧元素由
价被氧化为
价做还原剂
于过氧化氢;由 可知当参加反应的 NaClO 和的物质的量之 为
NaCl;
1∶1
时,该反应的还原产物为 NaCl;故答案为:>、
3
【 问
详解】
+3 +6 ,
在 反应中,铁元素从 价被氧化到 价
+1
氯元素由
-1
价被还原为
价,则双线桥为 ,根据
得失电 守恒可以配平: ,故
答案为: 、
【 问
;
4
详解】
1mol
10molNaN3
和
2molKNO3
参加反应,则 成的 16molN2 中有 15mol N2 由 NaN3 被氧化 来是氧化产物,
N2 KNO3
由
被还原 来是还原产物,氧化产 物 还原产物多 14mol,此时转移电 数为 10NA,则有
,可求得
(
、
:
);故答案为 1.25NA
24. [A
3.75mol
、 。
:
某化学兴趣 组 如图装置制取并探究氯 的性质。 装置中发 反应的化学 程式
1 A a
( ) 装置中 仪器的名称是 。
2 ( “ ” “ ”)
( )制取氯 反应中 所起的作 是 填 氧化剂 或 还原剂 。
( )实验进
( “B” C”)
或 装置中有 布条褪
(
,
其褪 原因是
)3 段时间后,可观察到 填 “
。
4 D ,可观察到溶液颜 变为
(“ ),写出相关反应的化学
( )当氯 进
装置后
_ ” “ ”
(
红 或
蓝
)填
程式 。
5 E
( ) 装置中发 的反应 程式是 。
( )实验室常
10 mol/L
若已知盐酸浓度 于 时
6 与浓盐酸制氯 ,写出反应 程式 。
则不易被 氧化,现 浓度为 12 mol/L 的浓盐酸与 8.7 g 反应,要使 全部反应掉 成最
?
多氯 ,则 少加 这种盐酸 毫升
1
【答案】( )圆底烧瓶
2 ( ) ① C ②
4 . .
氯 和 反应 成的次氯酸有漂 性
( ) ① 蓝 ②
5
( )
6 . . 200
( ) ① ②
【解析】
1
【 问
a
详解】
,答案为:圆底烧瓶;
指向的是圆底烧瓶
2
【 问
详解】
Mn
在此反应中
+7
的化合价从
+2
降低到 价被
还原, 氧化锰做氧化剂,答案为:氧化剂;
3
【 问
详解】
C
湿润氯 有漂 性,原因是氯 和 反应 成的次氯酸有强氧化性,能漂 ,故答案为: 、氯 和 反应
成的次氯酸有漂 性;
4
【 问 详解】
碘离 被氯 氧化为碘单质,淀粉遇碘变蓝,故答案为:蓝 、 ;
5
【 问 详解】
氯 和氢氧化钠反应 成次氯酸钠、氯化钠和 ,答案为: ;
6
【 问 详解】
氧化锰做氧化剂,将 HCl 氧化 成氯 , 身被还原为氯化锰, 程式为:
;盐酸浓度 于 10 mol/L 时则不易被氧化,现 浓度
12 mol/L
为
的浓盐酸与 8.7 g 反应,相当于 氧化锰和 2mol/L 的盐酸完全反应:
求得: ,故答案为:
200
、 。
25. 下:
某化 出 的漂 粉说明书如
(
使 说明
【主要成份】
次氯
酸钙、
氯
化钙
次氯
酸钙
的
质量分数为
(
35%)
2
3g
1000g
,
将病 具浸泡其中
5
10
分
【 途 量】取漂
粉
,
,
配成溶液
钟。
如需要
,
浓度可提
,
时间可延 。
【注意事项】密封避光保存于阴凉处
,
随配随
,
有
腐
蚀性
,
少
与
接触。
)
( )漂 粉的有效成分为 , 。
2 480 mL
,要使 浓度为 0.1 mol/L
则需称量漂 粉质量为
( )将漂 粉溶于 配成 溶液 ,
)
g ( 位 数
。 保留
( )配制
3 上述溶液玻璃仪器除了要使 烧杯、玻璃棒、胶头滴管外还需要使 的仪器有 。
( )在配制过程中
( “ “
偏 偏 或
4
“ ”)?
,下列实验操作对所配制的 溶液的物质的量浓度有何影响 填 ” ”
影响
a :
.定容时俯视容量瓶刻度线 _ 。
.定容后经振荡、摇匀、静置
b ,发现液 下降,再加适量的蒸馏 : 。
5 HCl
U ,可制得少量漂 粉 该反应为放热反应 ,温
( )将含有少量
的氯 通 盛有潮湿消 灰的
( )
形管中
度较 时氯 与消 灰反应: ,为避免此副反应的发
,可采取的措施是 ;
(m)与反应时间
的关系曲线
)
和 的反应 。
①如图为反应后溶液中 、 离 的物质的量
a
.图中曲线Ⅰ表示 离 的物质的量随反应时间变化的关系。
b mol
.所 灰乳中含有 的物质的量为 。
c
.另取
份含有等物质的量 的 灰乳,以较 的速率通 量氯 ,反应后测得产物中 的
0.39 mol,则产物中
物质的量为
。
( )
②试判断另 个副反应是 写出此反应的化学 程式 。
1 . .
【答案】( ) ① ②
( ) 3
500mL
容量瓶
)
4 . .
( ) ① 偏 ② 偏
5 . U
,降低 U 形管内的温度 ②
0.25
③ ④ ⑤
( ) ① 将
形管放在冰 浴中
. . . .
【解析】
1
【 问 详解】
漂 粉的有效成分: ; 业上制取漂 粉的化学 程式:
2
【 问
详解】
480mL
;
,需 500mL 容量瓶进 溶液配制,则需称量漂 粉质量:
实验室 容量瓶
;
3
【 问
详解】
500mL ;
配制上述溶液玻璃仪器除了要使 烧杯、玻璃棒、胶头滴管外还需要使 的仪器有:
4
容量瓶
【 问
a
详解】
,导致溶液体积偏 ,浓度偏 ;
.定容时俯视容量瓶刻度线
b
,发现液 下降,再加适量的蒸馏 ,导致溶液体积偏 ,浓度偏 ;
.定容后经振荡、摇匀、静置
5
【 问 详解】
温度较 时氯 与消 灰反应 成了 Ca(ClO3)2,为避免此副反应的发 ,可采取的措施:将 U 形管放在冰
浴中,降低 U 形管内的温度;
①
a , 在 温时才能 成,刚开始反应时,温度较低,氯 和氢氧化钙反应
. 在低温时即可 成
成氯化钙和次氯酸钙,故曲线Ⅰ表示 ;
b
,设氯离 的物质的量为 n 则
.根据氧化还原反应中得失电 数相等计算氯离 的物质的量 ,
,含氯元素的物质的量:
,氯化钙、次氯酸钙、氯酸钙中钙离 和含氯离 的个数 为 1 2
,所以所取 灰乳中含有 Ca(OH)2 的物质的量为 0.25mol;
.反应后产物中 的物质的量为
:
Ca(ClO)2 Ca
和
(ClO3)2
(
和
为
)物质的量之 0.055mol, 氯原 转变为 ,得电 总量为 0.39mol,设 Ca(ClO)2 和 Ca
(ClO3)2
分别为
xmol
(
、
)ymol,则有 、 ,联 解得: 、 ,
则产物中 ;
②由于盐酸具有挥发性, 成的氯 中混有
。
HCl,所以另 个副反应是:
考试时间:75 分钟 试卷总分:100 分
H 1 C
12 N
14 O
16 Na
Mg
Cl
35.5 Ba
可能 到的相对原 质量: : : : : : : :
137 S
(
:
):
32 Ca
:
40 He
:
4 Mn 55
:
(
只
) 、 选择题( 有 个选项符合题意,每 题 2 分,共 42 分)
1. 下列古诗词描述的场景中发 的反应不属于氧化还原反应的是
A. —— B. ——
烈 焚烧若等闲
——
灰 分解
蜡炬成灰泪始
D.
蜡的燃烧
——
C. 爆 声中 岁除
药爆炸
化作春泥更护花
花瓣的腐化
2. “ ”
兔 号 球 作为热源材料。关于 的叙述正确的是
A.
质量数是
C.
94 B.
239 D.
电 数是
145
94
中 数为
3. 下列说法正确的是
A.
原 序数是
分散质粒 直径 于 的分散系称为胶体
B.
向 溶液中滴加饱和 溶液可制得 胶体
C. 实验室可 丁达尔效应鉴别胶体与溶液
D. 可 过滤的 法分离胶体与 NaCl 溶液
4. 下列化学 语表示不正确的是
A. 的电离 程式:
B.
漂 粉的有效成分是
C.
、 、 互为同位素
D.
的结构示意图
Cl-
5. 下列溶液中,
浓度最 的是
5.0L 1mol·L-1NaClO
溶液
1.0L 0.2mol·L-1 FeCl3
溶液
2.0L 0.6mol·L-1KClO3
溶液
6. 下列说法正确的是
3.0L 0.15mol·L-1 BaCl2
溶液
A. 铜丝能导电,所以铜是电解质
B. 液态氯化氢、固体氯化钠均不导电,所以 不属于电解质
C. 虽然氯化铵溶液能导电,但氯化铵溶液不是电解质
D. 溶于 后得到的 溶液能导电,故 是电解质
7. NA
设
为阿伏加德罗常数,下列说法正确的是
1.6gO2
和 O3 混合 体中,所含氧原 数 为 0.1NA
1mol/LAl2(SO4)3
溶液中,所含 数 为 3NA
C. 标准状况下,11.2LCCl4 中所含氯原 数 为 2NA
D. 71gCl2 与 量 NaOH 溶液反应,转移电 数 为 2NA
8. 在探究新制饱和氯 成分 实验中,下列实验现象或结论不正确的是( )
(
-
)A. 氯 的颜 呈浅 绿 ,说明氯 中含有 Cl2
B.
向氯 中滴加硝酸酸化的
AgNO3
溶液,产 沉淀,说明氯 中含有 Cl
C.
向氯 中加
D.
NaHCO3
粉末,有 泡产 ,说明氯 中含有 H
(
+
),溶液颜 变成红 ,说明氯 中含有 HClO
向氯 中滴加紫 蕊
9. 下列实验操作正确,并且与选项中实验 的匹配的是
A.
稀释浓硫酸
C.
收集氯
B.
读取液体体积
D. pH
测定饱和氯 的
10.
A.
B.
C.
D.
为检验溶液 的某种离 ,分别取少量待测液进 下列实验,其中结论正确的是
先加适量的盐酸将溶液酸化,再加 溶液,产 了 沉淀,则原溶液中 定含有 量的 往某溶液中加 氢氧化钠溶液,加热后产 使湿润的红 蕊试纸变蓝的 体,则该溶液中含有
洁净的铂丝蘸取溶液进 焰 反应, 焰呈 ,则溶液有 ,
往某溶液中加 盐酸,产 能使澄清 灰 变浑浊的 体,则该溶液中含有
某同学查阅教材得知
NH4Cl
ZnCl2 池内
的 固体并回收利 时,进 如图所示实验,下列有关实验的叙述不正确的是
A.
操作④的 的是为验证滤渣中含
B.
操作③盛放滤渣的仪器是蒸发
MnO2
C.
操作②为过滤
D.
,得到的滤液加强碱并微热,会产 刺激性 味的 体
操作①中玻璃棒能加快固体溶解
12. (ClO2)
种 效消毒剂,通过下列反应可制得 ClO2:
N H2 4 2 +
氧化氯
2Na2SO4+
是
对于该反应
确的是
2NaClO3+
a2SO3+
SO =2ClO
↑
NaClO3
H2O
是还原剂
,下列说法正
Na2SO3
被还原
C. H2SO4 发 氧化反应 D. 成 1 mol ClO2,转移电 数为 NA
13. 种同位素 X 的原 质量数为 A N 个中 ,它与原 组成 HmX 分 。在 a 克 HmX 中
(
含
)某元素的 ,
所含质 的物质的量是
A. B.
D.
14. 某兴趣 组设计如图所示的装置进 氯 与 属钠的反应,先将钠预热,在钠熔化成 球时撤去热源,
并通 氯 即发 反应 氯 可
),下列叙述不正确的是
A.
B.
C.
D.
15.
钠在氯 中燃烧产 焰
反应产 的 量 烟是氯化钠固体 棉球①的作 是吸收过量氯 防 产 污染 棉球②变蓝 则证明氯 已被碱完全吸收 在下列溶液中 定能 量共存的离 组是
Na+ K+ Cl-
A. 在强酸性溶液中:
2+
、
Mg2+
、 、
Cl-
B. 溶液中:Fe 、
Fe3+
、 、
OH- I- K+
Br-
含有 量
的溶液中:
、 、 、
K+ Na+
D. 滴 酚酞变红的溶液中: 、 、 、
16. 下列说法正确的是
A.
将 的 溶液加 稀释到
,稀释后溶液中 的物质的量浓度为
B
溶液中含
,溶液中
C.
配制 稀盐酸需取 浓盐酸
(
),得到溶
D. 将 的 溶液与 的 溶液混合 忽略溶液体积变化
液的物质的量浓度为
17. :
反应①②分别是从海藻灰和某种矿 中提取碘的主要反应
2H2O I2
① MnSO4+ +
H2O I2
② 3NaHSO4+ +
下列说法正确的是
A. 两个反应中硫元素均被氧化
B.
碘元素 反应①中被氧化、在反应②中被还原
MnO2 I2
>
由①②可得氧化性
I2
,转移电 数之 为 2 5
反应①②中 成等质量的 时
18. 25
:
,氯 中部分含氯微粒的物质的量浓度随 pH 的变化关系如
已知 杀菌能 强。 ℃时
图所示。下列叙述正确的是
pH
可
pH
试纸测氯 的
pH
随着
C.
增 ,氯 的杀菌能 逐渐增强
:
D.
19. Cl2O
的氯 中
时,溶液中的含氯微粒主要为 和 是 棕 具有强烈刺激性 味的 体,是 种强氧化剂,易溶于 且会与 反应 成次氯酸,与有
机物、还原剂接触或加热时会发 燃烧并爆炸。制取
Cl2O
的装置如图所示。
Cl2
-34.6
; gO+2Cl2=HgCl2+Cl2O
Cl2O
-116
,沸点为 3.8 ,
H
的沸点为 ℃
已知: 的熔点为 ℃ ℃
下列说法不正确的是
A.
装置②、③中盛装的试剂依次是饱和 盐 和浓硫酸
Cl2O
通 燥空 的 的是将 成的
C.
从装置⑤中逸出 体的主要成分是
稀释减少爆炸危险
Cl2O
D.
20.
装置④与⑤之间不 橡 管连接,是为了防 橡 管燃烧和爆炸
臭氧氧化法处理含氰废 的 艺原理如图所示。下列说法错误的是
A.
Ⅰ阶段中
1mol NaCN
被氧化需消耗
B.
Ⅱ阶段的反应为
C.
与反应
Ⅰ阶段产 的 在Ⅱ阶段中作为氧化剂参
D. 两个阶段总反应的化学 程式为
21. 下列是某化学研究性学习 组对某 样成分的检验过程,已知该 样中只可能含有、 、
, 、 , 、 、 中的若 种离 ,该 组同学取 100 mL 样进 实验:向样品 中先滴加硝酸钡溶液,再滴加 1 mol L 硝酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是
A. 样中 定不存在、 、 ,可能存在
B. 样中 定存在、 和
B
由
C
点到 点变化过程中消耗硝酸的体积为
40 mL
D. 样中 定存在,且
(
(
、
) 填空题 共
58 )
分
22.
1
按要求填空:
:
( )如图是常 于混合物的分离和提纯的装置
a
①仪器
的名称是
1
。
( 118 )
( 77.1 )
(
,
仪
),还缺少的仪器是
②利 图
装置分离 酸 沸点
℃ 和 酸 酯 沸点
”)
℃ 的混合物
器 中冷凝 应该从
填 ” “下
进。
③从碘的饱和 溶液中提取碘应选择图
(
( )
填序号 装置
)
,该实验要 到萃取剂,下列关于所加萃
取剂的说法不正确的是 填字 。
A 不与碘反应 B.碘在该萃取剂中的溶解度 在 中的溶解度
.该萃取剂
C 与 不互溶 D
该萃取剂的密度必须 的密度
.该萃取剂
2
.
丙三种元素,甲元素 M 层的电 数是其 K 层的电 数的, 元素原 核内 中 ,丙
( )有甲、 、
8 个质 。
元素原 核内有
①写出甲、 、丙三种元素组成的化合物在 中的电离 程式 。
②画出甲元素的离 结构示意图 。
3 V mL
,取 mL 溶液稀释到 4V mL,此时溶液中物质的量浓度 a mol/L
( )从 溶液中 ,
则原溶液中含 的物质的量浓度是 。
22.4 L“
( ) 造空 氧
) 于减轻某些病痛或供深 潜 员,标准状况下,
造空
的质量是
可
(
。
),其中氧
( ) 作催化剂
(TOC)
在酸性条件下, 的加
5
TOC
,在废 中加 可以去除废 中的有机物 。
,则 的浓度为
TOC
中 去除效果最好。
量对
的去除效果如图所示
mol L 时,废
23.
I
回答下列问题:
84
两种消毒剂。
.双氧 和
消毒液是 活中常 的
)
( )某同学设计如
(
序号 。
填
序号 实验 实验现象
5%
1 向 溶液中滴加酸性 .溶液紫 褪去 b 泡产 a ; .有 量
溶液
5%
2 向 溶液中滴加淀粉碘化 c .溶液变蓝
钾溶液
2 ,由于 作 员将 84 消毒液与双氧 两种消毒剂混 ,导致游泳池藻类快速 ,
( )某届奥运会期间
池 变绿。 种原因可能是 NaClO 与反应产 促进藻类快速 。
NaClO
( “>”
“<”)
NaClO
该反应说明氧化性:
填 或 ,当参加反应的
和 的物质的量之
1∶1
为
时,该反应的还原产物为 。
( )(
-2 )
种新型的净 剂,可以通过下述反应制取:
Ⅱ. 铁酸钠 其中氧元素是 价 是
3
( )① 双线桥法在化学 程式中标出电 转移的情况。
②请完成 程式的配平:
Ⅲ.汽 剧烈碰撞时,安全 囊中发 反应 。
4 1.75 mol,则转移的电 数为 ( 为阿伏加德罗常数的值 ,被
( )若氧化产物 还原产物多 _ )
N
氧化的
24.
原 的物质的量为 。
[A :
某化学兴趣 组 如图装置制取并探究氯 的性质。 装置中发 反应的化学 程式
1 A a
( ) 装置中 仪器的名称是 。
2 ( “ ” “ ”)
( )制取氯 反应中 所起的作 是 填 氧化剂 或 还原剂 。
( )实验进
( “B” C”)
或 装置中有 布条褪
(
,
其褪 原因是
)3 段时间后,可观察到 填 “
。
4 D ,可观察到溶液颜 变为
(“ ),写出相关反应的化学
( )当氯 进
装置后
_ ” “ ”
(
红 或
蓝
)填
程式 。
5 E
( ) 装置中发 的反应 程式是 。
( )实验室常
10 mol/L
若已知盐酸浓度 于 时
6 与浓盐酸制氯 ,写出反应 程式 。
则不易被 氧化,现 浓度为 12 mol/L 的浓盐酸与 8.7 g 反应,要使 全部反应掉 成最
?
多氯 ,则 少加 这种盐酸 毫升
25. 下:
某化 出 的漂 粉说明书如
(
使 说明
【主要成份】
次氯
酸钙、
氯
化钙
次氯
酸钙
的
质量分数为
(
35%)
2
3g
1000g
,
将病 具浸泡其中
5
10
分
【 途 量】取漂
粉
,
,
配成溶液
钟。
如需要
,
浓度可提
,
时间可延 。
【注意事项】密封避光保存于阴凉处
,
随配随
,
有
腐
蚀性
,
少
与
接触。
)
( )漂 粉的有效成分为 , 。
2 480 mL
,要使 浓度为 0.1 mol/L
则需称量漂 粉质量为
( )将漂 粉溶于 配成 溶液 ,
)
g ( 位 数
。 保留
( )配制
3 上述溶液玻璃仪器除了要使 烧杯、玻璃棒、胶头滴管外还需要使 的仪器有 。
( )在配制过程中
( “ “
偏 偏 或
4
“ ”)?
,下列实验操作对所配制的 溶液的物质的量浓度有何影响 填 ” ”
影响
a :
.定容时俯视容量瓶刻度线 _ 。
.定容后经振荡、摇匀、静置
b ,发现液 下降,再加适量的蒸馏 : 。
5 HCl
U ,可制得少量漂 粉 该反应为放热反应 ,温
( )将含有少量
的氯 通 盛有潮湿消 灰的
( )
形管中
度较 时氯 与消 灰反应: ,为避免此副反应的发
,可采取的措施是 ;
(m)与反应时间
的关系曲线
)
和 的反应 。
①如图为反应后溶液中 、 离 的物质的量
a
.图中曲线Ⅰ表示
b
离 的物质的量随反应时间变化的关系。
mol
.所 灰乳中含有 的物质的量为 。
c
.另取
份含有等物质的量 的 灰乳,以较 的速率通 量氯 ,反应后测得产物中 的
0.39 mol,则产物中
物质的量为 。
( )
②试判断另 个副反应是 写出此反应 化学 程式 。
永春 中 年期中考试化学科试卷
考试时间:75 分钟 试卷总分:100 分
H 1 C
12 N
14 O
16 Na
Mg
Cl
35.5 Ba
可能 到的相对原 质量: : : : : : : :
137 S
(
:
):
32 Ca
:
40 He
:
4 Mn 55
:
(
只
) 、 选择题( 有 个选项符合题意,每 题 2 分,共 42 分)
1. 下列古诗词描述的场景中发 的反应不属于氧化还原反应的是
A. —— B. ——
烈 焚烧若等闲
——
灰 分解
蜡炬成灰泪始
D.
蜡的燃烧
——
C. 爆 声中 岁除
A
药爆炸
化作春泥更护花
花瓣的腐化
【答案】
【解析】
A ——
,反应中元素化合价不发 变化,属于
【详解】
.烈 焚烧若等闲
灰 分解 成氧化钙和 氧化碳
A
氧化还原反应,
符合;
. 蜡炬成灰泪始
蜡的燃烧 成 氧化碳和
B 不符
合;
. 爆 声中 —
酸钾、 炭和硫磺发 反应 成硫化钾、氮 和 氧化碳等,反
C 不符合;
应过程中元素化加发 变化,是氧化还原反应,
. 化作春泥更护花
D
(
不
) 然环境
D
符合;
A
答案选 。
2. “ ”
—— 下花瓣的腐化通常是氧 参与下的化学反应,属于氧化还原反应,
兔 号 球 作为热源材料。关于 的叙述正确的是
A.
质量数是
C.
94 B.
239 D.
电 数是
145
94
中 数为
D
【答案】
原 序数是
【解析】
= + ,核电荷数
核外电
【分析】原 中元素符号左上 为质量数,最下 为质 数,质量数
质 数
=
中 数
= =
数 原 序数
A.
质 数。
=239 A ;
【详解】
B. =
质量数 ,故 错误
=94 B ;
电 数
质 数
,故 错误
C. =239 94=145 C ;
中 数
D. =
,故 错误
=94 D ;
原 序数
质 数
,故 正确
D
故选 。
3. 下列说法正确的是
A.
分散质粒 直径 于 的分散系称为胶体
B.
向 溶液中滴加饱和 溶液可制得 胶体
C. 实验室可 丁达尔效应鉴别胶体与溶液
D. 可 过滤的 法分离胶体与 NaCl 溶液
C
【答案】
【解析】
A
1nm
,分散质粒 直径在 1nm- 100nm 之间的分散系
【详解】
.分散质粒 直径 于
的分散系称为溶液
称为胶体,故 A 错误;
B
(
胶
体
应该向沸
)FeCl3
NaOH
FeCl3
,故 B 错误;
Fe(OH)3
, e(OH)3 中滴加饱和
溶液 溶液呈透明的红褐
C 丁达尔效应是胶体特有的性质,溶液不具有,所以可以 丁达尔效应鉴别溶液和胶体,故 C 正确;
.
D Fe(OH)3
与 NaCl 溶液都能透过滤纸,不能 过滤的 法分离,可以利 半透膜 渗析的 法分离
. 胶体
胶体和溶液,故 D 错误;
C
故选: 。
4. 下列化学 语表示不正确的是
A. 的电离 程式:
B.
漂 粉的有效成分是
C.
、 、 互为同位素
D.
的结构示意图
C
【答案】
【解析】
【详解】
. 是强电解质
A 确;
A ,电离 程式: , 正
B B
.漂 粉的有效成分是 ,
正确;
C 不同的同 元素的不同原 互称为同位素,即同 元素的不同核素互称
.同位素是指质 数相同 中 数
(
为
同
位
素
,
), 、 、 均为单质 C
错误;
D D
. 的结构示意图 ,
正确;
C
答案选 。
Cl-
5. 下列溶液中,
浓度最 的是
5.0L 1mol·L-1NaClO
溶液
1.0L 0.2mol·L-1 FeCl3
溶液
2.0L 0.6mol·L-1KClO3
溶液
B
【答案】
3.0L 0.15mol·L-1 BaCl2
溶液
【解析】
A
5.0L 1mol·L-1NaClO
Cl-
Cl- 0
【详解】 .
溶液中
, 浓度为 ;
1.0L 0.2mol·L-1 FeCl3
Cl-
0.6mol/L
. 溶液中, 浓度为 ;
2.0L 0.6mol·L-1KClO3
Cl-
Cl- 0
. 溶液中 , 浓度为 ;
3.0L 0.15mol·L-1 BaCl2
Cl-
0.3mol/L
. 溶液中, 浓度为 ;
(
综
,
)上分析 B 中氯离 的物质的量浓度最 ,答案选 B。
6. 下列说法正确的是
A. 铜丝能导电,所以铜是电解质
B. 液态氯化氢、固体氯化钠均不导电,所以 不属于电解质
C. 虽然氯化铵溶液能导电,但氯化铵溶液不是电解质
D. 溶于 后得到的 溶液能导电,故 是电解质
C
【答案】
【解析】
A
,不是电解质,
错误;
【详解】
.铜为单质 A
(
;
).液态氯化氢、固体氯化钠均 B 错误
C ,既不是电解质也不是 电解质,
正确;
D , 本身不能电离产 由移动的离 ,是 电解质,
.电解质必须是本身能电离产 由移动的离
D 错误;
C
答案选 。
7. NA
设
为阿伏加德罗常数,下列说法正确的是
1.6gO2
和 O3 混合 体中,所含氧原 数 为 0.1NA
1mol/LAl2(SO4)3
溶液中,所含 数 3NA
C. 标准状况下,11.2LCCl4 中所含氯原 数 为 2NA
D. 71gCl2 与 量 NaOH 溶液反应,转移电 数 为 2NA
A
【答案】
【解析】
【详解】 .
1.6g O 0.1mol
(
,
所含
氧
原
)该混合物含有 原 物质的量为
数 为
0.1 NA,A 正确;
(
;
).未给出溶液的体积 B 错误
.标准状况 C 错误
(
;
)C 下,CCl4 不是 体,不能 体摩尔体积计算,
.
71gCl 1mol
(
2
,
则转
)物质的量为
移电 数 为
A
NA D
,
错误;
故选 。
8.
,下列实验现象或结论不正确的是( )
在探究新制饱和氯 成分的实验中
A. 氯 的颜 呈浅 绿 ,说明氯 中含有 Cl2
-
B.
向氯 中滴加硝酸酸化的
AgNO3
溶液,产 沉淀,说明氯 中含有 Cl
C.
向氯 中加
D.
NaHCO3
粉末,有 泡产 ,说明氯 中含有 H
(
+
),溶液颜 变成红 ,说明氯 中含有 HClO
向氯 中滴加紫 蕊
D
【答案】
【解析】
【分析】氯 中存在平衡
Cl2+H2O HCl+HClO
,
氯 为 绿 ,因此氯 中因含有 Cl2 呈浅 绿 ,
溶液中含有
Cl-
,与硝酸银反应 成
AgCl
沉淀;氯 呈酸性,含有
H+
,能与
NaHCO3
反应 成
CO2;
氯 中有
HClO
存在,因此具有漂 性。
A
,不符合题意;
A.
【详解】
B.
氯 中因含有
Cl-
Cl2
呈浅 绿 ,
AgCl
项正确
B
氯 中存在
,与硝酸银反应 成
+
沉淀,
项正确,不符合题意;
C
C. 氯 呈酸性,含有 H ,能与 NaHCO3 反应 成 CO2,
项正确,不符合题意;
+
D. 向氯 中滴加紫 蕊,溶液颜 变成红 ,说明溶液呈酸性,含有 H , 因氯 中有 HClO 存在,
具有漂 性
D
D ,符合题意;
答案选 。
【点睛】本题的难点是确定新制氯 的成分。新制氯 中存在三种分 和四种离 即:
9. 下列实验操作正确,并且与选项中实验 的匹配的是
A.
稀释浓硫酸
C.
收集氯
A
B.
读取液体体积
D. pH
测定饱和氯 的
【答案】
【解析】
【详解】
.稀释浓硫酸时 A 正确
(
;
) (
;
).读取液体体积时 B 错误
(
;
).氯 密度 空 C 错误
(
;
)D ,具有漂 性,不能 pH 试纸测定和氯 的 pH D 错误
.氯 中含有次氯酸 ,
A
故答案选 。
10.
,分别取少量待测液进 下列实验,其中结论正确的是
为检验溶液 的某种离
A.
,再加 溶液,产 了 沉淀,则原溶液中 定含有 量的
先加适量的盐酸将溶液酸化
B.
,加热后产 使湿润的红 蕊试纸变蓝的 体,则该溶液中含有
往某溶液中加 氢氧化钠溶液
C. 洁净的铂丝蘸取溶液进 焰 反应, 焰呈 ,则溶液有,
D. 往某溶液中加 盐酸,产 能使澄清 灰 变浑浊的 体,则该溶液中含有
B
【答案】
【解析】
【详解】
.加 盐酸酸化 A 错误
A ,引 氯离 ,对检验原溶液中的氯离 产 扰,
B ,则该溶液中 定含有 ,
(
;
)
正确;
C
. 光遮挡紫光
D
,检验钾离 ,应透过蓝 钴玻璃 C ;
(
,
错误
)H+
. 、 、 、 均能和 反应 成 体 氧化碳或 氧化硫,则溶液中可能含有
D
或 或 或 ,
B
错误;
故选: 。
NH4Cl
ZnCl2 池内
某同学查阅教材得知
的 固体并回收利 时,进 如图所示实验,下列有关实验的叙述不正确的是
A.
操作④的 的是为验证滤渣中含
B.
操作③盛放滤渣的仪器是蒸发
MnO2
C.
操作②为过滤
D.
,得到的滤液加强碱并微热,会产 刺激性 味的 体
操作①中玻璃棒能加快固体溶解
B
【答案】
【解析】
A
,能作过氧化氢分解的催化剂,加快过氧化氢分解产 氧 的速率,所以
【详解】
. 氧化锰是 固体
A
操作④的 的是验证滤渣中含
MnO2,
B
正确。
;
B
(
,
)错误
.操作③是在坩埚内灼烧滤渣
.操作②为过滤
D
C
(
;
)正确
(
,
)D 正确;
.操作①中玻璃棒起到搅拌加速溶解的作
B
故选: 。
12.
(ClO2)
种 效消毒剂,通过下列反应可制得 ClO2:
N H2 4 2 +
氧化氯
2Na2SO4+
是
对于该反应
确的是
2NaClO3+
a2SO3+
SO =2ClO
↑
NaClO3
H2O
是还原剂
,下列说法正
Na2SO3
被还原
H2SO4
发 D. 1 mol ClO2,转移电 数为 NA
(
氧
化反应
成
)D
【答案】
【解析】
Na2SO3+
+ Na2SO4+
(
,
)O aClO3 Cl
中 中 元素从
5
价降低到
【分析】反应
H2SO4=2ClO2↑ 2
H2 N + +
Na2SO3 S +4
价
+6 ,作还原剂,据此结合氧化还原反应的规律分析解答。
【详解】 .
中 元素从
A
价降低到 价 错误
(
;
)A ClO3 Cl +5
+4 ,作氧化剂,
Na2SO3 S
+4
(
价
)升 到
化, 错误;
. 中 元素从 价
+6 ,被氧 B
C H2SO4 , 错误;
. 中元素化合价没有发 变化 C
.根据分析可知
D 确;
D
D
故选 。
, 成 1 mol ClO2,转移电 数为 NA, 正
13. 种同位素 X 的原 质量数为 A N 个中 ,它与原 组成 HmX 分 。在 a 克 HmX 中
(
含
)某元素的 ,
所含质 的物质的量是
A. B.
C. D.
A
【答案】
【解析】
【详解】某元素的 种同位素 X 的原 质量数为 A
N 个中 ,则质 数为( )
个 HmX 分
(
含
), A-N
,则每
A
故选 。
14.
A-N+m), gH mX 的物质的量为 mol,故含有质 物质的量为 ;
与 属钠的反应,先将钠预热,在钠熔化成 球时撤去热源,
某兴趣 组设计如图所示的装置进 氯
并通 氯 即发 反应 氯 可
),下列叙述不正确的是
A.
钠在氯 中燃烧产 焰
B.
反应产 的 量 烟是氯化钠固体
C.
棉球①的作 是吸收过量氯 防 产 污染
D.
棉球②变蓝 则证明氯 已被碱完全吸收
D
【答案】
【解析】
【分析】
A
,产 量 烟, 焰为 ,故 A 正确;
【详解】
B
.钠在氯 中燃烧 成氯化钠
,产 量 烟, 焰为 ,故 B 正确;
.钠在氯 中燃烧 成氯化钠
C 与碱溶液反应 成氯离 、次氯酸根离 和 ,则浸有碱液的棉球 于吸收有毒的氯 ,防 污
.氯 能
染空 ,故 C 正确;
D —碘化钾溶液的棉球变蓝 ,说明与碱液反应时氯 过量,过量氯 与碘化钾溶液发 置换反
.浸有淀粉
应反 成的碘遇淀粉变蓝 ,故 D 错误;
D
故选
15.
。
下列溶液中 定能 量共存的离 组是
在
Na+ K+
Cl-
A. 在强酸性溶液中:
2+
、
Mg2+
、 、
Cl-
B. 溶液中:Fe 、
Fe3+
、 、
OH- I- K+
Br-
含有 量
的溶液中:
、 、 、
K+ Na+
D. 滴 酚酞变红的溶液中: 、 、 、
D
【答案】
【解析】
A
, 与氢离 反应不能 量共存,故 A 不符合题意;
【详解】 .强酸性溶液中存在 量氢离
B 不存在有 离 , Fe
2+
(
B
)为浅绿 ,故 不符合题意;
. 溶液中
Fe3+ I-
Fe3+
OH- C
. 具有氧化性,
具有还原性,两者能发 氧化还原反应,且
与 能形成氢氧化铁沉淀,故
不符合题意;
D
,该组离 均不与氢氧根离 反应,且彼此也不反应可 量共存,
.滴 酚酞变红的溶液中存在氢氧根离
故 D 符合题意;
D
故选: 。
16. 下列说法正确的是
A.
将 的 溶液加 稀释到
,稀释后溶液中 的物质的量浓度为
B.
溶液中含
,溶液中
C.
配制 稀盐酸需取 浓盐酸
(
),得到溶
D. 将 的 溶液与 的 溶液混合 忽略溶液体积变化
液的物质的量浓度为
C
【答案】
【解析】
A
30 mL 0.5 mol·L-1
Na2SO4
500 mL
Na+
【详解】 .将
的 溶液加 稀释到
,稀释后溶液中
的物质的量浓度为
(
,
)A 错误;
B VL Mg(NO3)2
Mg2+ a g
c(NO )= B
. 溶液中含
,溶液中 ,
错误;
C
.配制
220mL6mol/L
稀盐酸需要 到
250mL
容量瓶,需取 12mol/L 浓盐酸的体积为
(
,
)C 正确;
D 100 mL 1.0 mol·L-1
NaCl
200 mL 1.5 mol·L-1
NaCl ( )
.将 的
溶液与
的 溶液混合 忽略溶液体积变化 ,得到溶
D
液的物质的量浓度为 ,
错误;
C
故选 。
17. :
反应①②分别是从海藻灰和某种矿 中提取碘的主要反应
2H2O I2
① MnSO4+ +
H2O I2
② 3NaHSO4+ +
下列说法正确的是
A. 两个反应中硫元素均被氧化
B.
碘元素在反应①中被氧化、在反应②中被还原
MnO2 I2
>
由①②可得氧化性
I2
,转移电 数之 为 2 5
反应①②中 成等质量的 时 :
B
【答案】
【解析】
A
,锰化合价降低,硫化合价未变,反应②中碘化合价降低,硫化合价升
【详解】 .反应①中碘化合价升
,故 A 错误;
B
,被氧化,碘元素在反应②中化合价降低,被还原,故 B 正
.根据前 分析碘元素在反应①中化合价升
确;
MnO2>
,故 C 错误;
.根据氧化剂的氧化性 于氧化产物的氧化性
I2, I2
D
.反应①中 成
1 个 I2,转移 2 个电 ,反应②中 成 1 个 I2,转移 10 个电 ,因此反应①②中 成等
I2 ,转移电 数之 为 1
5 D
故 错误。
质量的 时 : ,
(
。
)综上所述,答案为 B
18.
25 ,氯 中部分含氯微粒的物质的量浓度随 pH 的变化关系如
已知 的杀菌能 强。 ℃时
图所示。下列叙述正确的是
(
10
第
共
) (
/
) (
21
)
pH
可
pH
试纸测氯 的
pH
随着
C.
增 ,氯 的杀菌能 逐渐增强
:
的氯 中
D. 时,溶液中的含氯微粒主要为 和
D
【答案】
【解析】
【分析】
A
,能漂 pH 试纸,故不能 pH试纸测氯 的 pH A 错误
(
;
)【详解】 .氯 有漂 性 ,
pH 6
. 于
之后,随着 pH增 ,次氯酸的浓度下降、 的浓度增 ,已知 的杀菌能
(
强
,
) ,故氯 的杀菌能 逐渐随之逐渐下降 B
. 由图知
错误;
C
错误
(
;
)C , 的氯 中: ,
D , 时,溶液中 乎没有氯分 、次氯酸分 ,有 量 ,氯 转变为 的反应中,
.由图知
D ;
氯元素化合价升 ,则另有 部分氯元素化合价降低转变为 , 正确
D
答案选 。
19. Cl2O
棕 具有强烈刺激性 味的 体,是 种强氧化剂,易溶于 且会与 反应 成次氯酸,与有
是
机物、还原剂接触或加热时会发 燃烧并爆炸。制取
Cl2O
的装置如图所示。
Cl2
-34.6
; gO+2Cl2=HgCl2+Cl2O
Cl2O
-116
,沸点为 3.8 ,
H
的沸点为 ℃
已知: 的熔点为 ℃ ℃
下列说法不正确的是
A.
装置②、③中盛装的试剂依次是饱和 盐 和浓硫酸
B.
通 燥空 的 的是将 成的
Cl2O
稀释减少爆炸危险
C.
从装置⑤中逸出 体的主要成分是
Cl2O
D.
装置④与⑤之间不 橡 管连接,是为了防 橡 管燃烧和爆炸
C
【答案】
【解析】
【分析】本实验的 的是先制得 燥、纯净的氯 ,再与 HgO 反应制取 Cl2O
Cl2O
最后利 液化法实现
与 Cl2 的分离。
A
【详解】 .利
,
KMnO4 与浓盐酸反应制得氯 中混有 HCl 体和 蒸 ,装置② 饱和 盐 吸收 HCl,
A
(
,
从
制得 燥、纯净
的氯
)装置③ 浓硫酸吸收 蒸 ,
正确;
B , 可将装置内的 Cl2O 不断排出,另 可起稀释作 ,降低 Cl2O 的浓度,减
.通 燥的空
B ;
少爆炸危险, 正确
-34.6
, 液氨
中逸出 体的主
Cl2O
3.8
l
(
,
2
)的沸点为 ℃
降温,可将 Cl2O 液化,则从装置⑤
要成分是
C 不正确;
;
D
C
故选 。
20.
, l2O 与有机物接触会发 燃烧并爆炸,所以装置④与⑤之间不 橡 管连接, 正确
下列说法错误的是
臭氧氧化法处理含氰废 的 艺原理如图所示。
A.
Ⅰ阶段中
1mol NaCN
被氧化需消耗
B.
Ⅱ阶段的反应为
C.
与反应
Ⅰ阶段产 的 在Ⅱ阶段中作为氧化剂参
D. 两个阶段总反应的化学 程式为
C
【答案】
【解析】
【分析】由图可知,Ⅰ阶段发 反应为
NaCN 与 O3 反应 成 NaCNO 和 O2,反应的化学 程式为 NaCN
N2 和 O2,反应的化学 程
+O3=NaCNO+O2,Ⅱ阶段发 的反应为 NaCNO 与 H2O O3 反应 成 NaHCO3、
、
式为 2NaCNO+H2O+3O3=2NaHCO3+N2+3O2,整合可知,两个阶段总反应的化学 程式为 2NaCN
+H2O+5O3=2NaHCO3+N2+5O2
。
A NaCN+O =NaCNO+O 1mol O 1molNaCN
(
3
2
,
反应中
3
氧
化
),Ⅰ阶段反应的化学 程式为
【详解】 .由分析可知
,故 A 正确;
2NaCNO+H O+3O =2NaHCO +N +3O B
(
2
3
3
2
2
,
故
正确
;
),Ⅱ阶段反应的化学 程式为
.由分析可知
O C
(
2
,
故
错误
;
),Ⅰ阶段和Ⅱ阶段中 都为 成物
.由分析可知
D
,两个阶段总反应的化学 程式为 2NaCN+H2O+5O3=2NaHCO3+N2+5O2,故 D 正确;
.由分析可知
C
故选 。
21. 下列是某化学研究性学习 组对某 样成分的检验过程,已知该 样中只可能含有 、 、
, 、 , 、 、 中的若 种离 ,该 组同学取 100 mL 样进 实验:向样品 中先滴加硝酸钡溶液,再滴加 1 mol L 硝酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是
A. 样中 定不存在、 、 ,可能存在
B. 样中 定存在、 和
B
由
C
点到 点变化过程中消耗硝酸的体积为
40 mL
D. 样中 定存在,且
C
【答案】
【解析】
【分析】加 硝酸钡溶液后产 沉淀,再加 硝酸沉淀部分溶解,说明溶液中肯定存在碳酸根离 和硫酸 根离 ,肯定不存在镁离 、铜离 、银离 、钙离 ,根据溶液呈电中性肯定存在钾离 ,氯离 法
判断。
A
,溶液中个肯定存在硫酸根离 ,硫酸银微溶,故肯定不存在银离 ,故 A 错误;
【详解】
B
.根据分析
,氯离 法判断,故 B 错误;
.根据分析
BC
,故碳酸钡的质量为 6.27-2.33=3.94g 求得
. 段加 硝酸后是溶解碳酸钡 ,
,故 C 正确;
BC
0.02mol,剩余
. 段溶解钡碳酸钡的物质的量为 则碳酸根的物质的量也为
固体为硫酸钡其物质的量为 则硫酸根的物质的量为
0.01mol,溶液显电中性则溶液
中含有钾离 其浓度 ,
故 D 错误;
C
故选 。
、 (
58 )
22.
1
填空题 共 分
按要求填空:
:
( )如图是常 于混合物的分离和提纯的装置
a
①仪器
的名称是
1
。
( 118 )
( 77.1 )
(
,
仪
),还缺少的仪器是
②利 图
装置分离 酸 沸点
℃ 和 酸 酯 沸点
”)
℃ 的混合物
器 中冷凝 应该从
填 ” “下
进。
③从碘的饱和 溶液中提取碘应选择图
(
( )
填序号 装置
)
,该实验要 到萃取剂,下列关于所加萃
取剂的说法不正确的是 填字 。
A 不与碘反应 B.碘在该萃取剂中的溶解度 在 中的溶解度
.该萃取剂
C 与 不互溶 D
该萃取剂的密度必须 的密度
.该萃取剂
2
.
丙三种元素,甲元素 M 层的电 数是其 K 层的电 数的, 元素原 核内 中 ,丙
( )有甲、 、
8 个质 。
元素原 核内有
①写出甲、 、丙三种元素组成的化合物在 中的电离 程式 。
②画出甲元素 离 结构示意图 。
3 V mL
,取 mL 溶液稀释到 4V mL,此时溶液中物质的量浓度 a mol/L
( )从 溶液中 ,
则原溶液中含 的物质的量浓度是 。
22.4 L“
( ) 造空 氧
) 于减轻某些病痛或供深 潜 员,标准状况下,
造空
的质量是
可
(
。
),其中氧
( ) 作催化剂
(TOC)
在酸性条件下, 的加
5
TOC
,在废 中加 可以去除废 中的有机物 。
,则 的浓度为
TOC
中 去除效果最好。
量对
的去除效果如图所示
mol L 时,废
22.
【答案】
. .
① 冷凝管 ②
温度计 . 下 . 2 . D
(
③
④
) (
⑤
)23. . .
① ②
24.
25. 1 4 26.
:
【解析】
2
丙三种元素,甲元素 M 层的电 数是其 K 层的电 数的,则甲为 Na 元素;
【分析】( )有甲、 、
元素原 核内 中 ,则 为 H 元素;丙元素原 核内有 8 个质 ,则丙为 O 元素;
1
【 问
详解】
a ;
①根据图示,仪器
的名称是冷凝管
1
( 118 )
( 77.1 )
,需要测蒸汽的
②图示为蒸馏装置,利 图
装置分离 酸 沸点
℃ 和 酸 酯 沸点
℃ 的混合物
温度,还缺少的仪器是温度计;为提 冷凝效果,冷凝 应“ 低进 出” ,仪器 a 中冷凝 应该从下 进;
2
③ 萃取法从碘的饱和 溶液中提取碘,应选择图
装置;
.根据萃取剂 选取原则
B
A
(
;
)正确
, 正确;
.该萃取剂
D
C
(
;
)正确
, 错误;
.萃取剂的密度 的密度 、 均可以 D
答案选
【 问
D
;
2
详解】
①甲、 、丙三种元素组成的化合物: ,在 中的电离 程式: ;
(
②
)Na 元素的离 结构示意图: ;
3
【 问
详解】
稀释过程中溶质的浓度不变,从 V mL 溶液中,取 mL 溶液稀释到 4V mL,此时溶液中物
a mol/L : ;
质的量浓度 ,则原溶液中含 的物质的量浓度
4
【 问
详解】
22.4 L“ ”
9.6 g
xmol,氦 物质的量 ymol,则
标准状况下,
造空 的质量是
,设其中氧 物质的量
, ,解得: , ,相同状况下,体积 等于物质的量之 ,则氧 与
1 4
氦 体积 为: : ;
5
【 问 详解】
TOC
40mg/L : ;
如图,
去除率最好时双氧 浓度为
,此时
23.
I
回答下列问题:
84
两种消毒剂。
.双氧 和
消毒液是 活中常 的
)
( )某同学设计如
(
序号 。
填
序号 实验 实验现象
5%
1 向 溶液中滴加酸性 .溶液紫 褪去 b 泡产 a ; .有 量
溶液
5%
2 向 溶液中滴加淀粉碘化 c .溶液变蓝
钾溶液
2 ,由于 作 员将 84 消毒液与双氧 两种消毒剂混 ,导致游泳池藻类快速 ,
( )某届奥运会期间
池 变绿。 种原因可能是 NaClO 与反应产 促进藻类快速 。
NaClO
( “>”
“<”)
NaClO
该反应说明氧化性:
填 或 ,当参加反应的
和 的物质的量之
1∶1
为
时,该反应的还原产物为 。
( )(
-2 )
种新型的净 剂,可以通过下述反应制取:
Ⅱ. 铁酸钠 其中氧元素是 价 是
3
( )① 双线桥法在化学 程式中标出电 转移的情况。
②请完成 程式的配平:
Ⅲ.汽 剧烈碰撞时,安全 囊中发 反应 。
4 1.75 mol,则转移的电 数为 ( 为阿伏加德罗常数的值 ,被
( )若氧化产物 还原产物多 _ )
N
氧化的 原 的物质的量为 。
1 1 ( ) ① > ② NaCl
【答案】( ) 2 . .
3 . .
(
(
)) ① ②
( ) ① . 3.75mol
【解析】
1
【 问
1
详解】
,体现还原性;实验 2 过氧化氢将碘离 氧化为
实验 ,过氧化氢将酸性 锰酸钾还原 身被氧化 成氧
1
碘单质,体现氧化性,故答案为: ;
2
【 问
详解】
-1
0 ,则次氯酸钠做氧化剂,可以得出次氯酸钠的氧化性强
过氧化氢中的氧元素由
价被氧化为
价做还原剂
于过氧化氢;由 可知当参加反应的 NaClO 和的物质的量之 为
NaCl;
1∶1
时,该反应的还原产物为 NaCl;故答案为:>、
3
【 问
详解】
+3 +6 ,
在 反应中,铁元素从 价被氧化到 价
+1
氯元素由
-1
价被还原为
价,则双线桥为 ,根据
得失电 守恒可以配平: ,故
答案为: 、
【 问
;
4
详解】
1mol
10molNaN3
和
2molKNO3
参加反应,则 成的 16molN2 中有 15mol N2 由 NaN3 被氧化 来是氧化产物,
N2 KNO3
由
被还原 来是还原产物,氧化产 物 还原产物多 14mol,此时转移电 数为 10NA,则有
,可求得
(
、
:
);故答案为 1.25NA
24. [A
3.75mol
、 。
:
某化学兴趣 组 如图装置制取并探究氯 的性质。 装置中发 反应的化学 程式
1 A a
( ) 装置中 仪器的名称是 。
2 ( “ ” “ ”)
( )制取氯 反应中 所起的作 是 填 氧化剂 或 还原剂 。
( )实验进
( “B” C”)
或 装置中有 布条褪
(
,
其褪 原因是
)3 段时间后,可观察到 填 “
。
4 D ,可观察到溶液颜 变为
(“ ),写出相关反应的化学
( )当氯 进
装置后
_ ” “ ”
(
红 或
蓝
)填
程式 。
5 E
( ) 装置中发 的反应 程式是 。
( )实验室常
10 mol/L
若已知盐酸浓度 于 时
6 与浓盐酸制氯 ,写出反应 程式 。
则不易被 氧化,现 浓度为 12 mol/L 的浓盐酸与 8.7 g 反应,要使 全部反应掉 成最
?
多氯 ,则 少加 这种盐酸 毫升
1
【答案】( )圆底烧瓶
2 ( ) ① C ②
4 . .
氯 和 反应 成的次氯酸有漂 性
( ) ① 蓝 ②
5
( )
6 . . 200
( ) ① ②
【解析】
1
【 问
a
详解】
,答案为:圆底烧瓶;
指向的是圆底烧瓶
2
【 问
详解】
Mn
在此反应中
+7
的化合价从
+2
降低到 价被
还原, 氧化锰做氧化剂,答案为:氧化剂;
3
【 问
详解】
C
湿润氯 有漂 性,原因是氯 和 反应 成的次氯酸有强氧化性,能漂 ,故答案为: 、氯 和 反应
成的次氯酸有漂 性;
4
【 问 详解】
碘离 被氯 氧化为碘单质,淀粉遇碘变蓝,故答案为:蓝 、 ;
5
【 问 详解】
氯 和氢氧化钠反应 成次氯酸钠、氯化钠和 ,答案为: ;
6
【 问 详解】
氧化锰做氧化剂,将 HCl 氧化 成氯 , 身被还原为氯化锰, 程式为:
;盐酸浓度 于 10 mol/L 时则不易被氧化,现 浓度
12 mol/L
为
的浓盐酸与 8.7 g 反应,相当于 氧化锰和 2mol/L 的盐酸完全反应:
求得: ,故答案为:
200
、 。
25. 下:
某化 出 的漂 粉说明书如
(
使 说明
【主要成份】
次氯
酸钙、
氯
化钙
次氯
酸钙
的
质量分数为
(
35%)
2
3g
1000g
,
将病 具浸泡其中
5
10
分
【 途 量】取漂
粉
,
,
配成溶液
钟。
如需要
,
浓度可提
,
时间可延 。
【注意事项】密封避光保存于阴凉处
,
随配随
,
有
腐
蚀性
,
少
与
接触。
)
( )漂 粉的有效成分为 , 。
2 480 mL
,要使 浓度为 0.1 mol/L
则需称量漂 粉质量为
( )将漂 粉溶于 配成 溶液 ,
)
g ( 位 数
。 保留
( )配制
3 上述溶液玻璃仪器除了要使 烧杯、玻璃棒、胶头滴管外还需要使 的仪器有 。
( )在配制过程中
( “ “
偏 偏 或
4
“ ”)?
,下列实验操作对所配制的 溶液的物质的量浓度有何影响 填 ” ”
影响
a :
.定容时俯视容量瓶刻度线 _ 。
.定容后经振荡、摇匀、静置
b ,发现液 下降,再加适量的蒸馏 : 。
5 HCl
U ,可制得少量漂 粉 该反应为放热反应 ,温
( )将含有少量
的氯 通 盛有潮湿消 灰的
( )
形管中
度较 时氯 与消 灰反应: ,为避免此副反应的发
,可采取的措施是 ;
(m)与反应时间
的关系曲线
)
和 的反应 。
①如图为反应后溶液中 、 离 的物质的量
a
.图中曲线Ⅰ表示 离 的物质的量随反应时间变化的关系。
b mol
.所 灰乳中含有 的物质的量为 。
c
.另取
份含有等物质的量 的 灰乳,以较 的速率通 量氯 ,反应后测得产物中 的
0.39 mol,则产物中
物质的量为
。
( )
②试判断另 个副反应是 写出此反应的化学 程式 。
1 . .
【答案】( ) ① ②
( ) 3
500mL
容量瓶
)
4 . .
( ) ① 偏 ② 偏
5 . U
,降低 U 形管内的温度 ②
0.25
③ ④ ⑤
( ) ① 将
形管放在冰 浴中
. . . .
【解析】
1
【 问 详解】
漂 粉的有效成分: ; 业上制取漂 粉的化学 程式:
2
【 问
详解】
480mL
;
,需 500mL 容量瓶进 溶液配制,则需称量漂 粉质量:
实验室 容量瓶
;
3
【 问
详解】
500mL ;
配制上述溶液玻璃仪器除了要使 烧杯、玻璃棒、胶头滴管外还需要使 的仪器有:
4
容量瓶
【 问
a
详解】
,导致溶液体积偏 ,浓度偏 ;
.定容时俯视容量瓶刻度线
b
,发现液 下降,再加适量的蒸馏 ,导致溶液体积偏 ,浓度偏 ;
.定容后经振荡、摇匀、静置
5
【 问 详解】
温度较 时氯 与消 灰反应 成了 Ca(ClO3)2,为避免此副反应的发 ,可采取的措施:将 U 形管放在冰
浴中,降低 U 形管内的温度;
①
a , 在 温时才能 成,刚开始反应时,温度较低,氯 和氢氧化钙反应
. 在低温时即可 成
成氯化钙和次氯酸钙,故曲线Ⅰ表示 ;
b
,设氯离 的物质的量为 n 则
.根据氧化还原反应中得失电 数相等计算氯离 的物质的量 ,
,含氯元素的物质的量:
,氯化钙、次氯酸钙、氯酸钙中钙离 和含氯离 的个数 为 1 2
,所以所取 灰乳中含有 Ca(OH)2 的物质的量为 0.25mol;
.反应后产物中 的物质的量为
:
Ca(ClO)2 Ca
和
(ClO3)2
(
和
为
)物质的量之 0.055mol, 氯原 转变为 ,得电 总量为 0.39mol,设 Ca(ClO)2 和 Ca
(ClO3)2
分别为
xmol
(
、
)ymol,则有 、 ,联 解得: 、 ,
则产物中 ;
②由于盐酸具有挥发性, 成的氯 中混有
。
HCl,所以另 个副反应是:
同课章节目录
