4.2电解池(含解析) 限时训练 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2电解池(含解析) 限时训练 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 13:42:55 | ||
图片预览

文档简介
选择性必修一第四章4.2电解池限时训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关物质和反应的叙述中,正确的是
A.反应的
B.为了增强溶液的氧化性,可选用浓盐酸进行酸化
C.电解饱和NaCl溶液制取氯气时,可用铁作阳极、石墨作阴极
D.浓盐酸与足量共热反应,可生成
2.欲在铁制品上镀一层一定厚度的铜,以下方案设计正确的是
A.铜作阳极,镀件作阴极,溶液中含有铜离子
B.铂作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜作阴极,镀件作阳极,溶液中含有亚铁离子
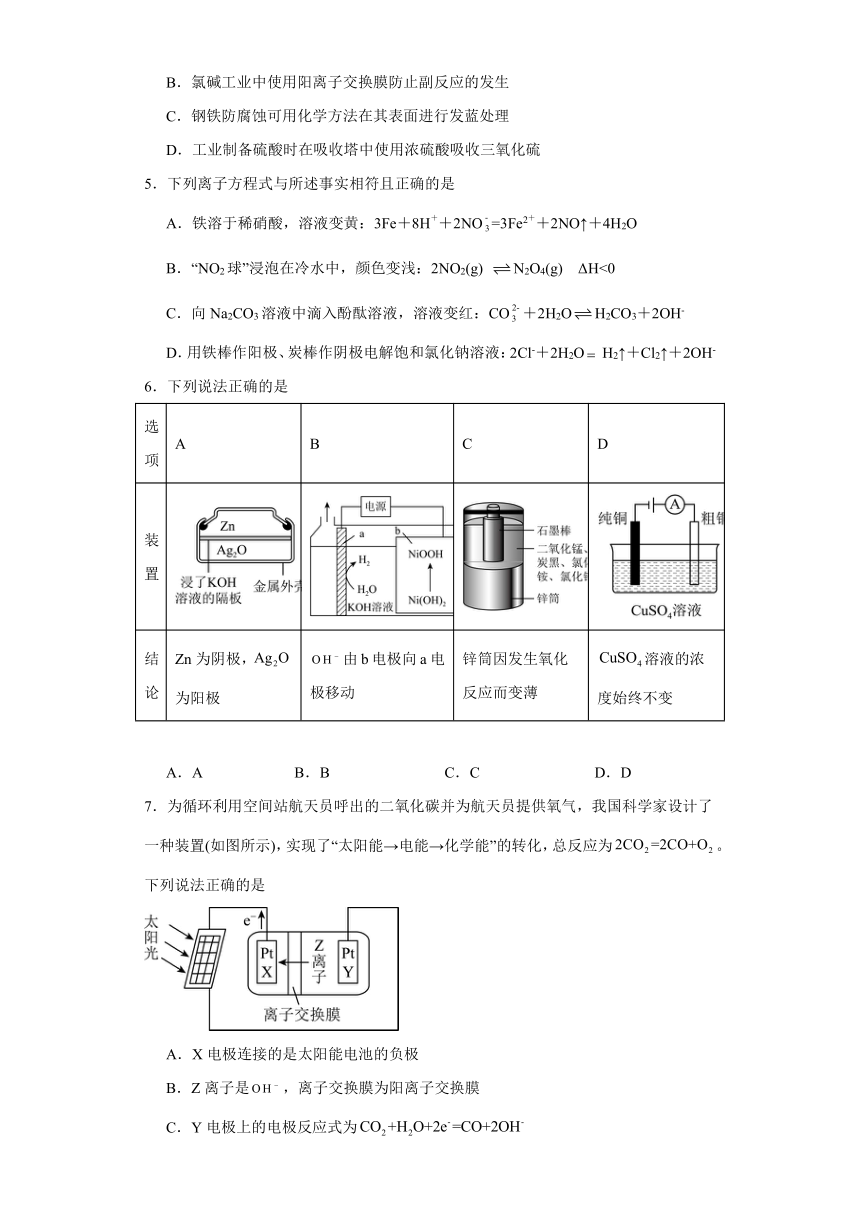
3.关于下列装置说法正确的是( )
A.装置①中,一段时间后CuSO4浓度增大
B.装置②中滴入酚酞,a极附近变红
C.用装置③精炼铜时,c极为粗铜
D.装置④中发生吸氧腐蚀
4.下列关于工业生产说法不正确的是
A.工业上用电解熔融氧化物的方法制金属镁和铝
B.氯碱工业中使用阳离子交换膜防止副反应的发生
C.钢铁防腐蚀可用化学方法在其表面进行发蓝处理
D.工业制备硫酸时在吸收塔中使用浓硫酸吸收三氧化硫
5.下列离子方程式与所述事实相符且正确的是
A.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) N2O4(g) ΔH<0
C.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO+2H2OH2CO3+2OH-
D.用铁棒作阳极、炭棒作阴极电解饱和氯化钠溶液:2Cl-+2H2OH2↑+Cl2↑+2OH-
6.下列说法正确的是
选项 A B C D
装置
结论 Zn为阴极,为阳极 由b电极向a电极移动 锌筒因发生氧化反应而变薄 溶液的浓度始终不变
A.A B.B C.C D.D
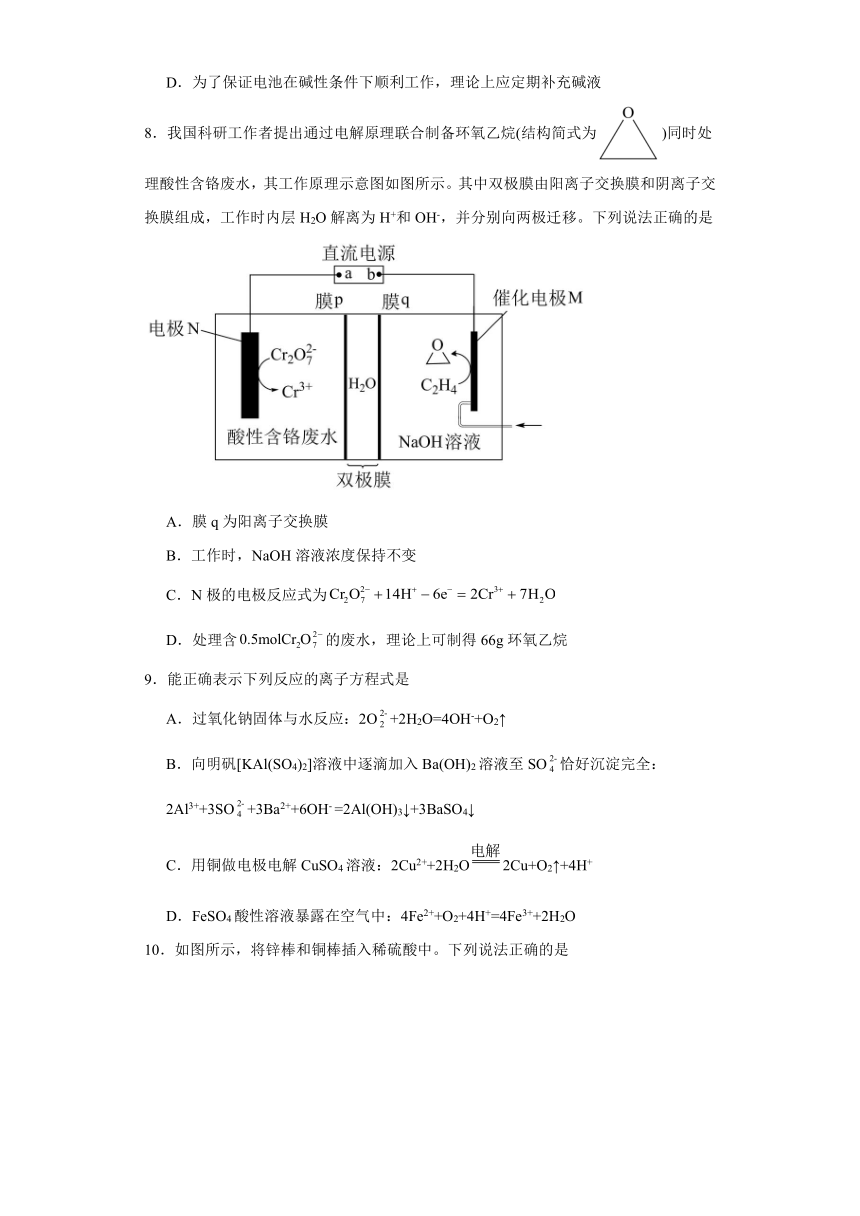
7.为循环利用空间站航天员呼出的二氧化碳并为航天员提供氧气,我国科学家设计了一种装置(如图所示),实现了“太阳能→电能→化学能”的转化,总反应为。下列说法正确的是
A.X电极连接的是太阳能电池的负极
B.Z离子是,离子交换膜为阳离子交换膜
C.Y电极上的电极反应式为
D.为了保证电池在碱性条件下顺利工作,理论上应定期补充碱液
8.我国科研工作者提出通过电解原理联合制备环氧乙烷(结构简式为)同时处理酸性含铬废水,其工作原理示意图如图所示。其中双极膜由阳离子交换膜和阴离子交换膜组成,工作时内层H2O解离为H+和OH-,并分别向两极迁移。下列说法正确的是
A.膜q为阳离子交换膜
B.工作时,NaOH溶液浓度保持不变
C.N极的电极反应式为
D.处理含的废水,理论上可制得66g环氧乙烷
9.能正确表示下列反应的离子方程式是
A.过氧化钠固体与水反应:2O+2H2O=4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO恰好沉淀完全:2Al3++3SO+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
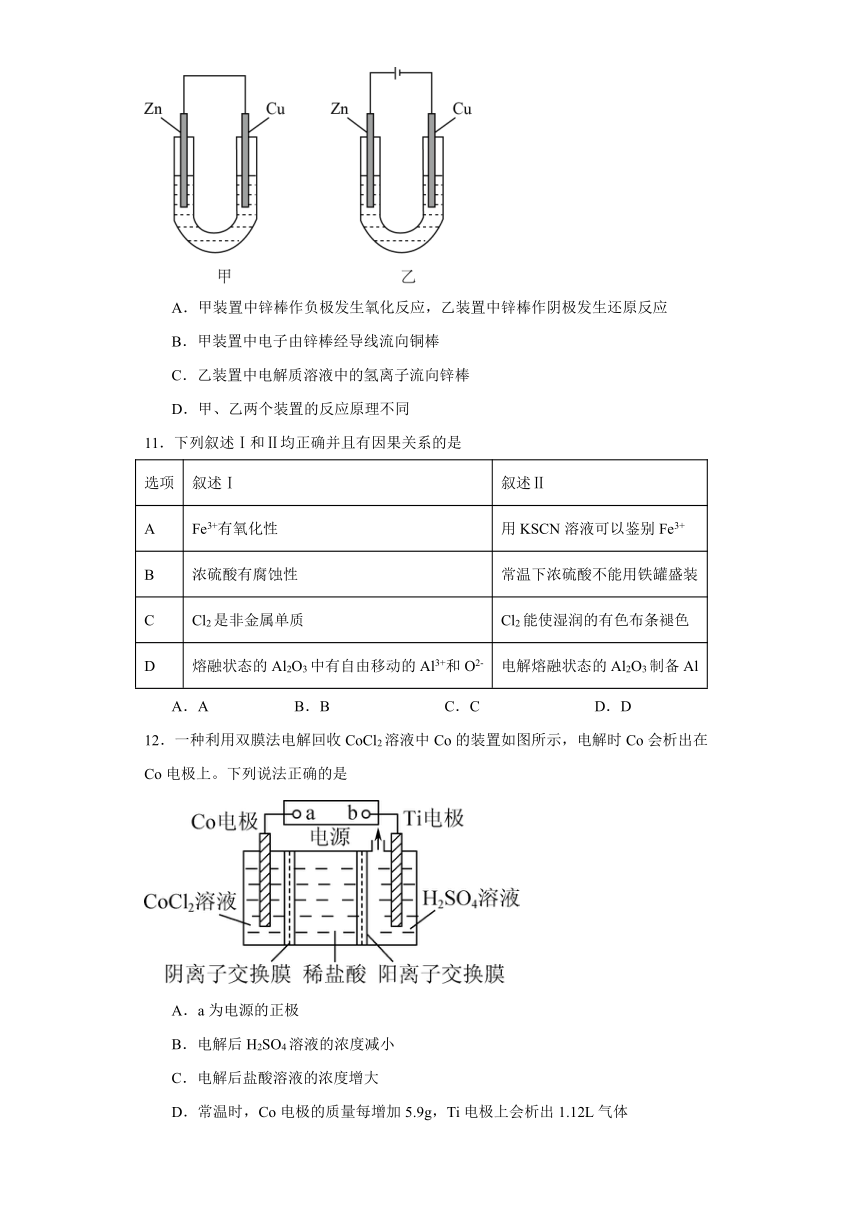
10.如图所示,将锌棒和铜棒插入稀硫酸中。下列说法正确的是
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应
B.甲装置中电子由锌棒经导线流向铜棒
C.乙装置中电解质溶液中的氢离子流向锌棒
D.甲、乙两个装置的反应原理不同
11.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 叙述Ⅰ 叙述Ⅱ
A Fe3+有氧化性 用KSCN溶液可以鉴别Fe3+
B 浓硫酸有腐蚀性 常温下浓硫酸不能用铁罐盛装
C Cl2是非金属单质 Cl2能使湿润的有色布条褪色
D 熔融状态的Al2O3中有自由移动的Al3+和O2- 电解熔融状态的Al2O3制备Al
A.A B.B C.C D.D
12.一种利用双膜法电解回收CoCl2溶液中Co的装置如图所示,电解时Co会析出在Co电极上。下列说法正确的是
A.a为电源的正极
B.电解后H2SO4溶液的浓度减小
C.电解后盐酸溶液的浓度增大
D.常温时,Co电极的质量每增加5.9g,Ti电极上会析出1.12L气体
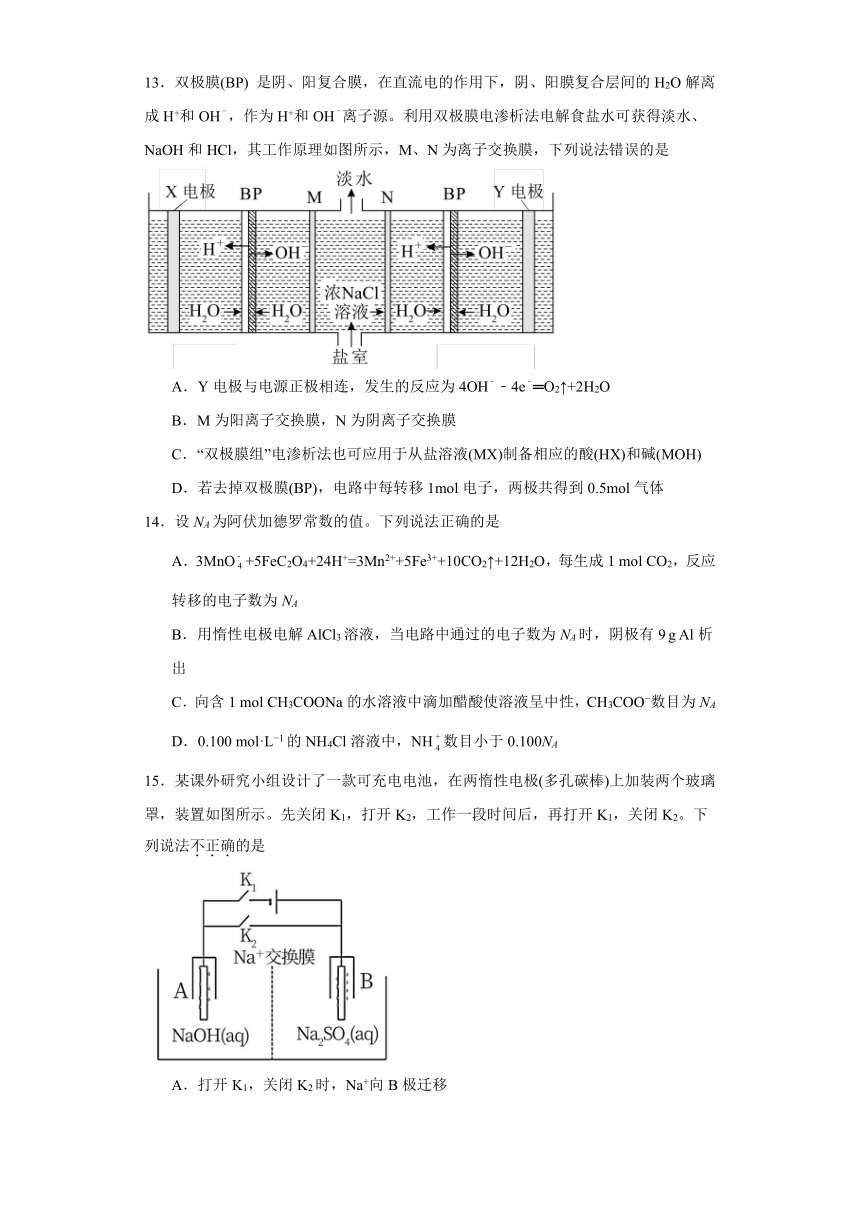
13.双极膜(BP) 是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH﹣,作为H+和OH﹣离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜,下列说法错误的是
A.Y电极与电源正极相连,发生的反应为4OH﹣﹣4e﹣═O2↑+2H2O
B.M为阳离子交换膜,N为阴离子交换膜
C.“双极膜组”电渗析法也可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH)
D.若去掉双极膜(BP),电路中每转移1mol电子,两极共得到0.5mol气体
14.设NA为阿伏加德罗常数的值。下列说法正确的是
A.3MnO+5FeC2O4+24H+=3Mn2++5Fe3++10CO2↑+12H2O,每生成1 mol CO2,反应转移的电子数为NA
B.用惰性电极电解AlCl3溶液,当电路中通过的电子数为NA时,阴极有9 g Al析出
C.向含1 mol CH3COONa的水溶液中滴加醋酸使溶液呈中性,CH3COO 数目为NA
D.0.100 mol·L 1的NH4Cl溶液中,NH数目小于0.100NA
15.某课外研究小组设计了一款可充电电池,在两惰性电极(多孔碳棒)上加装两个玻璃罩,装置如图所示。先关闭K1,打开K2,工作一段时间后,再打开K1,关闭K2。下列说法不正确的是
A.打开K1,关闭K2时,Na+向B极迁移
B.该装置电解过程总反应方程式为:2H2O2H2+O2
C.电极A发生还原反应过程中,A区域碱性增强
D.关闭K1,打开K2,转移2mol电子,左池增重44g
16.下列说法正确的是
A.NO2溶于水生成HNO3,则NO2是HNO3的酸酐
B.高温条件下,铁粉和水蒸气反应生成Fe3O4
C.SiO2不溶于水,不能以SiO2为原料制备H2SiO3
D.电解精炼铜时,粗铜连接电源负极
17.根据如图回答,下列说法不正确的是
A.此装置用于铁表面镀铜时,a为铁
B.此装置用于电镀铜时,硫酸铜溶液的浓度不变
C.燃料电池中正极反应为1/2O2+2e-+2H+===H2O
D.若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
18.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:据此反应式判断,下列叙述中不正确的是
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,正极的电极反应为:
C.电池充电时,阳极周围溶液的的pH不断减小
D.电池充电时,阴极的电极反应为:
二、填空题
19.如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuSO4溶液。
(1)A、B、C三个装置中属于原电池的是 (填字母,下同),属于电解池的是 。
(2)A池中Cu电极上发生的是 (填“氧化”或“还原”)反应。
(3)B池中C是 极,Pt极发生的反应的电极反应式为 。
(4)C池反应过程中,CuSO4溶液的物质的量浓度 (填“变大”“变小”或“不变”)
20.工业废气、汽车尾气排放出的 SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g)2NO2(g) △ H = 113.0kJmol 1
2SO2(g) + O2(g)2SO3(g) △ H = 196.6kJmol 1
SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为 .
②随温度升高,该反应化学平衡常数变化趋势是 .
(2)提高2SO2(g) + O2(g)2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是 .②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2的转化率提高的是 (填字母).
a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 .
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 .
21.金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。
(1)铜和铬构成的原电池装置如图1所示,其中盛有稀硫酸的烧杯中出现的现象为 。盐桥中装的是琼脂-饱和KCl溶液,下列关于该原电池的说法正确的是 (填序号)
A.盐桥的作用是使整个装置构成通路并保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以盛装琼脂-饱和KCl溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左烧杯中,2molK+进入右烧杯中
C.在原电池反应中H+得电子发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥转移到左烧杯中
(2)铜和铬构成的另一原电池装置如图2所示,铜电极上不再有图1装置中铜电极上出现的现象,铬电极上产生大量气泡,且气体遇空气呈红棕色。写出该原电池正极的电极反应式: 。
(3))CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr(Ⅲ)常见的处理方法是电解法。
将含Cr2O的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极生成的Fe2+和Cr2O发生反应,其离子方程式为 。阴极上Cr2O、H+、Fe3+都可能放电。若Cr2O放电,则阴极的电极反应式为 。
试卷第1页,共3页
参考答案:
1.A
【详解】A.自发需,该反应为熵减的自发反应,则,A正确;
B.酸性条件下,高锰酸钾会和氯离子反应生成氯气,B错误;
C.铁为活泼金属,用铁作阳极,阳极铁会放电导致阳极溶解,C错误;
D.浓盐酸中HCl的物质的量为0.6mol,随着反应进行,盐酸浓度减小,反应停止,得到Cl2的物质的量小于0.15mol,D错误;
故选A。
2.A
【详解】电镀原理是镀层金属作阳极发生氧化反应,镀件作阴极镀层金属阳离子在镀件发生还原反应,含有镀层金属阳离子的电解质溶液作电镀液,综上分析A符合题意,故选A。
答案选A
3.B
【详解】A. 装置①是原电池,溶液中SO42 不参加反应,所以放电过程中硫酸根离子浓度不变,铜电极上,铜离子得到电子变为铜单质,铜离子数量减少,因此CuSO4浓度减小,故A错误;
B. 电解时,b是阳极、a是阴极,阳极上生成氯气、阴极上生成氢气,且阴极附近有NaOH生成,溶液呈碱性,所以a电极附近溶液呈红色,故B正确;
C. 电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以d为粗铜,故C错误;
D.酸性条件下,锌发生析氢腐蚀,弱酸性或中性条件下,锌发生吸氧腐蚀,该溶液呈强酸性,所以应该发生析氢腐蚀,故D错误;
答案选B。
【点睛】电化学腐蚀中,强酸性条件下,发生析氢腐蚀,弱酸性或中性条件下,发生吸氧腐蚀。
4.A
【详解】A.工业上用电解熔融制金属镁:,A错误;
B.氯碱工业中使用阳离子交换膜(只允许阳离子通过,不允许阴离子和气体通过)可以防止阴极产生的氢氧化钠和阳极产生的氯气发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O,B正确;
C.用化学方法在钢铁部件表面进行“发蓝”处理是一种普遍采用的金属防护方法,C正确;
D.工业制备硫酸时在吸收塔中使用98.3%的浓硫酸吸收三氧化硫,防止形成酸雾,D正确;
故选A。
5.B
【详解】铁溶于稀硝酸,溶液变黄,说明生成了三价铁离子,故正确的离子方程式为:
Fe+4H++NO=Fe3++NO↑+2H2O,A错误;
B.“NO2球”浸泡在冷水中,颜色变浅,说明二氧化氮浓度下降,该反应 2NO2(g) N2O4(g)的化学平衡正向移动,故ΔH<0,B正确;
C.碳酸根的水解分步进行,CO+H2O+OH-,+H2O H2CO3+OH-,C错误;
D.用铁棒作阳极,铁失去电子,故正确的电解方程式为:
Fe+2H2O H2↑+Fe(OH)2,D错误;
故本题选B。
6.C
【详解】A.该装置为原电池,Zn的化合价由0→+2价,化合价升高,Zn为负极,中Ag化合价由+1→0价,为正极,A错误;
B.该装置为电解池,a极由H2O→H2,发生氧化反应,为阳极,阳极带负电,会向b极移动,B错误;
C.该装置为锌锰干电池,锌筒为负极,发生氧化反应被消耗,故变薄,C正确;
D.该装置为电解池,精炼铜,阳极泥中含有铁、锌杂质会将硫酸铜中的铜置换,故溶液的浓会改变,D;
答案选C。
7.C
【分析】根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,Y电极(阴极)上得电子生成CO。
【详解】A.根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,选项A错误;
B.根据电池总反应可知Y电极(阴极)上得电子生成CO,电极反应式为,Y电极生成的通过阴离子交换膜向X电极迁移,选项B错误;
C.根据电池总反应可知Y电极(阴极)上得电子生成CO,电极反应式为,选项C正确;
D.X电极的电极反应式为,所以理论上不需要补充碱液,选项D错误;
答案选C。
8.D
【分析】该原理为电解池原理,电极N发生转化为的反应,铬元素由+6→+3价,得电子化合价降低,为还原反应,电极N为阴极,则催化电极M为阳极。
【详解】A.催化电极M为阳极,该极区电解质为NaOH溶液,双极膜内层H2O解离产生的OH-移向阳极,膜q为阴离子交换膜,A错误;
B.催化电极M的电极反应式为,每2mol电子转移有2mol OH-移向该电极区,但反应中有水生成,NaOH溶液浓度降低,B错误;
C.N极的电极反应式应为,C错误;
D.由电极M的电极反应式和N极的电极反应式,可知参加反应,生成3mol,处理含的废水,理论上可制得1.5mol环氧乙烷,质量为,D正确;
答案选D。
9.D
【详解】A.过氧化钠固体与水反应生成氢氧化钠和氧气,过氧化钠为固体不能拆开,正确的离子方程式为: 2Na2O2+2H2O=4Na++4OH-+O2↑,故A错误;
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO-恰好沉淀完全,氢氧化钡提供的氢氧根离子和铝离子完全反应生成偏铝酸根离子,正确的离子方程式为:Al3++2SO+2Ba2++4OH-=+2BaSO4↓+2H2O,故B错误;
C.用铜做电极电解CuSO4溶液,阳极铜放电生成铜离子,阴极铜离子放电生成铜单质,电解的实质为电解精炼铜,故C错误;
D.硫酸亚铁酸性溶液暴露在空气中,亚铁离子容易被空气中氧气氧化成铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故D正确;
故选D。
10.B
【分析】甲装置是原电池,锌棒作负极失去电子发生氧化反应,铜棒作正极发生还原反应;乙装置中有直流电源是电解池,锌棒与电源的正极相连,作阳极发生氧化反应,铜棒与电源的负极相连,作阴极发生还原反应,据此答题。
【详解】A.乙装置是电解池,锌棒与电源的正极相连,作阳极发生氧化反应,故A项错误;
B.甲装置中锌棒作负极失去电子,电子经过导线流向铜棒,故B正确;
C.乙装置中电解质溶液中的氢离子向阴极铜棒移动,故C错误;
D.甲、乙两装置中对应的氧化还原反应均为,反应原理相同,故D错误。
故答案选B。
11.D
【详解】A.用KSCN溶液可以鉴别Fe3+是因为两者反应生成血红色的络合物,与Fe3+的氧化性无关,A错误;
B.常温下浓硫酸能用铁罐盛装,原因是浓硫酸使铁钝化,B错误;
C.Cl2能使湿润的有色布条褪色,是因为氯气与水反应生成了HClO,与氯气是非金属单质无关,C错误;
D.熔融状态的Al2O3中有自由移动的Al3+和O2-,可通过电解熔融状态的Al2O3制备Al,D正确;
故选D。
12.C
【分析】电解时CoCl2中Co2+会析出在Co电极上,因此Co电极上Co2+发生还原反应,则电源的a为负极,b为正极,阳极上水电离的OH-发生氧化反应生成O2。
【详解】A.由上述分析可知,a为电源的负极,故A错误;
B.电解过程中,阳极区的水被消耗,溶液中H+穿过阳离子交换膜进入稀盐酸溶液中,不参加反应,根据电荷守恒可知,n(H2SO4)不变,V水减小,因此电解后H2SO4溶液的浓度增大,故B错误;
C.电解过程中,阴极区的Cl-穿过阴离子交换膜进入稀盐酸中,阳极区中H+穿过阳离子交换膜进入稀盐酸溶液中,因此电解后盐酸溶液的浓度增大,故C正确;
D.5.9g Co的物质的量为=0.1mol,得到0.2mol电子,阳极上电极反应为2H2O-4e-=4H++O2↑,根据转移电子守恒可知,阳极上生成0.05mol O2,但常温常压下的气体摩尔体积并不等于22.4L/mol,因此Ti电极上析出的O2体积不等于1.12L,故D错误;
故答案为C。
13.D
【详解】A.根据装置图中H+、OH﹣移动方向可知,X电极为电解池的阴极,Y电极为阳极,阳极与电源正极相连,发生的反应为4OH﹣﹣4e﹣═O2↑+2H2O,故A正确;
B.电解时,溶液中的阳离子向阴极移动,阴离子向阳极移动,Na+经过M离子交换膜移向左室,与BP双极膜中转移过来的OH﹣结合生成NaOH,所以M膜为阳离子交换膜,盐室中Cl﹣经过N离子交换膜移向右室,与BP双极膜中转移过来的H+结合生成HCl,所以N膜为阴离子交换膜,故B正确;
C.“双极膜组”电渗析法电解食盐水可获得NaOH和HCl,则该法可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH),故C正确;
D.若去掉双极膜(BP),则为电解食盐水装置,反应为2H2O+2Cl﹣Cl2↑+H2↑+2OH﹣,电路中每转移1mol电子,生成0.5mol氢气和0.5mol氯气,两极共得到1mol气体,故D错误;
选D。
14.C
【详解】A.在该反应中每反应产生10 mol CO2气体,转移15 mol电子,则生成1 mol CO2,反应转移的电子数为1.5NA,A错误;
B.离子放电能力:H+>Al3+,用惰性电极电解AlCl3溶液时,阴极上溶液中的H+得到电子变为H2,不会产生Al单质,B错误;
C.在CH3COONa溶液中存在电荷守恒:c(CH3COO )+c(OH-)=c(H+)+c(Na+)。由于溶液显中性,c(OH-)=c(H+),所以当溶液中含1 mol CH3COONa时,CH3COO 数目为NA,C正确;
D.只有物质浓度,缺少溶液体积,不能计算微粒数目,D错误;
故合理选项是C。
15.B
【详解】A.打开K1,关闭K2时,形成氢氧燃料电池,A极是充满氢气负极,B极是充满氧气的正极,电解质里的阳离子向电池的阳极移动,即 Na+向B极迁移,A项正确;
B.该装置电解过程总反应方程式为:,选项中漏写了气体符号,B项错误;
C.电极A发生还原反应过程中,反应的电极方程式为:2H2O+2e-=2OH-+H2↑,即A区域碱性增强,C项正确;
D.关闭K1,打开K2,形成电解池,A极阴极,B极是阳极,Na+向A极移动,A极电极方程式为:2H2O+2e-=2OH-+H2↑,当转移2mol电子时,Na+也转移了2mol,即增重的质量为46g,但同时有1mol氢气产生,即2g氢气,所以左池增重44g,D项正确;
答案选B。
16.B
【详解】A.溶于水生成和,不是酸酐,的酸酐是,A错误;
B.和水蒸气在高温条件下反应生成和,B正确;
C.溶于溶液,再加入酸可得,C错误;
D.电解精炼铜时,粗铜连接电源正极作电解池阳极,D错误。
故选B。
17.A
【详解】氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,故b极为阴极,a极为阳极.
A.铁表面镀铜时,金属铜必须作阳极,金属铁作阴极,所以a为金属铜,故A错误;
B.此装置用于电镀铜时,金属铜必须作阳极,电解前后硫酸铜溶液的浓度不变,故B正确;
C.氢氧燃料电池中,通入氧气的电极一定是正极,在酸性环境下,氧气放电的反应为: O2+2H++2e﹣=H2O,故C正确;
D.电解精炼铜时,粗铜作阳极,精铜作阴极,1mol水生成,转移2mol电子,可得到64g铜,故D正确.版权所有
故选A.
18.A
【分析】由总反应可知,放电时,氢气失去电子发生氧化反应:,为负极;得到电子发生还原反应:,为正极;
【详解】A.放电时电池负极反应为,电池负极周围溶液的OH-浓度不断减小,pH会减小,故A错误;
B.电池放电时,正极镍元素被还原发生还原反应,反应为:,故B正确;
C.充电时,极为阳极,失去电子发生氧化反应:,氢氧根离子被消耗,碱性减弱,pH不断减小,故C正确;
D.电池充电时,氢气所在极为阴极,阴极水得到电子发生还原反应,电极反应为:,故D正确;
故选A。
19. A BC 还原 阴 4OH--4e-=2H2O+O2↑ 不变
【分析】(1)根据装置图判断原电池和电解池;
(2)A池为原电池,硫酸铜溶液为电解质溶液,则活泼金属作负极,即Zn为负极,负极失去电子,发生氧化反应;Cu作正极,发生还原反应;
(3)B池为电解池,与电源正极连接的是阳极,原电源负极相连接的是阴极,因此Pt为阳极,C为阴极,阳极上OH-失去电子发生氧化反应,阴极上Cu2+得到电子发生还原反应;
(4)C池为电解池,阳极是铜,阴极是锌,阳极上Cu-2e-=Cu2+,阴极上Cu2++2e-=Cu。
【详解】(1)由装置图可知A装置为原电池,B和C装置为电解池;
(2)A池中Cu作正极,发生还原反应;
(3)B池为电解池,其中Pt为阳极,C为阴极,阳极上OH-失去电子发生氧化反应,电极反应为:4OH--4e-=2H2O+O2↑;
(4)C池为电解池,阳极是铜,阴极是锌,阳极上Cu-2e-=Cu2+,阴极上Cu2++2e-=Cu,阴极上析出的铜与阳极上溶解得铜相等,因此CuSO4溶液的物质的量浓度不变。
【点睛】解答本题时要注意原电池和电解池的区别,根据二者的结构特征判断原电池的正负极和电解池的阴阳极。
原电池 电解池
定义 将化学能转变成电能的装置 将电能转变成化学能的装置
形成 条件 ①活泼性不同的两电极(连接) ②电解质溶液(电极插入其中并与电解质溶液或其中溶解的其他物质自发反应) ③形成闭合回路 ④自发的氧化还原反应 ①两电极分别接直流电源的正、负极 ②两电极插入电解质溶液 ③形成闭合回路
电极 名称 负极:较活泼金属 正极:较不活泼金属(或能导电的非金属) 阳极:与电源正极相连的极 阴极:与电源负极相连的极
电极 反应 负极:金属失电子,发生氧化反应 正极:溶液中的阳离子得电子,发生还原反应 阳极:氧化反应、溶液中的阴离子失电子或电极金属失电子 阴极:还原反应,溶液中的阳离子得电子
电子 流向 负极正极 电源负极阴极 电源正极阳极
20. NO2(g)+SO2(g)=SO3(g)+NO(g) △H= 41.8kJ mol 1 减小 2 bc SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O) SO2+Cl2+H2O=4H++SO42-+2Cl-
【分析】(1)①NO2和SO2反应的化学方程式为:NO2(g)+SO2(g)=SO3(g)+NO(g),根据盖斯定律可得:(②-①)/2可得其△H。
②对于吸热反应,温度升高,平衡常数增大,对于放热反应,温度升高,平衡常数减小。
(2)①根据三段式计算平衡常数。
②a.温度和容器体积不变,充入惰性气体,平衡不移动,转化率不变;
b.温度和容器体积不变,增加反应物浓度,平衡正向移动,转化率增大;
c.减少容器的体积,相当于增大压强,平衡正向移动,转化率提高;
d.催化剂只改变反应速率,不影响转化率;
e.该反应正反应为放热反应,升高体系温度,平衡逆向移动,转化率变小;
(3)电解饱和食盐水,阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,总反应为:2NaCl+2H2O2NaOH+Cl2↑+H2↑,所以气体B为氯气,溶液A为氢氧化钠。
【详解】(1)①NO2和SO2反应的化学方程式为:NO2(g)+SO2(g)=SO3(g)+NO(g),根据盖斯定律:(②-①)/2得:△H =( 196.6kJmol 1+113.0kJmol 1)= 41.8kJ mol 1,其热化学反应方程式为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H= 41.8kJ mol 1,故答案为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H= 41.8kJ mol 1。
②由①可知,该反应的正反应为放热反应,所以升高温度,平衡向逆向移动,平衡常数减小,故答案为:减小。
(2)①1L密闭容器中,5min内各物质浓度发生的变化如下:
2SO2(g)+O2(g)2SO3(g),
起始浓度(mol/L) 2 1 0
变化浓度(mol/L) 1 0.5 1
平衡浓度(mol/L) 1 0.5 1
平衡常数,故答案为:2。
②a.温度和容器体积不变,充入1.0molHe,平衡不移动,SO2的转化率不变,a错误;
b.温度和容器体积不变,充入1.0molO2,平衡正向移动,SO2的转化率提高,b正确;
c.在其他条件不变,减少容器的体积,相当于增大压强,平衡正向移动,SO2的转化率提高,c正确;
d.在其他条件不变时,改用高效催化剂,平衡不移动,SO2的转化率不变,d错误;
e.该反应正反应为放热反应,在其他条件不变时,升高体系温度,平衡逆向移动,SO2的转化率变小,e错误;故答案为:bc。
(3)①电解饱和食盐水,阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,总反应为:2NaCl+2H2O2NaOH+Cl2↑+H2↑,气体B为氯气,溶液A为氢氧化钠。氢氧化钠与二氧化硫反应,其化学反应方程式为:SO2+NaOH= NaHSO3(或SO2+2NaOH=Na2SO3+H2O),其离子反应方程式为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O),故答案为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O);
②气体B为氯气,其溶液与二氧化硫发生氧化还原反应生成硫酸和盐酸,其化学反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,其离子反应方程式为:SO2+Cl2+H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+H2O=4H++SO42-+2Cl-。
21. 铜电极上有气泡生成 B 4H+++3e-=NO↑+2H2O Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O Cr2O+14H++6e-=2Cr3++7H2O
【分析】本题考查双液原电池的结构、陌生电极式的书写,学生需掌握陌生电极式的一般书写方法。
【详解】(1)根据题中信息可知在图1装置中,铬失去电子生成,氢离子在铜电极上得到电子生成氢气,故现象为:铜电极上有气泡生成。
A.双液原电池中盐桥中通常盛装的是琼脂-饱和氯化钾溶液,但若某溶液中的溶质是硝酸银,则盐桥中应改装琼脂-饱和硝酸钾溶液,防止生成的氯化银沉淀堵塞盐桥使离子移动不畅,故A项错误;
B.由电子守恒可知,1molCr溶解转移2mol电子,左烧杯中增加2mol正电荷,右烧杯中减少2mol正电荷,盐桥中将有2mol进入左烧杯中,2mol进入右烧杯中,故B项正确;
C.在原电池反应中氢离子得到电子发生还原反应,故C项错误;
D.导线中发生移动的是电子,电解质溶液中发生移动的是离子,故电子无法通过盐桥转移到左烧杯中,故D项错误;
故答案选B。
故答案为:铜电极上有气泡生成,B
(2)由实验现象可知,在图2装置中铬电极作正极,硝酸根离子在铬电极上得到电子发生还原反应转化为NO,所以正极电极式为4H+++3e-=NO↑+2H2O,故答案为:4H+++3e-=NO↑+2H2O
(3)根据题意可知,该溶液环境为酸性环境,则Fe2+和Cr2O发生的反应为:Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr2O放电的阴极电极反应式为:Cr2O+14H++6e-=2Cr3++7H2O,故答案为:Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr2O+14H++6e-=2Cr3++7H2O。
【点睛】本题必须要明确电极式中的反应物和产物,并且结合电解质溶液酸碱性环境书写电极式
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关物质和反应的叙述中,正确的是
A.反应的
B.为了增强溶液的氧化性,可选用浓盐酸进行酸化
C.电解饱和NaCl溶液制取氯气时,可用铁作阳极、石墨作阴极
D.浓盐酸与足量共热反应,可生成
2.欲在铁制品上镀一层一定厚度的铜,以下方案设计正确的是
A.铜作阳极,镀件作阴极,溶液中含有铜离子
B.铂作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜作阴极,镀件作阳极,溶液中含有亚铁离子
3.关于下列装置说法正确的是( )
A.装置①中,一段时间后CuSO4浓度增大
B.装置②中滴入酚酞,a极附近变红
C.用装置③精炼铜时,c极为粗铜
D.装置④中发生吸氧腐蚀
4.下列关于工业生产说法不正确的是
A.工业上用电解熔融氧化物的方法制金属镁和铝
B.氯碱工业中使用阳离子交换膜防止副反应的发生
C.钢铁防腐蚀可用化学方法在其表面进行发蓝处理
D.工业制备硫酸时在吸收塔中使用浓硫酸吸收三氧化硫
5.下列离子方程式与所述事实相符且正确的是
A.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO=3Fe2++2NO↑+4H2O
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) N2O4(g) ΔH<0
C.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO+2H2OH2CO3+2OH-
D.用铁棒作阳极、炭棒作阴极电解饱和氯化钠溶液:2Cl-+2H2OH2↑+Cl2↑+2OH-
6.下列说法正确的是
选项 A B C D
装置
结论 Zn为阴极,为阳极 由b电极向a电极移动 锌筒因发生氧化反应而变薄 溶液的浓度始终不变
A.A B.B C.C D.D
7.为循环利用空间站航天员呼出的二氧化碳并为航天员提供氧气,我国科学家设计了一种装置(如图所示),实现了“太阳能→电能→化学能”的转化,总反应为。下列说法正确的是
A.X电极连接的是太阳能电池的负极
B.Z离子是,离子交换膜为阳离子交换膜
C.Y电极上的电极反应式为
D.为了保证电池在碱性条件下顺利工作,理论上应定期补充碱液
8.我国科研工作者提出通过电解原理联合制备环氧乙烷(结构简式为)同时处理酸性含铬废水,其工作原理示意图如图所示。其中双极膜由阳离子交换膜和阴离子交换膜组成,工作时内层H2O解离为H+和OH-,并分别向两极迁移。下列说法正确的是
A.膜q为阳离子交换膜
B.工作时,NaOH溶液浓度保持不变
C.N极的电极反应式为
D.处理含的废水,理论上可制得66g环氧乙烷
9.能正确表示下列反应的离子方程式是
A.过氧化钠固体与水反应:2O+2H2O=4OH-+O2↑
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO恰好沉淀完全:2Al3++3SO+3Ba2++6OH- =2Al(OH)3↓+3BaSO4↓
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
10.如图所示,将锌棒和铜棒插入稀硫酸中。下列说法正确的是
A.甲装置中锌棒作负极发生氧化反应,乙装置中锌棒作阴极发生还原反应
B.甲装置中电子由锌棒经导线流向铜棒
C.乙装置中电解质溶液中的氢离子流向锌棒
D.甲、乙两个装置的反应原理不同
11.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 叙述Ⅰ 叙述Ⅱ
A Fe3+有氧化性 用KSCN溶液可以鉴别Fe3+
B 浓硫酸有腐蚀性 常温下浓硫酸不能用铁罐盛装
C Cl2是非金属单质 Cl2能使湿润的有色布条褪色
D 熔融状态的Al2O3中有自由移动的Al3+和O2- 电解熔融状态的Al2O3制备Al
A.A B.B C.C D.D
12.一种利用双膜法电解回收CoCl2溶液中Co的装置如图所示,电解时Co会析出在Co电极上。下列说法正确的是
A.a为电源的正极
B.电解后H2SO4溶液的浓度减小
C.电解后盐酸溶液的浓度增大
D.常温时,Co电极的质量每增加5.9g,Ti电极上会析出1.12L气体
13.双极膜(BP) 是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH﹣,作为H+和OH﹣离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜,下列说法错误的是
A.Y电极与电源正极相连,发生的反应为4OH﹣﹣4e﹣═O2↑+2H2O
B.M为阳离子交换膜,N为阴离子交换膜
C.“双极膜组”电渗析法也可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH)
D.若去掉双极膜(BP),电路中每转移1mol电子,两极共得到0.5mol气体
14.设NA为阿伏加德罗常数的值。下列说法正确的是
A.3MnO+5FeC2O4+24H+=3Mn2++5Fe3++10CO2↑+12H2O,每生成1 mol CO2,反应转移的电子数为NA
B.用惰性电极电解AlCl3溶液,当电路中通过的电子数为NA时,阴极有9 g Al析出
C.向含1 mol CH3COONa的水溶液中滴加醋酸使溶液呈中性,CH3COO 数目为NA
D.0.100 mol·L 1的NH4Cl溶液中,NH数目小于0.100NA
15.某课外研究小组设计了一款可充电电池,在两惰性电极(多孔碳棒)上加装两个玻璃罩,装置如图所示。先关闭K1,打开K2,工作一段时间后,再打开K1,关闭K2。下列说法不正确的是
A.打开K1,关闭K2时,Na+向B极迁移
B.该装置电解过程总反应方程式为:2H2O2H2+O2
C.电极A发生还原反应过程中,A区域碱性增强
D.关闭K1,打开K2,转移2mol电子,左池增重44g
16.下列说法正确的是
A.NO2溶于水生成HNO3,则NO2是HNO3的酸酐
B.高温条件下,铁粉和水蒸气反应生成Fe3O4
C.SiO2不溶于水,不能以SiO2为原料制备H2SiO3
D.电解精炼铜时,粗铜连接电源负极
17.根据如图回答,下列说法不正确的是
A.此装置用于铁表面镀铜时,a为铁
B.此装置用于电镀铜时,硫酸铜溶液的浓度不变
C.燃料电池中正极反应为1/2O2+2e-+2H+===H2O
D.若用该装置进行粗铜的精炼,当有1 mol水生成时,可得到64 g精铜
18.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:据此反应式判断,下列叙述中不正确的是
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,正极的电极反应为:
C.电池充电时,阳极周围溶液的的pH不断减小
D.电池充电时,阴极的电极反应为:
二、填空题
19.如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuSO4溶液。
(1)A、B、C三个装置中属于原电池的是 (填字母,下同),属于电解池的是 。
(2)A池中Cu电极上发生的是 (填“氧化”或“还原”)反应。
(3)B池中C是 极,Pt极发生的反应的电极反应式为 。
(4)C池反应过程中,CuSO4溶液的物质的量浓度 (填“变大”“变小”或“不变”)
20.工业废气、汽车尾气排放出的 SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)NOx和 SO2在空气中存在下列平衡:
2NO(g) + O2(g)2NO2(g) △ H = 113.0kJmol 1
2SO2(g) + O2(g)2SO3(g) △ H = 196.6kJmol 1
SO2通常在二氧化氮的存在下,进一步被氧化,生成 SO3.
①写出 NO2和 SO2反应的热化学方程式为 .
②随温度升高,该反应化学平衡常数变化趋势是 .
(2)提高2SO2(g) + O2(g)2SO3(g)反应中 SO2的转化率,是减少 SO2排放的有效措施:①T 温度时,在 1L 的密闭容器中加入 2.0mol SO2和 1.0mol O2,5min 后反应达到平衡,二氧化硫的转化率为 50%,该反应的平衡常数是 .②在①中条件下,反应达到平衡后,改变下列条件,能使 SO2的转化率提高的是 (填字母).
a.温度和容器体积不变,充入 1.0mol He
b.温度和容器体积不变,充入 1.0mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
(3)工业上利用氯碱工业产品治理含二氧化硫的废气.如图是氯碱工业中电解饱和食盐水的原理示意图
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 .
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是 .
21.金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。
(1)铜和铬构成的原电池装置如图1所示,其中盛有稀硫酸的烧杯中出现的现象为 。盐桥中装的是琼脂-饱和KCl溶液,下列关于该原电池的说法正确的是 (填序号)
A.盐桥的作用是使整个装置构成通路并保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以盛装琼脂-饱和KCl溶液
B.理论上1molCr溶解,盐桥中将有2molCl-进入左烧杯中,2molK+进入右烧杯中
C.在原电池反应中H+得电子发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥转移到左烧杯中
(2)铜和铬构成的另一原电池装置如图2所示,铜电极上不再有图1装置中铜电极上出现的现象,铬电极上产生大量气泡,且气体遇空气呈红棕色。写出该原电池正极的电极反应式: 。
(3))CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr(Ⅲ)常见的处理方法是电解法。
将含Cr2O的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl进行电解,使阳极生成的Fe2+和Cr2O发生反应,其离子方程式为 。阴极上Cr2O、H+、Fe3+都可能放电。若Cr2O放电,则阴极的电极反应式为 。
试卷第1页,共3页
参考答案:
1.A
【详解】A.自发需,该反应为熵减的自发反应,则,A正确;
B.酸性条件下,高锰酸钾会和氯离子反应生成氯气,B错误;
C.铁为活泼金属,用铁作阳极,阳极铁会放电导致阳极溶解,C错误;
D.浓盐酸中HCl的物质的量为0.6mol,随着反应进行,盐酸浓度减小,反应停止,得到Cl2的物质的量小于0.15mol,D错误;
故选A。
2.A
【详解】电镀原理是镀层金属作阳极发生氧化反应,镀件作阴极镀层金属阳离子在镀件发生还原反应,含有镀层金属阳离子的电解质溶液作电镀液,综上分析A符合题意,故选A。
答案选A
3.B
【详解】A. 装置①是原电池,溶液中SO42 不参加反应,所以放电过程中硫酸根离子浓度不变,铜电极上,铜离子得到电子变为铜单质,铜离子数量减少,因此CuSO4浓度减小,故A错误;
B. 电解时,b是阳极、a是阴极,阳极上生成氯气、阴极上生成氢气,且阴极附近有NaOH生成,溶液呈碱性,所以a电极附近溶液呈红色,故B正确;
C. 电解精炼粗铜时,粗铜作阳极、纯铜作阴极,所以d为粗铜,故C错误;
D.酸性条件下,锌发生析氢腐蚀,弱酸性或中性条件下,锌发生吸氧腐蚀,该溶液呈强酸性,所以应该发生析氢腐蚀,故D错误;
答案选B。
【点睛】电化学腐蚀中,强酸性条件下,发生析氢腐蚀,弱酸性或中性条件下,发生吸氧腐蚀。
4.A
【详解】A.工业上用电解熔融制金属镁:,A错误;
B.氯碱工业中使用阳离子交换膜(只允许阳离子通过,不允许阴离子和气体通过)可以防止阴极产生的氢氧化钠和阳极产生的氯气发生副反应:2NaOH+Cl2=NaCl+NaClO+H2O,B正确;
C.用化学方法在钢铁部件表面进行“发蓝”处理是一种普遍采用的金属防护方法,C正确;
D.工业制备硫酸时在吸收塔中使用98.3%的浓硫酸吸收三氧化硫,防止形成酸雾,D正确;
故选A。
5.B
【详解】铁溶于稀硝酸,溶液变黄,说明生成了三价铁离子,故正确的离子方程式为:
Fe+4H++NO=Fe3++NO↑+2H2O,A错误;
B.“NO2球”浸泡在冷水中,颜色变浅,说明二氧化氮浓度下降,该反应 2NO2(g) N2O4(g)的化学平衡正向移动,故ΔH<0,B正确;
C.碳酸根的水解分步进行,CO+H2O+OH-,+H2O H2CO3+OH-,C错误;
D.用铁棒作阳极,铁失去电子,故正确的电解方程式为:
Fe+2H2O H2↑+Fe(OH)2,D错误;
故本题选B。
6.C
【详解】A.该装置为原电池,Zn的化合价由0→+2价,化合价升高,Zn为负极,中Ag化合价由+1→0价,为正极,A错误;
B.该装置为电解池,a极由H2O→H2,发生氧化反应,为阳极,阳极带负电,会向b极移动,B错误;
C.该装置为锌锰干电池,锌筒为负极,发生氧化反应被消耗,故变薄,C正确;
D.该装置为电解池,精炼铜,阳极泥中含有铁、锌杂质会将硫酸铜中的铜置换,故溶液的浓会改变,D;
答案选C。
7.C
【分析】根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,Y电极(阴极)上得电子生成CO。
【详解】A.根据题干信息“太阳能→电能→化学能”可判断该装置为电解池,根据图中电子的流向可知,X电极为阳极,与太阳能电池的正极相连,选项A错误;
B.根据电池总反应可知Y电极(阴极)上得电子生成CO,电极反应式为,Y电极生成的通过阴离子交换膜向X电极迁移,选项B错误;
C.根据电池总反应可知Y电极(阴极)上得电子生成CO,电极反应式为,选项C正确;
D.X电极的电极反应式为,所以理论上不需要补充碱液,选项D错误;
答案选C。
8.D
【分析】该原理为电解池原理,电极N发生转化为的反应,铬元素由+6→+3价,得电子化合价降低,为还原反应,电极N为阴极,则催化电极M为阳极。
【详解】A.催化电极M为阳极,该极区电解质为NaOH溶液,双极膜内层H2O解离产生的OH-移向阳极,膜q为阴离子交换膜,A错误;
B.催化电极M的电极反应式为,每2mol电子转移有2mol OH-移向该电极区,但反应中有水生成,NaOH溶液浓度降低,B错误;
C.N极的电极反应式应为,C错误;
D.由电极M的电极反应式和N极的电极反应式,可知参加反应,生成3mol,处理含的废水,理论上可制得1.5mol环氧乙烷,质量为,D正确;
答案选D。
9.D
【详解】A.过氧化钠固体与水反应生成氢氧化钠和氧气,过氧化钠为固体不能拆开,正确的离子方程式为: 2Na2O2+2H2O=4Na++4OH-+O2↑,故A错误;
B.向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO-恰好沉淀完全,氢氧化钡提供的氢氧根离子和铝离子完全反应生成偏铝酸根离子,正确的离子方程式为:Al3++2SO+2Ba2++4OH-=+2BaSO4↓+2H2O,故B错误;
C.用铜做电极电解CuSO4溶液,阳极铜放电生成铜离子,阴极铜离子放电生成铜单质,电解的实质为电解精炼铜,故C错误;
D.硫酸亚铁酸性溶液暴露在空气中,亚铁离子容易被空气中氧气氧化成铁离子,反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故D正确;
故选D。
10.B
【分析】甲装置是原电池,锌棒作负极失去电子发生氧化反应,铜棒作正极发生还原反应;乙装置中有直流电源是电解池,锌棒与电源的正极相连,作阳极发生氧化反应,铜棒与电源的负极相连,作阴极发生还原反应,据此答题。
【详解】A.乙装置是电解池,锌棒与电源的正极相连,作阳极发生氧化反应,故A项错误;
B.甲装置中锌棒作负极失去电子,电子经过导线流向铜棒,故B正确;
C.乙装置中电解质溶液中的氢离子向阴极铜棒移动,故C错误;
D.甲、乙两装置中对应的氧化还原反应均为,反应原理相同,故D错误。
故答案选B。
11.D
【详解】A.用KSCN溶液可以鉴别Fe3+是因为两者反应生成血红色的络合物,与Fe3+的氧化性无关,A错误;
B.常温下浓硫酸能用铁罐盛装,原因是浓硫酸使铁钝化,B错误;
C.Cl2能使湿润的有色布条褪色,是因为氯气与水反应生成了HClO,与氯气是非金属单质无关,C错误;
D.熔融状态的Al2O3中有自由移动的Al3+和O2-,可通过电解熔融状态的Al2O3制备Al,D正确;
故选D。
12.C
【分析】电解时CoCl2中Co2+会析出在Co电极上,因此Co电极上Co2+发生还原反应,则电源的a为负极,b为正极,阳极上水电离的OH-发生氧化反应生成O2。
【详解】A.由上述分析可知,a为电源的负极,故A错误;
B.电解过程中,阳极区的水被消耗,溶液中H+穿过阳离子交换膜进入稀盐酸溶液中,不参加反应,根据电荷守恒可知,n(H2SO4)不变,V水减小,因此电解后H2SO4溶液的浓度增大,故B错误;
C.电解过程中,阴极区的Cl-穿过阴离子交换膜进入稀盐酸中,阳极区中H+穿过阳离子交换膜进入稀盐酸溶液中,因此电解后盐酸溶液的浓度增大,故C正确;
D.5.9g Co的物质的量为=0.1mol,得到0.2mol电子,阳极上电极反应为2H2O-4e-=4H++O2↑,根据转移电子守恒可知,阳极上生成0.05mol O2,但常温常压下的气体摩尔体积并不等于22.4L/mol,因此Ti电极上析出的O2体积不等于1.12L,故D错误;
故答案为C。
13.D
【详解】A.根据装置图中H+、OH﹣移动方向可知,X电极为电解池的阴极,Y电极为阳极,阳极与电源正极相连,发生的反应为4OH﹣﹣4e﹣═O2↑+2H2O,故A正确;
B.电解时,溶液中的阳离子向阴极移动,阴离子向阳极移动,Na+经过M离子交换膜移向左室,与BP双极膜中转移过来的OH﹣结合生成NaOH,所以M膜为阳离子交换膜,盐室中Cl﹣经过N离子交换膜移向右室,与BP双极膜中转移过来的H+结合生成HCl,所以N膜为阴离子交换膜,故B正确;
C.“双极膜组”电渗析法电解食盐水可获得NaOH和HCl,则该法可应用于从盐溶液(MX)制备相应的酸(HX)和碱(MOH),故C正确;
D.若去掉双极膜(BP),则为电解食盐水装置,反应为2H2O+2Cl﹣Cl2↑+H2↑+2OH﹣,电路中每转移1mol电子,生成0.5mol氢气和0.5mol氯气,两极共得到1mol气体,故D错误;
选D。
14.C
【详解】A.在该反应中每反应产生10 mol CO2气体,转移15 mol电子,则生成1 mol CO2,反应转移的电子数为1.5NA,A错误;
B.离子放电能力:H+>Al3+,用惰性电极电解AlCl3溶液时,阴极上溶液中的H+得到电子变为H2,不会产生Al单质,B错误;
C.在CH3COONa溶液中存在电荷守恒:c(CH3COO )+c(OH-)=c(H+)+c(Na+)。由于溶液显中性,c(OH-)=c(H+),所以当溶液中含1 mol CH3COONa时,CH3COO 数目为NA,C正确;
D.只有物质浓度,缺少溶液体积,不能计算微粒数目,D错误;
故合理选项是C。
15.B
【详解】A.打开K1,关闭K2时,形成氢氧燃料电池,A极是充满氢气负极,B极是充满氧气的正极,电解质里的阳离子向电池的阳极移动,即 Na+向B极迁移,A项正确;
B.该装置电解过程总反应方程式为:,选项中漏写了气体符号,B项错误;
C.电极A发生还原反应过程中,反应的电极方程式为:2H2O+2e-=2OH-+H2↑,即A区域碱性增强,C项正确;
D.关闭K1,打开K2,形成电解池,A极阴极,B极是阳极,Na+向A极移动,A极电极方程式为:2H2O+2e-=2OH-+H2↑,当转移2mol电子时,Na+也转移了2mol,即增重的质量为46g,但同时有1mol氢气产生,即2g氢气,所以左池增重44g,D项正确;
答案选B。
16.B
【详解】A.溶于水生成和,不是酸酐,的酸酐是,A错误;
B.和水蒸气在高温条件下反应生成和,B正确;
C.溶于溶液,再加入酸可得,C错误;
D.电解精炼铜时,粗铜连接电源正极作电解池阳极,D错误。
故选B。
17.A
【详解】氢氧燃料电池中,通入氢气的电极一定是负极,通入氧气的电极一定是正极,故b极为阴极,a极为阳极.
A.铁表面镀铜时,金属铜必须作阳极,金属铁作阴极,所以a为金属铜,故A错误;
B.此装置用于电镀铜时,金属铜必须作阳极,电解前后硫酸铜溶液的浓度不变,故B正确;
C.氢氧燃料电池中,通入氧气的电极一定是正极,在酸性环境下,氧气放电的反应为: O2+2H++2e﹣=H2O,故C正确;
D.电解精炼铜时,粗铜作阳极,精铜作阴极,1mol水生成,转移2mol电子,可得到64g铜,故D正确.版权所有
故选A.
18.A
【分析】由总反应可知,放电时,氢气失去电子发生氧化反应:,为负极;得到电子发生还原反应:,为正极;
【详解】A.放电时电池负极反应为,电池负极周围溶液的OH-浓度不断减小,pH会减小,故A错误;
B.电池放电时,正极镍元素被还原发生还原反应,反应为:,故B正确;
C.充电时,极为阳极,失去电子发生氧化反应:,氢氧根离子被消耗,碱性减弱,pH不断减小,故C正确;
D.电池充电时,氢气所在极为阴极,阴极水得到电子发生还原反应,电极反应为:,故D正确;
故选A。
19. A BC 还原 阴 4OH--4e-=2H2O+O2↑ 不变
【分析】(1)根据装置图判断原电池和电解池;
(2)A池为原电池,硫酸铜溶液为电解质溶液,则活泼金属作负极,即Zn为负极,负极失去电子,发生氧化反应;Cu作正极,发生还原反应;
(3)B池为电解池,与电源正极连接的是阳极,原电源负极相连接的是阴极,因此Pt为阳极,C为阴极,阳极上OH-失去电子发生氧化反应,阴极上Cu2+得到电子发生还原反应;
(4)C池为电解池,阳极是铜,阴极是锌,阳极上Cu-2e-=Cu2+,阴极上Cu2++2e-=Cu。
【详解】(1)由装置图可知A装置为原电池,B和C装置为电解池;
(2)A池中Cu作正极,发生还原反应;
(3)B池为电解池,其中Pt为阳极,C为阴极,阳极上OH-失去电子发生氧化反应,电极反应为:4OH--4e-=2H2O+O2↑;
(4)C池为电解池,阳极是铜,阴极是锌,阳极上Cu-2e-=Cu2+,阴极上Cu2++2e-=Cu,阴极上析出的铜与阳极上溶解得铜相等,因此CuSO4溶液的物质的量浓度不变。
【点睛】解答本题时要注意原电池和电解池的区别,根据二者的结构特征判断原电池的正负极和电解池的阴阳极。
原电池 电解池
定义 将化学能转变成电能的装置 将电能转变成化学能的装置
形成 条件 ①活泼性不同的两电极(连接) ②电解质溶液(电极插入其中并与电解质溶液或其中溶解的其他物质自发反应) ③形成闭合回路 ④自发的氧化还原反应 ①两电极分别接直流电源的正、负极 ②两电极插入电解质溶液 ③形成闭合回路
电极 名称 负极:较活泼金属 正极:较不活泼金属(或能导电的非金属) 阳极:与电源正极相连的极 阴极:与电源负极相连的极
电极 反应 负极:金属失电子,发生氧化反应 正极:溶液中的阳离子得电子,发生还原反应 阳极:氧化反应、溶液中的阴离子失电子或电极金属失电子 阴极:还原反应,溶液中的阳离子得电子
电子 流向 负极正极 电源负极阴极 电源正极阳极
20. NO2(g)+SO2(g)=SO3(g)+NO(g) △H= 41.8kJ mol 1 减小 2 bc SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O) SO2+Cl2+H2O=4H++SO42-+2Cl-
【分析】(1)①NO2和SO2反应的化学方程式为:NO2(g)+SO2(g)=SO3(g)+NO(g),根据盖斯定律可得:(②-①)/2可得其△H。
②对于吸热反应,温度升高,平衡常数增大,对于放热反应,温度升高,平衡常数减小。
(2)①根据三段式计算平衡常数。
②a.温度和容器体积不变,充入惰性气体,平衡不移动,转化率不变;
b.温度和容器体积不变,增加反应物浓度,平衡正向移动,转化率增大;
c.减少容器的体积,相当于增大压强,平衡正向移动,转化率提高;
d.催化剂只改变反应速率,不影响转化率;
e.该反应正反应为放热反应,升高体系温度,平衡逆向移动,转化率变小;
(3)电解饱和食盐水,阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,总反应为:2NaCl+2H2O2NaOH+Cl2↑+H2↑,所以气体B为氯气,溶液A为氢氧化钠。
【详解】(1)①NO2和SO2反应的化学方程式为:NO2(g)+SO2(g)=SO3(g)+NO(g),根据盖斯定律:(②-①)/2得:△H =( 196.6kJmol 1+113.0kJmol 1)= 41.8kJ mol 1,其热化学反应方程式为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H= 41.8kJ mol 1,故答案为:NO2(g)+SO2(g)=SO3(g)+NO(g) △H= 41.8kJ mol 1。
②由①可知,该反应的正反应为放热反应,所以升高温度,平衡向逆向移动,平衡常数减小,故答案为:减小。
(2)①1L密闭容器中,5min内各物质浓度发生的变化如下:
2SO2(g)+O2(g)2SO3(g),
起始浓度(mol/L) 2 1 0
变化浓度(mol/L) 1 0.5 1
平衡浓度(mol/L) 1 0.5 1
平衡常数,故答案为:2。
②a.温度和容器体积不变,充入1.0molHe,平衡不移动,SO2的转化率不变,a错误;
b.温度和容器体积不变,充入1.0molO2,平衡正向移动,SO2的转化率提高,b正确;
c.在其他条件不变,减少容器的体积,相当于增大压强,平衡正向移动,SO2的转化率提高,c正确;
d.在其他条件不变时,改用高效催化剂,平衡不移动,SO2的转化率不变,d错误;
e.该反应正反应为放热反应,在其他条件不变时,升高体系温度,平衡逆向移动,SO2的转化率变小,e错误;故答案为:bc。
(3)①电解饱和食盐水,阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,总反应为:2NaCl+2H2O2NaOH+Cl2↑+H2↑,气体B为氯气,溶液A为氢氧化钠。氢氧化钠与二氧化硫反应,其化学反应方程式为:SO2+NaOH= NaHSO3(或SO2+2NaOH=Na2SO3+H2O),其离子反应方程式为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O),故答案为:SO2+OH-=HSO3-(或SO2+2OH-=SO32-+H2O);
②气体B为氯气,其溶液与二氧化硫发生氧化还原反应生成硫酸和盐酸,其化学反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,其离子反应方程式为:SO2+Cl2+H2O=4H++SO42-+2Cl-,故答案为:SO2+Cl2+H2O=4H++SO42-+2Cl-。
21. 铜电极上有气泡生成 B 4H+++3e-=NO↑+2H2O Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O Cr2O+14H++6e-=2Cr3++7H2O
【分析】本题考查双液原电池的结构、陌生电极式的书写,学生需掌握陌生电极式的一般书写方法。
【详解】(1)根据题中信息可知在图1装置中,铬失去电子生成,氢离子在铜电极上得到电子生成氢气,故现象为:铜电极上有气泡生成。
A.双液原电池中盐桥中通常盛装的是琼脂-饱和氯化钾溶液,但若某溶液中的溶质是硝酸银,则盐桥中应改装琼脂-饱和硝酸钾溶液,防止生成的氯化银沉淀堵塞盐桥使离子移动不畅,故A项错误;
B.由电子守恒可知,1molCr溶解转移2mol电子,左烧杯中增加2mol正电荷,右烧杯中减少2mol正电荷,盐桥中将有2mol进入左烧杯中,2mol进入右烧杯中,故B项正确;
C.在原电池反应中氢离子得到电子发生还原反应,故C项错误;
D.导线中发生移动的是电子,电解质溶液中发生移动的是离子,故电子无法通过盐桥转移到左烧杯中,故D项错误;
故答案选B。
故答案为:铜电极上有气泡生成,B
(2)由实验现象可知,在图2装置中铬电极作正极,硝酸根离子在铬电极上得到电子发生还原反应转化为NO,所以正极电极式为4H+++3e-=NO↑+2H2O,故答案为:4H+++3e-=NO↑+2H2O
(3)根据题意可知,该溶液环境为酸性环境,则Fe2+和Cr2O发生的反应为:Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr2O放电的阴极电极反应式为:Cr2O+14H++6e-=2Cr3++7H2O,故答案为:Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O,Cr2O+14H++6e-=2Cr3++7H2O。
【点睛】本题必须要明确电极式中的反应物和产物,并且结合电解质溶液酸碱性环境书写电极式
