广东省2023-2024学年高二上学期第二次月考化学试题(含答案)
文档属性
| 名称 | 广东省2023-2024学年高二上学期第二次月考化学试题(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 614.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 19:00:01 | ||
图片预览




文档简介
注意事项:
1.试卷共8页,答题卷共1页,考试时间:75分钟,卷面满分:100分。
2.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名与考生号、试室号、座位号填写在答题卡上。
3.选择题用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,但注意不能擦破试卷,否则不能扫描。
4.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内
的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液。不按要求作答的答案无效。
请不要褶皱答题卡,以免无法扫描。
可能用到的相对原子质量: H 1 N 14 O 16 Na 23
一、选择题:本大题共 16 小题,共 44 分。第1—10小题,每小题2 分;第11—16小题,每小题4分。在每个小题给出的四个选项中,只有一个是符合题目要求的。
1. 中国航天事业取得突破性发展。有关空间站建设中的说法不正确的是( )
A.蓄热材料可以实现电能与热能的直接转换
B.“太阳翼”及光伏发电系统能将太阳能直接变为电能
C.“长征五号”火箭使用的液氢燃料具有无污染的特点
D.“天和”核心舱使用电推发动机,比化石燃料更加环保
2.下列溶液一定显酸性的是( )
A.使甲基橙变黄的溶液 B.的溶液
C.的溶液 D.的溶液
3.下列说法错误的是( )
A.所有燃烧反应都是放热反应
B.经加热而发生的化学反应不一定都是吸热反应
C.由H原子形成1molH-H键要吸收热量
D.在稀溶液中,强酸与强碱发生中和反应生成1mol液态水时释放的热量称为中和热
4.反应 X(g)+Y(g) 2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是( )
A.加入催化剂
B.降低温度
C.减小压强
D.保持容器体积不变,冲入He气
5.对于常温下的次氯酸溶液,下列说法正确的是( )
A.
B.加水稀释,溶液的氢离子浓度增加
C.加入少量次氯酸钠固体,溶液降低
D.加入等体积0.1mol/L的溶液,反应后的溶液中c(Na+) > c(ClO-)
6.下列说法正确的是( )
A. 已知: ,则碳的燃烧热
B.已知:C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定
C.已知:;,则
D.已知: ,
则
7.下列说法不能证明HA是弱电解质的是( )
A.常温下测得NaA溶液呈碱性 B.常温下测得0.0l mol·L 1 HA溶液的pH=4
C.往HA溶液中滴加甲基橙,溶液显红色 D.相同浓度时,HA的导电性比醋酸弱
8.某学生活动小组设计下列①~④方案,能达到实验目的的是( )
A.①可以准确测定盐酸的浓度 B.②可以判断温度对平衡的影响
C.③可以研究催化剂对反应速率的影响 D.④可以准确测定酸碱反应的中和热
9.下列有关物质的用途或现象与盐的水解无关的是( )
A.某雨水样品采集后放置一段时间,由4.68变为4.28
B.实验室中盛放溶液的试剂瓶不能用磨口玻璃塞
C.与两种溶液可用作泡沬灭火剂
D.与溶液可用作焊接金属时的除锈剂
10.在一定温度下的容积不变的密闭容器中充入2molCO和6molH2,使其发生反应:CO(g)+3H2(g) CH4(g)+H2O(g)。下列不能说明反应达到平衡状态的是( )
A.混合气体的压强保持不变 B.混合气体的平均摩尔质量保持不变
C.CH4和H2的体积比保持不变 D.每生成1molCH4消耗1molCO
11.一定温度下,在某密闭容器中发生反应:,若15s内
由0.1降到0.07,则下列说法正确的是( )
A.减小反应体系的体积,化学反应速率不变
B.升高温度正反应速率增大,逆反应速率减小
C.0~15s内用I2表示的平均反应速率为=0.001mol·L—1·s—1
D.由0.07降到0.05所需的反应时间小于10s
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. pH=1的稀硫酸中,含有H+总数为0.1NA
B.16g由O2和O3组成的混合气体中含有氧原子总数为NA
C.1L 0.1mol/L CuCl2溶液中,含有Cu2+总数为0.2NA
D.1mol NaCl的分子数为NA
13.下列实验能达到预期目的是( )
编号 实验内容 实验目的
A 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 证明Na2CO3溶液中存水解平衡
B 室温下,用pH试纸测定浓度为0.1 mol·L 1 NaClO溶液和0.1 mol·L 1 溶液的pH 比较HClO和CH3COOH的酸性强弱
C 等体积pH=2的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX放出的氢气多且反应速率快 证明HX酸性比HY强
D 制备无水 将氯化铁溶液在盐酸中蒸发结晶
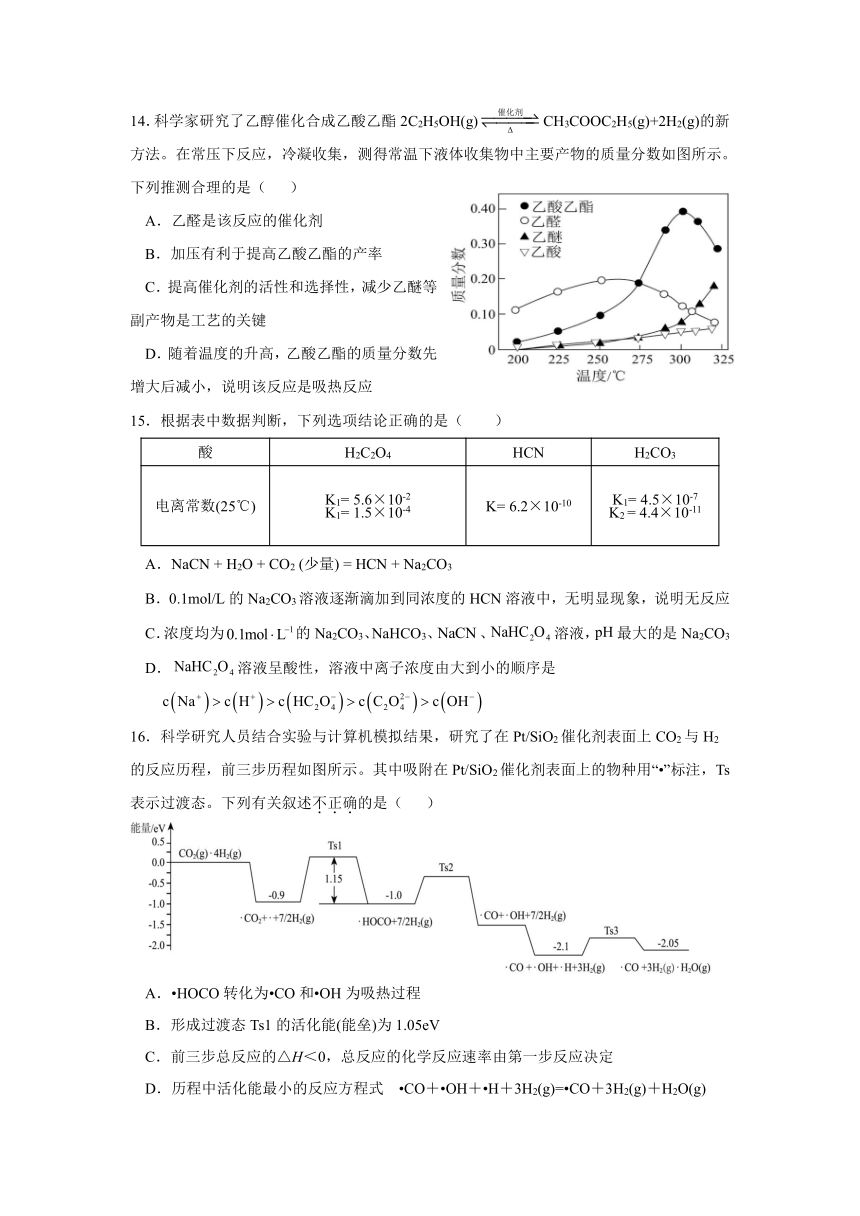
14.科学家研究了乙醇催化合成乙酸乙酯2C2H5OH(g)CH3COOC2H5(g)+2H2(g)的新方法。在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。下列推测合理的是( )
A.乙醛是该反应的催化剂
B.加压有利于提高乙酸乙酯的产率
C.提高催化剂的活性和选择性,减少乙醚等副产物是工艺的关键
D.随着温度的升高,乙酸乙酯的质量分数先增大后减小,说明该反应是吸热反应
15.根据表中数据判断,下列选项结论正确的是( )
酸 H2C2O4 HCN H2CO3
电离常数(25℃) K1= 5.6×10-2 K1= 1.5×10-4 K= 6.2×10-10 K1= 4.5×10-7 K2 = 4.4×10-11
A.NaCN + H2O + CO2 (少量) = HCN + Na2CO3
B.0.1mol/L的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,无明显现象,说明无反应
C.浓度均为的Na2CO3、NaHCO3、、溶液,最大的是Na2CO3
D.溶液呈酸性,溶液中离子浓度由大到小的顺序是
16.科学研究人员结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面上的物种用“ ”标注,Ts表示过渡态。下列有关叙述不正确的是( )
A. HOCO转化为 CO和 OH为吸热过程
B.形成过渡态Ts1的活化能(能垒)为1.05eV
C.前三步总反应的△H<0,总反应的化学反应速率由第一步反应决定
D.历程中活化能最小的反应方程式 CO+ OH+ H+3H2(g)= CO+3H2(g)+H2O(g)
二.非选择题:本题共4小题,全部为必考题,共56分。
17.(14分)回答下列问题:
Ⅰ、用括号内的字母代号填空:中和热测定实验时,若用环形铜丝代替环形玻璃搅拌棒,会导致测定的数值_______(A.偏高;B.偏低)
Ⅱ、甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1。该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:2CO(g)+4H2(g)2CH3OH(g) ΔH=-182.0 kJ·mol-1
ⅱ.甲醇脱水反应:
(1)请写出ⅱ中甲醇脱水反应的热化学方程式:____________________________________。
(2) 在一定条件下,将CO和H2按体积比1∶2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列不能说明该反应达到平衡状态的是___________(填字母)。
A.混合气体的总物质的量保持不变
B.混合气体的密度保持不变
C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
D.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(3)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是_____________________。
②图2中,温度高于265℃后,甲醚选择性降低的原因是____________________________。
18.(14分)某实验小组探究外界条件对化学反应速率的影响,进行了以下实验。
Ⅰ.探究温度、浓度对硫代硫酸钠与稀硫酸反应速率的影响
(1)写出Na2S2O3与H2SO4反应的离子方程式
(2)该小组同学设计了如下表所示系列实验:
实验序号 反应温度/℃ Na2S2O3溶液 H2SO4稀溶液 H2O
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
① 20 10.0 0.10 10.0 0.50 0
② t1 V1 0.10 V2 0.50 V3
③ t2 V4 0.10 V5 0.50 V6
实验①和②探究温度对该反应速率的影响,则实验②中,t1=_______(填“20℃”或“60℃”)、V2= _______mL。
若V5=6.0,实验①和③的实验目的是
Ⅱ.探究催化剂对H2O2分解速率的影响
(3)按下图进行定量实验研究。挤压注射器使FeCl3溶液全部加入试管中,记录数据;用CuCl2溶液代替FeCl3溶液进行平行实验,比较催化剂对反应速率的影响。该实验需测定的实验数据是
(4)用上图中的装置,探究MnO2催化H2O2分解的最佳条件。此时注射器中应加入的试剂是_______。挤压注射器使液体全部加入试管中开始至不再有气体产生,记录反应时间。反应物用量和反应时间如下表:
H2O2 时间 MMMMMMMM 0.1g 0.3g 0.8g
10mL1.5% 223s 67s 56s
10mL3.0% 308s 109s 98s
10mL4.5% 395s 149s 116s
分析表中数据,从实验效果和“绿色化学”的角度考虑,H2O2的浓度一定时,加入_______g的MnO2为较佳选择。
(14分)丙酮蒸气热裂解可生产乙烯酮,反应为
(g) + ,
现对该热裂解反应进行研究,回答下列问题:
化学键 C H C C
键能 412 348 612
(1)根据表格中的键能数据,计算____________ ;
(2)丙酮的平衡转化率随温度、压强变化如图所示:
①图中X表示的物理量是 ____________;
②A、C两点化学平衡常数 KA____________ KC (填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是________________________。
(3)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压 (110kPa)
经过时间t min,丙酮转化了10%。用单位时间内气体分压变化表示的反应速率
v(丙酮)= kPa/min;
②该条件平衡时丙酮转化率为a,则KP = (以平衡时分压代替浓度计算)
( 分压总压物质的量分数 )
(4)其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图所示。工业上选择催化剂____________ (填“甲”或“乙”)。
20.(14分)醋酸是一种常见的弱酸,回答下列问题:
Ⅰ、(1)向100 mL 0.1 mol·L 1的醋酸中加入V mL 0.1 mol·L 1的NaOH溶液完全反应后,溶液呈中性,则V____100 mL(填“>”“<”或“=”)。
(2)25℃时,pH=8的CH3COONa溶液中,水电离产生的OH 浓度c(OH )水=___________。
Ⅱ、某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”以下某一刻度,并记下读数
④经准确操作后,量取V mL待测液注入洁净的锥形瓶中,并加入3滴指示剂溶液
⑤用标准液滴定至终点,记下滴定管液面读数
(完全反应时所得溶液的pH大致为9)
以上步骤有错误的是____________ (填序号)。
Ⅲ、(1)如图表示50 mL滴定管中液面的位置,若A与C刻度间相差1 mL,
A处的刻度为25,滴定管中液面读数应为___________mL;
(2)为减小实验误差,该实验最好选用 (填石蕊、酚酞或甲基橙)作指示剂;除此外该同学一共进行了三次实验,假设每次所取白醋体积均为V mL,NaOH标准液浓度为c mol·L 1,三次实验结果记录如下:
实验次数 第一次 第二次 第三次
消耗NaOH溶液体积/mL 26.02 25.35 25.30
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是___________。
A.实验结束时,仰视刻度线读取滴定终/点时NaOH溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束尖嘴部分有气泡
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
(3)据②所得到的数据,写出计算该白醋中醋酸的物质的量浓度的表达式c=____ mol·L 1
(只代数据不必化简)。
选择题,44分
1 2 3 4 5 6 7 8 9 10
A B C B D D C B A D
11 12 13 14 15 16
C B A C C A
二、非选择题,56分
17、(14分)
Ⅰ、B (2分)
Ⅱ、(1)2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1 (2分),
(2)BC(4分)
(3)①副反应CH3OH(g)+H2O(g)CO2(g)+3H2(g)逆向移动,被抑制;甲醇脱水反应2CH3OH(g)CH3OCH3(g)+H2O(g)不受压强影响(3分)
②甲醇脱水反应2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1正向为放热反应,升高温度平衡逆移,甲醚选择性降低;副反应CH3OH(g)+H2O(g)CO2(g)+3H2(g)
ΔH=+48.8 kJ·mol 1正向为吸热反应,升高温度平衡正移,副产物增加,甲醚选择性降低(3分)(以上①②回答有相同意思即可给分)
(14分)
(1)(2分)
(2) 60℃ (2分) 、 10.0 (2分)、
其它条件不变时, 探究H2SO4浓度对该反应速率的影响(2分)
(3)一定时间内产生气体的体积(或生成相同体积的气体所需要的时间) (2分)
(4)H2O2溶液(2分) 0.3(2分)
19、(14分)
(1)+84(2分)(2)①压强(2分) 、 ②< (2分) 、 ③升高温度(2分)
(3)①(2分) 、 ②(2分) (4)乙 (2分)
20.(14分)
Ⅰ、(1)<(2分) (2)1.0×10 6 mol·L 1(2分)
Ⅱ、① (2分) Ⅲ、(1)25.40(2分) (2) 酚酞(2分)、AD(2分)
(2分)
1.试卷共8页,答题卷共1页,考试时间:75分钟,卷面满分:100分。
2.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名与考生号、试室号、座位号填写在答题卡上。
3.选择题用2B铅笔把答题卡上对应题目选项的答案信息点涂黑,如需改动,用橡皮擦干净后,再选涂其他答案,但注意不能擦破试卷,否则不能扫描。
4.非选择题必须用黑色字迹的钢笔或签字笔作答,答案必须写在答题卡各题目指定区域内
的相应位置上;如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液。不按要求作答的答案无效。
请不要褶皱答题卡,以免无法扫描。
可能用到的相对原子质量: H 1 N 14 O 16 Na 23
一、选择题:本大题共 16 小题,共 44 分。第1—10小题,每小题2 分;第11—16小题,每小题4分。在每个小题给出的四个选项中,只有一个是符合题目要求的。
1. 中国航天事业取得突破性发展。有关空间站建设中的说法不正确的是( )
A.蓄热材料可以实现电能与热能的直接转换
B.“太阳翼”及光伏发电系统能将太阳能直接变为电能
C.“长征五号”火箭使用的液氢燃料具有无污染的特点
D.“天和”核心舱使用电推发动机,比化石燃料更加环保
2.下列溶液一定显酸性的是( )
A.使甲基橙变黄的溶液 B.的溶液
C.的溶液 D.的溶液
3.下列说法错误的是( )
A.所有燃烧反应都是放热反应
B.经加热而发生的化学反应不一定都是吸热反应
C.由H原子形成1molH-H键要吸收热量
D.在稀溶液中,强酸与强碱发生中和反应生成1mol液态水时释放的热量称为中和热
4.反应 X(g)+Y(g) 2Z(g) △H<0,在一定条件下,反应情况如图所示.若使曲线a变为曲线b可采取的措施是( )
A.加入催化剂
B.降低温度
C.减小压强
D.保持容器体积不变,冲入He气
5.对于常温下的次氯酸溶液,下列说法正确的是( )
A.
B.加水稀释,溶液的氢离子浓度增加
C.加入少量次氯酸钠固体,溶液降低
D.加入等体积0.1mol/L的溶液,反应后的溶液中c(Na+) > c(ClO-)
6.下列说法正确的是( )
A. 已知: ,则碳的燃烧热
B.已知:C(石墨,s)=C(金刚石,s) ,则金刚石比石墨稳定
C.已知:;,则
D.已知: ,
则
7.下列说法不能证明HA是弱电解质的是( )
A.常温下测得NaA溶液呈碱性 B.常温下测得0.0l mol·L 1 HA溶液的pH=4
C.往HA溶液中滴加甲基橙,溶液显红色 D.相同浓度时,HA的导电性比醋酸弱
8.某学生活动小组设计下列①~④方案,能达到实验目的的是( )
A.①可以准确测定盐酸的浓度 B.②可以判断温度对平衡的影响
C.③可以研究催化剂对反应速率的影响 D.④可以准确测定酸碱反应的中和热
9.下列有关物质的用途或现象与盐的水解无关的是( )
A.某雨水样品采集后放置一段时间,由4.68变为4.28
B.实验室中盛放溶液的试剂瓶不能用磨口玻璃塞
C.与两种溶液可用作泡沬灭火剂
D.与溶液可用作焊接金属时的除锈剂
10.在一定温度下的容积不变的密闭容器中充入2molCO和6molH2,使其发生反应:CO(g)+3H2(g) CH4(g)+H2O(g)。下列不能说明反应达到平衡状态的是( )
A.混合气体的压强保持不变 B.混合气体的平均摩尔质量保持不变
C.CH4和H2的体积比保持不变 D.每生成1molCH4消耗1molCO
11.一定温度下,在某密闭容器中发生反应:,若15s内
由0.1降到0.07,则下列说法正确的是( )
A.减小反应体系的体积,化学反应速率不变
B.升高温度正反应速率增大,逆反应速率减小
C.0~15s内用I2表示的平均反应速率为=0.001mol·L—1·s—1
D.由0.07降到0.05所需的反应时间小于10s
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. pH=1的稀硫酸中,含有H+总数为0.1NA
B.16g由O2和O3组成的混合气体中含有氧原子总数为NA
C.1L 0.1mol/L CuCl2溶液中,含有Cu2+总数为0.2NA
D.1mol NaCl的分子数为NA
13.下列实验能达到预期目的是( )
编号 实验内容 实验目的
A 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 证明Na2CO3溶液中存水解平衡
B 室温下,用pH试纸测定浓度为0.1 mol·L 1 NaClO溶液和0.1 mol·L 1 溶液的pH 比较HClO和CH3COOH的酸性强弱
C 等体积pH=2的HX和HY两种酸分别与足量的锌粒反应,排水法收集气体,HX放出的氢气多且反应速率快 证明HX酸性比HY强
D 制备无水 将氯化铁溶液在盐酸中蒸发结晶
14.科学家研究了乙醇催化合成乙酸乙酯2C2H5OH(g)CH3COOC2H5(g)+2H2(g)的新方法。在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。下列推测合理的是( )
A.乙醛是该反应的催化剂
B.加压有利于提高乙酸乙酯的产率
C.提高催化剂的活性和选择性,减少乙醚等副产物是工艺的关键
D.随着温度的升高,乙酸乙酯的质量分数先增大后减小,说明该反应是吸热反应
15.根据表中数据判断,下列选项结论正确的是( )
酸 H2C2O4 HCN H2CO3
电离常数(25℃) K1= 5.6×10-2 K1= 1.5×10-4 K= 6.2×10-10 K1= 4.5×10-7 K2 = 4.4×10-11
A.NaCN + H2O + CO2 (少量) = HCN + Na2CO3
B.0.1mol/L的Na2CO3溶液逐渐滴加到同浓度的HCN溶液中,无明显现象,说明无反应
C.浓度均为的Na2CO3、NaHCO3、、溶液,最大的是Na2CO3
D.溶液呈酸性,溶液中离子浓度由大到小的顺序是
16.科学研究人员结合实验与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示。其中吸附在Pt/SiO2催化剂表面上的物种用“ ”标注,Ts表示过渡态。下列有关叙述不正确的是( )
A. HOCO转化为 CO和 OH为吸热过程
B.形成过渡态Ts1的活化能(能垒)为1.05eV
C.前三步总反应的△H<0,总反应的化学反应速率由第一步反应决定
D.历程中活化能最小的反应方程式 CO+ OH+ H+3H2(g)= CO+3H2(g)+H2O(g)
二.非选择题:本题共4小题,全部为必考题,共56分。
17.(14分)回答下列问题:
Ⅰ、用括号内的字母代号填空:中和热测定实验时,若用环形铜丝代替环形玻璃搅拌棒,会导致测定的数值_______(A.偏高;B.偏低)
Ⅱ、甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1。该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:2CO(g)+4H2(g)2CH3OH(g) ΔH=-182.0 kJ·mol-1
ⅱ.甲醇脱水反应:
(1)请写出ⅱ中甲醇脱水反应的热化学方程式:____________________________________。
(2) 在一定条件下,将CO和H2按体积比1∶2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列不能说明该反应达到平衡状态的是___________(填字母)。
A.混合气体的总物质的量保持不变
B.混合气体的密度保持不变
C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
D.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(3)生产甲醚的过程中还存在以下副反应,与甲醇脱水反应形成竞争:CH3OH(g)+H2O(g)CO2(g)+3H2(g) ΔH=+48.8 kJ·mol-1,将反应物混合气按进料比n(CO)∶n(H2)=1∶2通入反应装置,选择合适的催化剂。在不同温度和压强下,测得甲醚的选择性分别如图1、图2所示。
资料:甲醚的选择性是指转化为甲醚的CO在全部CO反应物中所占的比例。
①图1中,温度一定,压强增大,甲醚选择性增大的原因是_____________________。
②图2中,温度高于265℃后,甲醚选择性降低的原因是____________________________。
18.(14分)某实验小组探究外界条件对化学反应速率的影响,进行了以下实验。
Ⅰ.探究温度、浓度对硫代硫酸钠与稀硫酸反应速率的影响
(1)写出Na2S2O3与H2SO4反应的离子方程式
(2)该小组同学设计了如下表所示系列实验:
实验序号 反应温度/℃ Na2S2O3溶液 H2SO4稀溶液 H2O
V/mL c/(mol/L) V/mL c/(mol/L) V/mL
① 20 10.0 0.10 10.0 0.50 0
② t1 V1 0.10 V2 0.50 V3
③ t2 V4 0.10 V5 0.50 V6
实验①和②探究温度对该反应速率的影响,则实验②中,t1=_______(填“20℃”或“60℃”)、V2= _______mL。
若V5=6.0,实验①和③的实验目的是
Ⅱ.探究催化剂对H2O2分解速率的影响
(3)按下图进行定量实验研究。挤压注射器使FeCl3溶液全部加入试管中,记录数据;用CuCl2溶液代替FeCl3溶液进行平行实验,比较催化剂对反应速率的影响。该实验需测定的实验数据是
(4)用上图中的装置,探究MnO2催化H2O2分解的最佳条件。此时注射器中应加入的试剂是_______。挤压注射器使液体全部加入试管中开始至不再有气体产生,记录反应时间。反应物用量和反应时间如下表:
H2O2 时间 MMMMMMMM 0.1g 0.3g 0.8g
10mL1.5% 223s 67s 56s
10mL3.0% 308s 109s 98s
10mL4.5% 395s 149s 116s
分析表中数据,从实验效果和“绿色化学”的角度考虑,H2O2的浓度一定时,加入_______g的MnO2为较佳选择。
(14分)丙酮蒸气热裂解可生产乙烯酮,反应为
(g) + ,
现对该热裂解反应进行研究,回答下列问题:
化学键 C H C C
键能 412 348 612
(1)根据表格中的键能数据,计算____________ ;
(2)丙酮的平衡转化率随温度、压强变化如图所示:
①图中X表示的物理量是 ____________;
②A、C两点化学平衡常数 KA____________ KC (填“>”、“<”或“=”);
③恒容下,既可提高反应速率,又可提高丙酮平衡转化率的一条合理措施是________________________。
(3)在容积可变的恒温密闭容器中,充入丙酮蒸气维持恒压 (110kPa)
经过时间t min,丙酮转化了10%。用单位时间内气体分压变化表示的反应速率
v(丙酮)= kPa/min;
②该条件平衡时丙酮转化率为a,则KP = (以平衡时分压代替浓度计算)
( 分压总压物质的量分数 )
(4)其他条件相同,在甲、乙两种催化剂作用下发生该反应,相同时间时丙酮的转化率与温度的关系如图所示。工业上选择催化剂____________ (填“甲”或“乙”)。
20.(14分)醋酸是一种常见的弱酸,回答下列问题:
Ⅰ、(1)向100 mL 0.1 mol·L 1的醋酸中加入V mL 0.1 mol·L 1的NaOH溶液完全反应后,溶液呈中性,则V____100 mL(填“>”“<”或“=”)。
(2)25℃时,pH=8的CH3COONa溶液中,水电离产生的OH 浓度c(OH )水=___________。
Ⅱ、某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室的标准NaOH溶液对其进行滴定实验以测定它的准确浓度,操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”以下某一刻度,并记下读数
④经准确操作后,量取V mL待测液注入洁净的锥形瓶中,并加入3滴指示剂溶液
⑤用标准液滴定至终点,记下滴定管液面读数
(完全反应时所得溶液的pH大致为9)
以上步骤有错误的是____________ (填序号)。
Ⅲ、(1)如图表示50 mL滴定管中液面的位置,若A与C刻度间相差1 mL,
A处的刻度为25,滴定管中液面读数应为___________mL;
(2)为减小实验误差,该实验最好选用 (填石蕊、酚酞或甲基橙)作指示剂;除此外该同学一共进行了三次实验,假设每次所取白醋体积均为V mL,NaOH标准液浓度为c mol·L 1,三次实验结果记录如下:
实验次数 第一次 第二次 第三次
消耗NaOH溶液体积/mL 26.02 25.35 25.30
从表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是___________。
A.实验结束时,仰视刻度线读取滴定终/点时NaOH溶液的体积
B.滴定前滴定管尖嘴无气泡,滴定结束尖嘴部分有气泡
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.锥形瓶预先用食用白醋润洗过
(3)据②所得到的数据,写出计算该白醋中醋酸的物质的量浓度的表达式c=____ mol·L 1
(只代数据不必化简)。
选择题,44分
1 2 3 4 5 6 7 8 9 10
A B C B D D C B A D
11 12 13 14 15 16
C B A C C A
二、非选择题,56分
17、(14分)
Ⅰ、B (2分)
Ⅱ、(1)2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1 (2分),
(2)BC(4分)
(3)①副反应CH3OH(g)+H2O(g)CO2(g)+3H2(g)逆向移动,被抑制;甲醇脱水反应2CH3OH(g)CH3OCH3(g)+H2O(g)不受压强影响(3分)
②甲醇脱水反应2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1正向为放热反应,升高温度平衡逆移,甲醚选择性降低;副反应CH3OH(g)+H2O(g)CO2(g)+3H2(g)
ΔH=+48.8 kJ·mol 1正向为吸热反应,升高温度平衡正移,副产物增加,甲醚选择性降低(3分)(以上①②回答有相同意思即可给分)
(14分)
(1)(2分)
(2) 60℃ (2分) 、 10.0 (2分)、
其它条件不变时, 探究H2SO4浓度对该反应速率的影响(2分)
(3)一定时间内产生气体的体积(或生成相同体积的气体所需要的时间) (2分)
(4)H2O2溶液(2分) 0.3(2分)
19、(14分)
(1)+84(2分)(2)①压强(2分) 、 ②< (2分) 、 ③升高温度(2分)
(3)①(2分) 、 ②(2分) (4)乙 (2分)
20.(14分)
Ⅰ、(1)<(2分) (2)1.0×10 6 mol·L 1(2分)
Ⅱ、① (2分) Ⅲ、(1)25.40(2分) (2) 酚酞(2分)、AD(2分)
(2分)
同课章节目录
