高中化学专题3微粒间作用力与物质性质第1单元金属键金属晶体课件(共33张PPT)苏教版选择性必修2
文档属性
| 名称 | 高中化学专题3微粒间作用力与物质性质第1单元金属键金属晶体课件(共33张PPT)苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 22:51:26 | ||
图片预览










文档简介
(共33张PPT)
第一单元 金属键 金属晶体
专题3
内容索引
01
02
03
自主预习 新知导学
合作探究 释疑解惑
课堂小结
课标定位、素养阐释
1.能从微观角度分析金属晶体中的构成微粒及粒子之间的相互作用,理解金属键的实质,知道影响金属键强弱的因素,并能用金属键解释金属的某些特征性质。
2.知道晶体、晶胞的概念,认识金属晶体中微粒间的堆积方式,能从晶胞的角度认识晶体的内部结构,并能用均摊法分析晶胞组成。
自主预习 新知导学
一、金属键
1.通常情况下,金属原子的部分或全部外围电子受原子核的束缚比较弱。在金属晶体内部,它们可以从原子上“脱落”下来,形成自由移动的电子。化学上把 金属离子 与 自由电子 之间强烈的相互作用称为金属键。
2.金属键的特征:金属键无方向性和饱和性。晶体里的电子不专属于某几个特定的金属离子,而是几乎均匀地分布在整个晶体里,把所有金属原子维系在一起,所以金属键没有方向性和饱和性。
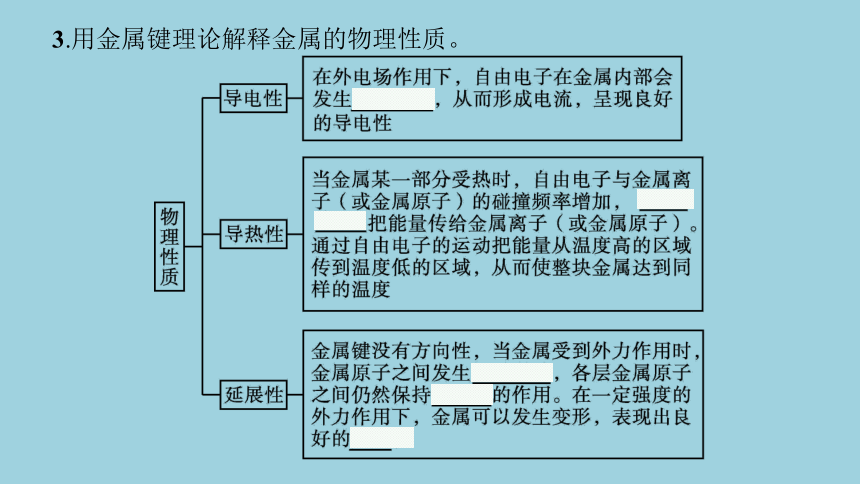
3.用金属键理论解释金属的物理性质。
4.金属的原子化热。
(1)金属键的强弱可以用金属的原子化热来衡量。金属的原子化热是指 1 mol金属固体完全气化成相互远离的气态原子时吸收的能量。
(2)意义:衡量金属键的强弱。金属的原子化热数值越大,金属键越 强 。
5.影响金属键强弱的因素:金属元素原子半径越 小 ,单位体积内自由移动电子数目越 多 ,金属键越强。
6.金属键的强弱对金属单质物理性质的影响:
金属的硬度和熔、沸点等物理性质与金属键的强弱有关。金属键越强,金属晶体的硬度越 大 ,熔、沸点越 高 。
【自主思考】 金属导电与电解质溶液导电有什么区别
提示:金属导电的微粒是电子,电解质溶液导电的微粒是阳离子和阴离子;金属导电过程不生成新物质,属于物理变化,而电解质溶液导电的同时要在阴、阳两极生成新物质,属于化学变化,故两者导电的本质是不同的。
二、金属晶体
1.存在。
通常条件下,大多数金属单质及其合金也是晶体。在金属晶体中,金属原子如同半径相等的小球一样,彼此相切、紧密堆积成晶体。
2.组成单元——晶胞。
能够反映晶体结构特征的 基本重复单位 。金属晶体是金属晶胞在空间连续重复延伸而形成的。
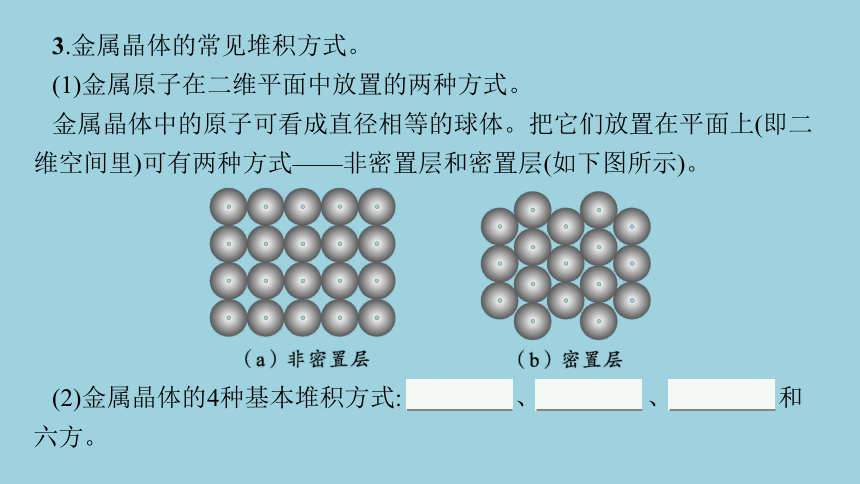
3.金属晶体的常见堆积方式。
(1)金属原子在二维平面中放置的两种方式。
金属晶体中的原子可看成直径相等的球体。把它们放置在平面上(即二维空间里)可有两种方式——非密置层和密置层(如下图所示)。
(2)金属晶体的4种基本堆积方式: 简单立方 、体心立方 、面心立方 和六方。
4.立方体晶胞中微粒数目的计算。
(1)晶胞的顶点原子为 8 个晶胞共用;
(3)晶胞面上的原子为 2 个晶胞共用。
如金属铜的一个晶胞(如图所示)均摊到的原子数为 4 。
铜晶胞
5.合金的组成和性质。
(1)合金:一种 金属 与另一种或几种 金属(或非金属) 的融合体。
(2)合金的性能:通常多数合金的熔点比它的成分金属的熔点要 低 ,而强度和硬度比它的成分金属要 大 。
(3)常见合金:不锈钢、储氢材料、形状记忆合金、钛合金等。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)金属的导电性与导热性均与自由电子有关。( )
(2)金属受外力作用变形后仍保持金属键的作用。( )
(3)金属键没有方向性和饱和性。( )
(4)金属中的自由电子来源于金属原子的部分或全部外围电子。( )
√
√
√
√
2.如图所示为甲、乙、丙三种晶体。
试写出:(1)甲晶体的化学式(X为阳离子) 。
(2)乙晶体中A、B、C三种微粒的个数比 。
(3)丙晶体中每个D周围结合E的个数 。
答案:(1)X2Y
(2)1∶3∶1
(3)8
合作探究 释疑解惑
探究任务1
金属晶体的结构与性质
【问题引领】
1.Na、Mg、Al的熔点如何变化 如何解释
提示:Na、Mg、Al的熔点逐渐升高,原因是金属阳离子半径减小,所带电荷增多,则金属键增强,金属的熔、沸点升高。
2.随着核电荷数的增加,碱金属单质的熔、沸点如何变化 如何解释
提示:从上到下熔、沸点降低,原因是金属阳离子半径增大,所带电荷相同,则金属键减弱,金属的熔、沸点就降低。
【归纳提升】
1.金属晶体的堆积方式。
堆积方式 图式 实例 配位数
简单立 方堆积 钋 6
体心立 方堆积 钠、钾、铬、钼、钨等 8
面心立 方堆积 金、银、 铜、铅等 12
六方堆积 镁、锌、 钛等 12
2.金属晶体熔、沸点高低的比较。
金属阳离子半径越小,所带电荷越多,则金属键越强,金属的熔、沸点就越高,一般存在以下规律:
(1)同周期金属单质,从左到右熔、沸点升高。
(2)同主族金属单质,从上到下熔、沸点降低。
(3)合金的熔、沸点比其各成分金属的熔、沸点低。
(4)金属晶体熔点差别很大,如汞常温下为液体,熔点很低(-38.9 ℃),而钨等金属熔点很高。
【典型例题】
【例题1】 (双选)下列关于金属晶体的叙述正确的是( )。
A.常温下,金属单质都以金属晶体形式存在
B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越好
答案:BC
解析:A项,Hg在常温下为液态。C项,r(Ca)K,所以金属键Ca>K,故熔、沸点Ca>K。D项,金属的导电性随温度升高而降低。
【变式训练1】 下列关于金属的叙述中,不正确的是( )。
A.金属键是金属离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,其实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
C.金属键是带异性电荷的金属离子和自由电子间的相互作用,故金属键无饱和性和方向性
D.金属中的自由电子在整个金属内部的三维空间中做自由运动
解析:从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用,特征都是无方向性和饱和性,自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键与共价键有类似之处,但两者又有明显的不同,如金属键无方向性和饱和性。
B
【问题引领】
探究任务2
晶胞的计算
下图是铜晶胞中所填入的原子及其切割示意图。结合示意图提供的信息分析下列问题。
现有甲、乙、丙(如图所示)三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心)。
1.分析铜晶胞的切割示意图,你能获取哪些有关晶胞原子组成的信息
提示:晶胞的顶角原子为8个晶胞共用;晶胞面上的原子为2个晶胞共用。
2.甲晶体中X与Y的个数比是多少 乙晶体中A与B的个数比是多少
提示:甲晶体中,X位于体心,Y位于顶点,所以N(X)∶N(Y)=1∶(6× )=4∶3。乙晶体中,A位于体心,B位于顶点,8× =1,所以N(A)∶N(B)=1∶1。
3.丙晶体中每个晶胞包含有C离子、D离子各为多少
提示:丙晶体中,C离子个数为12× +1=4,D离子个数为8× +6× =4。
【归纳提升】
1.晶胞的特点。
(1)晶胞一般是平行六面体,其三条边的长度不一定相等,也不一定互相垂直。晶胞的形状和大小由具体晶体的结构所决定。
(2)整个晶体就是晶胞按其周期性在三维空间重复排列而成。每个晶胞上下左右前后无隙并置地排列着与其一样的无数晶胞,决定了晶胞的8个顶点、平行的面以及平行的棱完全相同。
2.晶胞中微粒数目的计算——均摊法。
如某个微粒为n个晶胞所共有,则该微粒有 属于这个晶胞。
(1)立方晶胞中微粒数的计算方法如下:
如图所示的NaCl晶胞中,Na+占据立方体的体心和12条棱的棱心,Cl-占据立方体的顶点和面心。Na+在晶胞中的数目为12× (棱心)+1×1(体心)=4(个);Cl-在晶胞中的数目为8× (顶点)+6× (面心)=4(个)。
因此,在NaCl晶胞中Na+个数与Cl-个数比为1∶1,故NaCl晶体的化学式为NaCl。
(2)六棱柱晶胞中不同位置的粒子数的计算:
(2)非长方体(正方体)晶胞中微粒视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占 。
【典型例题】
【例题2】 (1)如图所示的是二维平面晶体示意图,所表示的化学式为AX3的是 。
(2)如图为一个金属铜的晶胞,请完成以下各题。
①该晶胞“实际”拥有的铜原子是 个。
②该晶胞称为 (填字母)。
A.六方晶胞 B.体心立方晶胞
C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为d g·cm-3,则阿伏加德罗常数为 (用a、d表示)。
归纳总结 立方晶胞中各物理量的关系
【变式训练2】 金属晶体的常见晶胞结构有(a)、(b)、(c)分别代表的三种结构示意图,则图示三种结构的金属原子个数比为( )。
A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9
A
课堂小结
第一单元 金属键 金属晶体
专题3
内容索引
01
02
03
自主预习 新知导学
合作探究 释疑解惑
课堂小结
课标定位、素养阐释
1.能从微观角度分析金属晶体中的构成微粒及粒子之间的相互作用,理解金属键的实质,知道影响金属键强弱的因素,并能用金属键解释金属的某些特征性质。
2.知道晶体、晶胞的概念,认识金属晶体中微粒间的堆积方式,能从晶胞的角度认识晶体的内部结构,并能用均摊法分析晶胞组成。
自主预习 新知导学
一、金属键
1.通常情况下,金属原子的部分或全部外围电子受原子核的束缚比较弱。在金属晶体内部,它们可以从原子上“脱落”下来,形成自由移动的电子。化学上把 金属离子 与 自由电子 之间强烈的相互作用称为金属键。
2.金属键的特征:金属键无方向性和饱和性。晶体里的电子不专属于某几个特定的金属离子,而是几乎均匀地分布在整个晶体里,把所有金属原子维系在一起,所以金属键没有方向性和饱和性。
3.用金属键理论解释金属的物理性质。
4.金属的原子化热。
(1)金属键的强弱可以用金属的原子化热来衡量。金属的原子化热是指 1 mol金属固体完全气化成相互远离的气态原子时吸收的能量。
(2)意义:衡量金属键的强弱。金属的原子化热数值越大,金属键越 强 。
5.影响金属键强弱的因素:金属元素原子半径越 小 ,单位体积内自由移动电子数目越 多 ,金属键越强。
6.金属键的强弱对金属单质物理性质的影响:
金属的硬度和熔、沸点等物理性质与金属键的强弱有关。金属键越强,金属晶体的硬度越 大 ,熔、沸点越 高 。
【自主思考】 金属导电与电解质溶液导电有什么区别
提示:金属导电的微粒是电子,电解质溶液导电的微粒是阳离子和阴离子;金属导电过程不生成新物质,属于物理变化,而电解质溶液导电的同时要在阴、阳两极生成新物质,属于化学变化,故两者导电的本质是不同的。
二、金属晶体
1.存在。
通常条件下,大多数金属单质及其合金也是晶体。在金属晶体中,金属原子如同半径相等的小球一样,彼此相切、紧密堆积成晶体。
2.组成单元——晶胞。
能够反映晶体结构特征的 基本重复单位 。金属晶体是金属晶胞在空间连续重复延伸而形成的。
3.金属晶体的常见堆积方式。
(1)金属原子在二维平面中放置的两种方式。
金属晶体中的原子可看成直径相等的球体。把它们放置在平面上(即二维空间里)可有两种方式——非密置层和密置层(如下图所示)。
(2)金属晶体的4种基本堆积方式: 简单立方 、体心立方 、面心立方 和六方。
4.立方体晶胞中微粒数目的计算。
(1)晶胞的顶点原子为 8 个晶胞共用;
(3)晶胞面上的原子为 2 个晶胞共用。
如金属铜的一个晶胞(如图所示)均摊到的原子数为 4 。
铜晶胞
5.合金的组成和性质。
(1)合金:一种 金属 与另一种或几种 金属(或非金属) 的融合体。
(2)合金的性能:通常多数合金的熔点比它的成分金属的熔点要 低 ,而强度和硬度比它的成分金属要 大 。
(3)常见合金:不锈钢、储氢材料、形状记忆合金、钛合金等。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)金属的导电性与导热性均与自由电子有关。( )
(2)金属受外力作用变形后仍保持金属键的作用。( )
(3)金属键没有方向性和饱和性。( )
(4)金属中的自由电子来源于金属原子的部分或全部外围电子。( )
√
√
√
√
2.如图所示为甲、乙、丙三种晶体。
试写出:(1)甲晶体的化学式(X为阳离子) 。
(2)乙晶体中A、B、C三种微粒的个数比 。
(3)丙晶体中每个D周围结合E的个数 。
答案:(1)X2Y
(2)1∶3∶1
(3)8
合作探究 释疑解惑
探究任务1
金属晶体的结构与性质
【问题引领】
1.Na、Mg、Al的熔点如何变化 如何解释
提示:Na、Mg、Al的熔点逐渐升高,原因是金属阳离子半径减小,所带电荷增多,则金属键增强,金属的熔、沸点升高。
2.随着核电荷数的增加,碱金属单质的熔、沸点如何变化 如何解释
提示:从上到下熔、沸点降低,原因是金属阳离子半径增大,所带电荷相同,则金属键减弱,金属的熔、沸点就降低。
【归纳提升】
1.金属晶体的堆积方式。
堆积方式 图式 实例 配位数
简单立 方堆积 钋 6
体心立 方堆积 钠、钾、铬、钼、钨等 8
面心立 方堆积 金、银、 铜、铅等 12
六方堆积 镁、锌、 钛等 12
2.金属晶体熔、沸点高低的比较。
金属阳离子半径越小,所带电荷越多,则金属键越强,金属的熔、沸点就越高,一般存在以下规律:
(1)同周期金属单质,从左到右熔、沸点升高。
(2)同主族金属单质,从上到下熔、沸点降低。
(3)合金的熔、沸点比其各成分金属的熔、沸点低。
(4)金属晶体熔点差别很大,如汞常温下为液体,熔点很低(-38.9 ℃),而钨等金属熔点很高。
【典型例题】
【例题1】 (双选)下列关于金属晶体的叙述正确的是( )。
A.常温下,金属单质都以金属晶体形式存在
B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔、沸点高于钾
D.温度越高,金属的导电性越好
答案:BC
解析:A项,Hg在常温下为液态。C项,r(Ca)
【变式训练1】 下列关于金属的叙述中,不正确的是( )。
A.金属键是金属离子和自由电子这两种带异性电荷的微粒间的强烈相互作用,其实质与离子键类似,也是一种电性作用
B.金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似,也有方向性和饱和性
C.金属键是带异性电荷的金属离子和自由电子间的相互作用,故金属键无饱和性和方向性
D.金属中的自由电子在整个金属内部的三维空间中做自由运动
解析:从基本构成微粒的性质看,金属键与离子键的实质类似,都属于电性作用,特征都是无方向性和饱和性,自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,从这个角度看,金属键与共价键有类似之处,但两者又有明显的不同,如金属键无方向性和饱和性。
B
【问题引领】
探究任务2
晶胞的计算
下图是铜晶胞中所填入的原子及其切割示意图。结合示意图提供的信息分析下列问题。
现有甲、乙、丙(如图所示)三种晶体的晶胞(甲中X处于晶胞的中心,乙中A处于晶胞的中心)。
1.分析铜晶胞的切割示意图,你能获取哪些有关晶胞原子组成的信息
提示:晶胞的顶角原子为8个晶胞共用;晶胞面上的原子为2个晶胞共用。
2.甲晶体中X与Y的个数比是多少 乙晶体中A与B的个数比是多少
提示:甲晶体中,X位于体心,Y位于顶点,所以N(X)∶N(Y)=1∶(6× )=4∶3。乙晶体中,A位于体心,B位于顶点,8× =1,所以N(A)∶N(B)=1∶1。
3.丙晶体中每个晶胞包含有C离子、D离子各为多少
提示:丙晶体中,C离子个数为12× +1=4,D离子个数为8× +6× =4。
【归纳提升】
1.晶胞的特点。
(1)晶胞一般是平行六面体,其三条边的长度不一定相等,也不一定互相垂直。晶胞的形状和大小由具体晶体的结构所决定。
(2)整个晶体就是晶胞按其周期性在三维空间重复排列而成。每个晶胞上下左右前后无隙并置地排列着与其一样的无数晶胞,决定了晶胞的8个顶点、平行的面以及平行的棱完全相同。
2.晶胞中微粒数目的计算——均摊法。
如某个微粒为n个晶胞所共有,则该微粒有 属于这个晶胞。
(1)立方晶胞中微粒数的计算方法如下:
如图所示的NaCl晶胞中,Na+占据立方体的体心和12条棱的棱心,Cl-占据立方体的顶点和面心。Na+在晶胞中的数目为12× (棱心)+1×1(体心)=4(个);Cl-在晶胞中的数目为8× (顶点)+6× (面心)=4(个)。
因此,在NaCl晶胞中Na+个数与Cl-个数比为1∶1,故NaCl晶体的化学式为NaCl。
(2)六棱柱晶胞中不同位置的粒子数的计算:
(2)非长方体(正方体)晶胞中微粒视具体情况而定,如石墨晶胞每一层内碳原子排成六边形,其顶点(1个碳原子)被三个六边形共有,每个六边形占 。
【典型例题】
【例题2】 (1)如图所示的是二维平面晶体示意图,所表示的化学式为AX3的是 。
(2)如图为一个金属铜的晶胞,请完成以下各题。
①该晶胞“实际”拥有的铜原子是 个。
②该晶胞称为 (填字母)。
A.六方晶胞 B.体心立方晶胞
C.面心立方晶胞 D.简单立方晶胞
③此晶胞立方体的边长为a cm,Cu的相对原子质量为64,金属铜的密度为d g·cm-3,则阿伏加德罗常数为 (用a、d表示)。
归纳总结 立方晶胞中各物理量的关系
【变式训练2】 金属晶体的常见晶胞结构有(a)、(b)、(c)分别代表的三种结构示意图,则图示三种结构的金属原子个数比为( )。
A.3∶2∶1 B.11∶8∶4 C.9∶8∶4 D.21∶14∶9
A
课堂小结
