专题3微粒间作用力与物质性质第2单元离子键离子晶体课件(共27张PPT)苏教版选择性必修2
文档属性
| 名称 | 专题3微粒间作用力与物质性质第2单元离子键离子晶体课件(共27张PPT)苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1012.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 22:54:22 | ||
图片预览







文档简介
(共27张PPT)
第二单元 离子键 离子晶体
专题3
内容索引
01
02
03
自主预习 新知导学
合作探究 释疑解惑
课堂小结
课标定位、素养阐释
1.能结合实例描述离子键的成键特征及其本质,能解释和预测同类型离子化合物的某些性质。
2.能描述常见类型的离子化合物的晶体结构。
3.能运用模型和有关理论解释不同类型离子化合物的晶胞构成。
自主预习 新知导学
一、离子键的形成
1.形成过程。
离子化合物中,阴、阳离子之间的 静电引力 使阴、阳离子相互吸引,而阴、阳离子的核外电子之间,阴、阳离子的原子核之间的 静电斥力 使阴、阳离子相互排斥。当阴、阳离子之间的 静电引力 和 静电斥力 达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量 最低 状态。
2.特征。
离子键没有 方向 性和 饱和 性
【自主思考1】 离子键是阴、阳离子之间的静电吸引吗
提示:不是。离子键是阴、阳离子之间的静电作用,包括静电引力和静电斥力。
二、离子晶体
1.定义:由 阴、阳离子 按一定方式有规则地排列形成的晶体。
2.物理性质。
(1)离子晶体具有较高的 熔点 ,难挥发。
(2)离子晶体硬而脆,离子晶体中,阴、阳离子间有较强的离子键,离子晶体一般具有一定的硬度。
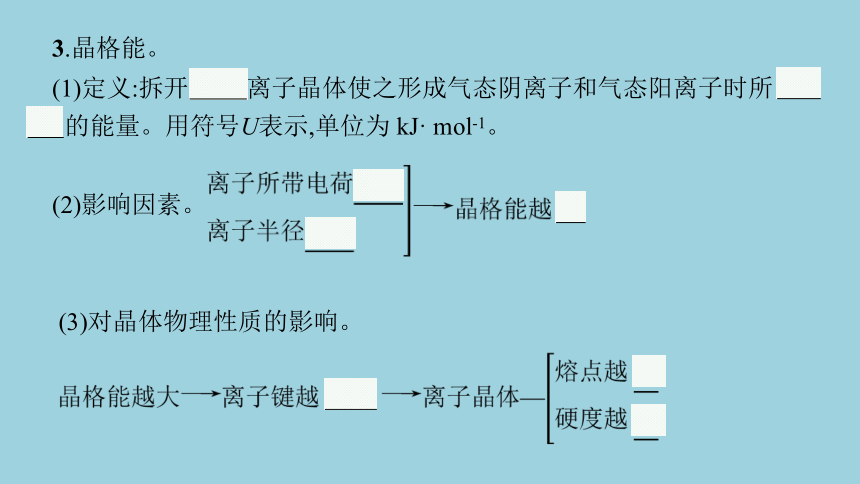
3.晶格能。
(1)定义:拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所 吸收 的能量。用符号U表示,单位为 kJ· mol-1。
(2)影响因素。
(3)对晶体物理性质的影响。
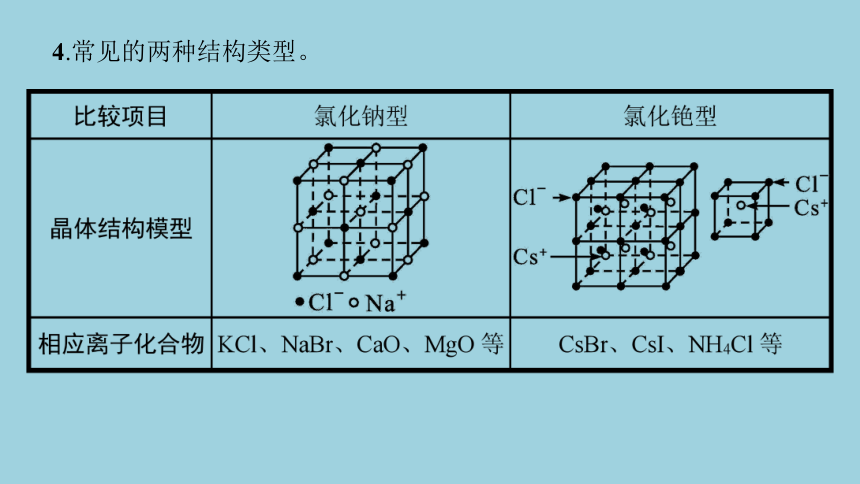
4.常见的两种结构类型。
【自主思考2】 某物质在固态时不导电,熔融状态能导电,能确定该物质一定是离子化合物吗
提示:能。离子化合物固态时不导电,熔融状态可以导电。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)离子晶体中含有阴、阳离子,在固态时导电。( )
(2)离子晶体中不存在共价键。( )
(3)氯化钠、氟化钙晶体我们通常写为NaCl、CaF2,说明晶体中存在组成为NaCl、CaF2的分子。( )
(4)氯化钠的熔点高于氯化钾的熔点。( )
×
×
√
×
2.NaF、NaI和MgO均为离子晶体,有关数据如下表:试判断,这三种化合物熔点由高到低的顺序是( )。
A.①>②>③ B.③>①>② C.③>②>① D.②>①>③
解析:NaF、NaI、MgO均为离子晶体,它们熔点高低由离子键强弱决定,而离子键的强弱与离子半径和离子电荷数有关,MgO中键长最短,离子电荷数最高,故离子键最强,熔点最高。
B
合作探究 释疑解惑
探究任务1
离子晶体的结构与性质
【问题引领】
在我们周围广泛存在着离子化合物,常温下,许多离子化合物以晶体形态存在,如碳酸钙等。
1.离子晶体的熔点一定很高吗
提示:不一定。离子晶体的熔点不一定很高,如NH4Cl。
2.离子晶体中除含有离子键外,是否含有共价键
提示:离子晶体中除含有离子键外,还有可能含有共价键。如Na2O2、NaOH、Ba(OH)2、Na2SO4中均含离子键和共价键。
探究任务1
离子晶体的结构与性质
3.写出下列离子化合物的电子式。
(1)MgCl2 (2)NaOH (3)Na2O2 (4)NaH
【归纳提升】
1.离子晶体的结构。
(1)离子晶体微粒之间的作用力是离子键,离子键不具有饱和性是相对的,每种离子化合物的组成和结构是一定的,而不是任意的。
(2)离子晶体中存在的微粒是阳离子和阴离子,离子晶体的化学式只表示晶体中阴、阳离子的个数比,而不是表示其组成。
2.离子晶体的性质。
(1)离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性。
(2)离子晶体不导电,但在熔融状态或水溶液中能导电。
(3)离子晶体一般难溶于有机溶剂(如苯、汽油)而易溶于水。
(4)离子晶体的熔点取决于构成晶体的阴、阳离子间离子键的强弱,而离子键的强弱,可用晶格能的大小来衡量。
易错提醒
离子晶体中不一定含有金属阳离子,如NH4Cl为离子晶体,不含有金属阳离子,但一定含有阴离子。
【典型例题】
【例题1】 MgO、Cs2O、CaO、BaO四种离子晶体熔点的高低顺序是
( )。
A.MgO>Cs2O>BaO>CaO B.MgO>CaO>BaO>Cs2O
C.CaO>BaO>MgO>Cs2O D.CaO>BaO>Cs2O>MgO
解析:四种离子晶体所含阴离子相同,所含阳离子不同。对Mg2+、Cs+、Ca2+、Ba2+进行比较,Cs+半径大,所带电荷数少,其与O2-形成的离子键最弱,故Cs2O的熔点最低。对Mg2+、Ca2+、Ba2+进行比较,它们所带电荷一样多,半径Mg2+CaO>BaO,相应离子晶体的熔点由高到低的顺序为MgO>CaO>BaO。综上所述,四种离子晶体熔点的高低顺序是MgO>CaO>BaO>Cs2O。
B
【变式训练1】 萤石(CaF2)是一种难溶于水的固体。下列实验事实能说明CaF2一定是离子晶体的是( )。
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
答案:C
解析:离子晶体区别于其他晶体的突出特点是固体不导电,熔融状态下能导电。
【问题引领】
探究任务2
晶胞的计算
1个CaO立方体晶胞中含有几个Ca2+、几个O2-
提示:4个Ca2+、4个O2-。
【归纳提升】
晶体类型 晶胞示意图 结构特点
NaCl型(KCl、NaBr、 CaO、MgO)等 ①Na+、Cl-的配位数均为6。
②每个Na+(Cl-)周围紧邻(距离最近且相等)的Cl-(Na+)构成正八面体。
③每个Na+(Cl-)周围紧邻的Na+(Cl-)有12个。
④每个晶胞中含有4个Na+、4个Cl-
CsCl型(CsBr、 CsI、NH4Cl等) ①Cs+、Cl-的配位数均为8。
②每个Cs+(Cl-)周围紧邻的Cl-(Cs+)构成正六面体。
③每个Cs+(Cl-)周围紧邻的Cs+(Cl-)有6个。
④每个晶胞中含1个Cs+、1个Cl-
【典型例题】
【例题2】 超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0,部分为-2。如图为超氧化钾晶体的一个晶胞。下列说法正确的是( )。
A.超氧化钾的化学式为KO2,
每个晶胞含有4个K+和4个
B.晶体中每个K+周围有8个 ,
每个 周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧元素与-2价氧元素的原
子个数比为1∶3
A
【变式训练2】 如图所示是从NaCl或CsCl的晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )。(球的大小不反映离子半径的实际大小)
A.图(1)和(3) B.图(2)和(3) C.图(1)和(4) D.只有图(4)
C
解析:本题考查了离子晶体的代表物质NaCl、CsCl的晶体结构。NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体;同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图,C项正确。
课堂小结
第二单元 离子键 离子晶体
专题3
内容索引
01
02
03
自主预习 新知导学
合作探究 释疑解惑
课堂小结
课标定位、素养阐释
1.能结合实例描述离子键的成键特征及其本质,能解释和预测同类型离子化合物的某些性质。
2.能描述常见类型的离子化合物的晶体结构。
3.能运用模型和有关理论解释不同类型离子化合物的晶胞构成。
自主预习 新知导学
一、离子键的形成
1.形成过程。
离子化合物中,阴、阳离子之间的 静电引力 使阴、阳离子相互吸引,而阴、阳离子的核外电子之间,阴、阳离子的原子核之间的 静电斥力 使阴、阳离子相互排斥。当阴、阳离子之间的 静电引力 和 静电斥力 达到平衡时,阴、阳离子保持一定的平衡核间距,形成稳定的离子键,整个体系达到能量 最低 状态。
2.特征。
离子键没有 方向 性和 饱和 性
【自主思考1】 离子键是阴、阳离子之间的静电吸引吗
提示:不是。离子键是阴、阳离子之间的静电作用,包括静电引力和静电斥力。
二、离子晶体
1.定义:由 阴、阳离子 按一定方式有规则地排列形成的晶体。
2.物理性质。
(1)离子晶体具有较高的 熔点 ,难挥发。
(2)离子晶体硬而脆,离子晶体中,阴、阳离子间有较强的离子键,离子晶体一般具有一定的硬度。
3.晶格能。
(1)定义:拆开1 mol离子晶体使之形成气态阴离子和气态阳离子时所 吸收 的能量。用符号U表示,单位为 kJ· mol-1。
(2)影响因素。
(3)对晶体物理性质的影响。
4.常见的两种结构类型。
【自主思考2】 某物质在固态时不导电,熔融状态能导电,能确定该物质一定是离子化合物吗
提示:能。离子化合物固态时不导电,熔融状态可以导电。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)离子晶体中含有阴、阳离子,在固态时导电。( )
(2)离子晶体中不存在共价键。( )
(3)氯化钠、氟化钙晶体我们通常写为NaCl、CaF2,说明晶体中存在组成为NaCl、CaF2的分子。( )
(4)氯化钠的熔点高于氯化钾的熔点。( )
×
×
√
×
2.NaF、NaI和MgO均为离子晶体,有关数据如下表:试判断,这三种化合物熔点由高到低的顺序是( )。
A.①>②>③ B.③>①>② C.③>②>① D.②>①>③
解析:NaF、NaI、MgO均为离子晶体,它们熔点高低由离子键强弱决定,而离子键的强弱与离子半径和离子电荷数有关,MgO中键长最短,离子电荷数最高,故离子键最强,熔点最高。
B
合作探究 释疑解惑
探究任务1
离子晶体的结构与性质
【问题引领】
在我们周围广泛存在着离子化合物,常温下,许多离子化合物以晶体形态存在,如碳酸钙等。
1.离子晶体的熔点一定很高吗
提示:不一定。离子晶体的熔点不一定很高,如NH4Cl。
2.离子晶体中除含有离子键外,是否含有共价键
提示:离子晶体中除含有离子键外,还有可能含有共价键。如Na2O2、NaOH、Ba(OH)2、Na2SO4中均含离子键和共价键。
探究任务1
离子晶体的结构与性质
3.写出下列离子化合物的电子式。
(1)MgCl2 (2)NaOH (3)Na2O2 (4)NaH
【归纳提升】
1.离子晶体的结构。
(1)离子晶体微粒之间的作用力是离子键,离子键不具有饱和性是相对的,每种离子化合物的组成和结构是一定的,而不是任意的。
(2)离子晶体中存在的微粒是阳离子和阴离子,离子晶体的化学式只表示晶体中阴、阳离子的个数比,而不是表示其组成。
2.离子晶体的性质。
(1)离子晶体中阴、阳离子交替出现,层与层之间如果滑动,同性离子相邻而使斥力增大导致不稳定,所以离子晶体无延展性。
(2)离子晶体不导电,但在熔融状态或水溶液中能导电。
(3)离子晶体一般难溶于有机溶剂(如苯、汽油)而易溶于水。
(4)离子晶体的熔点取决于构成晶体的阴、阳离子间离子键的强弱,而离子键的强弱,可用晶格能的大小来衡量。
易错提醒
离子晶体中不一定含有金属阳离子,如NH4Cl为离子晶体,不含有金属阳离子,但一定含有阴离子。
【典型例题】
【例题1】 MgO、Cs2O、CaO、BaO四种离子晶体熔点的高低顺序是
( )。
A.MgO>Cs2O>BaO>CaO B.MgO>CaO>BaO>Cs2O
C.CaO>BaO>MgO>Cs2O D.CaO>BaO>Cs2O>MgO
解析:四种离子晶体所含阴离子相同,所含阳离子不同。对Mg2+、Cs+、Ca2+、Ba2+进行比较,Cs+半径大,所带电荷数少,其与O2-形成的离子键最弱,故Cs2O的熔点最低。对Mg2+、Ca2+、Ba2+进行比较,它们所带电荷一样多,半径Mg2+
B
【变式训练1】 萤石(CaF2)是一种难溶于水的固体。下列实验事实能说明CaF2一定是离子晶体的是( )。
A.CaF2难溶于水,其水溶液的导电性极弱
B.CaF2的熔点较高,硬度较大
C.CaF2固体不导电,但在熔融状态下可以导电
D.CaF2在有机溶剂(如苯)中的溶解度极小
答案:C
解析:离子晶体区别于其他晶体的突出特点是固体不导电,熔融状态下能导电。
【问题引领】
探究任务2
晶胞的计算
1个CaO立方体晶胞中含有几个Ca2+、几个O2-
提示:4个Ca2+、4个O2-。
【归纳提升】
晶体类型 晶胞示意图 结构特点
NaCl型(KCl、NaBr、 CaO、MgO)等 ①Na+、Cl-的配位数均为6。
②每个Na+(Cl-)周围紧邻(距离最近且相等)的Cl-(Na+)构成正八面体。
③每个Na+(Cl-)周围紧邻的Na+(Cl-)有12个。
④每个晶胞中含有4个Na+、4个Cl-
CsCl型(CsBr、 CsI、NH4Cl等) ①Cs+、Cl-的配位数均为8。
②每个Cs+(Cl-)周围紧邻的Cl-(Cs+)构成正六面体。
③每个Cs+(Cl-)周围紧邻的Cs+(Cl-)有6个。
④每个晶胞中含1个Cs+、1个Cl-
【典型例题】
【例题2】 超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0,部分为-2。如图为超氧化钾晶体的一个晶胞。下列说法正确的是( )。
A.超氧化钾的化学式为KO2,
每个晶胞含有4个K+和4个
B.晶体中每个K+周围有8个 ,
每个 周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中,0价氧元素与-2价氧元素的原
子个数比为1∶3
A
【变式训练2】 如图所示是从NaCl或CsCl的晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )。(球的大小不反映离子半径的实际大小)
A.图(1)和(3) B.图(2)和(3) C.图(1)和(4) D.只有图(4)
C
解析:本题考查了离子晶体的代表物质NaCl、CsCl的晶体结构。NaCl晶体中,每个Na+周围最邻近的Cl-有6个,构成正八面体;同理,每个Cl-周围最邻近的6个Na+也构成正八面体,由此可知图(1)和(4)是从NaCl晶体中分割出来的结构图,C项正确。
课堂小结
