专题3微粒间作用力与物质性质第3单元共价键共价晶体第1课时共价键课件(共42张PPT)苏教版选择性必修2
文档属性
| 名称 | 专题3微粒间作用力与物质性质第3单元共价键共价晶体第1课时共价键课件(共42张PPT)苏教版选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 22:55:02 | ||
图片预览










文档简介
(共42张PPT)
第1课时 共价键
专题3
第三单元
内容索引
01
02
03
自主预习 新知导学
合作探究 释疑解惑
课堂小结
课标定位、素养阐释
1.了解共价键的形成条件及实质,能从微观角度分析共价键的类型,会区分σ键和π键,极性键和非极性键,促进宏观辨识与微观探析学科核心素养的发展。
2.能熟练判断分子中σ键和π键的存在及个数,从而建立判断σ键和π键的思维模型。
自主预习 新知导学
一、共价键的形成
1.通常情况下,吸引电子能力相近的原子之间通过 共用电子对 形成共价键。
2.形成过程(以氢气分子的形成为例)。
(1)当两个氢原子相互接近时,若两个氢原子核外电子的自旋方向相反,它们接近到一定距离时,两个 1s 轨道发生重叠,电子在两原子核间出现的机会 较大 。随着核间距的减小,核间电子出现的机会增大,体系的能量逐渐 下降 ,达到能量最低状态。核间距进一步减小时,两原子间的斥力使体系的能量迅速上升,这种排斥作用又将氢原子推回到平衡位置。氢分子的形成过程中能量(主要指势能)随核间距的变化如图中曲线a所示。
氢分子的能量与核间距的关系
(2)若两个氢原子核外电子的自旋方向相同,当它们相互接近时,原子间总是排斥作用占主导地位(如图中曲线b所示)。所以两个带有自旋方向 相同 的电子的氢原子不可能形成氢分子。
3.共价键的特征。
【自主思考1】 任何分子中的共价键都有方向性吗
提示:不是,如H2分子中的共价键没有方向性。s轨道是球形的,当两个s轨道电子形成共价键时,没有方向性。
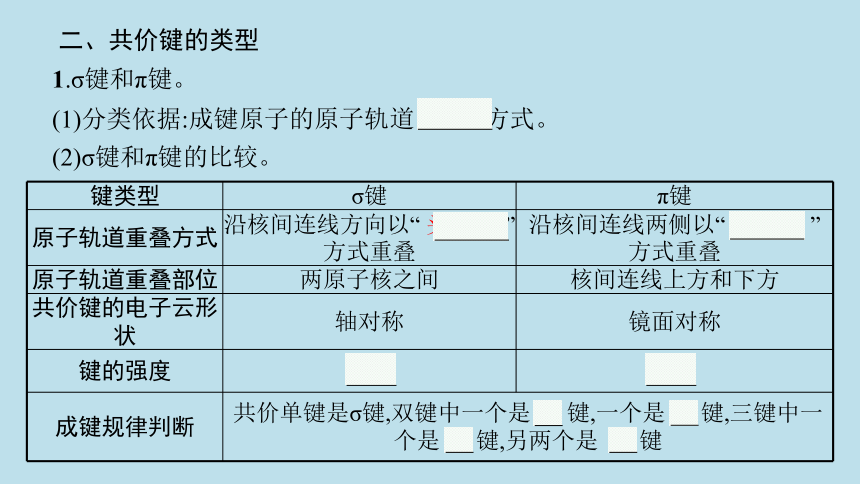
二、共价键的类型
1.σ键和π键。
(1)分类依据:成键原子的原子轨道 重叠 方式。
(2)σ键和π键的比较。
键类型 σ键 π键
原子轨道重叠方式 沿核间连线方向以“ 头碰头 ”方式重叠 沿核间连线两侧以“ 肩并肩 ”方式重叠
原子轨道重叠部位 两原子核之间 核间连线上方和下方
共价键的电子云形状 轴对称 镜面对称
键的强度 较大 较小
成键规律判断 共价单键是σ键,双键中一个是 σ 键,一个是 π 键,三键中一个是 σ 键,另两个是 π 键
2.极性键和非极性键。
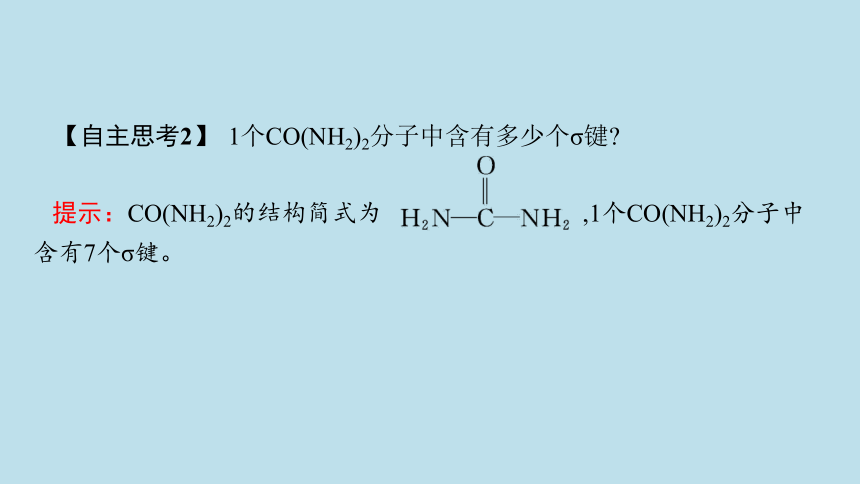
【自主思考2】 1个CO(NH2)2分子中含有多少个σ键
提示:CO(NH2)2的结构简式为 ,1个CO(NH2)2分子中含有7个σ键。
3.配位键。
(1)定义:由一个原子提供孤电子对与另一个有空轨道可接受电子的原子形成共价键。
(2)表示方法:常用“→”表示配位键,其箭头指向接受孤电子对的原子,如
,4个N—H键是完全相同的。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)金属元素原子与非金属元素原子形成的化学键一定是离子键。( )
(2)稀有气体元素原子形成的分子为双原子分子。( )
(3)O2分子中含有1个σ键,1个π键。( )
(4)形成Cl2分子时,p轨道的重叠方式为 。( )
×
×
×
√
2.下列说法不正确的是( )。
A.一般来说,σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有1个σ键,2个π键
答案:C
解析:σ键的“头碰头”重叠比π键“肩并肩”重叠的程度大,所以分子稳定,共价键强,A项正确。s电子只能形成σ键,p电子间优先形成1个σ键且也只能形成1个σ键,所以两个原子之间最多有1个σ键,B项正确。稀有气体是单原子分子,不存在化学键,C项错误。N2分子的结构式为N≡N,而三键是由1个σ键和2个π键组成的,D项正确。
3.过二硫酸(H2S2O8)的结构式为 ,
1分子H2S2O8含有 个σ键, 个极性键, 个非极性键。
答案:11 10 1
合作探究 释疑解惑
探究任务1
共价键的特征及存在
【问题引领】
共价键形成的本质是原子间通过原子轨道重叠产生的强烈的相互作用。原子轨道在两个原子核间重叠,意味着电子出现在核间的机会增大。s轨道和p轨道形成稳定共价键的几种重叠方式如图所示。
1.根据图示分析为什么共价键有方向性
提示:共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现机会最大的方向重叠,重叠程度越大,形成的共价键越牢固,所以共价键有方向性。
2.所有单质中都有共价键吗
提示:并不是所有的单质中都有共价键,稀有气体中不存在化学键,金属单质中不存在共价键。
【归纳提升】
1.共价键的特征。
(1)饱和性。
①一个原子有几个未成对电子,便和几个自旋状态相反的电子配对成键,形成几个共价键。例如1个N原子有3个未成对电子,两个N原子可以形成
N≡N,1个N原子可与3个H原子形成 ,1个NH3分子中含有3个共价键。
②共价键的饱和性决定了共价化合物的分子构成。
(2)方向性。
①共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现机会最大的方向重叠,重叠程度越大,形成的共价键越牢固。同种分子(如HX)中成键原子电子云(原子轨道)重叠程度越大,形成的共价键越牢固,分子结构越稳定。如HX的稳定性:HF>HCl>HBr>HI。
②共价键的方向性决定了分子的空间结构。
2.共价键的存在范围。
易错点拨
(1)所有的共价键都有饱和性,但不是所有的共价键都有方向性,如两个1s轨道(H原子与H原子)重叠形成的s-s σ键没有方向性。
(2)个别金属与非金属元素原子间也可以形成共价键,如BeCl2、AlCl3等原子间均以共价键结合。
(3)并不是所有的单质中都有共价键,稀有气体中不存在化学键,金属单质中不存在共价键。
【典型例题】
【例题1】 (双选)下列说法正确的是( )。
A.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
B.某原子跟其他原子形成共价键时,其共价键数目不一定等于该元素原子的价电子数
C.基态C原子有两个未成对电子,所以最多只能形成2个共价键
D.1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
BD
解析:只有2个s原子轨道重叠形成的共价键没有方向性,其他原子轨道重叠形成的共价键都有方向性,A项不正确。非金属元素的原子形成的共价键数目一般等于该原子最外层的未成对电子数,不能说一定等于该元素原子的价电子数,B项正确。在形成CH4分子的过程中,碳原子2s轨道中的1个电子激发到2p空轨道,这样形成了4个未成对电子,C项不正确。N原子最外层2p轨道上共有3个未成对电子,1个N原子可以与3个H原子结合形成NH3分子,此时共价键饱和,D项正确。
【变式训练1】 下列有关共价键的形成的说法错误的是( )。
A.原子间形成共价键,体系的能量降低
B.原子间形成共价键后,若原子核间距离更近时,体系的能量会更低
C.原子间形成共价键时,电子云在空间部分重叠
D.共用电子对在形成共价键的原子核之间区域出现的机会较大
B
解析:
【问题引领】
探究任务2
晶胞的计算
观察乙烷、乙烯和乙炔分子的结构,回答有关问题。
1.乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成
提示:单键都是σ键,共价双键中有1个σ键、1个π键;共价三键由1个σ键和2个π键组成。乙烷分子中有7个σ键;乙烯分子中有5个σ键和1个π键;乙炔分子中有3个σ键和2个π键。
2.乙烯和乙炔的化学性质为什么比乙烷活泼
提示:乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个π键和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定,不易断裂。
【归纳提升】
1.共价键的分类。
2.非极性键和极性键。
(1)键的极性判断。
(2)极性键的极性强弱。
3.配位键。
配位键是一种特殊的共价键。N、H3O+、H2SO4等以及种类繁多的配位化合物中都存在配位键。配位键与共价键在形成过程上的主要不同是配位键的共用电子对是由某个原子提供的,共价键的共用电子对是成键原子双方共同提供的。
4.单键、双键和三键。
【典型例题】
【例题2】 将下列微粒的序号填在相应的横线上。
①HCl ②N2 ③NH3 ④Na2O2 ⑤H2O2
⑥NH4Cl ⑦NaOH ⑧Ar ⑨CO2 ⑩C2H4
(1)只存在非极性键的分子是 ;既存在非极性键又存在极性键的分子是 ;只存在极性键的分子是 。
(2)只存在单键的分子是 ;存在三键的分子是 ;只存在双键的分子是 ;既存在单键又存在双键的分子是 。
(3)只存在σ键的分子是 ,既存在σ键又存在π键的分子是 。
(4)不存在化学键的是 。
(5)既存在离子键又存在极性键的是 ;既存在离子键又存在非极性键的是 。
答案:(1)② ⑤⑩ ①③⑨
(2)①③⑤ ② ⑨ ⑩
(3)①③⑤ ②⑨⑩
(4)⑧
(5)⑥⑦ ④
解析:(1)氮气分子由两个氮原子形成,只存在非极性键;H2O2中O—H键是极性键,O—O键是非极性键,C2H4中C C键是非极性键,C—H键是极性键,则既存在非极性键又存在极性键的分子是⑤⑩;HCl、NH3和CO2中只存在极性键。
(2)HCl、NH3、H2O2的结构式分别为H—Cl、 、H—O—
O—H,所以只存在单键的分子是①③⑤;氮气的结构式为N≡N,则存在三键的分子是②;CO2中氧原子的最外层有6个电子,能形成两对共用电子对,所以只存在双键的分子是⑨;乙烯的结构式为 ,既存在单键又存在双键。
(3)只存在σ键,即只存在单键,根据上述分析,只存在σ键的分子是①③⑤,含有双键、三键的分子中既存在σ键又存在π键,所以根据上述分析,既存在σ键又存在π键的分子是②⑨⑩。
(4)稀有气体是单原子分子,没有化学键,所以不存在化学键的分子是⑧。
(5)NH4Cl、NaOH中既有离子键又有极性共价键,所以既存在离子键又存在极性键的是⑥⑦;Na2O2中既有O—O非极性键,又有Na+和 之间的离子键,所以既存在离子键又存在非极性键的是④。
知识拓展 共价键的极性强弱
在极性共价键中,成键原子所属元素吸引电子的能力不同,形成的共价键的极性强弱也有所不同。所以,极性键又有强极性键(如H—F键)和弱极性键(如H—I键)之分。
【变式训练2】 下列有关化学键类型的判断错误的( )。
A.s-s σ键与s-p σ键的对称性不同
B.分子中含有共价键,则至少含有一个σ键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
答案: C
解析:s-s σ键无方向性,s-p σ键轴对称,A项正确。在含有共价键的分子中一定含有σ键,可能含有π键,如HCl、N2等,B项正确。碳碳三键中有1个σ键,2个π键,故乙炔(H—C≡C—H)分子中有3个σ键,2个π键,C项错误。单键都为σ键,乙烷分子结构式为 ,其6个C—H键和1个C—C键都为σ键,D项正确。
课堂小结
第1课时 共价键
专题3
第三单元
内容索引
01
02
03
自主预习 新知导学
合作探究 释疑解惑
课堂小结
课标定位、素养阐释
1.了解共价键的形成条件及实质,能从微观角度分析共价键的类型,会区分σ键和π键,极性键和非极性键,促进宏观辨识与微观探析学科核心素养的发展。
2.能熟练判断分子中σ键和π键的存在及个数,从而建立判断σ键和π键的思维模型。
自主预习 新知导学
一、共价键的形成
1.通常情况下,吸引电子能力相近的原子之间通过 共用电子对 形成共价键。
2.形成过程(以氢气分子的形成为例)。
(1)当两个氢原子相互接近时,若两个氢原子核外电子的自旋方向相反,它们接近到一定距离时,两个 1s 轨道发生重叠,电子在两原子核间出现的机会 较大 。随着核间距的减小,核间电子出现的机会增大,体系的能量逐渐 下降 ,达到能量最低状态。核间距进一步减小时,两原子间的斥力使体系的能量迅速上升,这种排斥作用又将氢原子推回到平衡位置。氢分子的形成过程中能量(主要指势能)随核间距的变化如图中曲线a所示。
氢分子的能量与核间距的关系
(2)若两个氢原子核外电子的自旋方向相同,当它们相互接近时,原子间总是排斥作用占主导地位(如图中曲线b所示)。所以两个带有自旋方向 相同 的电子的氢原子不可能形成氢分子。
3.共价键的特征。
【自主思考1】 任何分子中的共价键都有方向性吗
提示:不是,如H2分子中的共价键没有方向性。s轨道是球形的,当两个s轨道电子形成共价键时,没有方向性。
二、共价键的类型
1.σ键和π键。
(1)分类依据:成键原子的原子轨道 重叠 方式。
(2)σ键和π键的比较。
键类型 σ键 π键
原子轨道重叠方式 沿核间连线方向以“ 头碰头 ”方式重叠 沿核间连线两侧以“ 肩并肩 ”方式重叠
原子轨道重叠部位 两原子核之间 核间连线上方和下方
共价键的电子云形状 轴对称 镜面对称
键的强度 较大 较小
成键规律判断 共价单键是σ键,双键中一个是 σ 键,一个是 π 键,三键中一个是 σ 键,另两个是 π 键
2.极性键和非极性键。
【自主思考2】 1个CO(NH2)2分子中含有多少个σ键
提示:CO(NH2)2的结构简式为 ,1个CO(NH2)2分子中含有7个σ键。
3.配位键。
(1)定义:由一个原子提供孤电子对与另一个有空轨道可接受电子的原子形成共价键。
(2)表示方法:常用“→”表示配位键,其箭头指向接受孤电子对的原子,如
,4个N—H键是完全相同的。
【效果自测】
1.判断正误,正确的画“√”,错误的画“×”。
(1)金属元素原子与非金属元素原子形成的化学键一定是离子键。( )
(2)稀有气体元素原子形成的分子为双原子分子。( )
(3)O2分子中含有1个σ键,1个π键。( )
(4)形成Cl2分子时,p轨道的重叠方式为 。( )
×
×
×
√
2.下列说法不正确的是( )。
A.一般来说,σ键比π键重叠程度大,形成的共价键强
B.两个原子之间形成共价键时,最多有1个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有1个σ键,2个π键
答案:C
解析:σ键的“头碰头”重叠比π键“肩并肩”重叠的程度大,所以分子稳定,共价键强,A项正确。s电子只能形成σ键,p电子间优先形成1个σ键且也只能形成1个σ键,所以两个原子之间最多有1个σ键,B项正确。稀有气体是单原子分子,不存在化学键,C项错误。N2分子的结构式为N≡N,而三键是由1个σ键和2个π键组成的,D项正确。
3.过二硫酸(H2S2O8)的结构式为 ,
1分子H2S2O8含有 个σ键, 个极性键, 个非极性键。
答案:11 10 1
合作探究 释疑解惑
探究任务1
共价键的特征及存在
【问题引领】
共价键形成的本质是原子间通过原子轨道重叠产生的强烈的相互作用。原子轨道在两个原子核间重叠,意味着电子出现在核间的机会增大。s轨道和p轨道形成稳定共价键的几种重叠方式如图所示。
1.根据图示分析为什么共价键有方向性
提示:共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现机会最大的方向重叠,重叠程度越大,形成的共价键越牢固,所以共价键有方向性。
2.所有单质中都有共价键吗
提示:并不是所有的单质中都有共价键,稀有气体中不存在化学键,金属单质中不存在共价键。
【归纳提升】
1.共价键的特征。
(1)饱和性。
①一个原子有几个未成对电子,便和几个自旋状态相反的电子配对成键,形成几个共价键。例如1个N原子有3个未成对电子,两个N原子可以形成
N≡N,1个N原子可与3个H原子形成 ,1个NH3分子中含有3个共价键。
②共价键的饱和性决定了共价化合物的分子构成。
(2)方向性。
①共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现机会最大的方向重叠,重叠程度越大,形成的共价键越牢固。同种分子(如HX)中成键原子电子云(原子轨道)重叠程度越大,形成的共价键越牢固,分子结构越稳定。如HX的稳定性:HF>HCl>HBr>HI。
②共价键的方向性决定了分子的空间结构。
2.共价键的存在范围。
易错点拨
(1)所有的共价键都有饱和性,但不是所有的共价键都有方向性,如两个1s轨道(H原子与H原子)重叠形成的s-s σ键没有方向性。
(2)个别金属与非金属元素原子间也可以形成共价键,如BeCl2、AlCl3等原子间均以共价键结合。
(3)并不是所有的单质中都有共价键,稀有气体中不存在化学键,金属单质中不存在共价键。
【典型例题】
【例题1】 (双选)下列说法正确的是( )。
A.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
B.某原子跟其他原子形成共价键时,其共价键数目不一定等于该元素原子的价电子数
C.基态C原子有两个未成对电子,所以最多只能形成2个共价键
D.1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和性决定的
BD
解析:只有2个s原子轨道重叠形成的共价键没有方向性,其他原子轨道重叠形成的共价键都有方向性,A项不正确。非金属元素的原子形成的共价键数目一般等于该原子最外层的未成对电子数,不能说一定等于该元素原子的价电子数,B项正确。在形成CH4分子的过程中,碳原子2s轨道中的1个电子激发到2p空轨道,这样形成了4个未成对电子,C项不正确。N原子最外层2p轨道上共有3个未成对电子,1个N原子可以与3个H原子结合形成NH3分子,此时共价键饱和,D项正确。
【变式训练1】 下列有关共价键的形成的说法错误的是( )。
A.原子间形成共价键,体系的能量降低
B.原子间形成共价键后,若原子核间距离更近时,体系的能量会更低
C.原子间形成共价键时,电子云在空间部分重叠
D.共用电子对在形成共价键的原子核之间区域出现的机会较大
B
解析:
【问题引领】
探究任务2
晶胞的计算
观察乙烷、乙烯和乙炔分子的结构,回答有关问题。
1.乙烷、乙烯和乙炔分子中的共价键分别由几个σ键和几个π键组成
提示:单键都是σ键,共价双键中有1个σ键、1个π键;共价三键由1个σ键和2个π键组成。乙烷分子中有7个σ键;乙烯分子中有5个σ键和1个π键;乙炔分子中有3个σ键和2个π键。
2.乙烯和乙炔的化学性质为什么比乙烷活泼
提示:乙烯的碳碳双键和乙炔的碳碳三键中分别含有1个π键和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂。而乙烷中没有π键,σ键稳定,不易断裂。
【归纳提升】
1.共价键的分类。
2.非极性键和极性键。
(1)键的极性判断。
(2)极性键的极性强弱。
3.配位键。
配位键是一种特殊的共价键。N、H3O+、H2SO4等以及种类繁多的配位化合物中都存在配位键。配位键与共价键在形成过程上的主要不同是配位键的共用电子对是由某个原子提供的,共价键的共用电子对是成键原子双方共同提供的。
4.单键、双键和三键。
【典型例题】
【例题2】 将下列微粒的序号填在相应的横线上。
①HCl ②N2 ③NH3 ④Na2O2 ⑤H2O2
⑥NH4Cl ⑦NaOH ⑧Ar ⑨CO2 ⑩C2H4
(1)只存在非极性键的分子是 ;既存在非极性键又存在极性键的分子是 ;只存在极性键的分子是 。
(2)只存在单键的分子是 ;存在三键的分子是 ;只存在双键的分子是 ;既存在单键又存在双键的分子是 。
(3)只存在σ键的分子是 ,既存在σ键又存在π键的分子是 。
(4)不存在化学键的是 。
(5)既存在离子键又存在极性键的是 ;既存在离子键又存在非极性键的是 。
答案:(1)② ⑤⑩ ①③⑨
(2)①③⑤ ② ⑨ ⑩
(3)①③⑤ ②⑨⑩
(4)⑧
(5)⑥⑦ ④
解析:(1)氮气分子由两个氮原子形成,只存在非极性键;H2O2中O—H键是极性键,O—O键是非极性键,C2H4中C C键是非极性键,C—H键是极性键,则既存在非极性键又存在极性键的分子是⑤⑩;HCl、NH3和CO2中只存在极性键。
(2)HCl、NH3、H2O2的结构式分别为H—Cl、 、H—O—
O—H,所以只存在单键的分子是①③⑤;氮气的结构式为N≡N,则存在三键的分子是②;CO2中氧原子的最外层有6个电子,能形成两对共用电子对,所以只存在双键的分子是⑨;乙烯的结构式为 ,既存在单键又存在双键。
(3)只存在σ键,即只存在单键,根据上述分析,只存在σ键的分子是①③⑤,含有双键、三键的分子中既存在σ键又存在π键,所以根据上述分析,既存在σ键又存在π键的分子是②⑨⑩。
(4)稀有气体是单原子分子,没有化学键,所以不存在化学键的分子是⑧。
(5)NH4Cl、NaOH中既有离子键又有极性共价键,所以既存在离子键又存在极性键的是⑥⑦;Na2O2中既有O—O非极性键,又有Na+和 之间的离子键,所以既存在离子键又存在非极性键的是④。
知识拓展 共价键的极性强弱
在极性共价键中,成键原子所属元素吸引电子的能力不同,形成的共价键的极性强弱也有所不同。所以,极性键又有强极性键(如H—F键)和弱极性键(如H—I键)之分。
【变式训练2】 下列有关化学键类型的判断错误的( )。
A.s-s σ键与s-p σ键的对称性不同
B.分子中含有共价键,则至少含有一个σ键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
答案: C
解析:s-s σ键无方向性,s-p σ键轴对称,A项正确。在含有共价键的分子中一定含有σ键,可能含有π键,如HCl、N2等,B项正确。碳碳三键中有1个σ键,2个π键,故乙炔(H—C≡C—H)分子中有3个σ键,2个π键,C项错误。单键都为σ键,乙烷分子结构式为 ,其6个C—H键和1个C—C键都为σ键,D项正确。
课堂小结
