苏教版(2019)选择性必修2高中化学专题3微粒间作用力与物质性质第4单元分子间作用力分子晶体课后训练(含解析)
文档属性
| 名称 | 苏教版(2019)选择性必修2高中化学专题3微粒间作用力与物质性质第4单元分子间作用力分子晶体课后训练(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 85.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-08 23:00:55 | ||
图片预览


文档简介
第四单元 分子间作用力 分子晶体
课后训练巩固提升
基础巩固
1.如果分子间作用力只是范德华力,则该分子晶体将采取密堆积,原因是分子晶体中( )。
A.范德华力无方向性和饱和性
B.基本构成微粒是原子
C.化学键是共价键
D.三者都是
2.下列物质,按沸点降低顺序排列的一组是( )。
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
3.下列说法错误的是( )。
A.卤族元素的氢化物中HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键的键能大
D.氨极易溶于水与氨分子和水分子间形成氢键有关
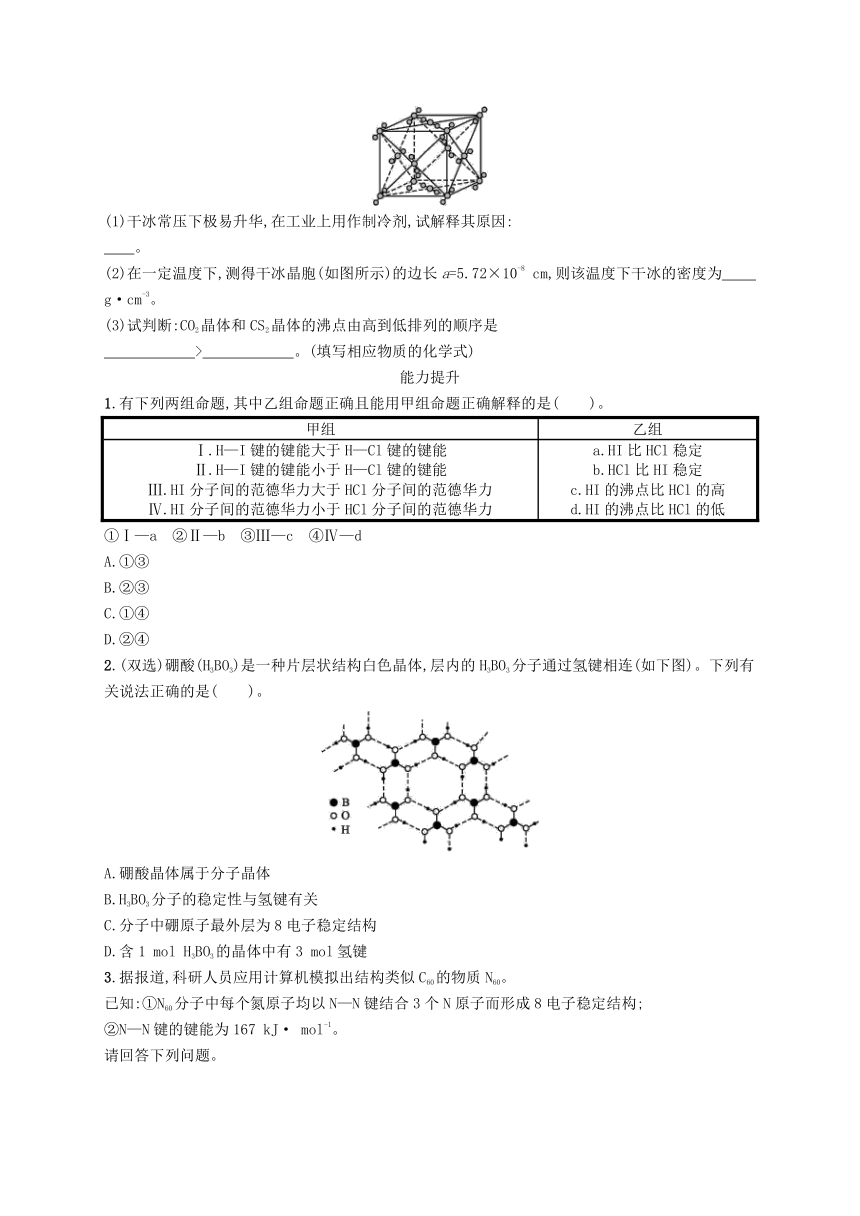
4.中学教材上介绍的干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有( )。
A.4个
B.8个
C.12个
D.6个
5.下列分子晶体在熔化时,只破坏范德华力的是 ,既破坏范德华力,又破坏氢键的是 。
①H2 ②O2 ③P4(白磷) ④SO2 ⑤CO2 ⑥H2O2 ⑦HF
⑧H2N—CH2CH2COOH ⑨H3PO4 ⑩C2H6
6.图所示为CO2分子晶体结构的一部分。
(1)干冰常压下极易升华,在工业上用作制冷剂,试解释其原因:
。
(2)在一定温度下,测得干冰晶胞(如图所示)的边长a=5.72×10-8 cm,则该温度下干冰的密度为 g·cm-3。
(3)试判断:CO2晶体和CS2晶体的沸点由高到低排列的顺序是
> 。(填写相应物质的化学式)
能力提升
1.有下列两组命题,其中乙组命题正确且能用甲组命题正确解释的是( )。
甲组 乙组
Ⅰ.H—I键的键能大于H—Cl键的键能 Ⅱ.H—I键的键能小于H—Cl键的键能 Ⅲ.HI分子间的范德华力大于HCl分子间的范德华力 Ⅳ.HI分子间的范德华力小于HCl分子间的范德华力 a.HI比HCl稳定 b.HCl比HI稳定 c.HI的沸点比HCl的高 d.HI的沸点比HCl的低
①Ⅰ—a ②Ⅱ—b ③Ⅲ—c ④Ⅳ—d
A.①③
B.②③
C.①④
D.②④
2.(双选)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )。
A.硼酸晶体属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
3.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N键结合3个N原子而形成8电子稳定结构;
②N—N键的键能为167 kJ· mol-1。
请回答下列问题。
(1)N60分子组成的晶体为 晶体,其熔、沸点比N2的 (填“高”或“低”),原因是 。
(2)1 mol N60分解成N2时 (填“吸收”或“放出”)的热量是 kJ(已知N≡N键的键能为942 kJ· mol-1),表明稳定性N60 (填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种): 。
第四单元 分子间作用力 分子晶体
课后训练巩固提升
基础巩固
1.如果分子间作用力只是范德华力,则该分子晶体将采取密堆积,原因是分子晶体中( )。
A.范德华力无方向性和饱和性
B.基本构成微粒是原子
C.化学键是共价键
D.三者都是
答案:A
解析:分子晶体中分子间以范德华力结合在一起,由于范德华力没有方向性和饱和性,所以分子在堆积成晶体时将采取分子密堆积,A项正确。
2.下列物质,按沸点降低顺序排列的一组是( )。
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
答案:D
解析:A、C项中HF和H2O均可形成分子间氢键,沸点反常得高;对结构相似的物质,B项中物质的沸点随相对分子质量的增加而增大;D项中物质的沸点依次降低。
3.下列说法错误的是( )。
A.卤族元素的氢化物中HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键的键能大
D.氨极易溶于水与氨分子和水分子间形成氢键有关
答案:C
解析:HF分子间存在氢键,故沸点相对较高,A项正确。能形成分子间氢键的物质熔、沸点较高,邻羟基苯甲醛易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,B项正确。H2O分子中的O可与周围H2O分子中的两个H原子形成两个氢键,而HF分子中的F原子只能形成一个氢键,氢键越多,沸点越高,所以H2O的沸点比HF的高,C项错误。氨分子和水分子间形成氢键,导致氨极易溶于水,D项正确。
4.中学教材上介绍的干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有( )。
A.4个
B.8个
C.12个
D.6个
答案:C
解析:如图在每个顶点处的CO2周围距离a的CO2即为每个面心上的CO2分子,共有8×(3×)=12个。
5.下列分子晶体在熔化时,只破坏范德华力的是 ,既破坏范德华力,又破坏氢键的是 。
①H2 ②O2 ③P4(白磷) ④SO2 ⑤CO2 ⑥H2O2 ⑦HF
⑧H2N—CH2CH2COOH ⑨H3PO4 ⑩C2H6
答案:①②③④⑤⑩ ⑥⑦⑧⑨
解析:有氢键的分子晶体,其分子中应含有H—F键、H—O键、H—N键中的任何一种,在熔化时其中的氢键被破坏。
6.图所示为CO2分子晶体结构的一部分。
(1)干冰常压下极易升华,在工业上用作制冷剂,试解释其原因:
。
(2)在一定温度下,测得干冰晶胞(如图所示)的边长a=5.72×10-8 cm,则该温度下干冰的密度为 g·cm-3。
(3)试判断:CO2晶体和CS2晶体的沸点由高到低排列的顺序是
> 。(填写相应物质的化学式)
答案:(1)CO2分子间作用力较弱,克服分子间作用力要吸热
(2)1.56 (3)CS2 CO2
解析:(2)CO2分子晶体为面心立方晶体,每个晶胞中含有4个CO2分子。每个晶胞的质量为[44g·mol-1÷(6.02×1023mol-1)×4],每个晶胞的体积为(5.72×10-8)3cm3,干冰的密度为[44÷(6.02×1023)×4]g÷(5.72×10-8)3cm3=1.56g·cm-3。(3)CO2、CS2都是分子晶体,CS2的相对分子质量大于CO2的,CS2的分子间作用力大于CO2的分子间作用力,CS2的沸点高于CO2的。
能力提升
1.有下列两组命题,其中乙组命题正确且能用甲组命题正确解释的是( )。
甲组 乙组
Ⅰ.H—I键的键能大于H—Cl键的键能 Ⅱ.H—I键的键能小于H—Cl键的键能 Ⅲ.HI分子间的范德华力大于HCl分子间的范德华力 Ⅳ.HI分子间的范德华力小于HCl分子间的范德华力 a.HI比HCl稳定 b.HCl比HI稳定 c.HI的沸点比HCl的高 d.HI的沸点比HCl的低
①Ⅰ—a ②Ⅱ—b ③Ⅲ—c ④Ⅳ—d
A.①③
B.②③
C.①④
D.②④
答案:B
解析:键能的大小影响物质的热稳定性,键能越大,物质越稳定。H—Cl键的键能大于H—I键的键能,所以HCl比HI稳定。范德华力影响物质的熔、沸点的高低,范德华力越大,熔、沸点越高。由于HI分子间的范德华力大于HCl分子间的范德华力,所以HI的沸点比HCl的高。
2.(双选)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )。
A.硼酸晶体属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
答案:AD
解析:A项,硼酸属于分子晶体;B项,H3BO3分子的稳定性与分子内部的共价键有关,与分子间的氢键无关;C项,分子中的硼原子不符合8电子稳定结构;D项,H3BO3分子中每个羟基上的H和O各形成1个氢键,但这些氢键为两个分子所共有,故1个H3BO3分子实际形成氢键数目为×3×2=3。
3.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N键结合3个N原子而形成8电子稳定结构;
②N—N键的键能为167 kJ· mol-1。
请回答下列问题。
(1)N60分子组成的晶体为 晶体,其熔、沸点比N2的 (填“高”或“低”),原因是 。
(2)1 mol N60分解成N2时 (填“吸收”或“放出”)的热量是 kJ(已知N≡N键的键能为942 kJ· mol-1),表明稳定性N60 (填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种): 。
答案:(1)分子 高 N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
(2)放出 13 230 < (3)N60可作高能炸药(其他合理答案也可)
解析:(1)N60、N2形成的晶体均为分子晶体,因Mr(N60)>Mr(N2),故N60晶体中分子间的范德华力比N2晶体中分子间的范德华力大,N60晶体的熔、沸点比N2晶体高。
(2)因N60中每个氮原子形成3个N—N键,每个N—N键被2个N原子共用,故1molN60中存在N—N键为1mol×60×3×=90mol。反应N6030N2的ΔH=90mol×167kJ·mol-1-30mol×942kJ·mol-1=-13230kJ<0,为放热反应,表明稳定性:N2>N60。
(3)由于反应放出大量的热,同时生成大量气体,因此N60可用作高能炸药。
课后训练巩固提升
基础巩固
1.如果分子间作用力只是范德华力,则该分子晶体将采取密堆积,原因是分子晶体中( )。
A.范德华力无方向性和饱和性
B.基本构成微粒是原子
C.化学键是共价键
D.三者都是
2.下列物质,按沸点降低顺序排列的一组是( )。
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
3.下列说法错误的是( )。
A.卤族元素的氢化物中HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键的键能大
D.氨极易溶于水与氨分子和水分子间形成氢键有关
4.中学教材上介绍的干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有( )。
A.4个
B.8个
C.12个
D.6个
5.下列分子晶体在熔化时,只破坏范德华力的是 ,既破坏范德华力,又破坏氢键的是 。
①H2 ②O2 ③P4(白磷) ④SO2 ⑤CO2 ⑥H2O2 ⑦HF
⑧H2N—CH2CH2COOH ⑨H3PO4 ⑩C2H6
6.图所示为CO2分子晶体结构的一部分。
(1)干冰常压下极易升华,在工业上用作制冷剂,试解释其原因:
。
(2)在一定温度下,测得干冰晶胞(如图所示)的边长a=5.72×10-8 cm,则该温度下干冰的密度为 g·cm-3。
(3)试判断:CO2晶体和CS2晶体的沸点由高到低排列的顺序是
> 。(填写相应物质的化学式)
能力提升
1.有下列两组命题,其中乙组命题正确且能用甲组命题正确解释的是( )。
甲组 乙组
Ⅰ.H—I键的键能大于H—Cl键的键能 Ⅱ.H—I键的键能小于H—Cl键的键能 Ⅲ.HI分子间的范德华力大于HCl分子间的范德华力 Ⅳ.HI分子间的范德华力小于HCl分子间的范德华力 a.HI比HCl稳定 b.HCl比HI稳定 c.HI的沸点比HCl的高 d.HI的沸点比HCl的低
①Ⅰ—a ②Ⅱ—b ③Ⅲ—c ④Ⅳ—d
A.①③
B.②③
C.①④
D.②④
2.(双选)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )。
A.硼酸晶体属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
3.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N键结合3个N原子而形成8电子稳定结构;
②N—N键的键能为167 kJ· mol-1。
请回答下列问题。
(1)N60分子组成的晶体为 晶体,其熔、沸点比N2的 (填“高”或“低”),原因是 。
(2)1 mol N60分解成N2时 (填“吸收”或“放出”)的热量是 kJ(已知N≡N键的键能为942 kJ· mol-1),表明稳定性N60 (填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种): 。
第四单元 分子间作用力 分子晶体
课后训练巩固提升
基础巩固
1.如果分子间作用力只是范德华力,则该分子晶体将采取密堆积,原因是分子晶体中( )。
A.范德华力无方向性和饱和性
B.基本构成微粒是原子
C.化学键是共价键
D.三者都是
答案:A
解析:分子晶体中分子间以范德华力结合在一起,由于范德华力没有方向性和饱和性,所以分子在堆积成晶体时将采取分子密堆积,A项正确。
2.下列物质,按沸点降低顺序排列的一组是( )。
A.HF、HCl、HBr、HI
B.F2、Cl2、Br2、I2
C.H2O、H2S、H2Se、H2Te
D.CI4、CBr4、CCl4、CF4
答案:D
解析:A、C项中HF和H2O均可形成分子间氢键,沸点反常得高;对结构相似的物质,B项中物质的沸点随相对分子质量的增加而增大;D项中物质的沸点依次降低。
3.下列说法错误的是( )。
A.卤族元素的氢化物中HF的沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.H2O的沸点比HF的沸点高,是由于水中氢键的键能大
D.氨极易溶于水与氨分子和水分子间形成氢键有关
答案:C
解析:HF分子间存在氢键,故沸点相对较高,A项正确。能形成分子间氢键的物质熔、沸点较高,邻羟基苯甲醛易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低,B项正确。H2O分子中的O可与周围H2O分子中的两个H原子形成两个氢键,而HF分子中的F原子只能形成一个氢键,氢键越多,沸点越高,所以H2O的沸点比HF的高,C项错误。氨分子和水分子间形成氢键,导致氨极易溶于水,D项正确。
4.中学教材上介绍的干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有( )。
A.4个
B.8个
C.12个
D.6个
答案:C
解析:如图在每个顶点处的CO2周围距离a的CO2即为每个面心上的CO2分子,共有8×(3×)=12个。
5.下列分子晶体在熔化时,只破坏范德华力的是 ,既破坏范德华力,又破坏氢键的是 。
①H2 ②O2 ③P4(白磷) ④SO2 ⑤CO2 ⑥H2O2 ⑦HF
⑧H2N—CH2CH2COOH ⑨H3PO4 ⑩C2H6
答案:①②③④⑤⑩ ⑥⑦⑧⑨
解析:有氢键的分子晶体,其分子中应含有H—F键、H—O键、H—N键中的任何一种,在熔化时其中的氢键被破坏。
6.图所示为CO2分子晶体结构的一部分。
(1)干冰常压下极易升华,在工业上用作制冷剂,试解释其原因:
。
(2)在一定温度下,测得干冰晶胞(如图所示)的边长a=5.72×10-8 cm,则该温度下干冰的密度为 g·cm-3。
(3)试判断:CO2晶体和CS2晶体的沸点由高到低排列的顺序是
> 。(填写相应物质的化学式)
答案:(1)CO2分子间作用力较弱,克服分子间作用力要吸热
(2)1.56 (3)CS2 CO2
解析:(2)CO2分子晶体为面心立方晶体,每个晶胞中含有4个CO2分子。每个晶胞的质量为[44g·mol-1÷(6.02×1023mol-1)×4],每个晶胞的体积为(5.72×10-8)3cm3,干冰的密度为[44÷(6.02×1023)×4]g÷(5.72×10-8)3cm3=1.56g·cm-3。(3)CO2、CS2都是分子晶体,CS2的相对分子质量大于CO2的,CS2的分子间作用力大于CO2的分子间作用力,CS2的沸点高于CO2的。
能力提升
1.有下列两组命题,其中乙组命题正确且能用甲组命题正确解释的是( )。
甲组 乙组
Ⅰ.H—I键的键能大于H—Cl键的键能 Ⅱ.H—I键的键能小于H—Cl键的键能 Ⅲ.HI分子间的范德华力大于HCl分子间的范德华力 Ⅳ.HI分子间的范德华力小于HCl分子间的范德华力 a.HI比HCl稳定 b.HCl比HI稳定 c.HI的沸点比HCl的高 d.HI的沸点比HCl的低
①Ⅰ—a ②Ⅱ—b ③Ⅲ—c ④Ⅳ—d
A.①③
B.②③
C.①④
D.②④
答案:B
解析:键能的大小影响物质的热稳定性,键能越大,物质越稳定。H—Cl键的键能大于H—I键的键能,所以HCl比HI稳定。范德华力影响物质的熔、沸点的高低,范德华力越大,熔、沸点越高。由于HI分子间的范德华力大于HCl分子间的范德华力,所以HI的沸点比HCl的高。
2.(双选)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是( )。
A.硼酸晶体属于分子晶体
B.H3BO3分子的稳定性与氢键有关
C.分子中硼原子最外层为8电子稳定结构
D.含1 mol H3BO3的晶体中有3 mol氢键
答案:AD
解析:A项,硼酸属于分子晶体;B项,H3BO3分子的稳定性与分子内部的共价键有关,与分子间的氢键无关;C项,分子中的硼原子不符合8电子稳定结构;D项,H3BO3分子中每个羟基上的H和O各形成1个氢键,但这些氢键为两个分子所共有,故1个H3BO3分子实际形成氢键数目为×3×2=3。
3.据报道,科研人员应用计算机模拟出结构类似C60的物质N60。
已知:①N60分子中每个氮原子均以N—N键结合3个N原子而形成8电子稳定结构;
②N—N键的键能为167 kJ· mol-1。
请回答下列问题。
(1)N60分子组成的晶体为 晶体,其熔、沸点比N2的 (填“高”或“低”),原因是 。
(2)1 mol N60分解成N2时 (填“吸收”或“放出”)的热量是 kJ(已知N≡N键的键能为942 kJ· mol-1),表明稳定性N60 (填“>”“<”或“=”)N2。
(3)由(2)列举N60的用途(举一种): 。
答案:(1)分子 高 N60、N2均形成分子晶体,且N60的相对分子质量大,分子间作用力大,故熔、沸点高
(2)放出 13 230 < (3)N60可作高能炸药(其他合理答案也可)
解析:(1)N60、N2形成的晶体均为分子晶体,因Mr(N60)>Mr(N2),故N60晶体中分子间的范德华力比N2晶体中分子间的范德华力大,N60晶体的熔、沸点比N2晶体高。
(2)因N60中每个氮原子形成3个N—N键,每个N—N键被2个N原子共用,故1molN60中存在N—N键为1mol×60×3×=90mol。反应N6030N2的ΔH=90mol×167kJ·mol-1-30mol×942kJ·mol-1=-13230kJ<0,为放热反应,表明稳定性:N2>N60。
(3)由于反应放出大量的热,同时生成大量气体,因此N60可用作高能炸药。
