1.2.2 一次电池和二次电池 (含解析)课时作业 2023-2024学年高二上学期化学苏教版(2019)选择性必修1
文档属性
| 名称 | 1.2.2 一次电池和二次电池 (含解析)课时作业 2023-2024学年高二上学期化学苏教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 359.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-09 14:19:25 | ||
图片预览



文档简介
课时作业9:1.2.2 一次电池和二次电池
学校:__________ 姓名:__________ 班级:__________ 考号:__________
一、单选题(共12小题)
1. (1分)随着人们生活质量的不断提高,废旧电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A. 利用电池外壳的金属材料
B. 防止电池中汞、镉和铅等重金属对土壤和水源造成污染
C. 防止电池中渗漏的电解液腐蚀其他物品
D. 回收其中的石墨电极
2. (1分)下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C. 银锌电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
3. (1分)铅蓄电池是最常见的二次电池,其电池总反应可以表示为Pb+PbO2+2H2SO42PbSO4+2H2O,下列说法不正确的是( )
A. 电池的电解液为酸性溶液,正极为PbO2、负极为Pb
B. 电池放电时,正极反应为PbO2+2e-+SO+4H+===PbSO4+2H2O
C. 电池充电过程中,阳极附近溶液的pH升高
D. 电池充电时,阴极反应为PbSO4+2e-===Pb+SO
4. (1分)银锌纽扣电池总反应为Zn+Ag2O+H2O===Zn(OH)2+2Ag,下列说法正确的是( )
A. Zn是负极,发生还原反应 B. Ag2O电极发生氧化反应
C. 电子流入Zn极 D. 每消耗65 g Zn,负极失去2 mol e-
5. (1分)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是( )
A. 正极反应式为O2+2H2O+4e-===4OH- B. 电池工作时,电流由铝电极沿导线流向铂电极
C. 以网状的铂为正极,可增大与氧气的接触面积 D. 该电池通常只需更换铝板就可继续使用
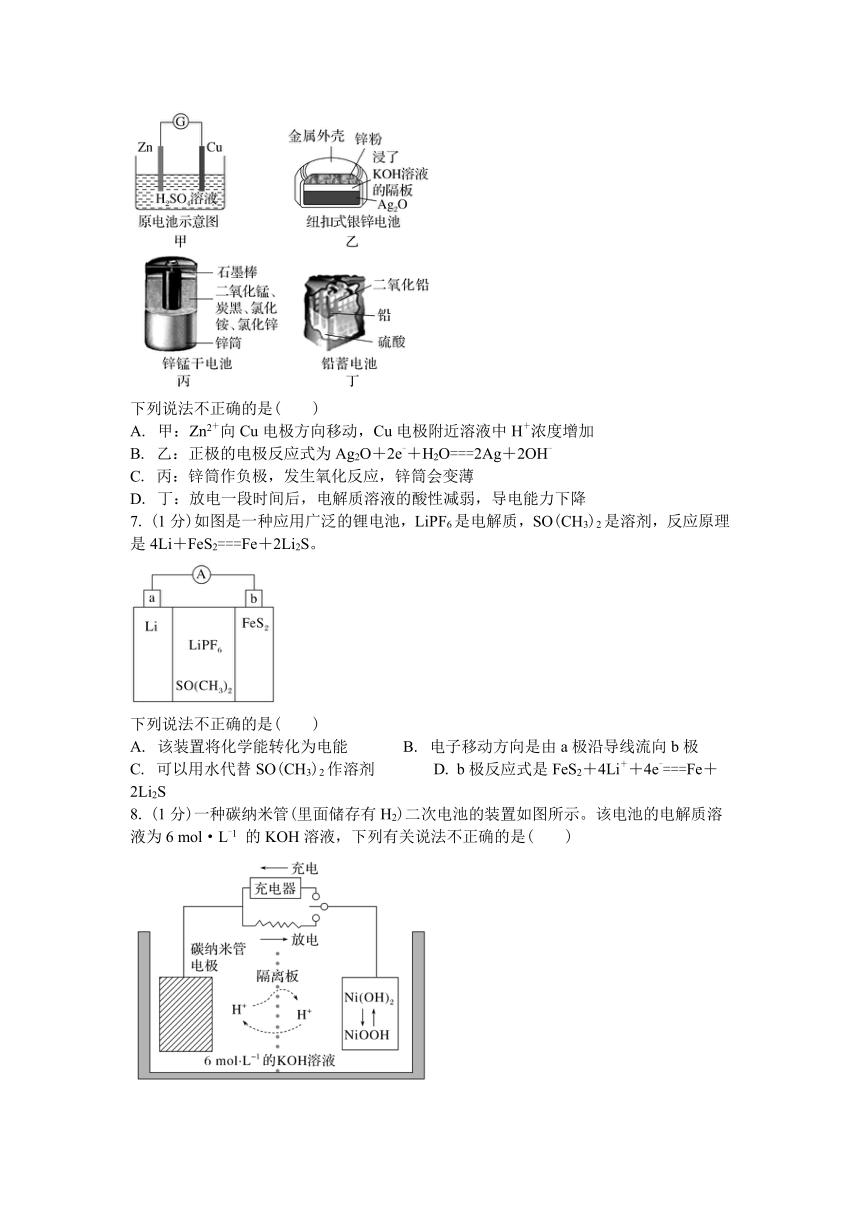
6. (1分)化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A. 甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 乙:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄
D. 丁:放电一段时间后,电解质溶液的酸性减弱,导电能力下降
7. (1分)如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。
下列说法不正确的是( )
A. 该装置将化学能转化为电能 B. 电子移动方向是由a极沿导线流向b极
C. 可以用水代替SO(CH3)2作溶剂 D. b极反应式是FeS2+4Li++4e-===Fe+2Li2S
8. (1分)一种碳纳米管(里面储存有H2)二次电池的装置如图所示。该电池的电解质溶液为6 mol·L-1 的KOH溶液,下列有关说法不正确的是( )
A. 储存H2的碳纳米管作电池的负极
B. 电池的负极反应式为H2+2OH--2e-===2H2O
C. 电池的正极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
D. 放电时,电池总反应为2H2+O2===2H2O
9. (1分)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法不正确的是( )
A. “水”电池的负极是Ag,AgCl是氧化产物
B. 正极反应为5MnO2+2e-+2NaCl===Na2Mn5O10+2Cl-
C. 每生成1 mol Na2Mn5O10,转移2 mol电子
D. “水”电池工作时,Na+往MnO2电极方向移动
10. (1分)一种石墨烯锂硫电池(2Li+S8===Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量,下列有关该电池说法不正确的是( )
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-===Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
11. (1分)“碳呼吸电池”是一种新型能源装置,其工作原理如图所示。
下列说法正确的是( )
A. 该装置是将电能转变为化学能 B. 正极的电极反应为C2O-2e-===2CO2↑
C. 每得到1 mol草酸铝,电路中转移3 mol电子 D. 利用该技术可捕捉大气中的二氧化碳
12. (1分)一种锂离子电池是将层状石墨加导电剂及黏合剂涂在铜箔基带上,将钴酸锂(LiCoO2)加导电剂及黏合剂涂在铝箔上制成电极,利用锂离子在两极上的嵌入和脱嵌进行充、放电,其原理如图所示(总反应为LiCoO2+6CLi1-xCoO2+LixC6)。下列说法错误的是( )
A. 放电时,石墨加导电剂及黏合剂涂在铜箔基带上形成锂离子电池的负极
B. 充电时Li+从石墨层状结构中脱嵌,进入电解液
C. 放电时正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
D. 锂离子电池常使用非水液态有机电解液
二、填空题(共3小题)
13. (1分)镁—H2O2酸性电池采用海水作电解质溶液(加入一定量酸)。
(1)该电池负极反应式为_________________________________________。
(2)电池工作时,正极周围海水的pH________(填“增大”或“减小”)。
(3)溶液中的H+向________(填“负极”或“正极”)移动。
(4)电池总反应为_________________________________________________。
14. (1分)锂离子电池有多种。
(1)某新型锂离子电池以含Li+导电固体为电解质,电池反应为Li+LiMn2O4===Li2Mn2O4。该电池的负极材料是________,正极反应式为_________________________________________________________。
(2)另一种锂电池由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器。电池总反应可表示为Li+MnO2===LiMnO2,锂电池比容量特别大的原因是________________________________________________。
(3)不管哪种锂电池都标明“严禁投入水中”,试用化学方程式解释其原因:_________________________________________________________
_________________________________________________________。
15. (1分)铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。
(1)O2辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________________________。
电池的正极反应式:6O2+6e-===6O
6CO2+6O===3C2O+6O2
反应过程中O2的作用是_________________________________________。
该电池的总反应式: ________________________________________________。
(2)如图为Al-AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池反应方程式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O,当电极上析出1.08 g Ag时,电路中转移的电子为________mol。
(3)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
①放电过程中,Li+向________(填“负极”或“正极”)移动。
②负极反应式为____________________________________________。
③电路中每转移0.2 mol电子,理论上生成________ g Pb。
1. 【答案】B
【解析】汞、镉、铅等重金属离子会对土壤和水源造成污染。
2. 【答案】B
【解析】铜锌原电池中,电子从负极锌沿外电路流向正极铜。
3. 【答案】C
【解析】铅蓄电池放电时,该装置是原电池,其中Pb失电子发生氧化反应,所以Pb是负极,PbO2是正极,电解液为硫酸,A项正确;放电时,正极上PbO2得电子和硫酸根离子反应生成硫酸铅,B项正确;电池充电时,阳极反应式为PbSO4+2H2O-2e-===PbO2+SO+4H+,酸性增强,pH降低,C项错误;阴极反应式为PbSO4+2e-===Pb+SO,D项正确。
4. 【答案】D
【解析】锌失电子,Zn是负极,发生氧化反应,A项错误;Ag元素的化合价由+1价降至0价,Ag2O电极发生还原反应,B项错误;电子从负极Zn流向正极Ag2O,C项错误;65 g Zn的物质的量为1 mol,负极反应为Zn-2e-+2OH-===Zn(OH)2,1 mol 锌失去2 mol e-,D项正确。
5. 【答案】B
【解析】该原电池负极反应为Al-3e-+3OH-===Al(OH)3,正极反应为O2+2H2O+4e-===4OH-,工作时电子由负极流向正极,而电流由正极流向负极,答案为B。
6. 【答案】A
【解析】甲装置属于原电池,Zn较Cu活泼,Zn作负极,Cu作正极,Zn2+和H+向Cu电极方向移动,H+氧化性较强,得电子变H2,2H++2e-===H2↑,因而c(H+)减小,A项错误;Ag2O作正极,得电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,B项正确;Zn为较活泼金属,作负极,发生氧化反应,电极反应式为Zn-2e-===Zn2+,锌溶解,因而锌筒会变薄,C项正确;铅蓄电池总反应式为PbO2+Pb+2H2SO42PbSO4+2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
7. 【答案】C
【解析】分析装置图可知该装置是原电池,是化学能转化为电能的装置,A项正确;原电池中电子从负极沿外电路流向正极,原电池中a为负极,是由a极流向b极,B项正确;水的导电性差且和锂发生反应,不符合此原电池的反应原理,C项错误;b电极为正极,得到电子发生还原反应,电极反应为FeS2+4Li++4e-===Fe+2Li2S,D项正确。
8. 【答案】D
【解析】该二次电池中H2在负极上失去电子被氧化,在碱性介质中生成水,电池的负极反应式为H2+2OH--2e-===2H2O。由图示可知,正极上NiOOH被还原为Ni(OH)2,电池的正极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-,正极反应式的计量数扩大2倍与负极电极反应式相加即得总反应为:2NiOOH+H2===2Ni(OH)2,故D错。
9. 【答案】B
【解析】根据电池总反应,Ag元素的化合价由0价→+1价,化合价升高,发生氧化反应,依据原电池工作原理,Ag为负极,AgCl是氧化产物,A项正确;NaCl、Na2Mn5O10为可溶强电解质,根据电池总反应,MnO2中Mn的化合价由+4价→+3.6价,得到电子,MnO2作正极,因此正极上的电极反应式为5MnO2+2e-===Mn5O,B项错误;根据B选项分析,生成1 mol Na2Mn5O10,转移2 mol电子,C项正确;原电池中阳离子向正极移动,阴离子向负极移动,因此Na+向MnO2电极方向移动,D项正确。
10. 【答案】D
【解析】单位质量的电极材料失去电子的物质的量越多,则得到的电能越多,能量越高,Li是所有金属元素中原子量最小的金属,所以金属锂是所有金属中比能量最高的电极材料,故A正确;原电池中阳离子向正极移动,由图可知,B为正极,A为负极,负极发生失电子的氧化反应,故B正确;B电极上S8得电子生成Li2S8,则B电极的反应:2Li++S8+2e-===Li2S8,故C正确;电子只能在电极和导线中移动,不能在电解质溶液中移动,故D错误。
11. 【答案】D
【解析】“碳呼吸电池”将化学能转变为电能,A项错误。由图可知,二氧化碳在正极上得电子生成草酸根,电极反应式为2CO2+2e-===C2O,B项错误;由图可知,金属铝为负极,失电子生成草酸铝,每得到1 mol草酸铝,电路中转移3 mol×2=6 mol电子,C项错误;“碳呼吸电池”能消耗二氧化碳气体,利用该技术可捕捉大气中的二氧化碳,D项正确。
12. 【答案】B
【解析】由图及题意可知,右侧为石墨加导电剂及黏合剂涂在铜箔基带上形成的电极,左侧为将钴酸锂(LiCoO2)加导电剂及黏合剂涂在铝箔上形成的电极,放电时,右侧电极中Li+脱嵌,LixC6失去电子转化成C和Li+,右侧电极为负极,A项正确;充电时,Li+从涂有钴酸锂加导电剂及黏合剂的铝箔电极上脱嵌,进入电解液,B项错误;放电时,Li+在正极上得电子,并与正极上的Li1-xCoO2结合生成LiCoO2,正极反应为Li1-xCoO2+xLi++xe-===LiCoO2,C项正确;锂是较活泼的金属,易与水发生反应,故锂离子电池常使用非水液态有机电解液,D项正确。
13. 【答案】(1)Mg-2e-===Mg2+ (2)增大
(3)正极 (4)Mg+H2O2+2H+===Mg2++2H2O
【解析】(1)镁—H2O2酸性电池中,镁为活泼金属,应为原电池的负极,发生氧化反应,电极反应式为Mg-2e-===Mg2+。(2)原电池工作时,正极发生还原反应,电极反应式为H2O2+2H++2e-===2H2O,由于不断消耗H+,使溶液中c(H+)逐渐减小,正极周围海水的pH逐渐增大。(3)H+是阳离子,在原电池中,溶液中的阳离子向正极移动。(4)由于在同一闭合回路中电子转移数目相等,将正极、负极的电极反应式相加,就可得到该原电池的总反应:Mg+H2O2+2H+===Mg2++2H2O。
14. 【答案】(1)Li LiMn2O4+Li++e-===Li2Mn2O4
(2)Li相对原子质量较小,单位质量Li释放的电子多
(3)2Li+2H2O===2LiOH+H2↑
【解析】(1)Li的化合价升高作负极;LiMn2O4作正极,正极反应式为LiMn2O4+Li++e-===Li2Mn2O4。(2)Li的相对原子质量较小,单位质量Li释放的电子多,比容量特别大。(3)Li是一种碱金属元素,很活泼,化学性质与钠类似,会与水发生反应:2Li+2H2O===2LiOH+H2↑。
15. 【答案】(1)2Al-6e-===2Al3+ 催化剂 2Al+6CO2===Al2(C2O4)3 (2)0.02 (3)正极 Ca-2e-===Ca2+ 20.7
【解析】(1)根据图示,铝为负极,电极反应式为2Al-6e-===2Al3+,负极与正极反应式合并得出总反应式:2Al+6CO2===Al2(C2O4)3。(2)该电池的正极反应为AgO+2e-+H2O===Ag+2OH-。AgO中Ag的化合价为+2价,当电极上析出1.08 g Ag(即0.01 mol)时,电路中转移的电子为0.02 mol。(3)①放电过程中,Li+向正极移动;②原电池的钙电极为负极,负极反应式为Ca-2e-===Ca2+;③根据方程式,电路中每转移0.2 mol电子,生成0.1 mol Pb,即20.7 g Pb
学校:__________ 姓名:__________ 班级:__________ 考号:__________
一、单选题(共12小题)
1. (1分)随着人们生活质量的不断提高,废旧电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A. 利用电池外壳的金属材料
B. 防止电池中汞、镉和铅等重金属对土壤和水源造成污染
C. 防止电池中渗漏的电解液腐蚀其他物品
D. 回收其中的石墨电极
2. (1分)下列有关电池的说法不正确的是( )
A. 手机上用的锂离子电池属于二次电池
B. 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C. 银锌电池可把化学能转化为电能
D. 锌锰干电池中,锌电极是负极
3. (1分)铅蓄电池是最常见的二次电池,其电池总反应可以表示为Pb+PbO2+2H2SO42PbSO4+2H2O,下列说法不正确的是( )
A. 电池的电解液为酸性溶液,正极为PbO2、负极为Pb
B. 电池放电时,正极反应为PbO2+2e-+SO+4H+===PbSO4+2H2O
C. 电池充电过程中,阳极附近溶液的pH升高
D. 电池充电时,阴极反应为PbSO4+2e-===Pb+SO
4. (1分)银锌纽扣电池总反应为Zn+Ag2O+H2O===Zn(OH)2+2Ag,下列说法正确的是( )
A. Zn是负极,发生还原反应 B. Ag2O电极发生氧化反应
C. 电子流入Zn极 D. 每消耗65 g Zn,负极失去2 mol e-
5. (1分)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O===4Al(OH)3,下列说法不正确的是( )
A. 正极反应式为O2+2H2O+4e-===4OH- B. 电池工作时,电流由铝电极沿导线流向铂电极
C. 以网状的铂为正极,可增大与氧气的接触面积 D. 该电池通常只需更换铝板就可继续使用
6. (1分)化学电源在日常生活和高科技领域中都有广泛应用。
下列说法不正确的是( )
A. 甲:Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B. 乙:正极的电极反应式为Ag2O+2e-+H2O===2Ag+2OH-
C. 丙:锌筒作负极,发生氧化反应,锌筒会变薄
D. 丁:放电一段时间后,电解质溶液的酸性减弱,导电能力下降
7. (1分)如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2===Fe+2Li2S。
下列说法不正确的是( )
A. 该装置将化学能转化为电能 B. 电子移动方向是由a极沿导线流向b极
C. 可以用水代替SO(CH3)2作溶剂 D. b极反应式是FeS2+4Li++4e-===Fe+2Li2S
8. (1分)一种碳纳米管(里面储存有H2)二次电池的装置如图所示。该电池的电解质溶液为6 mol·L-1 的KOH溶液,下列有关说法不正确的是( )
A. 储存H2的碳纳米管作电池的负极
B. 电池的负极反应式为H2+2OH--2e-===2H2O
C. 电池的正极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-
D. 放电时,电池总反应为2H2+O2===2H2O
9. (1分)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法不正确的是( )
A. “水”电池的负极是Ag,AgCl是氧化产物
B. 正极反应为5MnO2+2e-+2NaCl===Na2Mn5O10+2Cl-
C. 每生成1 mol Na2Mn5O10,转移2 mol电子
D. “水”电池工作时,Na+往MnO2电极方向移动
10. (1分)一种石墨烯锂硫电池(2Li+S8===Li2S8)工作原理示意图如图。已知参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量,下列有关该电池说法不正确的是( )
A. 金属锂是所有金属中比能量最高的电极材料
B. A电极为该电源的负极,发生氧化反应
C. B电极的反应:2Li++S8+2e-===Li2S8
D. 电子从A电极经过外电路流向B电极,再经过电解质流回A电极
11. (1分)“碳呼吸电池”是一种新型能源装置,其工作原理如图所示。
下列说法正确的是( )
A. 该装置是将电能转变为化学能 B. 正极的电极反应为C2O-2e-===2CO2↑
C. 每得到1 mol草酸铝,电路中转移3 mol电子 D. 利用该技术可捕捉大气中的二氧化碳
12. (1分)一种锂离子电池是将层状石墨加导电剂及黏合剂涂在铜箔基带上,将钴酸锂(LiCoO2)加导电剂及黏合剂涂在铝箔上制成电极,利用锂离子在两极上的嵌入和脱嵌进行充、放电,其原理如图所示(总反应为LiCoO2+6CLi1-xCoO2+LixC6)。下列说法错误的是( )
A. 放电时,石墨加导电剂及黏合剂涂在铜箔基带上形成锂离子电池的负极
B. 充电时Li+从石墨层状结构中脱嵌,进入电解液
C. 放电时正极反应为Li1-xCoO2+xLi++xe-===LiCoO2
D. 锂离子电池常使用非水液态有机电解液
二、填空题(共3小题)
13. (1分)镁—H2O2酸性电池采用海水作电解质溶液(加入一定量酸)。
(1)该电池负极反应式为_________________________________________。
(2)电池工作时,正极周围海水的pH________(填“增大”或“减小”)。
(3)溶液中的H+向________(填“负极”或“正极”)移动。
(4)电池总反应为_________________________________________________。
14. (1分)锂离子电池有多种。
(1)某新型锂离子电池以含Li+导电固体为电解质,电池反应为Li+LiMn2O4===Li2Mn2O4。该电池的负极材料是________,正极反应式为_________________________________________________________。
(2)另一种锂电池由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器。电池总反应可表示为Li+MnO2===LiMnO2,锂电池比容量特别大的原因是________________________________________________。
(3)不管哪种锂电池都标明“严禁投入水中”,试用化学方程式解释其原因:_________________________________________________________
_________________________________________________________。
15. (1分)铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。
(1)O2辅助的Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________________________。
电池的正极反应式:6O2+6e-===6O
6CO2+6O===3C2O+6O2
反应过程中O2的作用是_________________________________________。
该电池的总反应式: ________________________________________________。
(2)如图为Al-AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池反应方程式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O,当电极上析出1.08 g Ag时,电路中转移的电子为________mol。
(3)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
①放电过程中,Li+向________(填“负极”或“正极”)移动。
②负极反应式为____________________________________________。
③电路中每转移0.2 mol电子,理论上生成________ g Pb。
1. 【答案】B
【解析】汞、镉、铅等重金属离子会对土壤和水源造成污染。
2. 【答案】B
【解析】铜锌原电池中,电子从负极锌沿外电路流向正极铜。
3. 【答案】C
【解析】铅蓄电池放电时,该装置是原电池,其中Pb失电子发生氧化反应,所以Pb是负极,PbO2是正极,电解液为硫酸,A项正确;放电时,正极上PbO2得电子和硫酸根离子反应生成硫酸铅,B项正确;电池充电时,阳极反应式为PbSO4+2H2O-2e-===PbO2+SO+4H+,酸性增强,pH降低,C项错误;阴极反应式为PbSO4+2e-===Pb+SO,D项正确。
4. 【答案】D
【解析】锌失电子,Zn是负极,发生氧化反应,A项错误;Ag元素的化合价由+1价降至0价,Ag2O电极发生还原反应,B项错误;电子从负极Zn流向正极Ag2O,C项错误;65 g Zn的物质的量为1 mol,负极反应为Zn-2e-+2OH-===Zn(OH)2,1 mol 锌失去2 mol e-,D项正确。
5. 【答案】B
【解析】该原电池负极反应为Al-3e-+3OH-===Al(OH)3,正极反应为O2+2H2O+4e-===4OH-,工作时电子由负极流向正极,而电流由正极流向负极,答案为B。
6. 【答案】A
【解析】甲装置属于原电池,Zn较Cu活泼,Zn作负极,Cu作正极,Zn2+和H+向Cu电极方向移动,H+氧化性较强,得电子变H2,2H++2e-===H2↑,因而c(H+)减小,A项错误;Ag2O作正极,得电子,被还原成Ag,结合KOH作电解液,故电极反应式为Ag2O+2e-+H2O===2Ag+2OH-,B项正确;Zn为较活泼金属,作负极,发生氧化反应,电极反应式为Zn-2e-===Zn2+,锌溶解,因而锌筒会变薄,C项正确;铅蓄电池总反应式为PbO2+Pb+2H2SO42PbSO4+2H2O,可知放电一段时间后,H2SO4不断被消耗,因而电解质溶液的酸性减弱,导电能力下降,D项正确。
7. 【答案】C
【解析】分析装置图可知该装置是原电池,是化学能转化为电能的装置,A项正确;原电池中电子从负极沿外电路流向正极,原电池中a为负极,是由a极流向b极,B项正确;水的导电性差且和锂发生反应,不符合此原电池的反应原理,C项错误;b电极为正极,得到电子发生还原反应,电极反应为FeS2+4Li++4e-===Fe+2Li2S,D项正确。
8. 【答案】D
【解析】该二次电池中H2在负极上失去电子被氧化,在碱性介质中生成水,电池的负极反应式为H2+2OH--2e-===2H2O。由图示可知,正极上NiOOH被还原为Ni(OH)2,电池的正极反应式为NiOOH+H2O+e-===Ni(OH)2+OH-,正极反应式的计量数扩大2倍与负极电极反应式相加即得总反应为:2NiOOH+H2===2Ni(OH)2,故D错。
9. 【答案】B
【解析】根据电池总反应,Ag元素的化合价由0价→+1价,化合价升高,发生氧化反应,依据原电池工作原理,Ag为负极,AgCl是氧化产物,A项正确;NaCl、Na2Mn5O10为可溶强电解质,根据电池总反应,MnO2中Mn的化合价由+4价→+3.6价,得到电子,MnO2作正极,因此正极上的电极反应式为5MnO2+2e-===Mn5O,B项错误;根据B选项分析,生成1 mol Na2Mn5O10,转移2 mol电子,C项正确;原电池中阳离子向正极移动,阴离子向负极移动,因此Na+向MnO2电极方向移动,D项正确。
10. 【答案】D
【解析】单位质量的电极材料失去电子的物质的量越多,则得到的电能越多,能量越高,Li是所有金属元素中原子量最小的金属,所以金属锂是所有金属中比能量最高的电极材料,故A正确;原电池中阳离子向正极移动,由图可知,B为正极,A为负极,负极发生失电子的氧化反应,故B正确;B电极上S8得电子生成Li2S8,则B电极的反应:2Li++S8+2e-===Li2S8,故C正确;电子只能在电极和导线中移动,不能在电解质溶液中移动,故D错误。
11. 【答案】D
【解析】“碳呼吸电池”将化学能转变为电能,A项错误。由图可知,二氧化碳在正极上得电子生成草酸根,电极反应式为2CO2+2e-===C2O,B项错误;由图可知,金属铝为负极,失电子生成草酸铝,每得到1 mol草酸铝,电路中转移3 mol×2=6 mol电子,C项错误;“碳呼吸电池”能消耗二氧化碳气体,利用该技术可捕捉大气中的二氧化碳,D项正确。
12. 【答案】B
【解析】由图及题意可知,右侧为石墨加导电剂及黏合剂涂在铜箔基带上形成的电极,左侧为将钴酸锂(LiCoO2)加导电剂及黏合剂涂在铝箔上形成的电极,放电时,右侧电极中Li+脱嵌,LixC6失去电子转化成C和Li+,右侧电极为负极,A项正确;充电时,Li+从涂有钴酸锂加导电剂及黏合剂的铝箔电极上脱嵌,进入电解液,B项错误;放电时,Li+在正极上得电子,并与正极上的Li1-xCoO2结合生成LiCoO2,正极反应为Li1-xCoO2+xLi++xe-===LiCoO2,C项正确;锂是较活泼的金属,易与水发生反应,故锂离子电池常使用非水液态有机电解液,D项正确。
13. 【答案】(1)Mg-2e-===Mg2+ (2)增大
(3)正极 (4)Mg+H2O2+2H+===Mg2++2H2O
【解析】(1)镁—H2O2酸性电池中,镁为活泼金属,应为原电池的负极,发生氧化反应,电极反应式为Mg-2e-===Mg2+。(2)原电池工作时,正极发生还原反应,电极反应式为H2O2+2H++2e-===2H2O,由于不断消耗H+,使溶液中c(H+)逐渐减小,正极周围海水的pH逐渐增大。(3)H+是阳离子,在原电池中,溶液中的阳离子向正极移动。(4)由于在同一闭合回路中电子转移数目相等,将正极、负极的电极反应式相加,就可得到该原电池的总反应:Mg+H2O2+2H+===Mg2++2H2O。
14. 【答案】(1)Li LiMn2O4+Li++e-===Li2Mn2O4
(2)Li相对原子质量较小,单位质量Li释放的电子多
(3)2Li+2H2O===2LiOH+H2↑
【解析】(1)Li的化合价升高作负极;LiMn2O4作正极,正极反应式为LiMn2O4+Li++e-===Li2Mn2O4。(2)Li的相对原子质量较小,单位质量Li释放的电子多,比容量特别大。(3)Li是一种碱金属元素,很活泼,化学性质与钠类似,会与水发生反应:2Li+2H2O===2LiOH+H2↑。
15. 【答案】(1)2Al-6e-===2Al3+ 催化剂 2Al+6CO2===Al2(C2O4)3 (2)0.02 (3)正极 Ca-2e-===Ca2+ 20.7
【解析】(1)根据图示,铝为负极,电极反应式为2Al-6e-===2Al3+,负极与正极反应式合并得出总反应式:2Al+6CO2===Al2(C2O4)3。(2)该电池的正极反应为AgO+2e-+H2O===Ag+2OH-。AgO中Ag的化合价为+2价,当电极上析出1.08 g Ag(即0.01 mol)时,电路中转移的电子为0.02 mol。(3)①放电过程中,Li+向正极移动;②原电池的钙电极为负极,负极反应式为Ca-2e-===Ca2+;③根据方程式,电路中每转移0.2 mol电子,生成0.1 mol Pb,即20.7 g Pb
