1.3 电能转化为化学能——电解(含解析) 章节测试 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.3 电能转化为化学能——电解(含解析) 章节测试 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 1002.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-09 14:24:16 | ||
图片预览



文档简介
1.3 电能转化为化学能——电解 章节测试
一、单选题
1.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中K+向左移动
C.开始时,银片上发生的反应是Ag-e-=Ag+
D.电路中每转移2mole-,正极材料增重216g
2.化学无处不在。下列相关说法错误的是( )
A.漂白液可以灭活COVID-19病毒
B.大气污染物NO2主要来自于雷雨天气
C.纤维可素以加强胃肠的蠕动
D.高纯度硅可以作光电转换材料
3.判断如图原电池装置图示中电子或离子流向、正极或负极等标注正确的是( )
A.图甲铅蓄电池 B.图乙锌银纽扣电池
C.图丙燃料电池 D.图丁锌铜原电池
4.用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是( )
A.CuSO4 B.H2SO4 C.CuCl2 D.NaCl
5.用电解法提取氯化铜废液中的铜,方案正确的是( )
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
6.在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如右图所示。下列说法不正确的是( )
A.阴极的反应式是:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ
B.X是电源的负极
C.总反应可表示为:H2O+CO2=H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
7.氟离子电池()是一种新型的二次电池,具有极高的能量密度,其放电时变化原理如图所示。下列说法错误的是( )
A.该装置必须采用非水相电解质
B.放电时负极的电极反应式为
C.电能转化为化学能时总反应:
D.充电时当阴极减少38g时,电路中有2电子转移
8.某实验小组模拟海水淡化的同时制备H2、Cl2和NaOH溶液,装置如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
A.甲室产生的气体能使湿润的淀粉—KI试纸变蓝
B.膜①是阴离子交换膜
C.淡水的出口只有c
D.随着电解的进行,戊室溶液的pH不断增大
9.一种以锌一石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有 ,可表示为 )为正极、盐一水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法错误的( )
A.放电时,石墨烯气凝胶电极上的电极反应式为
B.多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面
C.电池总反应为
D.充电时, 被还原, 在石墨烯纤维无纺布电极侧沉积, 被氧化后在阴极嵌入
10.我国科学家使用电化学的方法(装置如图所示)用和制备。下列说法正确的是( )
A.M为电源的负极
B.阴极电极反应式为
C.该过程总反应为
D.理论上每产生1 mol CO有2 mol经过电解质
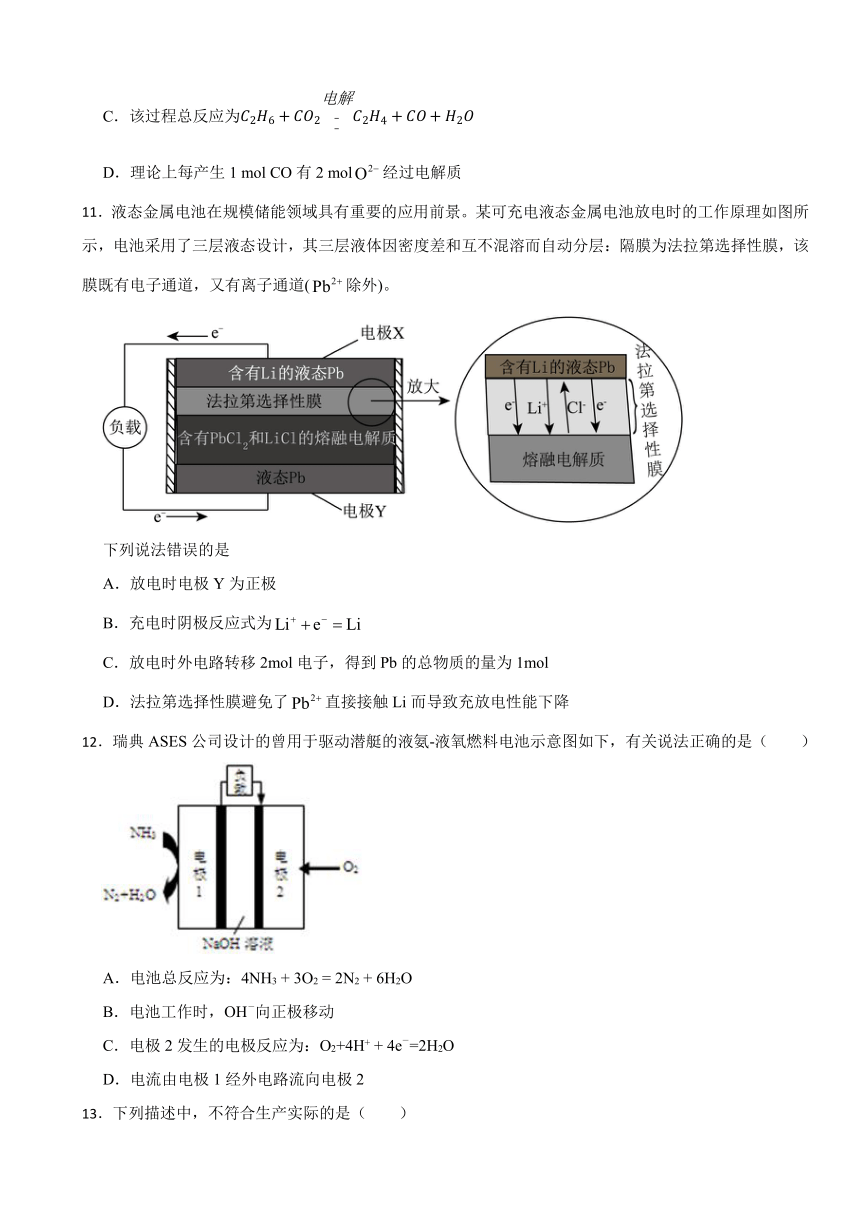
11.液态金属电池在规模储能领域具有重要的应用前景。某可充电液态金属电池放电时的工作原理如图所示,电池采用了三层液态设计,其三层液体因密度差和互不混溶而自动分层:隔膜为法拉第选择性膜,该膜既有电子通道,又有离子通道(除外)。
下列说法错误的是
A.放电时电极Y为正极
B.充电时阴极反应式为
C.放电时外电路转移2mol电子,得到Pb的总物质的量为1mol
D.法拉第选择性膜避免了直接接触Li而导致充放电性能下降
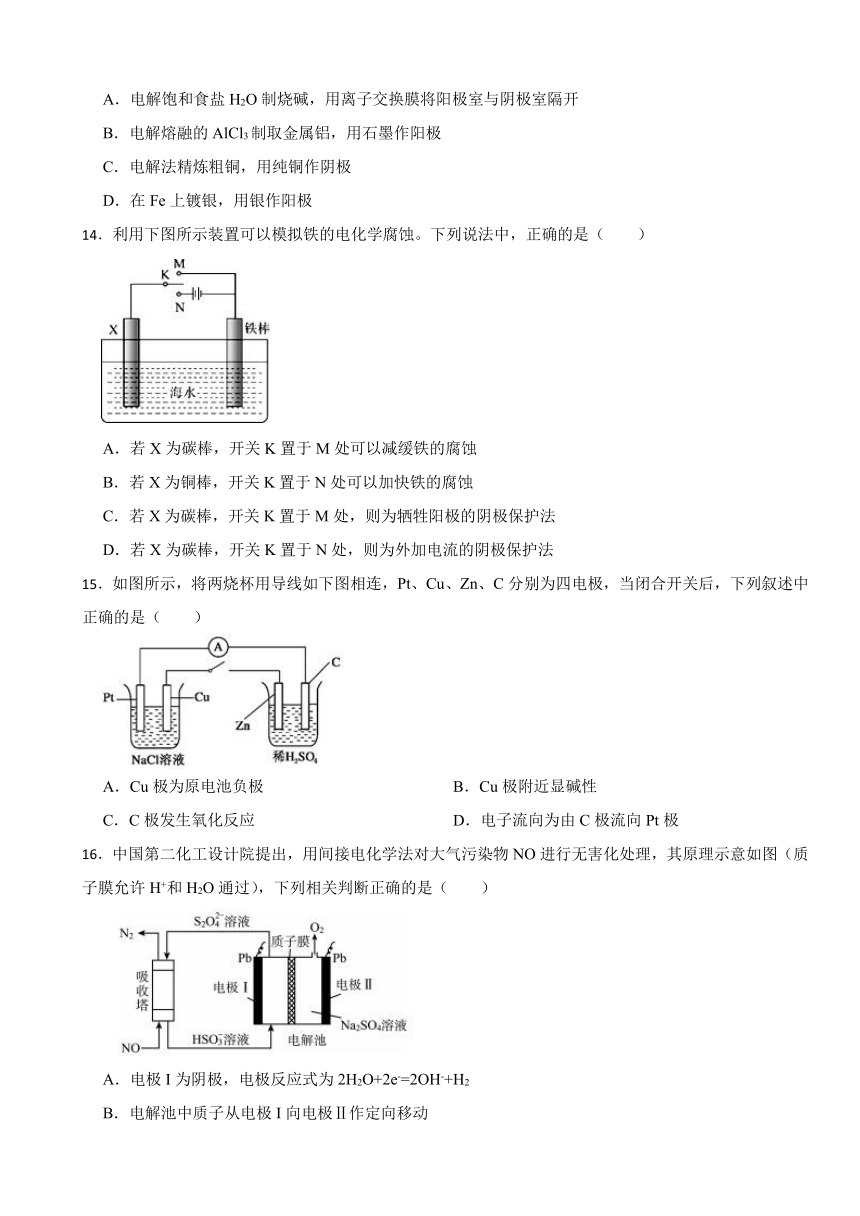
12.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是( )
A.电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O
B.电池工作时,OH-向正极移动
C.电极2发生的电极反应为:O2+4H+ + 4e-=2H2O
D.电流由电极1经外电路流向电极2
13.下列描述中,不符合生产实际的是( )
A.电解饱和食盐H2O制烧碱,用离子交换膜将阳极室与阴极室隔开
B.电解熔融的AlCl3制取金属铝,用石墨作阳极
C.电解法精炼粗铜,用纯铜作阴极
D.在Fe上镀银,用银作阳极
14.利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是( )
A.若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B.若X为铜棒,开关K置于N处可以加快铁的腐蚀
C.若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
15.如图所示,将两烧杯用导线如下图相连,Pt、Cu、Zn、C分别为四电极,当闭合开关后,下列叙述中正确的是( )
A.Cu极为原电池负极 B.Cu极附近显碱性
C.C极发生氧化反应 D.电子流向为由C极流向Pt极
16.中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
A.电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B.电解池中质子从电极I向电极Ⅱ作定向移动
C.吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D.每处理1 mol NO电解池质量减少16g
二、综合题
17.甲烷的直接转化具有较高的经济价值,因此备受科学家关注。请回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:CH4(g)+O2(g)CH3OH(g) △H1=-126.4kJ mol-1
方法II:CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ mol-1,则△H2= 。
(2)某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。
①下列措施可以提高CH4的平衡转化率的是 (填标号)。
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为 (精确到0.1%)。
③该反应温度下,方法I的标准压力平衡常数= (列出计算式)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)gG(g)+hH(g), =,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是 。
(3)为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。
已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是 ;请从反应速率的角度说明,通入CH4后反应温度维持在200℃的原因: 。
(4)用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。
写出ZrO2/NiCo2O4电极的反应式: 。
18.海洋是资源的宝库,含有丰富的化学元素。
(1)在电解饱和食盐水的实验中,阳极产物的检验方法是 。
(2)目前从海水中提溴(Br 2 )大致有以下步骤。
①向浓缩的海水中通入Cl2,将海水中的 Br- 氧化为 Br2 。
②用热空气将 Br 2 从上述溶液中吹出,并由浓 Na 2 CO 3 溶液吸收,转变为 NaBr、NaBrO 3和CO2 。吸收1 moL Br 2 需消耗 Na2CO3 moL。
③再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
Br-+ BrO3- + H + → Br2 + H2O
(3)碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是: 。
(4)同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为 。NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-) (填变大或变小),请用平衡理论解释发生这种变化的原因 。
19.如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 .
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀.他测得溶液的pH=5,则此时溶液中c(Fe3+)= mol/L.(已知Ksp=1×10﹣36).
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL.当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为: .
20.石墨烯锂离子电池可在-30~80℃环境下工作,充电效率是普通充电产品的24倍。它是一种新型二次电池。其工作原理如图所示。
电池反应式为。
请回答下列问题:
(1)放电时,负极上反应的物质为 ,LiCoO2电极的电极反应式为 。
(2)充电时,Li+向 (填“石墨烯”或“LiCoO2”)移动,转移0.5mol电子理论上阴极材料质量增加 g。
21.某小组采用电化学方法处理废气或废水中的污染物。
(1) (一)电解法处理废气中的氨(NH3),装置如图所示。
一段时间后,溶液中Fe3+、Fe2+的总物质的量 (填“增大”“减小”或“基本不变”)。
(2)阳极的电极反应式为 。
(3)若要处理8.96LNH3(标准状况),理论上消耗O2 mol。
(4)(二)采用纳米铁粉、炭粉的混合物可处理废水中的NO,原理如图1所示。
纳米铁粉中掺杂炭粉的原因是 。正极的电极反应式为 。
(5)实验表明酸性废水中NO的浓度与溶液pH的关系如图2所示。pH答案解析部分
1.【答案】D
【解析】【解答】A.电子从铜片经外电路流向银片,不经盐桥,A不符合题意;
B.盐桥中阳离子向正极移动,则K+向右移动,B不符合题意;
C.银片上发生的反应是:Ag++e-=Ag,C不符合题意;
D.每转移2mole-,正极生成2molAg,增重为,D符合题意;
故答案为:D。
【分析】A.口诀:“电子不小下水,离子不上岸”,电子不会通过电解质溶液
B.阴阳离子移动方向口诀:“阳正阴负”
C.正负极判断,活泼金属做负极,相对不活泼做正极,银做正极,Ag++e-=Ag
D.转移电子与生成银的关系e-~Ag,故转移2mol电子,生成2molAg,增重216g
2.【答案】B
【解析】【解答】A. 漂白液具强氧化性,故可以灭活COVID-19病毒,A不符合题意;
B. 大气污染物二氧化氮主要来自工业废气、汽车尾气等,B符合题意;
C. 纤维素在人体内不能消化,但可以加强胃肠的蠕动,C不符合题意;
D. 硅导电性介于导体与绝缘体之间,是良好的半导体,可以制成光电池,将光能直接转换为电能,D不符合题意;
故答案为:B。
【分析】A.漂白液的主要成分为NaClO,而ClO-具有强氧化性;
B.雷雨天气NO2会与水反应生成硝酸,从而形成酸雨;
D.硅属于半导体材料可以用来制备光电池。
3.【答案】C
【解析】【解答】A.铅蓄电池中Pb是原电池负极,PbO2是原电池正极,A不符合题意;
B.锌银纽扣电池中Zn是原电池负极,Ag2O是原电池正极,B不符合题意;
C.H2是燃料电池的负极,失去电子,O2是燃料电池的正极,溶液中H+向正极移动,C符合题意;
D.锌铜原电池,盐桥中Cl-向负极(右池)移动,D不符合题意;
故答案为:C。
【分析】A.铅蓄电池中Pb为负极;
B.锌银纽扣电池中Zn为负极;
C.氢氧燃料电池中,通入氢气的一极为负极,通入氧气的一极为正极;
D.原电池中阴离子向负极移动。
4.【答案】B
【解析】【解答】A、硫酸铜溶液电解质生成铜和氧气和硫酸,电解一段时间后,铜和氧元素减少,需要加入一定量的氧化铜才能恢复,不符合题意,不选A;
B、电解硫酸溶液实际上是电解水,所以电解一段时间后需要加入水就能恢复,符合题意,选B;
C、电解氯化铜溶液,产生铜和氯气,一段时间后加入氯化铜才能恢复,不符合题意,不选C;
D、电解氯化钠溶液产生氢气和氯气和氢氧化钠,一段时间后加入氯化氢才能恢复,不符合题意,不选D。
故答案为:B
【分析】加入水能够恢复原来的溶液,说明电解时相当于电解水,结合离子的放电顺序进行分析即可。
5.【答案】B
【解析】【解答】A. 用铜片连接电源的负极,另一电极用铂片,故A不符合题意
B. 用碳棒连接电源的正极,另一电极用铜片,故B符合题意
C.阴极析出了铜,故C不符合题意
D.阳极生成氯气,可用湿润的淀粉KI试纸检验,故D不符合题意
故答案为:B
【分析】电解氯化铜提取铜,则阴极析出了铜
6.【答案】D
【解析】【解答】A.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故A不符合题意;
B.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故B不符合题意;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2 H2+CO+O2,故C不符合题意;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2 H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D符合题意。
故答案为:D
【分析】根据电解原理进行分析电源电极、电极方程式的书写等即可.
7.【答案】B
【解析】【解答】A.Ca是活泼金属,钙能与水反应,所以该装置必须采用非水相电解质,故A不符合题意;
B.根据图示,放电时负极的电极反应式为,故B符合题意;
C.电池充电时,电能转化为化学能,总反应:,故C不符合题意;
D.充电时阴极反应为,当阴极减少38g时,生成2molF-,电路中有2电子转移,故D不符合题意;
故答案为:B。
【分析】A.钙的性质活泼,能与水反应;
B.放电时负极的电极反应式为;
C.充电时电能转化为化学能,总反应为;
D.根据得失电子守恒计算。
8.【答案】C
【解析】【解答】A.甲室为阳极室,电极反应式为 , 能使湿润的淀粉 试纸变蓝,A不符合题意;
B.反应过程中丙室中 通过膜②到丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,B不符合题意;
C.淡水的出口为a和c,C符合题意;
D.戊室的电极反应式为 ,随电解的进行,溶液的pH不断增大,D不符合题意。
故答案为:C。
【分析】该反应甲室连接电源正极为阳极室,戊室连接电源负极为阴极室;阳极电极反应式为 ,阴极电极反应式为 ;反应过程中丙室中 通过膜②到丁室,戊室中生成的OH-通过阴膜到达丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,淡水的出口为a和c,d中生成 NaOH ,以此分析。
9.【答案】D
【解析】【解答】A.放电时,正极发生还原反应,石墨烯气凝胶电极上的电极反应式为 ,故A不符合题意;
B.多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面,故B 不符合题意;
C.由分析可知,电池总反应为 ,故C不符合题意;
D.充电时, 被还原,Zn在石墨烯纤维无纺布电极侧沉积, 被氧化后在阳极嵌入,D项符合题意;
故答案为:D。
【分析】结合图可知,电池总反应为 ,放电时,正极反应为: ,负极反应为:Zn-2e-=Zn2+,据此解答。
10.【答案】C
【解析】【解答】A. 与M极相连的电极上将C2H6转化成C2H4,碳元素化合价由-3升高到-2,失去电子,发生了氧化反应,做阳极,与电源正极相连,因此M极为正极。A不符合题意。
B. 由A知M为正极,则N为负极。与N相连的为阴极,将CO2转化成CO。由装置示意图可知电解质允许O2-通过,故阴极电极反应方程式为CO2+2e-=CO+O2-。B不符合题意。
C. 由装置示意图可知C2H6和CO2制备C2H4的过程还有CO生成。另外,根据原子守恒还应有H2O生成。故总反应为。C符合题意。
D. 每生成1 mol CO外电路中应从阳极向阴极流入2 mol e-。当2 mol e-从阳极流出时会形成 2 mol 正电荷。阴阳极均为电中性,故阳极应有2 mol 负电荷补充。依据题意应是O2-移动到阳极补充负电荷。1 mol O2-即可提供2 mol 负电荷。因此,理论上每产生1 mol CO有1 mol O2-经过电解质。D不符合题意。
故答案为:C。
【分析】A. 阳极与电源正极相连发生氧化反应;
B. 阴极与负极相连发生还原反应。
C. 根据原子守恒;
D. 依据转移电子数等于移动离子所带电荷数。
11.【答案】C
【解析】【解答】A.放电时电极Y为正极,故A不符合题意;
B.电极X为负极电极方程式为:Li -e-=Li+,则充电时阴极反应式为,故B不符合题意;
C.放电时外电路转移2mol电子时,电极Y处发生电极反应,生成1molPb,同时电子又通过法拉第选择性膜中的电子通道进入含有PbCl2和LiCl的熔融电解质,Pb2+得到电子生成Pb,则得到Pb的总物质的量大于1mol,故C符合题意;
D.法拉第选择性膜,该膜既有电子通道,又有离子通道(除外),不能通过膜,法拉第选择性膜避免了直接接触Li而导致充放电性能下降,故D不符合题意;
故答案为:C。
【分析】放电时,根据电子流向可知,电极X为负极,电极反应式为Li -e-=Li+,电极Y为正极,电极反应式为,则充电时,电极X为阴极,电极反应式为,电极Y为阳极,电极反应式为Pb-2e-=Pb2+。
12.【答案】A
【解析】【解答】A.氨气的氧化产物是氮气,则燃料电池的总反应可表示为4NH3+3O2=2N2+6H2O,A符合题意;
B.原电池中,阳离子向正极移动,阴离子向负极移动,即OH-向负极移动,B不符合题意;
C.氧气在正极得到电子,溶液显碱性,则正极电极反应为O2+2H2O+4e-=4OH-,C不符合题意;
D.原电池中电流从正极流向负极,即电流由电极2经外电路流向电极1,D不符合题意,
故答案为:A。
【分析】A.结合反应物和生成物写出即可
B.考查的是原电池中阴阳离子移动的方向
C.电极2做正极,氧气发生还原反应,注意电解质溶液酸碱性
D.考查的电流的方向
13.【答案】B
【解析】【解答】A.电解饱和食盐H2O制烧碱,阳极室产生氯气,阴极室得到氢气,防止出现事故,则用离子交换膜将阳极室与阴极室隔开,A符合实际生产;
B.AlCl3为共价化合物,通常用电解熔融的氧化铝制取金属铝,用石墨作阳极,B不符合实际生产;
C.电解法精炼粗铜,粗铜作阳极失电子生成铜离子,用纯铜作阴极,溶液中的铜离子得电子生成单质铜,C符合实际生产;
D.在Fe上镀银,Fe作阴极,溶液中的银离子得电子生成银,用银作阳极,银失电子生成银离子,D符合实际生产;
故答案为:B。
【分析】A.电解饱和食盐水时负极产生氢气,H2易燃易爆,采用离子交换膜进行隔离;
B.AlCl3不导电,无法电离;
C.电解精炼铜时粗铜做阳极,纯铜在阴极析出;
D.电镀时镀层金属做阳极;
14.【答案】D
【解析】【解答】A、K置于M处是原电池,X为碳,铁比碳活泼作负极,铁失去电子,加速铁的腐蚀,A错误;
B、K置于N处是电解池,铁作阴极被保护,可以减缓铁的腐蚀,B错误;
C、K置于M处是原电池,Fe比碳活泼,铁作负极失去电子被腐蚀,这不是牺牲阳极的阴极保护法,若X为比铁活泼的金属,则铁作正极被保护,才是牺牲阳极的阴极保护法,C错误;
D、开关K置于N处是电解池,铁作阴极被保护,这是外加电流的阴极保护法,D正确。正确答案为D。
【分析】有外加电源的电解池,铁在阴极,保护铁不被腐蚀。不加外加电源的为原电池,若铁活泼。铁为负极,会加速腐蚀
15.【答案】B
【解析】【解答】A.据分析可知Zn极为原电池负极,A不符合题意;
B.阴极(Cu电极) :2H++2e-=H2↑,溶液中多余OH-,Cu极附近显碱性,B符合题意;
C.正极(C极):2H++2e-=H2,H化合价降低发生还原反应,C不符合题意;
D.电子流向为由负极流向负极,则电子流向为Zn极流向C极,D不符合题意;
故答案为:B。
【分析】开关闭合后,右侧烧杯为原电池,其中Zn为负极,其电极反应式为Zn-2e-=Zn2+;C为正极,其电极反应式为2H++2e-=H2↑。左侧烧杯为电解池,Cu电极为阴极,其电极反应式为2H2O+2e-=H2↑+2OH-;Pt电极为阳极,其电极反应式为2Cl--2e-=Cl2↑。
16.【答案】C
【解析】【解答】A. 电极I为阴极,阴极上是HSO3-获得电子生成S2O42-,酸性条件下还生成水,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,故A不符合题意;
B. 电解池中质子从电极Ⅱ向电极I作定向移动,故B不符合题意;
C. 吸收池中S2O42-与NO反应生成N2与HSO3-,反应离子方程式为:吸收塔中的反应为2NO+ 2S2O32-+H2O=N2+4HSO3-,故C符合题意;
D、电解池中发生的反应:4HSO3-=2H2O+O2+2S2O42-,结合吸收塔中的反应:2NO+ 2S2O32-+H2O=N2+4HSO3-,得关系式:2NO~O2~4H+,每处理1 mol NO电解池质量减少16 gO2和2gH+,共18g,故D不符合题意;
故答案为:C。
【分析】本题探究电解池的工作原理
A、酸性条件下,电极I为阴极,发生还原反应,2HSO3-+2H++2e-=S2O42-+2H2O;
B、 电解池中质子从阳极向阴极作定向移动;
C、陌生氧化还原反应方程式的书写;
D、用关系式法分析;
17.【答案】(1)+115.4kJ mol-1
(2)C;65.2%;;反应为放热反应,随着反应的进行,溶液温度升高,将使平衡逆向移动
(3)降低混合气的温度,使温度维持在200℃左右;200℃是催化剂的活性温度,且反应速率较快
(4)3CH4-6e-+6OH-=CH3CH2CH2OH+5H2O
【解析】【解答】(1)①CH4(g)+O2(g)CH3OH(g) △H1=-126.4kJ mol-1
②CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
③H2(g)+O2(g)= H2O(l)|△H3=-285.8kJ mol-1
④H2O(l)=H2O(g)| △H4=+44kJ mol-1
利用盖斯定律,将反应①-③-④,得反应②为CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2=+115.4kJ mol-1。故答案为:+115.4kJ mol-1
(2)①A.升高温度,平衡逆向移动,CH4的平衡转化率减小,A不正确;
B.反应达到平衡后,再充入一定量He,对反应物和生成物的压强都不产生影响,CH4的平衡转化率不变,B不正确;
C.投料比不变,增大反应物浓度,相当于加压,平衡正向移动,CH4的平衡转化率增大,C正确;
故答案为:C。
②在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,从图中看出,起始总压强为12kPa,平衡时总压强为9.05kPa,则He的压强为12kPa-6.0kPa-4.8kPa=1.2kPa,设参加反应的CH4的压强为x,则可建立如下三段式:
则6.0-x+4.8-0.5x+x+1.2=9.05 x=5.9kPa
则达到平衡时体系中CH3OH的体积分数为≈65.2%。
③该反应温度下,方法I的标准压力平衡常数=。
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是:反应为放热反应,随着反应的进行,溶液温度升高,将使平衡逆向移动。故答案为:C;65.2%;;反应为放热反应,随着反应的进行,溶液温度升高,将使平衡逆向移动;
(3)通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是:降低混合气的温度,使温度维持在200℃左右;从反应速率的角度分析,通入CH4后反应温度维持在200℃的原因:200℃是催化剂的活性温度,且反应速率较快。故答案为:降低混合气的温度,使温度维持在200℃左右;200℃是催化剂的活性温度,且反应速率较快;
(4)从图中可以看出,ZrO2/NiCo2O4电极为负极,则CH4失电子产物与电解质反应生成CH3CH2CH2OH等,电极反应式为3CH4-6e-+6OH-=CH3CH2CH2OH+5H2O。故答案为:3CH4-6e-+6OH-=CH3CH2CH2OH+5H2O。
【分析】(1)盖斯定律的应用要注意,判断列出的热化学方程式的对应关系,左右两边相同的物质互相抵消则相加,在同一边相同的物质互相抵消则相减;
① 提高甲烷转化率可以通过使平衡朝正向移动,或者投料比不变的情况下增大反应物的浓度;
② 结合三段式和已知数据判断;
③ 分压平衡常数要结合总压强和总物质的量判断;
④ 升高温度,平衡朝吸热方向移动;
(3)温度较高时,可以提高速率,且要控制在一定温度,不能过高,否则会使催化剂失去活性;
(4)甲烷失去电子,结合氢氧根离子生成丙醇和水。
18.【答案】(1)湿润的淀粉碘化钾试纸变蓝
(2)1mol;5;1;6;3;3
(3)单质碘在四氯化碳中的溶解度大于在水中的溶解度;四氯化碳与水互不相容,存在较大的密度差;碘与四氯化碳不反应
(4)Na2CO3;NaHCO3;增大;HCO3- H++ CO32-,滴入氢氧化钠,OH—结合H+生成水,导致电离平衡正向移动,[CO32-]增大
【解析】【解答】(1)在电解饱和食盐水的实验中,阳极产物是氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,所以阳极产物的检验方法是湿润的淀粉碘化钾试纸变蓝;(2)②溴与碳酸钠反应的方程式为3Br2+3Na2CO3= 5NaBr+NaBrO3+3CO2,吸收1 moL Br2需消耗 Na2CO3 1mol;③根据得失电子守恒、电荷守恒,离子方程式为5Br— +1 BrO3- +6H + =3 Br2 +3H2O;(3). 单质碘在四氯化碳中的溶解度大于在水中的溶解度;四氯化碳与水互不相容,存在较大的密度差;碘与四氯化碳不反应,所以用CCl4从碘水中萃取碘(4)CO32-水解程度大于HCO3-,所以同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为Na2CO3>NaHCO3;滴入氢氧化钠,OH-结合H+生成水,氢离子浓度减小,导致HCO3— H++ CO32—平衡正向移动,[CO32-]增大。
【分析】(1)电解饱和食盐水的实验中,接通电源后,连接电源正极的电极(阳极)表面有气泡冒出,该黄绿色气体能使湿润的淀粉碘化钾试纸变蓝;连接电源负极的电极(阴极)表面有气泡冒出,收集该无色气体点燃,可听到轻微爆鸣声.在阴极区滴加酚酞试液,酚酞变红;(2)根据得失电子守恒、电荷守恒书写方程式;(3)用CCl4从碘水中萃取碘;(4)根据CO32-水解程度大于HCO3-分析。
19.【答案】(1)1:2:2:2
(2)5.4g
(3)10﹣9
(4)CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣
【解析】【解答】解:(1)C、D、E、F电极发生的电极反应分别为:4OH﹣═O2↑+2H2O+4e﹣、Cu2++2e﹣═Cu、2Cl﹣═Cl2↑+2e﹣、2H++2e﹣═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2;故答案为:1:2:2:2;(2)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;当乙中溶液的pH是13时,溶液的c(OH﹣)=0.1mol L﹣1时,根据电极反应2H2O+2e﹣═H2↑+2OH﹣,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,故答案为:5.4g;(3)Fe(OH)3饱和溶液中,c(H+)=10﹣5mol/L,Fe(OH)3 Fe3++3OH﹣生成的氢氧根:c(OH﹣)=10﹣9mol/L,根据Ksp=c(Fe3+) c(OH﹣)3=1×10﹣36.解得c(Fe3+)=10﹣9mol/L,故答案为:10﹣9;(4)n(KOH)=2mol/L×2L=4mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,44.8L<V≤89.6L时,根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾,负极反应式为CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣,故答案为:CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣.
【分析】(1)C、D、E、F电极转移的电子数目相等,结合电极反应式根据转移电子数可计算生成的单质的量;(2)电镀装置中,镀层金属必须做阳极,镀件做阴极,电镀液含有镀层金属阳离子;根据乙中氢氧根离子的浓度计算其物质的量,结构电极反应式计算转移电子物质的量,各个电极上转移的电子数是相等的,据此计算丙中析出Ag的物质的量,进而计算质量;(3)Fe(OH)3存在如下平衡:Fe(OH)3(s) Fe3+(aq)+3OH﹣(aq),根据Fe(OH)3的溶度积常数和氢氧根离子浓度计算铁离子浓度计算;(4)n(KOH)=2mol/L×2L=4mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾.
20.【答案】(1);
(2)石墨烯;3.5
【解析】【解答】(1)根据电池反应式可知,失去电子,生成Li+和C6,则负极上放电物质为;LiCoO2为正极,正极发生还原反应,电极反应为。
(2)充电时,石墨烯为阴极,Li+移向阴极(石墨烯);阴极电极反应式为,转移0.5mol电子理论上阴极材料质量增加。
【分析】根据电池反应式可知,负极上LixC6失去电子,生成Li+和C6,则负极上放电物质为LixC6,电极反应为:LixC6 xe =xLi++C6,LiCoO2为正极,正极发生还原反应,电极反应为Li1 xCoO2+xe +xLi+=LiCoO2,充电时,石墨烯为阴极,阴极上发生得电子的还原反应,电极反应即为放电时负极反应的逆反应,阳极上发生失电子的氧化反应,电极反应即为放电时正极反应的逆反应,据此回答。
21.【答案】(1)基本不变
(2)2NH3-6e-=N2+6H+
(3)0.3
(4)形成了活泼性不同的两个电极,形成原电池,加快反应速率;NO+8e-+10H+=NH+3H2O
(5)氢离子也可以和Fe反应,会反应消耗纳米铁粉,导致与NO发生反应的纳米Fe量减小,NO处理率降低
【解析】【解答】(1)由图可知,该反应通过Fe3+和Fe2+的循环实现了废气中氨气的处理,则Fe3+、Fe2+的总量是基本不变的;
(2)在阳极氨气中的氮原子失去电子生成氮气,电极反应为:2NH3-6e-=N2+6H+;
(3)由图可知,氨气失去的电子最终是给了氧气,根据得失电子守恒可知,4NH3~3O2,8.96LNH3的物质的量=,则氧气的物质的量=0.3mol;
(4)纳米铁粉中掺杂炭粉,形成了活泼性不同的两个电极,形成原电池,加快反应速率;由图可知,在正极是硝酸根离子得到电子生成了铵根离子,电极反应式为:NO+8e-+10H+=NH+3H2O;
(5)pH较低时,氢离子也可以和Fe反应,会反应消耗纳米铁粉,导致与NO发生反应的纳米Fe量减小,NO处理率降低。
【分析】(1)依据循环反应原理判断;
(2)阳极失去电子,发生氧化反应;
(3)根据得失电子守恒计算;
(4)依据形成原电池分析,正极得到电子,发生还原反应;
(5)依据图中曲线变化及反应物的性质分析。
一、单选题
1.用铜片、银片设计成如图所示的原电池。以下有关该原电池的叙述正确的是( )
A.电子通过盐桥从乙池移向甲池
B.盐桥中K+向左移动
C.开始时,银片上发生的反应是Ag-e-=Ag+
D.电路中每转移2mole-,正极材料增重216g
2.化学无处不在。下列相关说法错误的是( )
A.漂白液可以灭活COVID-19病毒
B.大气污染物NO2主要来自于雷雨天气
C.纤维可素以加强胃肠的蠕动
D.高纯度硅可以作光电转换材料
3.判断如图原电池装置图示中电子或离子流向、正极或负极等标注正确的是( )
A.图甲铅蓄电池 B.图乙锌银纽扣电池
C.图丙燃料电池 D.图丁锌铜原电池
4.用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是( )
A.CuSO4 B.H2SO4 C.CuCl2 D.NaCl
5.用电解法提取氯化铜废液中的铜,方案正确的是( )
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
6.在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如右图所示。下列说法不正确的是( )
A.阴极的反应式是:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ
B.X是电源的负极
C.总反应可表示为:H2O+CO2=H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
7.氟离子电池()是一种新型的二次电池,具有极高的能量密度,其放电时变化原理如图所示。下列说法错误的是( )
A.该装置必须采用非水相电解质
B.放电时负极的电极反应式为
C.电能转化为化学能时总反应:
D.充电时当阴极减少38g时,电路中有2电子转移
8.某实验小组模拟海水淡化的同时制备H2、Cl2和NaOH溶液,装置如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
A.甲室产生的气体能使湿润的淀粉—KI试纸变蓝
B.膜①是阴离子交换膜
C.淡水的出口只有c
D.随着电解的进行,戊室溶液的pH不断增大
9.一种以锌一石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有 ,可表示为 )为正极、盐一水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法错误的( )
A.放电时,石墨烯气凝胶电极上的电极反应式为
B.多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面
C.电池总反应为
D.充电时, 被还原, 在石墨烯纤维无纺布电极侧沉积, 被氧化后在阴极嵌入
10.我国科学家使用电化学的方法(装置如图所示)用和制备。下列说法正确的是( )
A.M为电源的负极
B.阴极电极反应式为
C.该过程总反应为
D.理论上每产生1 mol CO有2 mol经过电解质
11.液态金属电池在规模储能领域具有重要的应用前景。某可充电液态金属电池放电时的工作原理如图所示,电池采用了三层液态设计,其三层液体因密度差和互不混溶而自动分层:隔膜为法拉第选择性膜,该膜既有电子通道,又有离子通道(除外)。
下列说法错误的是
A.放电时电极Y为正极
B.充电时阴极反应式为
C.放电时外电路转移2mol电子,得到Pb的总物质的量为1mol
D.法拉第选择性膜避免了直接接触Li而导致充放电性能下降
12.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如下,有关说法正确的是( )
A.电池总反应为:4NH3 + 3O2 = 2N2 + 6H2O
B.电池工作时,OH-向正极移动
C.电极2发生的电极反应为:O2+4H+ + 4e-=2H2O
D.电流由电极1经外电路流向电极2
13.下列描述中,不符合生产实际的是( )
A.电解饱和食盐H2O制烧碱,用离子交换膜将阳极室与阴极室隔开
B.电解熔融的AlCl3制取金属铝,用石墨作阳极
C.电解法精炼粗铜,用纯铜作阴极
D.在Fe上镀银,用银作阳极
14.利用下图所示装置可以模拟铁的电化学腐蚀。下列说法中,正确的是( )
A.若X为碳棒,开关K置于M处可以减缓铁的腐蚀
B.若X为铜棒,开关K置于N处可以加快铁的腐蚀
C.若X为碳棒,开关K置于M处,则为牺牲阳极的阴极保护法
D.若X为碳棒,开关K置于N处,则为外加电流的阴极保护法
15.如图所示,将两烧杯用导线如下图相连,Pt、Cu、Zn、C分别为四电极,当闭合开关后,下列叙述中正确的是( )
A.Cu极为原电池负极 B.Cu极附近显碱性
C.C极发生氧化反应 D.电子流向为由C极流向Pt极
16.中国第二化工设计院提出,用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),下列相关判断正确的是( )
A.电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2
B.电解池中质子从电极I向电极Ⅱ作定向移动
C.吸收塔中的反应为2NO+2S2O32-+H2O=N2+4HSO3-
D.每处理1 mol NO电解池质量减少16g
二、综合题
17.甲烷的直接转化具有较高的经济价值,因此备受科学家关注。请回答下列问题:
(1)用丝光沸石作催化剂可实现甲烷直接转化制备甲醇,合成方法有以下两种:
方法I:CH4(g)+O2(g)CH3OH(g) △H1=-126.4kJ mol-1
方法II:CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
已知H2的燃烧热为285.8kJ/mol,H2O(l)=H2O(g) △H=+44kJ mol-1,则△H2= 。
(2)某工厂采用方法Ⅰ生产甲醇。在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,体系的总压强随时间的变化如图所示。
①下列措施可以提高CH4的平衡转化率的是 (填标号)。
A.升高温度
B.反应达到平衡后,再充入一定量He
C.投料比不变,增大反应物浓度
②达到平衡时体系中CH3OH的体积分数为 (精确到0.1%)。
③该反应温度下,方法I的标准压力平衡常数= (列出计算式)。[已知:分压=总压×该组分物质的量分数,对于反应dD(g)+eE(g)gG(g)+hH(g), =,其中pθ=100kPa,pC、pH、pD、pE为各组分的平衡分压。]
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是 。
(3)为提高生产效率,利用方法Ⅱ进行连续生产时采用如图所示的步骤控制体系温度和通入气体(各阶段气体流速相同)。
已知大多数气体分子在催化剂表面的吸附过程是放热的,He不会在催化剂表面吸附,吸附和解吸附不会导致体系温度的变化。通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是 ;请从反应速率的角度说明,通入CH4后反应温度维持在200℃的原因: 。
(4)用ZrO2/NiCo2O4作电解催化剂也可以实现甲烷的直接转化,装置如图所示。
写出ZrO2/NiCo2O4电极的反应式: 。
18.海洋是资源的宝库,含有丰富的化学元素。
(1)在电解饱和食盐水的实验中,阳极产物的检验方法是 。
(2)目前从海水中提溴(Br 2 )大致有以下步骤。
①向浓缩的海水中通入Cl2,将海水中的 Br- 氧化为 Br2 。
②用热空气将 Br 2 从上述溶液中吹出,并由浓 Na 2 CO 3 溶液吸收,转变为 NaBr、NaBrO 3和CO2 。吸收1 moL Br 2 需消耗 Na2CO3 moL。
③再将所得混合溶液用稀硫酸酸化,得到浓度较高的溴水,配平该反应的离子方程式。
Br-+ BrO3- + H + → Br2 + H2O
(3)碘主要从海带中提取,某课外兴趣小组的同学用海带为原料制得少量碘水之后,欲用CCl4从碘水中萃取碘,请简述能用CCl4从碘水中萃取碘的原因是: 。
(4)同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为 。NaHCO3溶液中滴入少量氢氧化钠溶液,溶液中c(CO32-) (填变大或变小),请用平衡理论解释发生这种变化的原因 。
19.如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深.请回答:
(1)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 .
(2)现用丙装置给铜件镀银,当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 .
(3)Fe(OH)3胶体的制备有严格的要求,小明想向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体,结果很快就生成了红褐色的沉淀.他测得溶液的pH=5,则此时溶液中c(Fe3+)= mol/L.(已知Ksp=1×10﹣36).
(4)若用甲烷燃料电池(电解质溶液为2L2mol/LKOH溶液)提供电源,持续通入甲烷,在标准状况下,消耗甲烷的体积VL.当消耗CH4的体积在44.8<V≤89.6时,此时电源中B极发生的电极反应为: .
20.石墨烯锂离子电池可在-30~80℃环境下工作,充电效率是普通充电产品的24倍。它是一种新型二次电池。其工作原理如图所示。
电池反应式为。
请回答下列问题:
(1)放电时,负极上反应的物质为 ,LiCoO2电极的电极反应式为 。
(2)充电时,Li+向 (填“石墨烯”或“LiCoO2”)移动,转移0.5mol电子理论上阴极材料质量增加 g。
21.某小组采用电化学方法处理废气或废水中的污染物。
(1) (一)电解法处理废气中的氨(NH3),装置如图所示。
一段时间后,溶液中Fe3+、Fe2+的总物质的量 (填“增大”“减小”或“基本不变”)。
(2)阳极的电极反应式为 。
(3)若要处理8.96LNH3(标准状况),理论上消耗O2 mol。
(4)(二)采用纳米铁粉、炭粉的混合物可处理废水中的NO,原理如图1所示。
纳米铁粉中掺杂炭粉的原因是 。正极的电极反应式为 。
(5)实验表明酸性废水中NO的浓度与溶液pH的关系如图2所示。pH
1.【答案】D
【解析】【解答】A.电子从铜片经外电路流向银片,不经盐桥,A不符合题意;
B.盐桥中阳离子向正极移动,则K+向右移动,B不符合题意;
C.银片上发生的反应是:Ag++e-=Ag,C不符合题意;
D.每转移2mole-,正极生成2molAg,增重为,D符合题意;
故答案为:D。
【分析】A.口诀:“电子不小下水,离子不上岸”,电子不会通过电解质溶液
B.阴阳离子移动方向口诀:“阳正阴负”
C.正负极判断,活泼金属做负极,相对不活泼做正极,银做正极,Ag++e-=Ag
D.转移电子与生成银的关系e-~Ag,故转移2mol电子,生成2molAg,增重216g
2.【答案】B
【解析】【解答】A. 漂白液具强氧化性,故可以灭活COVID-19病毒,A不符合题意;
B. 大气污染物二氧化氮主要来自工业废气、汽车尾气等,B符合题意;
C. 纤维素在人体内不能消化,但可以加强胃肠的蠕动,C不符合题意;
D. 硅导电性介于导体与绝缘体之间,是良好的半导体,可以制成光电池,将光能直接转换为电能,D不符合题意;
故答案为:B。
【分析】A.漂白液的主要成分为NaClO,而ClO-具有强氧化性;
B.雷雨天气NO2会与水反应生成硝酸,从而形成酸雨;
D.硅属于半导体材料可以用来制备光电池。
3.【答案】C
【解析】【解答】A.铅蓄电池中Pb是原电池负极,PbO2是原电池正极,A不符合题意;
B.锌银纽扣电池中Zn是原电池负极,Ag2O是原电池正极,B不符合题意;
C.H2是燃料电池的负极,失去电子,O2是燃料电池的正极,溶液中H+向正极移动,C符合题意;
D.锌铜原电池,盐桥中Cl-向负极(右池)移动,D不符合题意;
故答案为:C。
【分析】A.铅蓄电池中Pb为负极;
B.锌银纽扣电池中Zn为负极;
C.氢氧燃料电池中,通入氢气的一极为负极,通入氧气的一极为正极;
D.原电池中阴离子向负极移动。
4.【答案】B
【解析】【解答】A、硫酸铜溶液电解质生成铜和氧气和硫酸,电解一段时间后,铜和氧元素减少,需要加入一定量的氧化铜才能恢复,不符合题意,不选A;
B、电解硫酸溶液实际上是电解水,所以电解一段时间后需要加入水就能恢复,符合题意,选B;
C、电解氯化铜溶液,产生铜和氯气,一段时间后加入氯化铜才能恢复,不符合题意,不选C;
D、电解氯化钠溶液产生氢气和氯气和氢氧化钠,一段时间后加入氯化氢才能恢复,不符合题意,不选D。
故答案为:B
【分析】加入水能够恢复原来的溶液,说明电解时相当于电解水,结合离子的放电顺序进行分析即可。
5.【答案】B
【解析】【解答】A. 用铜片连接电源的负极,另一电极用铂片,故A不符合题意
B. 用碳棒连接电源的正极,另一电极用铜片,故B符合题意
C.阴极析出了铜,故C不符合题意
D.阳极生成氯气,可用湿润的淀粉KI试纸检验,故D不符合题意
故答案为:B
【分析】电解氯化铜提取铜,则阴极析出了铜
6.【答案】D
【解析】【解答】A.电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳,CO2+2e-═CO+O2-,故A不符合题意;
B.根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极,故B不符合题意;
C.电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2 H2+CO+O2,故C不符合题意;
D.电解H2O-CO2混合气体制备H2和CO,总反应为:H2O+CO2 H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,故D符合题意。
故答案为:D
【分析】根据电解原理进行分析电源电极、电极方程式的书写等即可.
7.【答案】B
【解析】【解答】A.Ca是活泼金属,钙能与水反应,所以该装置必须采用非水相电解质,故A不符合题意;
B.根据图示,放电时负极的电极反应式为,故B符合题意;
C.电池充电时,电能转化为化学能,总反应:,故C不符合题意;
D.充电时阴极反应为,当阴极减少38g时,生成2molF-,电路中有2电子转移,故D不符合题意;
故答案为:B。
【分析】A.钙的性质活泼,能与水反应;
B.放电时负极的电极反应式为;
C.充电时电能转化为化学能,总反应为;
D.根据得失电子守恒计算。
8.【答案】C
【解析】【解答】A.甲室为阳极室,电极反应式为 , 能使湿润的淀粉 试纸变蓝,A不符合题意;
B.反应过程中丙室中 通过膜②到丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,B不符合题意;
C.淡水的出口为a和c,C符合题意;
D.戊室的电极反应式为 ,随电解的进行,溶液的pH不断增大,D不符合题意。
故答案为:C。
【分析】该反应甲室连接电源正极为阳极室,戊室连接电源负极为阴极室;阳极电极反应式为 ,阴极电极反应式为 ;反应过程中丙室中 通过膜②到丁室,戊室中生成的OH-通过阴膜到达丁室, 通过膜①到乙室;膜①是阴离子交换膜,膜②是阳离子交换膜,淡水的出口为a和c,d中生成 NaOH ,以此分析。
9.【答案】D
【解析】【解答】A.放电时,正极发生还原反应,石墨烯气凝胶电极上的电极反应式为 ,故A不符合题意;
B.多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于 扩散至电极表面,故B 不符合题意;
C.由分析可知,电池总反应为 ,故C不符合题意;
D.充电时, 被还原,Zn在石墨烯纤维无纺布电极侧沉积, 被氧化后在阳极嵌入,D项符合题意;
故答案为:D。
【分析】结合图可知,电池总反应为 ,放电时,正极反应为: ,负极反应为:Zn-2e-=Zn2+,据此解答。
10.【答案】C
【解析】【解答】A. 与M极相连的电极上将C2H6转化成C2H4,碳元素化合价由-3升高到-2,失去电子,发生了氧化反应,做阳极,与电源正极相连,因此M极为正极。A不符合题意。
B. 由A知M为正极,则N为负极。与N相连的为阴极,将CO2转化成CO。由装置示意图可知电解质允许O2-通过,故阴极电极反应方程式为CO2+2e-=CO+O2-。B不符合题意。
C. 由装置示意图可知C2H6和CO2制备C2H4的过程还有CO生成。另外,根据原子守恒还应有H2O生成。故总反应为。C符合题意。
D. 每生成1 mol CO外电路中应从阳极向阴极流入2 mol e-。当2 mol e-从阳极流出时会形成 2 mol 正电荷。阴阳极均为电中性,故阳极应有2 mol 负电荷补充。依据题意应是O2-移动到阳极补充负电荷。1 mol O2-即可提供2 mol 负电荷。因此,理论上每产生1 mol CO有1 mol O2-经过电解质。D不符合题意。
故答案为:C。
【分析】A. 阳极与电源正极相连发生氧化反应;
B. 阴极与负极相连发生还原反应。
C. 根据原子守恒;
D. 依据转移电子数等于移动离子所带电荷数。
11.【答案】C
【解析】【解答】A.放电时电极Y为正极,故A不符合题意;
B.电极X为负极电极方程式为:Li -e-=Li+,则充电时阴极反应式为,故B不符合题意;
C.放电时外电路转移2mol电子时,电极Y处发生电极反应,生成1molPb,同时电子又通过法拉第选择性膜中的电子通道进入含有PbCl2和LiCl的熔融电解质,Pb2+得到电子生成Pb,则得到Pb的总物质的量大于1mol,故C符合题意;
D.法拉第选择性膜,该膜既有电子通道,又有离子通道(除外),不能通过膜,法拉第选择性膜避免了直接接触Li而导致充放电性能下降,故D不符合题意;
故答案为:C。
【分析】放电时,根据电子流向可知,电极X为负极,电极反应式为Li -e-=Li+,电极Y为正极,电极反应式为,则充电时,电极X为阴极,电极反应式为,电极Y为阳极,电极反应式为Pb-2e-=Pb2+。
12.【答案】A
【解析】【解答】A.氨气的氧化产物是氮气,则燃料电池的总反应可表示为4NH3+3O2=2N2+6H2O,A符合题意;
B.原电池中,阳离子向正极移动,阴离子向负极移动,即OH-向负极移动,B不符合题意;
C.氧气在正极得到电子,溶液显碱性,则正极电极反应为O2+2H2O+4e-=4OH-,C不符合题意;
D.原电池中电流从正极流向负极,即电流由电极2经外电路流向电极1,D不符合题意,
故答案为:A。
【分析】A.结合反应物和生成物写出即可
B.考查的是原电池中阴阳离子移动的方向
C.电极2做正极,氧气发生还原反应,注意电解质溶液酸碱性
D.考查的电流的方向
13.【答案】B
【解析】【解答】A.电解饱和食盐H2O制烧碱,阳极室产生氯气,阴极室得到氢气,防止出现事故,则用离子交换膜将阳极室与阴极室隔开,A符合实际生产;
B.AlCl3为共价化合物,通常用电解熔融的氧化铝制取金属铝,用石墨作阳极,B不符合实际生产;
C.电解法精炼粗铜,粗铜作阳极失电子生成铜离子,用纯铜作阴极,溶液中的铜离子得电子生成单质铜,C符合实际生产;
D.在Fe上镀银,Fe作阴极,溶液中的银离子得电子生成银,用银作阳极,银失电子生成银离子,D符合实际生产;
故答案为:B。
【分析】A.电解饱和食盐水时负极产生氢气,H2易燃易爆,采用离子交换膜进行隔离;
B.AlCl3不导电,无法电离;
C.电解精炼铜时粗铜做阳极,纯铜在阴极析出;
D.电镀时镀层金属做阳极;
14.【答案】D
【解析】【解答】A、K置于M处是原电池,X为碳,铁比碳活泼作负极,铁失去电子,加速铁的腐蚀,A错误;
B、K置于N处是电解池,铁作阴极被保护,可以减缓铁的腐蚀,B错误;
C、K置于M处是原电池,Fe比碳活泼,铁作负极失去电子被腐蚀,这不是牺牲阳极的阴极保护法,若X为比铁活泼的金属,则铁作正极被保护,才是牺牲阳极的阴极保护法,C错误;
D、开关K置于N处是电解池,铁作阴极被保护,这是外加电流的阴极保护法,D正确。正确答案为D。
【分析】有外加电源的电解池,铁在阴极,保护铁不被腐蚀。不加外加电源的为原电池,若铁活泼。铁为负极,会加速腐蚀
15.【答案】B
【解析】【解答】A.据分析可知Zn极为原电池负极,A不符合题意;
B.阴极(Cu电极) :2H++2e-=H2↑,溶液中多余OH-,Cu极附近显碱性,B符合题意;
C.正极(C极):2H++2e-=H2,H化合价降低发生还原反应,C不符合题意;
D.电子流向为由负极流向负极,则电子流向为Zn极流向C极,D不符合题意;
故答案为:B。
【分析】开关闭合后,右侧烧杯为原电池,其中Zn为负极,其电极反应式为Zn-2e-=Zn2+;C为正极,其电极反应式为2H++2e-=H2↑。左侧烧杯为电解池,Cu电极为阴极,其电极反应式为2H2O+2e-=H2↑+2OH-;Pt电极为阳极,其电极反应式为2Cl--2e-=Cl2↑。
16.【答案】C
【解析】【解答】A. 电极I为阴极,阴极上是HSO3-获得电子生成S2O42-,酸性条件下还生成水,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,故A不符合题意;
B. 电解池中质子从电极Ⅱ向电极I作定向移动,故B不符合题意;
C. 吸收池中S2O42-与NO反应生成N2与HSO3-,反应离子方程式为:吸收塔中的反应为2NO+ 2S2O32-+H2O=N2+4HSO3-,故C符合题意;
D、电解池中发生的反应:4HSO3-=2H2O+O2+2S2O42-,结合吸收塔中的反应:2NO+ 2S2O32-+H2O=N2+4HSO3-,得关系式:2NO~O2~4H+,每处理1 mol NO电解池质量减少16 gO2和2gH+,共18g,故D不符合题意;
故答案为:C。
【分析】本题探究电解池的工作原理
A、酸性条件下,电极I为阴极,发生还原反应,2HSO3-+2H++2e-=S2O42-+2H2O;
B、 电解池中质子从阳极向阴极作定向移动;
C、陌生氧化还原反应方程式的书写;
D、用关系式法分析;
17.【答案】(1)+115.4kJ mol-1
(2)C;65.2%;;反应为放热反应,随着反应的进行,溶液温度升高,将使平衡逆向移动
(3)降低混合气的温度,使温度维持在200℃左右;200℃是催化剂的活性温度,且反应速率较快
(4)3CH4-6e-+6OH-=CH3CH2CH2OH+5H2O
【解析】【解答】(1)①CH4(g)+O2(g)CH3OH(g) △H1=-126.4kJ mol-1
②CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2
③H2(g)+O2(g)= H2O(l)|△H3=-285.8kJ mol-1
④H2O(l)=H2O(g)| △H4=+44kJ mol-1
利用盖斯定律,将反应①-③-④,得反应②为CH4(g)+H2O(g)CH3OH(g)+H2(g) △H2=+115.4kJ mol-1。故答案为:+115.4kJ mol-1
(2)①A.升高温度,平衡逆向移动,CH4的平衡转化率减小,A不正确;
B.反应达到平衡后,再充入一定量He,对反应物和生成物的压强都不产生影响,CH4的平衡转化率不变,B不正确;
C.投料比不变,增大反应物浓度,相当于加压,平衡正向移动,CH4的平衡转化率增大,C正确;
故答案为:C。
②在200℃下,向容积为5L的恒容密闭反应器中加入催化剂,并充入6.0kPaCH4、4.8kPaO2和一定量He使反应充分进行,从图中看出,起始总压强为12kPa,平衡时总压强为9.05kPa,则He的压强为12kPa-6.0kPa-4.8kPa=1.2kPa,设参加反应的CH4的压强为x,则可建立如下三段式:
则6.0-x+4.8-0.5x+x+1.2=9.05 x=5.9kPa
则达到平衡时体系中CH3OH的体积分数为≈65.2%。
③该反应温度下,方法I的标准压力平衡常数=。
④若将容器改为绝热容器,初始温度为200℃,其他条件不变,达到新平衡时,甲醇产率降低,原因是:反应为放热反应,随着反应的进行,溶液温度升高,将使平衡逆向移动。故答案为:C;65.2%;;反应为放热反应,随着反应的进行,溶液温度升高,将使平衡逆向移动;
(3)通入CH4发生反应前,要往反应器中通入O2从而活化催化剂,活化催化剂后持续通入He一段时间的目的是:降低混合气的温度,使温度维持在200℃左右;从反应速率的角度分析,通入CH4后反应温度维持在200℃的原因:200℃是催化剂的活性温度,且反应速率较快。故答案为:降低混合气的温度,使温度维持在200℃左右;200℃是催化剂的活性温度,且反应速率较快;
(4)从图中可以看出,ZrO2/NiCo2O4电极为负极,则CH4失电子产物与电解质反应生成CH3CH2CH2OH等,电极反应式为3CH4-6e-+6OH-=CH3CH2CH2OH+5H2O。故答案为:3CH4-6e-+6OH-=CH3CH2CH2OH+5H2O。
【分析】(1)盖斯定律的应用要注意,判断列出的热化学方程式的对应关系,左右两边相同的物质互相抵消则相加,在同一边相同的物质互相抵消则相减;
① 提高甲烷转化率可以通过使平衡朝正向移动,或者投料比不变的情况下增大反应物的浓度;
② 结合三段式和已知数据判断;
③ 分压平衡常数要结合总压强和总物质的量判断;
④ 升高温度,平衡朝吸热方向移动;
(3)温度较高时,可以提高速率,且要控制在一定温度,不能过高,否则会使催化剂失去活性;
(4)甲烷失去电子,结合氢氧根离子生成丙醇和水。
18.【答案】(1)湿润的淀粉碘化钾试纸变蓝
(2)1mol;5;1;6;3;3
(3)单质碘在四氯化碳中的溶解度大于在水中的溶解度;四氯化碳与水互不相容,存在较大的密度差;碘与四氯化碳不反应
(4)Na2CO3;NaHCO3;增大;HCO3- H++ CO32-,滴入氢氧化钠,OH—结合H+生成水,导致电离平衡正向移动,[CO32-]增大
【解析】【解答】(1)在电解饱和食盐水的实验中,阳极产物是氯气,氯气能使湿润的淀粉碘化钾试纸变蓝,所以阳极产物的检验方法是湿润的淀粉碘化钾试纸变蓝;(2)②溴与碳酸钠反应的方程式为3Br2+3Na2CO3= 5NaBr+NaBrO3+3CO2,吸收1 moL Br2需消耗 Na2CO3 1mol;③根据得失电子守恒、电荷守恒,离子方程式为5Br— +1 BrO3- +6H + =3 Br2 +3H2O;(3). 单质碘在四氯化碳中的溶解度大于在水中的溶解度;四氯化碳与水互不相容,存在较大的密度差;碘与四氯化碳不反应,所以用CCl4从碘水中萃取碘(4)CO32-水解程度大于HCO3-,所以同温同浓度的Na2CO3溶液、NaHCO3溶液,PH大小顺序为Na2CO3>NaHCO3;滴入氢氧化钠,OH-结合H+生成水,氢离子浓度减小,导致HCO3— H++ CO32—平衡正向移动,[CO32-]增大。
【分析】(1)电解饱和食盐水的实验中,接通电源后,连接电源正极的电极(阳极)表面有气泡冒出,该黄绿色气体能使湿润的淀粉碘化钾试纸变蓝;连接电源负极的电极(阴极)表面有气泡冒出,收集该无色气体点燃,可听到轻微爆鸣声.在阴极区滴加酚酞试液,酚酞变红;(2)根据得失电子守恒、电荷守恒书写方程式;(3)用CCl4从碘水中萃取碘;(4)根据CO32-水解程度大于HCO3-分析。
19.【答案】(1)1:2:2:2
(2)5.4g
(3)10﹣9
(4)CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣
【解析】【解答】解:(1)C、D、E、F电极发生的电极反应分别为:4OH﹣═O2↑+2H2O+4e﹣、Cu2++2e﹣═Cu、2Cl﹣═Cl2↑+2e﹣、2H++2e﹣═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2;故答案为:1:2:2:2;(2)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;当乙中溶液的pH是13时,溶液的c(OH﹣)=0.1mol L﹣1时,根据电极反应2H2O+2e﹣═H2↑+2OH﹣,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,故答案为:5.4g;(3)Fe(OH)3饱和溶液中,c(H+)=10﹣5mol/L,Fe(OH)3 Fe3++3OH﹣生成的氢氧根:c(OH﹣)=10﹣9mol/L,根据Ksp=c(Fe3+) c(OH﹣)3=1×10﹣36.解得c(Fe3+)=10﹣9mol/L,故答案为:10﹣9;(4)n(KOH)=2mol/L×2L=4mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,44.8L<V≤89.6L时,根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾,负极反应式为CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣,故答案为:CH4﹣8e﹣+9CO32﹣+3H2O=10HCO3﹣.
【分析】(1)C、D、E、F电极转移的电子数目相等,结合电极反应式根据转移电子数可计算生成的单质的量;(2)电镀装置中,镀层金属必须做阳极,镀件做阴极,电镀液含有镀层金属阳离子;根据乙中氢氧根离子的浓度计算其物质的量,结构电极反应式计算转移电子物质的量,各个电极上转移的电子数是相等的,据此计算丙中析出Ag的物质的量,进而计算质量;(3)Fe(OH)3存在如下平衡:Fe(OH)3(s) Fe3+(aq)+3OH﹣(aq),根据Fe(OH)3的溶度积常数和氢氧根离子浓度计算铁离子浓度计算;(4)n(KOH)=2mol/L×2L=4mol,该装置是燃料电池,负极上甲烷失电子发生氧化反应,正极上氧气得电子发生还原反应,根据原子守恒得2mol<n(CO2)≤4mol,反应生成碳酸氢钾.
20.【答案】(1);
(2)石墨烯;3.5
【解析】【解答】(1)根据电池反应式可知,失去电子,生成Li+和C6,则负极上放电物质为;LiCoO2为正极,正极发生还原反应,电极反应为。
(2)充电时,石墨烯为阴极,Li+移向阴极(石墨烯);阴极电极反应式为,转移0.5mol电子理论上阴极材料质量增加。
【分析】根据电池反应式可知,负极上LixC6失去电子,生成Li+和C6,则负极上放电物质为LixC6,电极反应为:LixC6 xe =xLi++C6,LiCoO2为正极,正极发生还原反应,电极反应为Li1 xCoO2+xe +xLi+=LiCoO2,充电时,石墨烯为阴极,阴极上发生得电子的还原反应,电极反应即为放电时负极反应的逆反应,阳极上发生失电子的氧化反应,电极反应即为放电时正极反应的逆反应,据此回答。
21.【答案】(1)基本不变
(2)2NH3-6e-=N2+6H+
(3)0.3
(4)形成了活泼性不同的两个电极,形成原电池,加快反应速率;NO+8e-+10H+=NH+3H2O
(5)氢离子也可以和Fe反应,会反应消耗纳米铁粉,导致与NO发生反应的纳米Fe量减小,NO处理率降低
【解析】【解答】(1)由图可知,该反应通过Fe3+和Fe2+的循环实现了废气中氨气的处理,则Fe3+、Fe2+的总量是基本不变的;
(2)在阳极氨气中的氮原子失去电子生成氮气,电极反应为:2NH3-6e-=N2+6H+;
(3)由图可知,氨气失去的电子最终是给了氧气,根据得失电子守恒可知,4NH3~3O2,8.96LNH3的物质的量=,则氧气的物质的量=0.3mol;
(4)纳米铁粉中掺杂炭粉,形成了活泼性不同的两个电极,形成原电池,加快反应速率;由图可知,在正极是硝酸根离子得到电子生成了铵根离子,电极反应式为:NO+8e-+10H+=NH+3H2O;
(5)pH较低时,氢离子也可以和Fe反应,会反应消耗纳米铁粉,导致与NO发生反应的纳米Fe量减小,NO处理率降低。
【分析】(1)依据循环反应原理判断;
(2)阳极失去电子,发生氧化反应;
(3)根据得失电子守恒计算;
(4)依据形成原电池分析,正极得到电子,发生还原反应;
(5)依据图中曲线变化及反应物的性质分析。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
