1.4 金属的腐蚀与防护 (含解析)章节测试 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.4 金属的腐蚀与防护 (含解析)章节测试 2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 863.1KB | ||
| 资源类型 | 教案 | ||
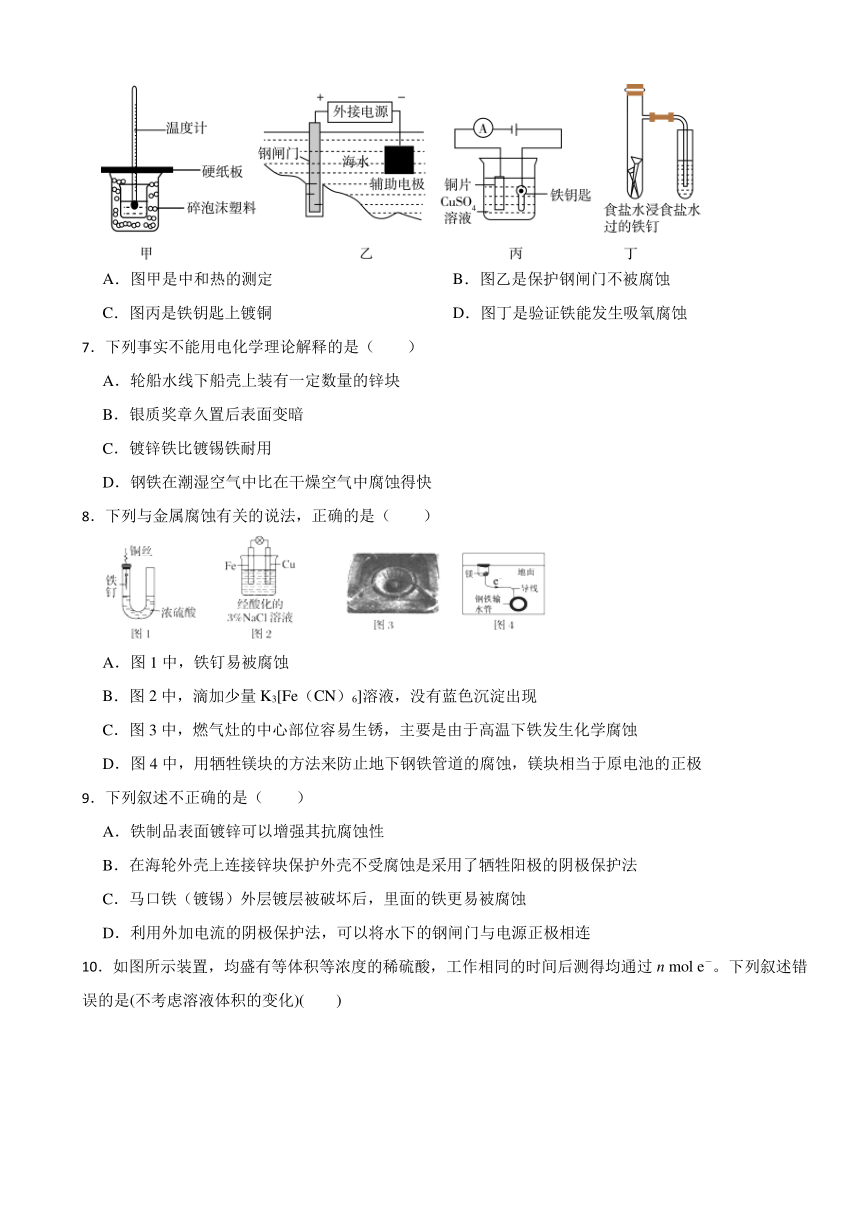
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
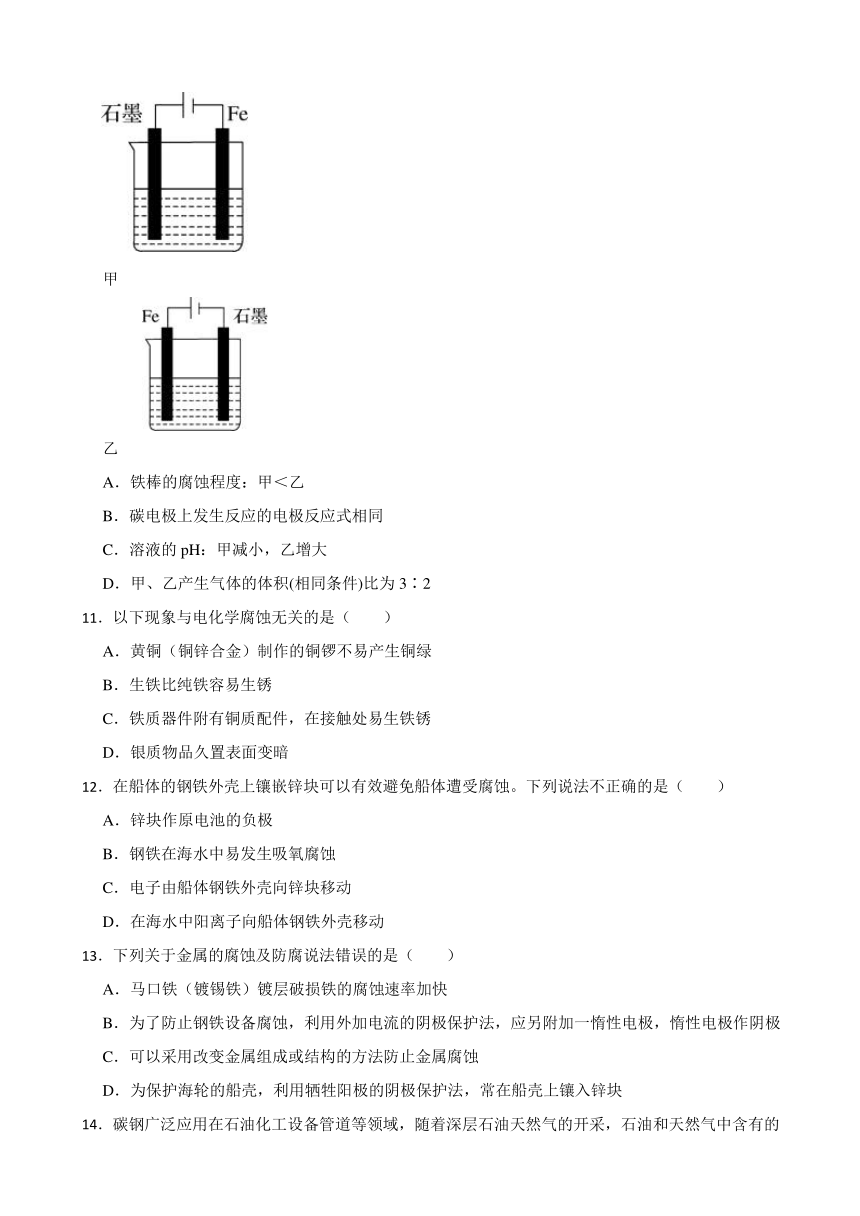
| 更新时间 | 2023-12-09 14:24:56 | ||
图片预览

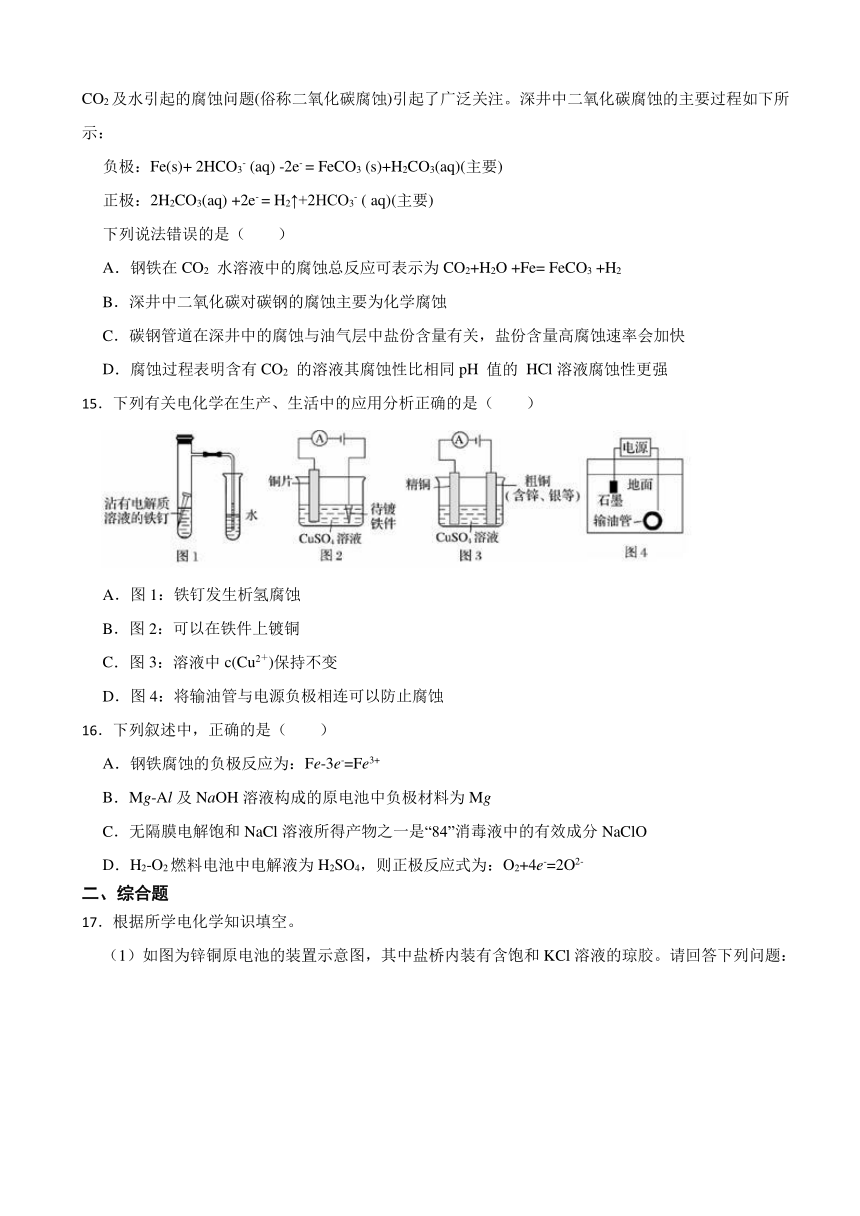
文档简介
1.4 金属的腐蚀与防护 章节测试
一、单选题
1.能有效防止铁质栏杆锈蚀的措施是( )
A.接上铜网 B.定期擦去铁锈
C.与石墨相连 D.定期涂上油漆
2.下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
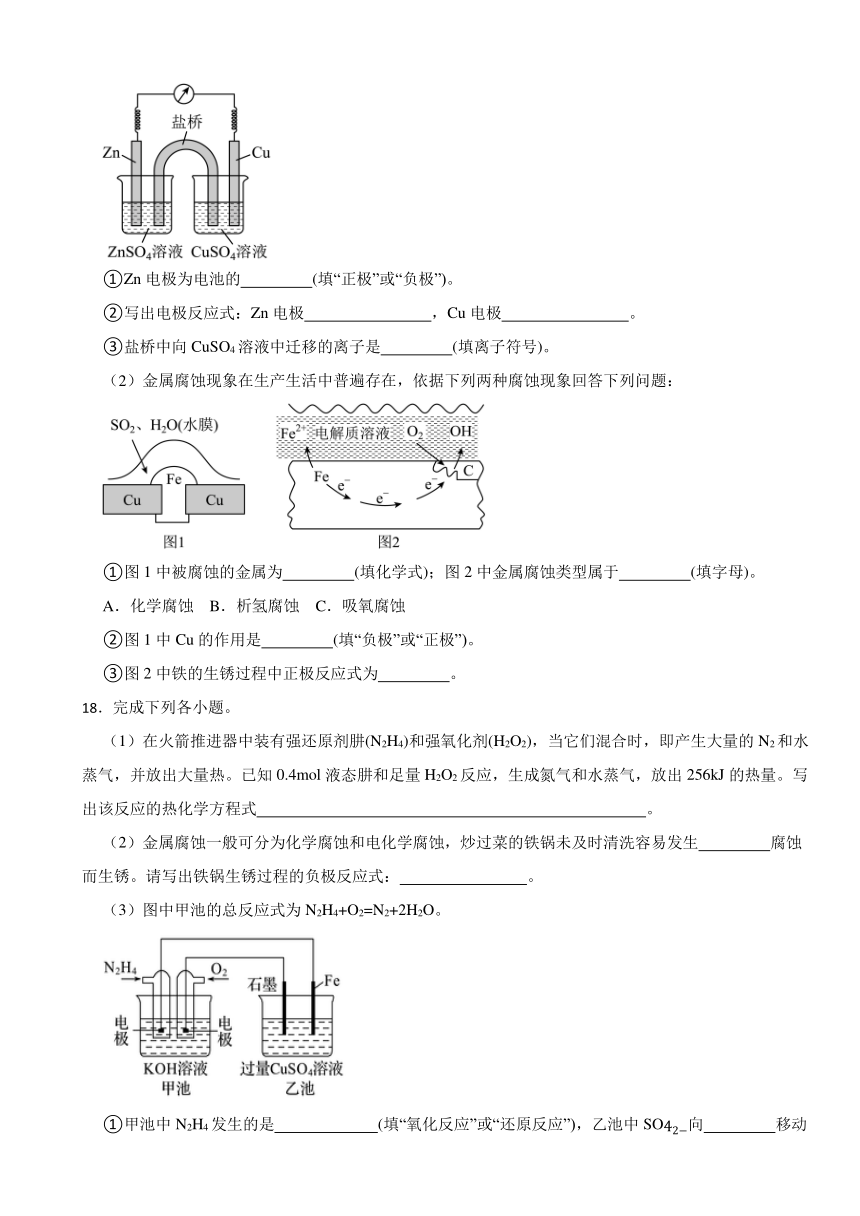
A.地下钢管连接镁块 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
3.钢铁又叫铁碳合金,是工业生产中极其重要且用量很大的金属材料。下列方法不能减缓钢铁腐蚀速率的是( )
A.在钢铁制品表面喷一层漆 B.掺入铬、镍制成不锈钢产品 C.把钢铁置于干燥空气中保存 D.外加电流法
A.A B.B C.C D.D
4.下列有关金属腐蚀与防护的说法不正确的是( )
A.纯银器的表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
5.下列说法正确的是( )
A.淀粉、蛋白质、油脂均属于天然有机高分子化含物
B.FeO粉末在空气中受热,迅速被氧化成
C.可漂白纸浆,可用于杀菌、消毒
D.镀锌铁皮的镀层破损后,铁皮会加速腐蚀
6.下列实验装置图符合题意且能达到相应实验目的的是( )
A.图甲是中和热的测定 B.图乙是保护钢闸门不被腐蚀
C.图丙是铁钥匙上镀铜 D.图丁是验证铁能发生吸氧腐蚀
7.下列事实不能用电化学理论解释的是( )
A.轮船水线下船壳上装有一定数量的锌块
B.银质奖章久置后表面变暗
C.镀锌铁比镀锡铁耐用
D.钢铁在潮湿空气中比在干燥空气中腐蚀得快
8.下列与金属腐蚀有关的说法,正确的是( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
9.下列叙述不正确的是( )
A.铁制品表面镀锌可以增强其抗腐蚀性
B.在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀
D.利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连
10.如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)( )
甲
乙
A.铁棒的腐蚀程度:甲<乙
B.碳电极上发生反应的电极反应式相同
C.溶液的pH:甲减小,乙增大
D.甲、乙产生气体的体积(相同条件)比为3∶2
11.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比纯铁容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质物品久置表面变暗
12.在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )
A.锌块作原电池的负极
B.钢铁在海水中易发生吸氧腐蚀
C.电子由船体钢铁外壳向锌块移动
D.在海水中阳离子向船体钢铁外壳移动
13.下列关于金属的腐蚀及防腐说法错误的是( )
A.马口铁(镀锡铁)镀层破损铁的腐蚀速率加快
B.为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极
C.可以采用改变金属组成或结构的方法防止金属腐蚀
D.为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块
14.碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:Fe(s)+ 2HCO3- (aq) -2e- = FeCO3 (s)+H2CO3(aq)(主要)
正极:2H2CO3(aq) +2e- = H2↑+2HCO3- ( aq)(主要)
下列说法错误的是( )
A.钢铁在CO2 水溶液中的腐蚀总反应可表示为CO2+H2O +Fe= FeCO3 +H2
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2 的溶液其腐蚀性比相同pH 值的 HCl溶液腐蚀性更强
15.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
16.下列叙述中,正确的是( )
A.钢铁腐蚀的负极反应为:Fe-3e-=Fe3+
B.Mg-Al及NaOH溶液构成的原电池中负极材料为Mg
C.无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO
D.H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2-
二、综合题
17.根据所学电化学知识填空。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
①Zn电极为电池的 (填“正极”或“负极”)。
②写出电极反应式:Zn电极 ,Cu电极 。
③盐桥中向CuSO4溶液中迁移的离子是 (填离子符号)。
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
①图1中被腐蚀的金属为 (填化学式);图2中金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是 (填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为 。
18.完成下列各小题。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,炒过菜的铁锅未及时清洗容易发生 腐蚀而生锈。请写出铁锅生锈过程的负极反应式: 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
①甲池中N2H4发生的是 (填“氧化反应”或“还原反应”),乙池中SO向 移动(填“左”或“右”)。
②乙池中总反应的离子方程式为 。
③要使乙池恢复到反应前的状态,应向溶液中加入 (填化学式)。
19.钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是 。
(2)下列哪个装置可防止铁棒被腐蚀________。
A. B.
C. D.
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
①A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
20.资源必须要合理使用.
(1)水是一种宝贵的资源,保护水资源就是保护我们的生命.
①下列做法不利于水资源保护的是 (填字母代号)
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于 (填“可回收物”或“可堆肥垃圾”);
③在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染.在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式 .
(2)保护环境、爱护地球已成为人们的共同呼声.
①我们常在公共场所见到下列标志,其中属于回收标志的是
②2014年1月,教育部规定在学校公共场所禁止吸烟.下列有关说法中,不正确的是 .
A.吸烟会对室内和公共场所造成污染
B.吸入焦油、尼古丁及颗粒物可导致多种病变
C.N2、CO2、CO尼古丁和都属于室内空气污染物
(3)化学与生活关系密切.现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
① 是重要的体内能源;
② 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(4)材料是人类赖以生存和发展的重要物质基础
①试管、烧杯和烧瓶等化学仪器的主要材质是 ;
A.玻璃 B.陶瓷 C.水泥
②“辽宁号”航母的服役举世瞩目.钢铁是制造航母的主要材料.生铁和钢成分上的主要差别是 ;
A.碳的含量不同 B.磷、硫的含量不同 C.镍、铬等金属含量不同
③钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为 .
21.根据问题进行作答:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
D.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
答案解析部分
1.【答案】D
【解析】【解答】A、接上铜网与铁形成原电池,铁活泼作负极加快锈蚀,故A不符合题意;
B、定期擦去铁锈,不能隔绝氧气和水,不能防止钢铁锈蚀,故B不符合题意;
C、与石墨相连,石墨与铁形成原电池,铁活泼作负极加快锈蚀,故C不符合题意;
D、定期涂上油漆,能隔绝氧气和水,能防止钢铁锈蚀,故D符合题意.
故答案为:D.
【分析】根据金属的腐蚀可知铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈,据此进行分析即可.
2.【答案】A
【解析】【解答】A.地下钢管连接镁块,Fe、Mg、电解质溶液构成原电池,Fe失电子能力小于Mg而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法,故A符合题意;
B.金属护拦表面涂漆,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故B不符合题意;
C.汽车底盘喷涂高分子膜,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故C不符合题意;
D.水中的钢闸门连接电源的负极,充当电解池的阴极,属于外加电流的阴极保护法,故D不符合题意;
故答案为:A。
【分析】金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析判断。
3.【答案】D
【解析】【解答】A.在钢铁制品表面喷一层漆,可以避免钢铁制品与空气接触,因而就可以减缓钢铁腐蚀速率,A不符合题意;
B.掺入铬、镍制成不锈钢产品,改变了金属的内部结构,提高了钢铁的抗腐蚀性能,故可以减缓钢铁腐蚀速率,B不符合题意;
C.金属腐蚀大多是在潮湿的环境中发生的电化学腐蚀,把钢铁置于干燥空气中保存,就可以避免原电池反应的发生,因而可减缓钢铁腐蚀速率,C不符合题意;
D.根据图示可知外加电流法连接时,钢闸门连接电源的正极,作阳极,导致钢铁腐蚀速率比不连接电源还快,使钢闸门腐蚀速率大大增加,因而不能减缓钢铁腐蚀速率,D符合题意;
故答案为:D。
【分析】金属与空气、水接触易腐蚀,形成原电池会加速金属腐蚀。
4.【答案】D
【解析】【解答】A.纯银器在空气中因发生化学腐蚀,表面易生成硫化物失去光泽,A正确;
B.当镀锡铁制品镀层破损时,由于铁比锡活泼,形成原电池时,铁作原电池的负极,加快铁的腐蚀,B正确;
C.锌比铁活泼,当在海轮外壳上连接锌块后,锌失电子而海轮外壳被保护,C正确;
D.要采用电解原理保护金属,应将金属与电源的负极相连,即作电解池的阴极,D错误。
故答案为:D
【分析】A. 纯银器的表面变暗的原因是被氧气氧化,属于化学腐蚀;
B. 当镀锡铁制品的镀层破损时,会加速内部金属的腐蚀;
C. 在海轮外壳连接锌块时,采用 牺牲阳极的阴极保护法来保护外壳不受腐蚀;
D.电源的负极连接电解池的阴极,发生还原反应,不被腐蚀。
5.【答案】C
【解析】【解答】A.油脂是高级脂肪酸甘油酯,不是高分子化合物,A不符合题意;
B.氧化亚铁具有较强的还原性,在空气中受热容易被氧气氧化为稳定的四氧化三铁,B不符合题意;
C.二氧化硫除了具有漂白作用,可漂白纸浆、毛和丝等,还可用于杀菌消毒,例如,在葡萄酒酿制过程中可适当添加二氧化硫,起到杀菌、抗氧化作用,C符合题意;
D.镀锌的铁皮镀层破损后构成原电池,锌作负极,铁作正极被保护,铁皮不易被腐蚀,D不符合题意;
故答案为:C。
【分析】易错分析:A.油脂不属于高分子化合物,高分子化合物的分子量一般从几千到十几万不等。
6.【答案】D
【解析】【解答】A.图甲中缺少混合溶液使用的环形玻璃搅拌棒,因此不能达到准确测定中和热数值的目的,A不符合题意;
B.要保护铁闸门,应该使电源的负极与铁闸门连接,图乙中铁闸门与电源正极连接,作阳极,会加快金属的腐蚀,不能保护钢闸门,B不符合题意;
C.要在铁钥匙上镀铜,应该使铁钥匙连接电源负极作阴极,Cu连接电源正极作阳极,图示连接刚好顺序相反,不能达到实验目的,C不符合题意;
D.铁钉用中性食盐水浸泡后,放在密闭试管中,若其发生吸氧腐蚀,且试管中气体由于消耗而导致压强减小,小试管中的食盐水会在外界大气压强作用下进入导气管而形成一小段水柱,因此图丁可以达到验证铁能发生吸氧腐蚀的目的,D符合题意;
故答案为:D。
【分析】A.缺少环形玻璃搅拌棒;
B.钢闸门与电源正极相连作阳极,加快腐蚀;
C.要在铁钥匙上镀铜,应该使铁钥匙连接电源负极作阴极。
7.【答案】B
【解析】【解答】A,轮船水线下船壳上装有一定数量的锌块,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生的是原电池反应,可用电化学理论解释,故A不符合题意;
B,银质奖章久置后表面变暗是银单质直接被氧化的结果,属于化学腐蚀,故B符合题意;
C,镀锌铁与镀锡铁相比,若破损后,镀锌铁因Zn比Fe活泼,Zn被腐蚀,镀锡铁因Fe比Sn活泼,Fe被腐蚀,所以镀锌铁比镀锡铁耐用,发生的是原电池反应,可用电化学原理解释,故C不符合题意;
D,在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH-,还溶解了氧气等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳形无数微小的原电池,而在干燥空气中主要发生化学腐蚀,比电化学腐蚀慢得多,故D不符合题意。
答案选B
【分析】A、Zn比Fe活泼,构成Zn与Fe原电池;
B、银制品变黑是被空气中氧气氧化;
C、Zn比Fe活泼,Fe比Sn活泼,分别构成原电池,较活泼的金属为负极;
D、钢铁在潮湿空气中发生经典的电化学腐蚀;
8.【答案】C
【解析】【解答】解:A.浓硫酸具有吸水性,能够干燥空气,干燥条件下,铁钉不易被腐蚀,故A错误;
B.Fe失电子生成亚铁离子,滴加少量K3[Fe(CN)6]溶液,有蓝色沉淀出现,故B错误;
C.高温下,Fe与氧气反应生成四氧化三铁,该条件下,铁发生化学腐蚀,故C正确;
D.Fe、Mg构成原电池时,Mg的活泼性比Fe强,Mg失电子作负极,故D错误.
故选C.
【分析】A.浓硫酸具有吸水性,干燥条件下,铁钉不易被腐蚀;
B.Fe失电子生成亚铁离子;
C.高温下,Fe与氧气反应;
D.Fe、Mg构成原电池时,Mg的活泼性比Fe强,作负极.
9.【答案】D
【解析】【解答】解:A.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈,故A正确;
B.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故B正确;
C.当马口铁(镀锡)破损后,形成的原电池中,金属铁是负极,易被腐蚀,故C正确;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极,所以钢闸门与电源的负极相连,故D错误.
故选D.
【分析】A.锌在空气中容易形成致密的氧化膜;
B.海轮外壳连接锌块,锌为负极;
C.原电池的负极更易被腐蚀,正极金属被保护;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极.
10.【答案】B
【解析】【解答】A、甲装置中铁做阴极被保护,乙装置中Fe为负极,被腐蚀,因此铁棒的腐蚀程度:甲<乙,A不符合题意;
B、甲池中,石墨电极(阳极)上反应为4OH--4e-=2H2O+O2↑,乙池中,石墨电极(正极)反应为2H++2e-=H2↑,B符合题意;
C、甲池因水被电解,H2SO4浓度变大,pH减小,乙池因H2SO4被消耗,酸性减弱,pH增大,C不符合题意;
D、甲池产生H2、O2且体积比为2∶1,乙池只生成H2,可见甲乙产生气体的体积(相同条件)比为3∶2,D不符合题意;
故答案为:B
【分析】A.甲装置中,铁做阴极,被保护,乙装置中,铁做阳极,被腐蚀;
B.甲装置中,石墨电极上OH-发生失电子的氧化反应,乙装置中,石墨电极上H+发生得电子的还原反应;
C.根据电解池发生的反应分析溶液pH的变化;
D.根据电极反应式计算产生气体的体积;
11.【答案】D
【解析】【解答】解:A.黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀有关,故A不选;
B.生铁中金属铁、碳、潮湿的空气能构成原电池,金属铁为负极,易被腐蚀而生锈,和电化学腐蚀有关,故B不选;
C.铁质器件附有铜质配件,在接触处形成原电池装置,其中金属铁为负极,易生铁锈,和电化学腐蚀有关,故C不选;
D.银质奖牌长期放置后在其奖牌的表面变暗是由于金属银和空气中的成分发生反应的结果,属于化学腐蚀,与电化学腐蚀无关,故D选;
故选D.
【分析】根据是否能构成原电池判断,如果金属能构成原电池的就能产生电化学腐蚀,否则不能产生电化学腐蚀,据此分析解答.
12.【答案】C
【解析】【解答】A.牺牲阳极法安装活泼金属做原电池负极,被保护的钢铁做正极,锌块作负极,A项不符合题意;
B.海水中pH接近中性,易发生吸氧腐蚀,B项不符合题意;
C.原电池中电子从负极经外电路流向正极,C项符合题意;
D.原电池正极得电子,电解质中阳离子向正极移动,D项不符合题意;
故答案为:C。
【分析】 钢铁外壳上镶嵌锌块 ,形成锌铁原电池,锌作负极,铁作正极,电子从锌电极流向铁电极,钢铁被保护。
13.【答案】B
【解析】【解答】解:A、马口铁(镀锡)的表面一旦破损,构成原电池,Fe为负极,则铁腐蚀加快,故A正确;
B、电解池中,阳极被腐蚀,阴极被保护,故应将钢铁的设备做阴极,故B错误;
C、将金属制成合金,即改变金属的组成和结构,能起到很好的防止腐蚀的作用,故C正确;
D、海轮外壳镶嵌锌块,此时铁作为原电池的正极金属而被保护,不易腐蚀,是采用了牺牲阳极的阴极保护法,故D正确.
故选B.
【分析】A、马口铁(镀锡)的表面一旦破损,构成原电池,Fe为负极;
B、电解池中,阳极被腐蚀,阴极被保护;
C、将金属制成合金,即改变金属的组成和结构;
D、原电池的正极金属易被保护,不易腐蚀.
14.【答案】B
【解析】【解答】A、由深井中二氧化碳腐蚀的主要过程的电极反应式:负极:Fe(s)+2HCO3-(aq)-2e-═FeCO3(s)+H2CO3(aq);正极:2H2CO3(aq)+2e-═H2↑+2HCO3-(aq),因此总反应可表示为CO2+H2O+Fe═FeCO3+H2,故A不符合题意;
B、深井中二氧化碳对碳钢的腐蚀涉及原电池原理,故主要为电化学腐蚀,不是化学腐蚀,故B符合题意;
C、碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量越高,溶液中离子浓度越大,导电能力越强,腐蚀速率越快,故C不符合题意;
D、碳酸是弱酸,盐酸是强酸,等pH值的CO2的溶液与HCl溶液相比,H2CO3(aq)的浓度要大得多,故腐蚀性比相同pH值的HCl溶液腐蚀性更强,故D不符合题意;
故答案为:B。
【分析】本题的易错点为D,要注意等pH值的CO2的溶液与HCl溶液相比,H2CO3(aq)的浓度大于盐酸。
15.【答案】D
【解析】【解答】A.该电解质溶液的酸碱性未知,无法判断铁钉发生析氢腐蚀或吸氧腐蚀,A不符合题意;
B.在铁件上镀铜,则铁件为镀件,应做阴极,与电源的负极相连,铜为镀层金属,做阳极,与电源的正极相连,B不符合题意;
C.电解精炼铜的初期,由于粗铜中含有Zn、Fe等活泼金属,阳极由Zn、Fe发生失电子的氧化反应,此时阴极由电解质溶液中的Cu2+发生得电子的还原反应,因此电解过程中,溶液中c(Cu2+)减小,C不符合题意;
D.将输油管与电源负极相连,则输油管作为阴极,由溶液中的阳离子发生得电子的还原反应,起到保护作用,可防止输油管腐蚀,D符合题意;
故答案为:D
【分析】A.根据析氢腐蚀的过程分析;
B.根据电镀过程分析;
C.根据电解精炼铜的过程分析;
D.根据外加电流的阴极保护法分析;
16.【答案】C
【解析】【解答】A. 钢铁腐蚀的负极反应为Fe-2e-=Fe2+,A不符合题意;
B. Mg-Al及NaOH溶液构成的原电池中负极材料为Al,因为铝可以溶于氢氧化钠溶液、镁不能,B不符合题意;
C. 无隔膜电解饱和NaCl溶液,阳极生所的氯气和阴极生成的氢氧化钠可以反应,生成次氯酸钠和氯化钠,NaClO是“84”消毒液中的有效成分,C符合题意;
D. H2-O2燃料电池中电解液为H2SO4,则正极反应式为O2+4H++4e-=2H2O,D不符合题意。
故答案为:C
【分析】A.钢铁腐蚀负极生成亚铁离子;
B.Mg、Al在NaOH溶液中发生氧化反应;
C.氯气与氢氧化钠溶液反应生成次氯酸钠具有消毒作用;
D.氢氧酸性燃料电池中正极氧气发生还原反应生成水.
17.【答案】(1)负极;;;K+
(2)Fe;C;正极;
【解析】【解答】(1)铜锌形成的原电池,比活泼,为负极,发生反应为:,为正极,在溶液中发生反应:,在原电池中,阳离子向正极移动,所以盐桥中向CuSO4溶液中迁移的离子是。
(2)图1中,和形成原电池的两级,比活泼,做负极,被腐蚀;图2在碱性条件下,有参与反应,故该腐蚀为吸氧腐蚀,选C;图1中,和形成原电池的两级,比活泼,做负极,作正极;图2在铁生锈的过程中,正极反应为:。
【分析】(1)电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应;溶液中阴离子向负极移动,阳离子向正极定向移动。
(2)中性或弱酸性条件下,金属发生吸氧腐蚀,酸性环境下,金属发生析氢腐蚀;电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应。
18.【答案】(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol
(2)电化学;Fe-2e-=Fe2+
(3)氧化反应;左;2Cu2++2H2O2Cu+O2↑+4H+;CuO
【解析】【解答】(1)N2H4和H2O2反应的化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),0.4mol液态肼完全反应放热256kJ,则1mol液态肼完全反应放热256kJ×
=640kJ/mol,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol;
(2)炒过菜的铁锅未及时清洗,为潮湿环境,且炒菜的铁锅为合金,所以会发生电化学腐蚀,负极为Fe被氧化为Fe2+,电极反应为Fe-2e-=Fe2+;
(3)①甲池中N2H4转化为N2,N元素化合价升高,所以发生氧化反应;N2H4被氧化,所以甲池中左侧电极为负极,右侧电极为正极,乙池为电解池,石墨电极与电源正极相连,为阳极,Fe电极为阴极,电解池中阴离子流向阳极,所以乙池中SO
向左移动;
②乙池中石墨为阳极,溶液中水电离出的氢氧根被氧化生成氧气,Fe电极为阴极,铜离子被还原为铜单质,总反应为2Cu2++2H2O
2Cu+O2↑+4H+;
③根据乙池总反应可知电解过程中从溶液中出来的为Cu和O2,所以应向溶液中加入CuO使之恢复反应前的状态。
【分析】(1)根据题给条件书写热化学方程式的原则写出;
(2)生铁的吸氧腐蚀中,负极上铁失电子发生氧化反应;
(3)①甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-;
②乙池为电解池,阴极Ag反应为Cu2++2e-=Cu、阳极石墨反应为4OH--4e-=2H2O+O2↑;
③根据析出什么加入什么原则使溶液恢复原状。
19.【答案】(1)2FeCl3+Fe=3FeCl2
(2)B;D
(3)铜;Cu2++2e-=Cu;0.08;铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
【解析】【解答】(1)铁锈的主要成分为氧化铁的水合物,与盐酸反应后生成了三价铁离子,而后铁与三价铁离子会化合生成亚铁离子。
(2)为防止铁棒腐蚀一般采用牺牲阳极的阴极保护法和外加电流的阴极保护法。
(3)为在铁表面镀铜需将铁作阴极、铜作阳极,当析出1 mol铜时两电极的质量差为64+64=128(g),转移2 mol电子,当质量差为5.12 g时,电路中通过的电子为0.08 mol;镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,因为镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀。
【分析】(1)铁锈的主要成分是Fe2O3,与盐酸反应后生成FeCl3,FeCl3能与Fe反应生成FeCl2;
(2)可防止铁棒被腐蚀,则铁应做阴极或正极,据此结合选项所给装置分析;
(3)①铁件镀铜,则铁件做阴极,与电源的负极相连,铜做阳极,与电源的正极相连;
②二者的质量差为参与反应的铜的质量,据此结合电极反应式计算转移电子数;
③镀层破损后形成原电池,根据金属的活动性:Zn>Fe>Cu进行分析;
20.【答案】(1)B;可回收物;2NO+2CO N2+2CO2
(2)B;C
(3)D;C
(4)A;A;Fe﹣2e﹣=Fe2+
【解析】【解答】解:(1)①生活用水、工业废水、农药和化肥的不合理使用都能造成地下水的污染,因此科学合理使用农药、处理生活污水,达标排放是保护水资源的有效措施,故答案为:B;②矿泉水瓶的主要成分是聚对苯二甲酸乙二醇酯,是食品用塑料瓶,属于可回收物,故答案为:可回收物;③可排入大气说明气体无污染,反应前后C元素化合价升高,O元素化合价没变,因此N元素的化合价肯定降低,因此产物为氮气,则反应方程式为:2NO+2CO N2+2CO2;
故答案为:2NO+2CO N2+2CO2;(2)①A.该图是可燃垃圾标志,故A错误;B.该图是可回收标志,故B正确;C.图为当心辐射标志,故C错误;
故答案为:B;②A.吸烟会产生有毒气体,如CO等,所以吸烟会对室内和公共场所造成污染,故A正确;B.焦油、尼古丁及颗粒物会危害人体健康,吸入焦油、尼古丁及颗粒物可导致多种病变,故B正确;C.N2、CO2无毒,对人体无害,所以N2、CO2不属于室内空气污染物,故C错误;故答案为:C;(3)油脂在人体内发生氧化反应生成释放大量能量;绿色植物中富含维生素C,维生素C有酸性和还原性,又称为抗坏血酸;①油脂是重要的体内能源;②维生素C广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;故答案为:D;C;(4)①试管、烧杯和烧瓶等化学仪器的主要材质是玻璃;
故答案为:A;②生铁和钢都是铁和碳的合金,生铁中含碳量比钢中含碳量高,所以生铁和钢成分上的主要差别是碳的含量不同;故答案为:A;③钢铁发生电化学腐蚀时,铁做负极,失去电子生成亚铁离子,负极电极反应式为:Fe﹣2e﹣=Fe2+,故答案为:Fe﹣2e﹣=Fe2+.
【分析】(1)①生活用水、工业废水、农药和化肥的不合理使用都能造成地下水的污染;②矿泉水瓶是食品用塑料瓶,属于可回收物;③可排入大气说明气体无污染,再结合氧化还原关系可知产物为氮气;(2)①根据图表的意义进行分析解答即可;②A.吸烟会产生有毒气体;B.焦油、尼古丁及颗粒物会危害人体健康;C.N2、CO2不属于室内空气污染物;(3)油脂在人体内发生氧化反应生成释放大量能量;绿色植物中富含维生素C;(4)①试管、烧杯和烧瓶等化学仪器的主要材质是玻璃;②生铁和钢都是铁和碳的合金;③钢铁发生电化学腐蚀时,铁做负极,失去电子生成亚铁离子.
21.【答案】(1)C;D
(2)O2+4H2O+4e﹣=4OH﹣
(3)阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定
(4)N;X
【解析】【解答】(1)A.C(s)+CO2(g)=2CO(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A不符合题意;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,不属于氧化还原反应,不能设计为原电池,故B不符合题意;
C.2CO(g)+O2(g)=2CO2(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C符合题意;
D.2H2(g)+O2(g)═2H2O(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故D符合题意.
故答案为:CD.
(2)正极上氧化剂得电子发生还原反应,以KOH溶液为电解质溶液,则正极电极反应式为:O2+4 H2O+4e﹣=4OH﹣,
故答案为:O2+4 H2O+4e﹣=4OH﹣.
(3)电镀铜时用铜做阳极,阳极上铜被氧化,电解质溶液浓度不变,用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定,采用石墨无法补充Cu2+,故答案为:阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定.
(4)电极材料是铁和碳棒,铁比碳活泼,所以为减缓铁的腐蚀,必须将其设计成电解池,且铁作阴极,碳棒作阳极,该保护法的名称是外加电流的阴极保护法,则开关K应该置于N,溶液中阴离子向阳极即X极移动;
故答案为:N;X.
【分析】(1)根据能够自发进行的氧化还原反应的能够设计为原电池装置进行判断即可;
(2)根据原电池的正极发生还原反应,结合氧化还原反应进行书写电极方程式即可;
(3)根据电镀原理分析镀铜时利用铜作阳极的原因即可;
(4)根据外加电流的阴极保护法的原理进行分析回答即可.
一、单选题
1.能有效防止铁质栏杆锈蚀的措施是( )
A.接上铜网 B.定期擦去铁锈
C.与石墨相连 D.定期涂上油漆
2.下列金属防腐的措施中,使用牺牲阳极的阴极保护法的是( )
A.地下钢管连接镁块 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.水中的钢闸门连接电源的负极
3.钢铁又叫铁碳合金,是工业生产中极其重要且用量很大的金属材料。下列方法不能减缓钢铁腐蚀速率的是( )
A.在钢铁制品表面喷一层漆 B.掺入铬、镍制成不锈钢产品 C.把钢铁置于干燥空气中保存 D.外加电流法
A.A B.B C.C D.D
4.下列有关金属腐蚀与防护的说法不正确的是( )
A.纯银器的表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
5.下列说法正确的是( )
A.淀粉、蛋白质、油脂均属于天然有机高分子化含物
B.FeO粉末在空气中受热,迅速被氧化成
C.可漂白纸浆,可用于杀菌、消毒
D.镀锌铁皮的镀层破损后,铁皮会加速腐蚀
6.下列实验装置图符合题意且能达到相应实验目的的是( )
A.图甲是中和热的测定 B.图乙是保护钢闸门不被腐蚀
C.图丙是铁钥匙上镀铜 D.图丁是验证铁能发生吸氧腐蚀
7.下列事实不能用电化学理论解释的是( )
A.轮船水线下船壳上装有一定数量的锌块
B.银质奖章久置后表面变暗
C.镀锌铁比镀锡铁耐用
D.钢铁在潮湿空气中比在干燥空气中腐蚀得快
8.下列与金属腐蚀有关的说法,正确的是( )
A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
9.下列叙述不正确的是( )
A.铁制品表面镀锌可以增强其抗腐蚀性
B.在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
C.马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀
D.利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连
10.如图所示装置,均盛有等体积等浓度的稀硫酸,工作相同的时间后测得均通过n mol e-。下列叙述错误的是(不考虑溶液体积的变化)( )
甲
乙
A.铁棒的腐蚀程度:甲<乙
B.碳电极上发生反应的电极反应式相同
C.溶液的pH:甲减小,乙增大
D.甲、乙产生气体的体积(相同条件)比为3∶2
11.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比纯铁容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质物品久置表面变暗
12.在船体的钢铁外壳上镶嵌锌块可以有效避免船体遭受腐蚀。下列说法不正确的是( )
A.锌块作原电池的负极
B.钢铁在海水中易发生吸氧腐蚀
C.电子由船体钢铁外壳向锌块移动
D.在海水中阳离子向船体钢铁外壳移动
13.下列关于金属的腐蚀及防腐说法错误的是( )
A.马口铁(镀锡铁)镀层破损铁的腐蚀速率加快
B.为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极
C.可以采用改变金属组成或结构的方法防止金属腐蚀
D.为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块
14.碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:Fe(s)+ 2HCO3- (aq) -2e- = FeCO3 (s)+H2CO3(aq)(主要)
正极:2H2CO3(aq) +2e- = H2↑+2HCO3- ( aq)(主要)
下列说法错误的是( )
A.钢铁在CO2 水溶液中的腐蚀总反应可表示为CO2+H2O +Fe= FeCO3 +H2
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2 的溶液其腐蚀性比相同pH 值的 HCl溶液腐蚀性更强
15.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中c(Cu2+)保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
16.下列叙述中,正确的是( )
A.钢铁腐蚀的负极反应为:Fe-3e-=Fe3+
B.Mg-Al及NaOH溶液构成的原电池中负极材料为Mg
C.无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分NaClO
D.H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2+4e-=2O2-
二、综合题
17.根据所学电化学知识填空。
(1)如图为锌铜原电池的装置示意图,其中盐桥内装有含饱和KCl溶液的琼胶。请回答下列问题:
①Zn电极为电池的 (填“正极”或“负极”)。
②写出电极反应式:Zn电极 ,Cu电极 。
③盐桥中向CuSO4溶液中迁移的离子是 (填离子符号)。
(2)金属腐蚀现象在生产生活中普遍存在,依据下列两种腐蚀现象回答下列问题:
①图1中被腐蚀的金属为 (填化学式);图2中金属腐蚀类型属于 (填字母)。
A.化学腐蚀 B.析氢腐蚀 C.吸氧腐蚀
②图1中Cu的作用是 (填“负极”或“正极”)。
③图2中铁的生锈过程中正极反应式为 。
18.完成下列各小题。
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式 。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,炒过菜的铁锅未及时清洗容易发生 腐蚀而生锈。请写出铁锅生锈过程的负极反应式: 。
(3)图中甲池的总反应式为N2H4+O2=N2+2H2O。
①甲池中N2H4发生的是 (填“氧化反应”或“还原反应”),乙池中SO向 移动(填“左”或“右”)。
②乙池中总反应的离子方程式为 。
③要使乙池恢复到反应前的状态,应向溶液中加入 (填化学式)。
19.钢铁工业是国家工业的基础,请回答钢铁腐蚀与防护过程中的有关问题。
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是 。
(2)下列哪个装置可防止铁棒被腐蚀________。
A. B.
C. D.
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下:
①A电极对应的金属是 (写元素名称),B电极的电极反应式是 。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为 mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因 。
20.资源必须要合理使用.
(1)水是一种宝贵的资源,保护水资源就是保护我们的生命.
①下列做法不利于水资源保护的是 (填字母代号)
A.科学合理使用农药 B.任意排放化工厂废水 C.处理生活污水,达标排放
②矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于 (填“可回收物”或“可堆肥垃圾”);
③在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染.在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式 .
(2)保护环境、爱护地球已成为人们的共同呼声.
①我们常在公共场所见到下列标志,其中属于回收标志的是
②2014年1月,教育部规定在学校公共场所禁止吸烟.下列有关说法中,不正确的是 .
A.吸烟会对室内和公共场所造成污染
B.吸入焦油、尼古丁及颗粒物可导致多种病变
C.N2、CO2、CO尼古丁和都属于室内空气污染物
(3)化学与生活关系密切.现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
① 是重要的体内能源;
② 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(4)材料是人类赖以生存和发展的重要物质基础
①试管、烧杯和烧瓶等化学仪器的主要材质是 ;
A.玻璃 B.陶瓷 C.水泥
②“辽宁号”航母的服役举世瞩目.钢铁是制造航母的主要材料.生铁和钢成分上的主要差别是 ;
A.碳的含量不同 B.磷、硫的含量不同 C.镍、铬等金属含量不同
③钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为 .
21.根据问题进行作答:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是 ( )
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
D.2H2(g)+O2(g)═2H2O(l)△H<0
(2)以KOH溶液为电解质溶液,依据(1)中所选反应设计一个原电池,其正极的电极反应式为:
(3)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨做阳极的原因是:
(4)利用如图装置,可以模拟铁的电化学防护. 若X为碳棒,为减缓铁的腐蚀,开关K应该置于 (填M或者N)处,此时溶液中的阴离子向 极(填X或铁)移动.
答案解析部分
1.【答案】D
【解析】【解答】A、接上铜网与铁形成原电池,铁活泼作负极加快锈蚀,故A不符合题意;
B、定期擦去铁锈,不能隔绝氧气和水,不能防止钢铁锈蚀,故B不符合题意;
C、与石墨相连,石墨与铁形成原电池,铁活泼作负极加快锈蚀,故C不符合题意;
D、定期涂上油漆,能隔绝氧气和水,能防止钢铁锈蚀,故D符合题意.
故答案为:D.
【分析】根据金属的腐蚀可知铁与水、氧气充分接触时容易生锈,使铁制品与氧气和水隔绝可以防止生锈,据此进行分析即可.
2.【答案】A
【解析】【解答】A.地下钢管连接镁块,Fe、Mg、电解质溶液构成原电池,Fe失电子能力小于Mg而作正极被保护,所以该保护方法属于牺牲阳极的阴极保护法,故A符合题意;
B.金属护拦表面涂漆,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故B不符合题意;
C.汽车底盘喷涂高分子膜,阻止Fe与空气、水接触,从而防止金属被腐蚀,属于物理方法,故C不符合题意;
D.水中的钢闸门连接电源的负极,充当电解池的阴极,属于外加电流的阴极保护法,故D不符合题意;
故答案为:A。
【分析】金属防腐的措施中,使用牺牲阳极的阴极保护法,说明该装置构成原电池,被保护的金属作正极,据此分析判断。
3.【答案】D
【解析】【解答】A.在钢铁制品表面喷一层漆,可以避免钢铁制品与空气接触,因而就可以减缓钢铁腐蚀速率,A不符合题意;
B.掺入铬、镍制成不锈钢产品,改变了金属的内部结构,提高了钢铁的抗腐蚀性能,故可以减缓钢铁腐蚀速率,B不符合题意;
C.金属腐蚀大多是在潮湿的环境中发生的电化学腐蚀,把钢铁置于干燥空气中保存,就可以避免原电池反应的发生,因而可减缓钢铁腐蚀速率,C不符合题意;
D.根据图示可知外加电流法连接时,钢闸门连接电源的正极,作阳极,导致钢铁腐蚀速率比不连接电源还快,使钢闸门腐蚀速率大大增加,因而不能减缓钢铁腐蚀速率,D符合题意;
故答案为:D。
【分析】金属与空气、水接触易腐蚀,形成原电池会加速金属腐蚀。
4.【答案】D
【解析】【解答】A.纯银器在空气中因发生化学腐蚀,表面易生成硫化物失去光泽,A正确;
B.当镀锡铁制品镀层破损时,由于铁比锡活泼,形成原电池时,铁作原电池的负极,加快铁的腐蚀,B正确;
C.锌比铁活泼,当在海轮外壳上连接锌块后,锌失电子而海轮外壳被保护,C正确;
D.要采用电解原理保护金属,应将金属与电源的负极相连,即作电解池的阴极,D错误。
故答案为:D
【分析】A. 纯银器的表面变暗的原因是被氧气氧化,属于化学腐蚀;
B. 当镀锡铁制品的镀层破损时,会加速内部金属的腐蚀;
C. 在海轮外壳连接锌块时,采用 牺牲阳极的阴极保护法来保护外壳不受腐蚀;
D.电源的负极连接电解池的阴极,发生还原反应,不被腐蚀。
5.【答案】C
【解析】【解答】A.油脂是高级脂肪酸甘油酯,不是高分子化合物,A不符合题意;
B.氧化亚铁具有较强的还原性,在空气中受热容易被氧气氧化为稳定的四氧化三铁,B不符合题意;
C.二氧化硫除了具有漂白作用,可漂白纸浆、毛和丝等,还可用于杀菌消毒,例如,在葡萄酒酿制过程中可适当添加二氧化硫,起到杀菌、抗氧化作用,C符合题意;
D.镀锌的铁皮镀层破损后构成原电池,锌作负极,铁作正极被保护,铁皮不易被腐蚀,D不符合题意;
故答案为:C。
【分析】易错分析:A.油脂不属于高分子化合物,高分子化合物的分子量一般从几千到十几万不等。
6.【答案】D
【解析】【解答】A.图甲中缺少混合溶液使用的环形玻璃搅拌棒,因此不能达到准确测定中和热数值的目的,A不符合题意;
B.要保护铁闸门,应该使电源的负极与铁闸门连接,图乙中铁闸门与电源正极连接,作阳极,会加快金属的腐蚀,不能保护钢闸门,B不符合题意;
C.要在铁钥匙上镀铜,应该使铁钥匙连接电源负极作阴极,Cu连接电源正极作阳极,图示连接刚好顺序相反,不能达到实验目的,C不符合题意;
D.铁钉用中性食盐水浸泡后,放在密闭试管中,若其发生吸氧腐蚀,且试管中气体由于消耗而导致压强减小,小试管中的食盐水会在外界大气压强作用下进入导气管而形成一小段水柱,因此图丁可以达到验证铁能发生吸氧腐蚀的目的,D符合题意;
故答案为:D。
【分析】A.缺少环形玻璃搅拌棒;
B.钢闸门与电源正极相连作阳极,加快腐蚀;
C.要在铁钥匙上镀铜,应该使铁钥匙连接电源负极作阴极。
7.【答案】B
【解析】【解答】A,轮船水线下船壳上装有一定数量的锌块,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生的是原电池反应,可用电化学理论解释,故A不符合题意;
B,银质奖章久置后表面变暗是银单质直接被氧化的结果,属于化学腐蚀,故B符合题意;
C,镀锌铁与镀锡铁相比,若破损后,镀锌铁因Zn比Fe活泼,Zn被腐蚀,镀锡铁因Fe比Sn活泼,Fe被腐蚀,所以镀锌铁比镀锡铁耐用,发生的是原电池反应,可用电化学原理解释,故C不符合题意;
D,在潮湿的空气里,钢铁表面吸附了一层薄薄的水膜,这层水膜里含有少量H+和OH-,还溶解了氧气等气体,结果在钢铁表面形成了一层电解质溶液,它跟钢铁里的铁和少量的碳形无数微小的原电池,而在干燥空气中主要发生化学腐蚀,比电化学腐蚀慢得多,故D不符合题意。
答案选B
【分析】A、Zn比Fe活泼,构成Zn与Fe原电池;
B、银制品变黑是被空气中氧气氧化;
C、Zn比Fe活泼,Fe比Sn活泼,分别构成原电池,较活泼的金属为负极;
D、钢铁在潮湿空气中发生经典的电化学腐蚀;
8.【答案】C
【解析】【解答】解:A.浓硫酸具有吸水性,能够干燥空气,干燥条件下,铁钉不易被腐蚀,故A错误;
B.Fe失电子生成亚铁离子,滴加少量K3[Fe(CN)6]溶液,有蓝色沉淀出现,故B错误;
C.高温下,Fe与氧气反应生成四氧化三铁,该条件下,铁发生化学腐蚀,故C正确;
D.Fe、Mg构成原电池时,Mg的活泼性比Fe强,Mg失电子作负极,故D错误.
故选C.
【分析】A.浓硫酸具有吸水性,干燥条件下,铁钉不易被腐蚀;
B.Fe失电子生成亚铁离子;
C.高温下,Fe与氧气反应;
D.Fe、Mg构成原电池时,Mg的活泼性比Fe强,作负极.
9.【答案】D
【解析】【解答】解:A.锌比铁活泼,并且在空气中容易形成致密的氧化膜,防止生锈,故A正确;
B.海轮外壳连接锌块,锌为负极,保护外壳不受腐蚀,为牺牲阳极的阴极保护法,故B正确;
C.当马口铁(镀锡)破损后,形成的原电池中,金属铁是负极,易被腐蚀,故C正确;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极,所以钢闸门与电源的负极相连,故D错误.
故选D.
【分析】A.锌在空气中容易形成致密的氧化膜;
B.海轮外壳连接锌块,锌为负极;
C.原电池的负极更易被腐蚀,正极金属被保护;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极.
10.【答案】B
【解析】【解答】A、甲装置中铁做阴极被保护,乙装置中Fe为负极,被腐蚀,因此铁棒的腐蚀程度:甲<乙,A不符合题意;
B、甲池中,石墨电极(阳极)上反应为4OH--4e-=2H2O+O2↑,乙池中,石墨电极(正极)反应为2H++2e-=H2↑,B符合题意;
C、甲池因水被电解,H2SO4浓度变大,pH减小,乙池因H2SO4被消耗,酸性减弱,pH增大,C不符合题意;
D、甲池产生H2、O2且体积比为2∶1,乙池只生成H2,可见甲乙产生气体的体积(相同条件)比为3∶2,D不符合题意;
故答案为:B
【分析】A.甲装置中,铁做阴极,被保护,乙装置中,铁做阳极,被腐蚀;
B.甲装置中,石墨电极上OH-发生失电子的氧化反应,乙装置中,石墨电极上H+发生得电子的还原反应;
C.根据电解池发生的反应分析溶液pH的变化;
D.根据电极反应式计算产生气体的体积;
11.【答案】D
【解析】【解答】解:A.黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀有关,故A不选;
B.生铁中金属铁、碳、潮湿的空气能构成原电池,金属铁为负极,易被腐蚀而生锈,和电化学腐蚀有关,故B不选;
C.铁质器件附有铜质配件,在接触处形成原电池装置,其中金属铁为负极,易生铁锈,和电化学腐蚀有关,故C不选;
D.银质奖牌长期放置后在其奖牌的表面变暗是由于金属银和空气中的成分发生反应的结果,属于化学腐蚀,与电化学腐蚀无关,故D选;
故选D.
【分析】根据是否能构成原电池判断,如果金属能构成原电池的就能产生电化学腐蚀,否则不能产生电化学腐蚀,据此分析解答.
12.【答案】C
【解析】【解答】A.牺牲阳极法安装活泼金属做原电池负极,被保护的钢铁做正极,锌块作负极,A项不符合题意;
B.海水中pH接近中性,易发生吸氧腐蚀,B项不符合题意;
C.原电池中电子从负极经外电路流向正极,C项符合题意;
D.原电池正极得电子,电解质中阳离子向正极移动,D项不符合题意;
故答案为:C。
【分析】 钢铁外壳上镶嵌锌块 ,形成锌铁原电池,锌作负极,铁作正极,电子从锌电极流向铁电极,钢铁被保护。
13.【答案】B
【解析】【解答】解:A、马口铁(镀锡)的表面一旦破损,构成原电池,Fe为负极,则铁腐蚀加快,故A正确;
B、电解池中,阳极被腐蚀,阴极被保护,故应将钢铁的设备做阴极,故B错误;
C、将金属制成合金,即改变金属的组成和结构,能起到很好的防止腐蚀的作用,故C正确;
D、海轮外壳镶嵌锌块,此时铁作为原电池的正极金属而被保护,不易腐蚀,是采用了牺牲阳极的阴极保护法,故D正确.
故选B.
【分析】A、马口铁(镀锡)的表面一旦破损,构成原电池,Fe为负极;
B、电解池中,阳极被腐蚀,阴极被保护;
C、将金属制成合金,即改变金属的组成和结构;
D、原电池的正极金属易被保护,不易腐蚀.
14.【答案】B
【解析】【解答】A、由深井中二氧化碳腐蚀的主要过程的电极反应式:负极:Fe(s)+2HCO3-(aq)-2e-═FeCO3(s)+H2CO3(aq);正极:2H2CO3(aq)+2e-═H2↑+2HCO3-(aq),因此总反应可表示为CO2+H2O+Fe═FeCO3+H2,故A不符合题意;
B、深井中二氧化碳对碳钢的腐蚀涉及原电池原理,故主要为电化学腐蚀,不是化学腐蚀,故B符合题意;
C、碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量越高,溶液中离子浓度越大,导电能力越强,腐蚀速率越快,故C不符合题意;
D、碳酸是弱酸,盐酸是强酸,等pH值的CO2的溶液与HCl溶液相比,H2CO3(aq)的浓度要大得多,故腐蚀性比相同pH值的HCl溶液腐蚀性更强,故D不符合题意;
故答案为:B。
【分析】本题的易错点为D,要注意等pH值的CO2的溶液与HCl溶液相比,H2CO3(aq)的浓度大于盐酸。
15.【答案】D
【解析】【解答】A.该电解质溶液的酸碱性未知,无法判断铁钉发生析氢腐蚀或吸氧腐蚀,A不符合题意;
B.在铁件上镀铜,则铁件为镀件,应做阴极,与电源的负极相连,铜为镀层金属,做阳极,与电源的正极相连,B不符合题意;
C.电解精炼铜的初期,由于粗铜中含有Zn、Fe等活泼金属,阳极由Zn、Fe发生失电子的氧化反应,此时阴极由电解质溶液中的Cu2+发生得电子的还原反应,因此电解过程中,溶液中c(Cu2+)减小,C不符合题意;
D.将输油管与电源负极相连,则输油管作为阴极,由溶液中的阳离子发生得电子的还原反应,起到保护作用,可防止输油管腐蚀,D符合题意;
故答案为:D
【分析】A.根据析氢腐蚀的过程分析;
B.根据电镀过程分析;
C.根据电解精炼铜的过程分析;
D.根据外加电流的阴极保护法分析;
16.【答案】C
【解析】【解答】A. 钢铁腐蚀的负极反应为Fe-2e-=Fe2+,A不符合题意;
B. Mg-Al及NaOH溶液构成的原电池中负极材料为Al,因为铝可以溶于氢氧化钠溶液、镁不能,B不符合题意;
C. 无隔膜电解饱和NaCl溶液,阳极生所的氯气和阴极生成的氢氧化钠可以反应,生成次氯酸钠和氯化钠,NaClO是“84”消毒液中的有效成分,C符合题意;
D. H2-O2燃料电池中电解液为H2SO4,则正极反应式为O2+4H++4e-=2H2O,D不符合题意。
故答案为:C
【分析】A.钢铁腐蚀负极生成亚铁离子;
B.Mg、Al在NaOH溶液中发生氧化反应;
C.氯气与氢氧化钠溶液反应生成次氯酸钠具有消毒作用;
D.氢氧酸性燃料电池中正极氧气发生还原反应生成水.
17.【答案】(1)负极;;;K+
(2)Fe;C;正极;
【解析】【解答】(1)铜锌形成的原电池,比活泼,为负极,发生反应为:,为正极,在溶液中发生反应:,在原电池中,阳离子向正极移动,所以盐桥中向CuSO4溶液中迁移的离子是。
(2)图1中,和形成原电池的两级,比活泼,做负极,被腐蚀;图2在碱性条件下,有参与反应,故该腐蚀为吸氧腐蚀,选C;图1中,和形成原电池的两级,比活泼,做负极,作正极;图2在铁生锈的过程中,正极反应为:。
【分析】(1)电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应;溶液中阴离子向负极移动,阳离子向正极定向移动。
(2)中性或弱酸性条件下,金属发生吸氧腐蚀,酸性环境下,金属发生析氢腐蚀;电池工作时,负极失电子,发生氧化反应,正极得电子,发生还原反应。
18.【答案】(1)N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol
(2)电化学;Fe-2e-=Fe2+
(3)氧化反应;左;2Cu2++2H2O2Cu+O2↑+4H+;CuO
【解析】【解答】(1)N2H4和H2O2反应的化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g),0.4mol液态肼完全反应放热256kJ,则1mol液态肼完全反应放热256kJ×
=640kJ/mol,所以热化学方程式为N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) H=-640kJ/mol;
(2)炒过菜的铁锅未及时清洗,为潮湿环境,且炒菜的铁锅为合金,所以会发生电化学腐蚀,负极为Fe被氧化为Fe2+,电极反应为Fe-2e-=Fe2+;
(3)①甲池中N2H4转化为N2,N元素化合价升高,所以发生氧化反应;N2H4被氧化,所以甲池中左侧电极为负极,右侧电极为正极,乙池为电解池,石墨电极与电源正极相连,为阳极,Fe电极为阴极,电解池中阴离子流向阳极,所以乙池中SO
向左移动;
②乙池中石墨为阳极,溶液中水电离出的氢氧根被氧化生成氧气,Fe电极为阴极,铜离子被还原为铜单质,总反应为2Cu2++2H2O
2Cu+O2↑+4H+;
③根据乙池总反应可知电解过程中从溶液中出来的为Cu和O2,所以应向溶液中加入CuO使之恢复反应前的状态。
【分析】(1)根据题给条件书写热化学方程式的原则写出;
(2)生铁的吸氧腐蚀中,负极上铁失电子发生氧化反应;
(3)①甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-;
②乙池为电解池,阴极Ag反应为Cu2++2e-=Cu、阳极石墨反应为4OH--4e-=2H2O+O2↑;
③根据析出什么加入什么原则使溶液恢复原状。
19.【答案】(1)2FeCl3+Fe=3FeCl2
(2)B;D
(3)铜;Cu2++2e-=Cu;0.08;铁比铜活泼,镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀
【解析】【解答】(1)铁锈的主要成分为氧化铁的水合物,与盐酸反应后生成了三价铁离子,而后铁与三价铁离子会化合生成亚铁离子。
(2)为防止铁棒腐蚀一般采用牺牲阳极的阴极保护法和外加电流的阴极保护法。
(3)为在铁表面镀铜需将铁作阴极、铜作阳极,当析出1 mol铜时两电极的质量差为64+64=128(g),转移2 mol电子,当质量差为5.12 g时,电路中通过的电子为0.08 mol;镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,因为镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀。
【分析】(1)铁锈的主要成分是Fe2O3,与盐酸反应后生成FeCl3,FeCl3能与Fe反应生成FeCl2;
(2)可防止铁棒被腐蚀,则铁应做阴极或正极,据此结合选项所给装置分析;
(3)①铁件镀铜,则铁件做阴极,与电源的负极相连,铜做阳极,与电源的正极相连;
②二者的质量差为参与反应的铜的质量,据此结合电极反应式计算转移电子数;
③镀层破损后形成原电池,根据金属的活动性:Zn>Fe>Cu进行分析;
20.【答案】(1)B;可回收物;2NO+2CO N2+2CO2
(2)B;C
(3)D;C
(4)A;A;Fe﹣2e﹣=Fe2+
【解析】【解答】解:(1)①生活用水、工业废水、农药和化肥的不合理使用都能造成地下水的污染,因此科学合理使用农药、处理生活污水,达标排放是保护水资源的有效措施,故答案为:B;②矿泉水瓶的主要成分是聚对苯二甲酸乙二醇酯,是食品用塑料瓶,属于可回收物,故答案为:可回收物;③可排入大气说明气体无污染,反应前后C元素化合价升高,O元素化合价没变,因此N元素的化合价肯定降低,因此产物为氮气,则反应方程式为:2NO+2CO N2+2CO2;
故答案为:2NO+2CO N2+2CO2;(2)①A.该图是可燃垃圾标志,故A错误;B.该图是可回收标志,故B正确;C.图为当心辐射标志,故C错误;
故答案为:B;②A.吸烟会产生有毒气体,如CO等,所以吸烟会对室内和公共场所造成污染,故A正确;B.焦油、尼古丁及颗粒物会危害人体健康,吸入焦油、尼古丁及颗粒物可导致多种病变,故B正确;C.N2、CO2无毒,对人体无害,所以N2、CO2不属于室内空气污染物,故C错误;故答案为:C;(3)油脂在人体内发生氧化反应生成释放大量能量;绿色植物中富含维生素C,维生素C有酸性和还原性,又称为抗坏血酸;①油脂是重要的体内能源;②维生素C广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;故答案为:D;C;(4)①试管、烧杯和烧瓶等化学仪器的主要材质是玻璃;
故答案为:A;②生铁和钢都是铁和碳的合金,生铁中含碳量比钢中含碳量高,所以生铁和钢成分上的主要差别是碳的含量不同;故答案为:A;③钢铁发生电化学腐蚀时,铁做负极,失去电子生成亚铁离子,负极电极反应式为:Fe﹣2e﹣=Fe2+,故答案为:Fe﹣2e﹣=Fe2+.
【分析】(1)①生活用水、工业废水、农药和化肥的不合理使用都能造成地下水的污染;②矿泉水瓶是食品用塑料瓶,属于可回收物;③可排入大气说明气体无污染,再结合氧化还原关系可知产物为氮气;(2)①根据图表的意义进行分析解答即可;②A.吸烟会产生有毒气体;B.焦油、尼古丁及颗粒物会危害人体健康;C.N2、CO2不属于室内空气污染物;(3)油脂在人体内发生氧化反应生成释放大量能量;绿色植物中富含维生素C;(4)①试管、烧杯和烧瓶等化学仪器的主要材质是玻璃;②生铁和钢都是铁和碳的合金;③钢铁发生电化学腐蚀时,铁做负极,失去电子生成亚铁离子.
21.【答案】(1)C;D
(2)O2+4H2O+4e﹣=4OH﹣
(3)阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定
(4)N;X
【解析】【解答】(1)A.C(s)+CO2(g)=2CO(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A不符合题意;
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0,不属于氧化还原反应,不能设计为原电池,故B不符合题意;
C.2CO(g)+O2(g)=2CO2(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C符合题意;
D.2H2(g)+O2(g)═2H2O(l)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故D符合题意.
故答案为:CD.
(2)正极上氧化剂得电子发生还原反应,以KOH溶液为电解质溶液,则正极电极反应式为:O2+4 H2O+4e﹣=4OH﹣,
故答案为:O2+4 H2O+4e﹣=4OH﹣.
(3)电镀铜时用铜做阳极,阳极上铜被氧化,电解质溶液浓度不变,用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定,采用石墨无法补充Cu2+,故答案为:阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+的浓度恒定.
(4)电极材料是铁和碳棒,铁比碳活泼,所以为减缓铁的腐蚀,必须将其设计成电解池,且铁作阴极,碳棒作阳极,该保护法的名称是外加电流的阴极保护法,则开关K应该置于N,溶液中阴离子向阳极即X极移动;
故答案为:N;X.
【分析】(1)根据能够自发进行的氧化还原反应的能够设计为原电池装置进行判断即可;
(2)根据原电池的正极发生还原反应,结合氧化还原反应进行书写电极方程式即可;
(3)根据电镀原理分析镀铜时利用铜作阳极的原因即可;
(4)根据外加电流的阴极保护法的原理进行分析回答即可.
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
