1.3氧化还原反应 课时作业 (含答案)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 1.3氧化还原反应 课时作业 (含答案)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 379.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-09 22:42:11 | ||
图片预览


文档简介
高中化学人教版必修第一册1.3氧化还原反应 课时作业
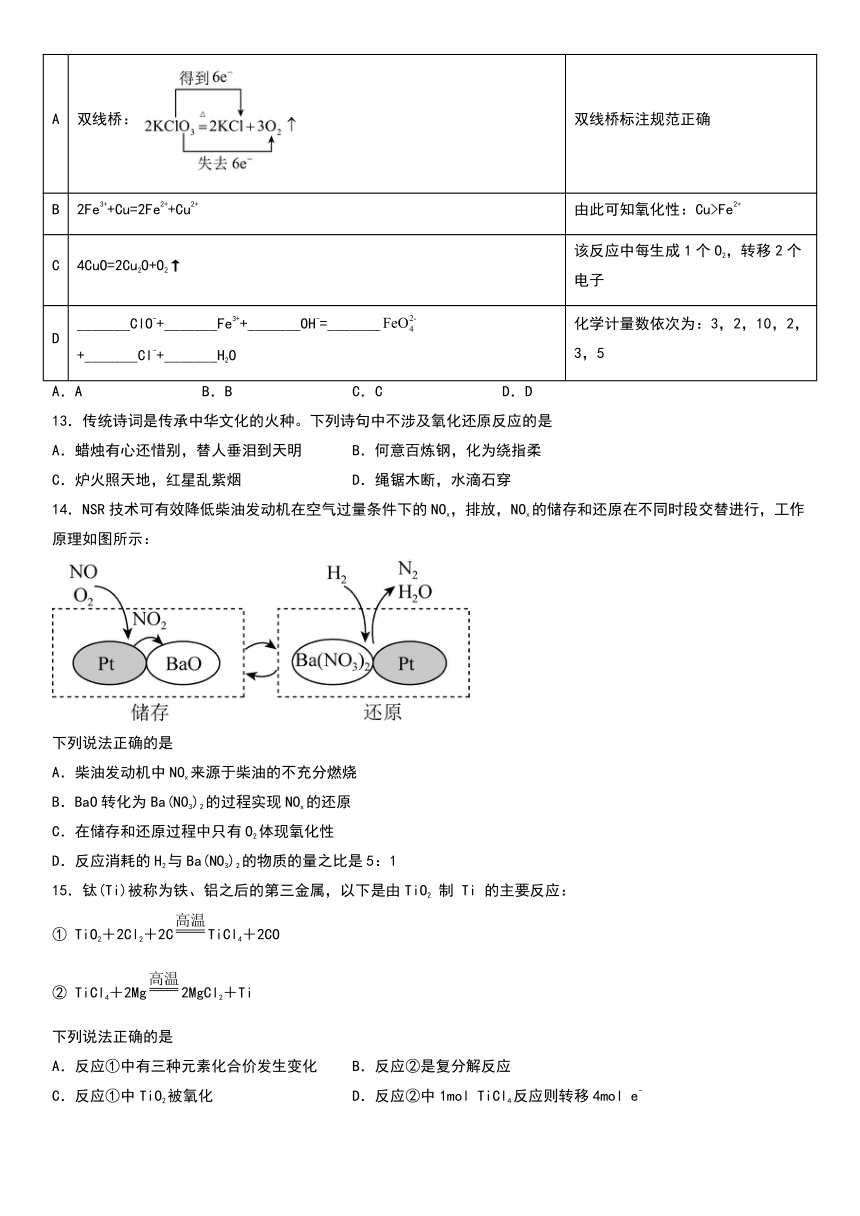
一、单选题
1.下列变化过程中,加入氧化剂才能实现的是
A. B. C. D.
2.下列化学反应中电子转移的表示方法正确的是
A. B.=2NaOH+H2↑
C. D.CuSO4+SO2↑+2H2O
3.下面的“诗”情“化”意中,分析正确的是
A.“千锤万凿出深山,烈火焚烧若等闲”只发生了物理变化
B.“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质很稳定
C.“试玉要烧三日满”,该句诗表明玉的硬度很大
D.“野火烧不尽,春风吹又生”,诗中描述的过程不涉及氧化还原反应
4.下列说法正确的是( )
A.Cl2+2Br-=2Cl-+Br2,Zn+Cu2+=Zn2++Cu均为单质被还原的置换反应
B.2Na2O2+2H2O=4NaOH+O2↑,Cl2+H2O=HCl+HClO,均为水作还原剂的氧化还原反应
C.Na2SO3与H2O2的反应为氧化还原反应
D.生石灰用作食品抗氧化剂
5.废水脱氯工艺中有一种方法是在废水中加入过量NaClO使完全转化为N2,该反应过程可表示为+ClO-→N2↑+Cl-+H++H2O。下列说法中不正确的是
A.经此法处理过的废水可以直接排放
B.还原性:>Cl-
C.反应中每生成1个N2,转移6个电子
D.反应中氯元素被还原,N2是氧化产物
6.二氧化氮通入水中,发生下列反应:该反应中,有关下列说法正确的是
A.H2O作还原剂 B.被氧化与被还原的物质的个数之比为2∶1
C.HNO3是氧化剂 D.HNO3是还原产物
7.硼氢化钠(NaBH4)吸湿性强,是最常用的还原剂之一,偏硼酸钠(NaBO2)制备提纯NaBH4的流程如下,下列有关说法错误的是
A.合成反应中H2作还原剂
B.萃取是利用系统中组分在溶剂中溶解度不同的分离操作
C.操作X中用到直型冷凝管
D.化合物x可循环利用
8.我国古典富载化学知识,下列记载不涉及氧化还原反应的是
A.“何意百炼钢,化为绕指柔”
B.“盖此矾色绿,味酸,烧之则赤”
C.“石垩(生石灰)以水沃之,即热蒸而解”
D.“(火药)乃焰消()、硫磺、杉木炭所合,以烽燧铳极”
9.菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是
A.因为河虾中含有砷元素,所以不能食用
B.“两者同食”发生的反应中维生素C作氧化剂
C.五价砷在维生素C作用下发生了还原反应
D.已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5
10.蛟龙号载入潜水器外壳用特殊的钛合金材料制成,它可以在深海中承受700个大气压的压力。钛(Ti)常温下不与酸、碱反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图。下列说法错误的是
A.步骤Ⅰ、Ⅱ中均发生氧化还原反应 B.步骤Ⅲ中Mg被氧化
C.步骤Ⅲ的反应可在空气中进行 D.可用稀硫酸除去金属钛中的少量镁杂质
11.下列氧化还原反应中,氧化剂和还原剂的物质的量之比不是1:2的是 ( )
A.
B.
C.
D.
12.下列相关说法正确的是
化学反应方程式 相关说法
A 双线桥: 双线桥标注规范正确
B 2Fe3++Cu=2Fe2++Cu2+ 由此可知氧化性:Cu>Fe2+
C 4CuO=2Cu2O+O2↑ 该反应中每生成1个O2,转移2个电子
D _______ClO-+_______Fe3++_______OH-=_______ +_______Cl-+_______H2O 化学计量数依次为:3,2,10,2,3,5
A.A B.B C.C D.D
13.传统诗词是传承中华文化的火种。下列诗句中不涉及氧化还原反应的是
A.蜡烛有心还惜别,替人垂泪到天明 B.何意百炼钢,化为绕指柔
C.炉火照天地,红星乱紫烟 D.绳锯木断,水滴石穿
14.NSR技术可有效降低柴油发动机在空气过量条件下的NOx,排放,NOx的储存和还原在不同时段交替进行,工作原理如图所示:
下列说法正确的是
A.柴油发动机中NOx来源于柴油的不充分燃烧
B.BaO转化为Ba(NO3)2的过程实现NOx的还原
C.在储存和还原过程中只有O2体现氧化性
D.反应消耗的H2与Ba(NO3)2的物质的量之比是5:1
15.钛(Ti)被称为铁、铝之后的第三金属,以下是由TiO2 制 Ti 的主要反应:
① TiO2+2Cl2+2CTiCl4+2CO
② TiCl4+2Mg2MgCl2+Ti
下列说法正确的是
A.反应①中有三种元素化合价发生变化 B.反应②是复分解反应
C.反应①中TiO2被氧化 D.反应②中1mol TiCl4反应则转移4mol e-
二、填空题
16.甘肃马家窑遗址(今临洮县)出土的青铜刀,是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,其化学式为Cu2(OH)2CO3。
(1)从物质分类标准看,“铜绿”属于哪类物质___________。(填选项)
A.酸 B.碱 C.盐 D.氧化物
(2)铜器表面有时会生成“铜绿”,这层“铜绿”可用化学方法除去,写出盐酸去除“铜绿”的化学方程式: 。
(3)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:反应Ⅰ:2Cu2S+3O22Cu2O+2SO2,反应Ⅱ:Cu2S+2Cu2O6Cu+SO2↑,请回答下列问题:
①反应Ⅰ中,氧化产物是 ,用单线桥标出反应Ⅰ中电子转移的方向和数目 。
②反应Ⅱ中,Cu2O的作用是 (填“氧化剂”“还原剂”或“氧化剂和还原剂”)。
17.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:2KNO3+S+3CK2S+N2↑+3CO2↑。该反应中还原剂是 ,还原产物是 (均写化学式),用双线桥法标出电子转移的方向和数目: 。
18.按要求完成下列问题:
(1)NO被氧化为的离子方程式为 。
(2)水中的溶解氧是水生生物生存不可缺少的条件。将水样与碱性悬浊液混合,反应生成,实现氧的固定。“氧的固定”中发生反应的化学方程式为 。
(3)实验室中可用次氯酸钠溶液与氨反应制备联氨(),反应的化学方程式为 。
19.储氢碳纳米管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式□C+□( )+□H2SO4=□( )+□( )+□Cr2(SO4)3+□H2O: 。
(2)上述反应中氧化剂是 (填化学式),被氧化的元素是 (填元素符号)。
(3) H2SO4在上述反应中表现的性质是 (填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
三、计算题
20.(1)化学反应N2(g)+H2(g)NH3(l)的能量变化如图所示,
该反应放出的热量为 (用代数式表示)
(2)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数为 。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、稀硫酸构成,该电池工作时,(工作原理:Pb+PbO2+2H2SO4===2PbSO4+2H2O),若电路中转移2mol电子,则负极材料质量的变化量为 g.
(4)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:该反应中X的平衡转化率为
21.Cl2在70℃的NaOH溶液中,能同时发生两个自身氧化还原(氧化剂和还原剂都是同一种物质)反应,反应的化学方程式为:
(1)产物中有NaClO: ;
(2)产物中有NaClO3 ;
反应完全后测得溶液中NaClO和NaClO3的数目之比为4:1,则产物的溶液中NaCl和NaClO的物质的量之比为 。
22.Ⅰ.运用已学知识完成下列计算:
(1)0.5 mol CH4的质量是 ,在标准状况下的体积为 。
(2)3.1 g Na2X含有Na+ 0.1 mol,则X的相对原子质量为 。
Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是 ,氧化产物是 。
(2)当有3mol I2生成时,有 mol还原剂被氧化。
(3)用双线桥表示该反应电子转移的方向和数目 。
试卷第1页,共3页
参考答案:
1.B
2.B
3.B
4.C
5.A
6.B
7.A
8.C
9.C
10.C
11.B
12.D
13.D
14.D
15.D
16.(1)C
(2)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(3) SO2 氧化剂
17. C K2S、N2
18.
19. K2Cr2O7 C C
20. b+c-a NA或6.02x1023 96 65.8%
21. Cl2+2NaOH=NaCl+NaClO+H2O 3Cl2+6NaOH=5NaCl+NaClO3+3H2O 9:4
22. 8g 11.2L 16 KIO3 I2 5
一、单选题
1.下列变化过程中,加入氧化剂才能实现的是
A. B. C. D.
2.下列化学反应中电子转移的表示方法正确的是
A. B.=2NaOH+H2↑
C. D.CuSO4+SO2↑+2H2O
3.下面的“诗”情“化”意中,分析正确的是
A.“千锤万凿出深山,烈火焚烧若等闲”只发生了物理变化
B.“千淘万漉虽辛苦,吹尽狂沙始到金”说明金的化学性质很稳定
C.“试玉要烧三日满”,该句诗表明玉的硬度很大
D.“野火烧不尽,春风吹又生”,诗中描述的过程不涉及氧化还原反应
4.下列说法正确的是( )
A.Cl2+2Br-=2Cl-+Br2,Zn+Cu2+=Zn2++Cu均为单质被还原的置换反应
B.2Na2O2+2H2O=4NaOH+O2↑,Cl2+H2O=HCl+HClO,均为水作还原剂的氧化还原反应
C.Na2SO3与H2O2的反应为氧化还原反应
D.生石灰用作食品抗氧化剂
5.废水脱氯工艺中有一种方法是在废水中加入过量NaClO使完全转化为N2,该反应过程可表示为+ClO-→N2↑+Cl-+H++H2O。下列说法中不正确的是
A.经此法处理过的废水可以直接排放
B.还原性:>Cl-
C.反应中每生成1个N2,转移6个电子
D.反应中氯元素被还原,N2是氧化产物
6.二氧化氮通入水中,发生下列反应:该反应中,有关下列说法正确的是
A.H2O作还原剂 B.被氧化与被还原的物质的个数之比为2∶1
C.HNO3是氧化剂 D.HNO3是还原产物
7.硼氢化钠(NaBH4)吸湿性强,是最常用的还原剂之一,偏硼酸钠(NaBO2)制备提纯NaBH4的流程如下,下列有关说法错误的是
A.合成反应中H2作还原剂
B.萃取是利用系统中组分在溶剂中溶解度不同的分离操作
C.操作X中用到直型冷凝管
D.化合物x可循环利用
8.我国古典富载化学知识,下列记载不涉及氧化还原反应的是
A.“何意百炼钢,化为绕指柔”
B.“盖此矾色绿,味酸,烧之则赤”
C.“石垩(生石灰)以水沃之,即热蒸而解”
D.“(火药)乃焰消()、硫磺、杉木炭所合,以烽燧铳极”
9.菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是
A.因为河虾中含有砷元素,所以不能食用
B.“两者同食”发生的反应中维生素C作氧化剂
C.五价砷在维生素C作用下发生了还原反应
D.已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5
10.蛟龙号载入潜水器外壳用特殊的钛合金材料制成,它可以在深海中承受700个大气压的压力。钛(Ti)常温下不与酸、碱反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图。下列说法错误的是
A.步骤Ⅰ、Ⅱ中均发生氧化还原反应 B.步骤Ⅲ中Mg被氧化
C.步骤Ⅲ的反应可在空气中进行 D.可用稀硫酸除去金属钛中的少量镁杂质
11.下列氧化还原反应中,氧化剂和还原剂的物质的量之比不是1:2的是 ( )
A.
B.
C.
D.
12.下列相关说法正确的是
化学反应方程式 相关说法
A 双线桥: 双线桥标注规范正确
B 2Fe3++Cu=2Fe2++Cu2+ 由此可知氧化性:Cu>Fe2+
C 4CuO=2Cu2O+O2↑ 该反应中每生成1个O2,转移2个电子
D _______ClO-+_______Fe3++_______OH-=_______ +_______Cl-+_______H2O 化学计量数依次为:3,2,10,2,3,5
A.A B.B C.C D.D
13.传统诗词是传承中华文化的火种。下列诗句中不涉及氧化还原反应的是
A.蜡烛有心还惜别,替人垂泪到天明 B.何意百炼钢,化为绕指柔
C.炉火照天地,红星乱紫烟 D.绳锯木断,水滴石穿
14.NSR技术可有效降低柴油发动机在空气过量条件下的NOx,排放,NOx的储存和还原在不同时段交替进行,工作原理如图所示:
下列说法正确的是
A.柴油发动机中NOx来源于柴油的不充分燃烧
B.BaO转化为Ba(NO3)2的过程实现NOx的还原
C.在储存和还原过程中只有O2体现氧化性
D.反应消耗的H2与Ba(NO3)2的物质的量之比是5:1
15.钛(Ti)被称为铁、铝之后的第三金属,以下是由TiO2 制 Ti 的主要反应:
① TiO2+2Cl2+2CTiCl4+2CO
② TiCl4+2Mg2MgCl2+Ti
下列说法正确的是
A.反应①中有三种元素化合价发生变化 B.反应②是复分解反应
C.反应①中TiO2被氧化 D.反应②中1mol TiCl4反应则转移4mol e-
二、填空题
16.甘肃马家窑遗址(今临洮县)出土的青铜刀,是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、CO2、O2作用产生的,其化学式为Cu2(OH)2CO3。
(1)从物质分类标准看,“铜绿”属于哪类物质___________。(填选项)
A.酸 B.碱 C.盐 D.氧化物
(2)铜器表面有时会生成“铜绿”,这层“铜绿”可用化学方法除去,写出盐酸去除“铜绿”的化学方程式: 。
(3)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应:反应Ⅰ:2Cu2S+3O22Cu2O+2SO2,反应Ⅱ:Cu2S+2Cu2O6Cu+SO2↑,请回答下列问题:
①反应Ⅰ中,氧化产物是 ,用单线桥标出反应Ⅰ中电子转移的方向和数目 。
②反应Ⅱ中,Cu2O的作用是 (填“氧化剂”“还原剂”或“氧化剂和还原剂”)。
17.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:2KNO3+S+3CK2S+N2↑+3CO2↑。该反应中还原剂是 ,还原产物是 (均写化学式),用双线桥法标出电子转移的方向和数目: 。
18.按要求完成下列问题:
(1)NO被氧化为的离子方程式为 。
(2)水中的溶解氧是水生生物生存不可缺少的条件。将水样与碱性悬浊液混合,反应生成,实现氧的固定。“氧的固定”中发生反应的化学方程式为 。
(3)实验室中可用次氯酸钠溶液与氨反应制备联氨(),反应的化学方程式为 。
19.储氢碳纳米管的成功研制体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
(1)请用上述物质填空,并配平化学方程式□C+□( )+□H2SO4=□( )+□( )+□Cr2(SO4)3+□H2O: 。
(2)上述反应中氧化剂是 (填化学式),被氧化的元素是 (填元素符号)。
(3) H2SO4在上述反应中表现的性质是 (填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
三、计算题
20.(1)化学反应N2(g)+H2(g)NH3(l)的能量变化如图所示,
该反应放出的热量为 (用代数式表示)
(2)漂白剂亚氯酸钠(NaClO2)在常温下、黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子数为 。
(3)铅蓄电池是最早使用的充电电池,由Pb、PbO2、稀硫酸构成,该电池工作时,(工作原理:Pb+PbO2+2H2SO4===2PbSO4+2H2O),若电路中转移2mol电子,则负极材料质量的变化量为 g.
(4)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:该反应中X的平衡转化率为
21.Cl2在70℃的NaOH溶液中,能同时发生两个自身氧化还原(氧化剂和还原剂都是同一种物质)反应,反应的化学方程式为:
(1)产物中有NaClO: ;
(2)产物中有NaClO3 ;
反应完全后测得溶液中NaClO和NaClO3的数目之比为4:1,则产物的溶液中NaCl和NaClO的物质的量之比为 。
22.Ⅰ.运用已学知识完成下列计算:
(1)0.5 mol CH4的质量是 ,在标准状况下的体积为 。
(2)3.1 g Na2X含有Na+ 0.1 mol,则X的相对原子质量为 。
Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是 ,氧化产物是 。
(2)当有3mol I2生成时,有 mol还原剂被氧化。
(3)用双线桥表示该反应电子转移的方向和数目 。
试卷第1页,共3页
参考答案:
1.B
2.B
3.B
4.C
5.A
6.B
7.A
8.C
9.C
10.C
11.B
12.D
13.D
14.D
15.D
16.(1)C
(2)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(3) SO2 氧化剂
17. C K2S、N2
18.
19. K2Cr2O7 C C
20. b+c-a NA或6.02x1023 96 65.8%
21. Cl2+2NaOH=NaCl+NaClO+H2O 3Cl2+6NaOH=5NaCl+NaClO3+3H2O 9:4
22. 8g 11.2L 16 KIO3 I2 5
