第四章 物质结构元素周期律 单元测试 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 第四章 物质结构元素周期律 单元测试 (含解析)2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 534.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-09 22:59:54 | ||
图片预览



文档简介
第四章 物质结构 元素周期律 单元测试
一、单选题
1.日本将福岛核废水排海,引起全世界强烈谴责。核废水中含有放射性的氚、碘-131、铯-134、铯-137、碳-14、钴-60和锶-90等。下列叙述正确的是
A.原子所含中子数与质子数之差为25 B.铯-134和铯-137是两种不同元素
C.氕、氘、氚三种核素都含有中子 D.和的核外电子数之差为1
2.某矿石的主要成分由原子序数依次增大的前20号主族元素X、Y、Z、W组成。已知:X、Y、Z、W的原子序数之和为52,Y元素形成的单质在黑暗处遇氢气会发生爆炸,Z元素原子内层电子数是最外层电子数的2倍,W元素原子最外层电子数和最内层电子数相等。下列叙述正确的是
A.原子半径:W>Z>Y>X
B.中含有非极性共价键
C.Z元素最高价氧化物对应的水化物为强酸
D.最简单氢化物的沸点:X>Y>Z
3.是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
A.原子半径:
B.X的氧化物一定属于酸性氧化物
C.在Q的结构中,所有原子最外层均满足8电子稳定结构
D.Y元素组成的最常见单质和M的单质,在加热条件下生成的化合物中只含离子键
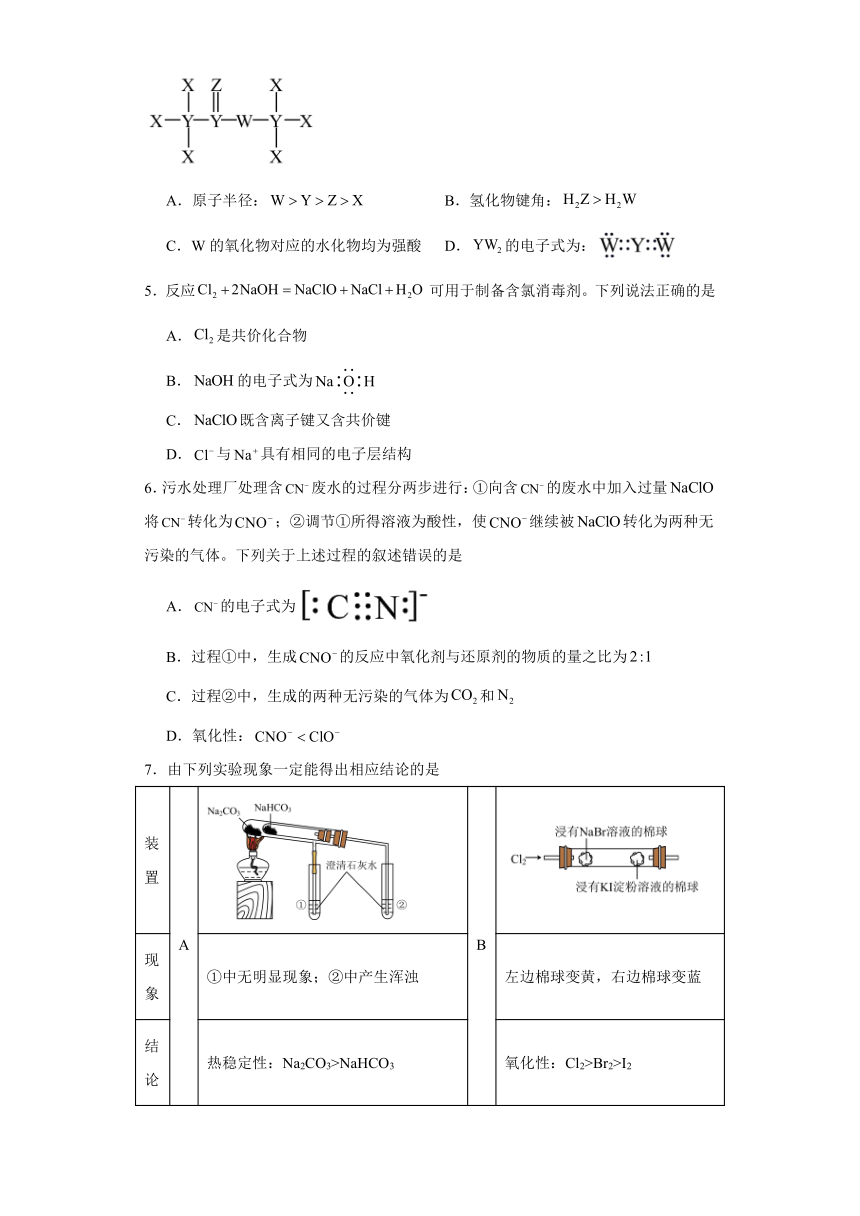
4.化合物常应用于各种调味香精中,其结构式如图所示。已知X、Y、Z、W为原子序数依次增大的短周期元素且分属三个不同周期,Z、W的基态原子价层电子都有2个未成对电子,下列有关叙述错误的是
A.原子半径: B.氢化物键角:
C.W的氧化物对应的水化物均为强酸 D.的电子式为:
5.反应可用于制备含氯消毒剂。下列说法正确的是
A.是共价化合物
B.的电子式为
C.既含离子键又含共价键
D.与具有相同的电子层结构
6.污水处理厂处理含废水的过程分两步进行:①向含的废水中加入过量将转化为;②调节①所得溶液为酸性,使继续被转化为两种无污染的气体。下列关于上述过程的叙述错误的是
A.的电子式为
B.过程①中,生成的反应中氧化剂与还原剂的物质的量之比为
C.过程②中,生成的两种无污染的气体为和
D.氧化性:
7.由下列实验现象一定能得出相应结论的是
装置 A B
现象 ①中无明显现象;②中产生浑浊 左边棉球变黄,右边棉球变蓝
结论 热稳定性:Na2CO3>NaHCO3 氧化性:Cl2>Br2>I2
装置 C D
现象 a中产生灰白色固体;b中溶液褪色 锥形瓶中产生大量气泡,试管出现浑浊
结论 在此条件下铜与浓硫酸发生氧化还原反应,但未生成硫酸铜 元素的非金属性Cl>C>Si
A.A B.B C.C D.D
8.近期意大利罗马大学的 FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是
A.N4属于一种新型的化合物
B.N4与N2的性质相同
C.N4转化为 N2属于物理变化
D.N4与 N2都是由氮元素的同素异形体
9.化学与生活、生产、科技密切相关。下列说法不正确的是
A.和是酸性氧化物,都能与NaOH溶液反应
B.“曾青得铁则化为铜”不包含化学变化
C.激光法蒸发石墨得发生的是化学变化
D.白磷和红磷互为同素异形体
10.短周期元素X、Y、Z、W的原子序数依次增大它们分别位于不同的主族,X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于,下列说法正确的是
A.原子半径大小顺序:W>Z>Y>X B.沸点:XW2>Y2W
C.简单氢化物的热稳定性:ZZ
11.黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑。下列说法正确的是
A.黑火药是纯净物 B.硝酸钾的电离方程式:KNO3=K++NO
C.硫的原子结构示意图: D.该反应为非氧化还原反应
12.我国在可控核聚变研究上处于世界领先水平。核聚变原料的制备与核聚变的产物如图。
已知:氚()是氢元素的一种放射性核素。下列说法不正确的是
A.、互为同位素 B.具有放射性
C.核聚变属于化学变化 D.、的化学性质基本相同
13.X、Y和Z为原子序数依次递增的3种短周期元素,已知X与Y同主族,Y与Z同周期且相邻,Z的核外电子数为17。下列说法错误的是
A.X的元素符号为O B.X的原子半径大于Y
C.Y的元素名称为硫 D.Z的非金属性强于Y
14.下列关于元素及化合物的性质的“类比”结果正确的是
A.的溶解度比的大,的溶解度也比的大
B.和均属于酸性氧化物,也是酸性氧化物
C.与NaOH溶液反应生成和,则和NaOH溶液反应生成和
D.与反应生成与,与反应生成与
二、非选择题
15.科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入探究。
①②晶体③固体 ④ ⑤熔融⑥ ⑦溶液⑧固体
(1)已知是一种酸根离子,则②属于 (填“酸”“碱”“盐”或“氧化物”)。
(2)以上物质中⑥ 电解质(填“是”、“不是”)。
(3)写出⑤⑦中溶质的电离方程式:
⑤ ;⑦ 。
(4)请写出与互为同素异形体的物质的名称: 。
(5)从以上物质中,选出适当的物质,按以下要求写出反应的离子方程式:
i.⑦与⑧反应: ;
ii.③与⑥反应: ;
iii.少量⑧的水溶液与足量的氢氧化钙溶液反应 。
(6)用双线桥表示反应电子转移情况: 。
16.已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题。
元素编号 元素性质或原子结构的相关叙述
T 失去一个电子后形成与Ne相同的核外电子排布
X 最外层电子数是次外层电子数的2倍
Y 其某种单质是空气的主要成分,也是最常见的助燃剂
Z 原子核外有3个电子层,最外层比次外层少1个电子
(1)元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是 。X的另一种同位素可用来测定文物所属年代,这种同位素的原子符号是 。
(2)Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是 。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是 (填化学式),电离方程式为 。
(4)画出T的原子结构示意图: 。
(5)由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的化学方程式为 。
17.砷及其化合物用途非常广泛。回答下列问题:
(1)已知:砷(As)与磷位于同一主族相邻位置。画出砷的原子结构示意图: 。
(2)(亚砷酸)是三元弱酸,第一步和第二步电离是通过和水中的氢氧根结合实现的,第三步则直接电离出。第一步电离方程式为,第二步的电离方程式为 。
(3)古代《本草衍义》提纯砒霜作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……”,该提纯用的基本操作是 。砷黄铁矿(FeAsS)制烧可生成砒霜和红棕色固体,该反应的化学方程式为 。
(4)处理含砷废水的方法很多,在含高浓度的酸性溶液中加入可将转化为而脱除,该脱除砷的离子方程式为 。
18.化学物质与人类的生产、生活密切相关。
(1)食盐的主要成分是氯化钠,氯化钠是由 (填“分子”、“原子”或“离子”)构成的。
(2)碘酒的主要作用是用来抑制和杀灭细菌、病毒等。碘酒的溶剂是 。
(3)金刚石、石墨都是碳元素组成的单质,但它们的物理性质有很大的差异,其根本原因是 。
(4)洗涤剂可以清洗掉盘子上的油污,洗涤剂起到 作用。
(5)如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据下图回答下列问题。
①P点的含义是 。
②大量的b中混有少量的a,提纯b的方法为 。
③t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃。下列说法正确的是 。
A.都是饱和溶液
B.溶质质量分数大小关系是:bac
C.析出晶体质量最多的是a
试卷第1页,共3页
参考答案:
1.A
【详解】A.原子所含中子数为131-53=78,中子数与质子数之差为78-53=25,A正确;
B.铯-134和铯-137是同种元素,B错误;
C.氕不含中子,C错误;
D.和的核外电子数相等,D错误;
故选A。
2.D
【分析】X、Y、Z、W原子序数依次增大;由Y元素形成的单质在黑暗处遇氢气会发生爆炸,可知Y元素为F;Z元素原子内层电子数是最外层电子数的2倍,则Z元素为P;W元素原子最外层电子数和最内层电子数相等,则W元素为Mg或Ca,因Z元素原子序数大于P元素,故W元素为Ca;根据四种元素原子序数之和为52,可推出X元素为O。
【详解】A.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径:Ca>P>O>F,故A错误;
B.CaF2是离子化合物,只含离子键,故B错误;
C.P元素最高价氧化物对应的水化物为H3PO4,H3PO4为弱酸,故C错误;
D.最简单氢化物的沸点:H2O>HF>PH3,故D正确;
选D。
3.D
【分析】M、W、X、Y、Z是五种原子序数依次增大的短周期主族元素,Y的最外层电子数等于 X 的核外电子总数,Y形成两对共用电子对,X形成4对共用电子对,则X为C,Y为O;Z形成1对共用电子对,W形成4对共用电子对,但Q中阴离子带1个单位负电荷,则Z为F,W为B,五种原子的原子序数之和为31,M的原子序数为31-5-6-8-9=3,则M为Li。
【详解】A.同周期元素原子,从左往右半径减小;同主族元素原子,从上到下半径增大,原子半径C>O>F,故A错误;
B.X的氧化物CO不是酸性氧化物,故B错误;
C.Q中的Li+最外层2个电子,不满足8e-稳定结构,故C错误;
D.Y元素的单质是O2,M的单质是Li,加热条件下只能生成一种氧化物Li2O,只含离子键,故D正确;
故选D。
4.C
【详解】X共价键为1,则X可能为H、F、Cl,Y存在4个共价键,Y可能为Si、C,Z存在2个共价键,Z可能为O、S,W存在2个共价键,Z可能为O、S,X、Y、Z、W为原子序数依次增大,且属于三个周期,则X为H、Y为C、Z为O、W为S,以此分析;
【分析】A.电子层越多,半径越大,当电子层越多,核电荷数越大,半径越小,则半径,S>C>O>H,A正确;
B.O的电负性比S大,而原子半径小于S, 所以键角HOH要大于HSH,B正确;
C.S的氧化物对应水化物H2SO4为强酸,H2SO3为弱酸,C错误;
D.CS2的电子数为 ,D正确;
故答案为:C。
5.C
【详解】A.为单质,不属于化合物,故A错误;
B.NaOH为离子化合物,电子式为,故B错误
C.NaClO是由钠离子和次氯酸根离子构成的离子化合物,既含离子键又含共价键,故C正确;
D.Na+核外电子排布为2、8,共有2个电子层,Cl-核外电子排布为2、8、8,共有3个电子层,所以二者电子层结构不同,故D错误;
故选C。
6.B
【分析】①向含CN-的废水中加入过量NaClO将CN-转化为CNO-,发生反应的离子方程式为CN-+ClO-=CNO-+Cl-;②调节①所得溶液为酸性,使CNO-继续被NaClO转化为两种无污染的气体CO2和N2,反应的离子方程式为2CNO-+3ClO-+2H+=2CO2↑+N2↑+3Cl-+H2O;据此作答。
【详解】A.CN-中C与N之间形成碳氮三键,电子式为,A项正确;
B.过程①中发生的反应为CN-+ClO-=CNO-+Cl-,该反应中Cl元素的化合价由+1价降至-1价,ClO-为氧化剂,C元素的化合价由+2价升至+4价,CN-为还原剂,根据得失电子守恒,该反应中氧化剂与还原剂物质的量之比为1∶1,B项错误;
C.根据分析,过程②中生成的两种无污染的气体为CO2和N2,C项正确;
D.过程①中发生的反应为CN-+ClO-=CNO-+Cl-,该反应中ClO-是氧化剂,CN-是还原剂、CNO-是氧化产物,根据同一氧化还原反应中,氧化剂的氧化性强于氧化产物,则氧化性:ClO->CNO-,D项正确;
答案选B。
7.A
【详解】A.澄清石灰水变浑浊,说明物质分解产生了CO2,直接加热的Na2CO3没有分解,反而间接加热的NaHCO3分解,说明了热稳定性:Na2CO3 >NaHCO3,故A正确;
B.右侧棉球变蓝说明生成了I2,既可能是Br2氧化了I-,也可能是Cl2氧化了I-,所以无法比较Br2和I2的氧化性强弱,故B错误;
C.b试管中品红褪色说明铜与浓硫酸反应生成发生氧化还原反应生成SO2,生成灰白色固体是硫酸铜失去结晶水所生成的,故C错误;
D.元素非金属性越强,最高价氧化物对应水化物酸性越强;该实验可证明盐酸酸性强于碳酸,碳酸酸性强于硅酸,但盐酸不是Cl元素最高价氧化物的水化物,所以不能比较Cl与C的非金属性,故D错误;
答案选A。
8.D
【详解】A.N4只含一种元素,属于一种新型的单质,A不正确;
B.N4与N2互为同素异形体,物理性质不同,B不正确;
C.N4转化为 N2属于同素异形体之间的转化,属于化学变化,C不正确;
D.N4与 N2的结构不同,物理性质不同,二者都是由氮元素组成的同素异形体,D正确;
故选D。
9.B
【详解】A.和都能与NaOH溶液反应生成盐和水,都是酸性氧化物,故A正确;
B.“曾青得铁则化为铜”描述的是铁置换铜的过程,有新物质产生,包含化学变化,故B错误;
C.激光法蒸发石墨得过程中产生新物质,该过程属于化学变化,故C正确;
D.白磷和红磷是由同种元素组成的性质不同的单质,互为同素异形体,故D正确;
答案选B。
10.C
【分析】根据题意可知:短周期元素X、Y、Z、W的原子序数依次增大,它们分别位于不同的主族,X的最高正价与最低负价代数和为0,X为C元素,X与W所在族序数之和等于,确定W是S元素,Y与Z最外层电子数之和与W的最外层电子数相等,Y为金属元素, Y、Z分别为Na、P元素。
【详解】A.电子层数越多原子半径越大,同周期元素自左向右原子半径逐渐减小,故原子半径Y(Na)>Z(P)>W(S)>X(C),A项错误;
B.W分别与X、Y形成的化合物为CS2、Na2S,前者为共价化合物,后者为离子化合物,则硫化钠的沸点高于二硫化碳,B项错误;
C.非金属性Z(P)D.Z、W的氧化物对应的水化物分别为H3PO4、H2SO4和H2SO3,H2SO4是强酸,H3PO4是中强酸,H2SO3是弱酸,则S的氧化物对应的水化物的酸性不一定比P的强,D项错误;
答案选C。
11.B
【详解】A.黑火药是由硫磺、碳单质和组成的混合物,A错误;
B.硝酸钾为强电解质,电离方程式为:,B正确;
C.是的结构示意图,C错误;
D.该反应为中S元素、C元素、N元素的化合价都发生变化,为氧化还原反应,D错误;
故选B。
12.C
【详解】A.、质子数相同,中子数不同,互为同位素,A正确;
B.中的氚()是放射性核素,因此具有放射性,B正确;
C.核聚变为原子核的变化,属于物理变化,化学变化的最小粒子是原子,C错误;
D.、的相对分子质量不同,二者的沸点不同,但二者同属于氢气,化学性质基本相同,D正确;
故选C。
13.B
【分析】Z的核外电子数为17,可知Z为Cl,Y与Z同周期且相邻,则Y为S,X与Y同主族,则X为O,据此分析解答;
【详解】A.由以上分析可知X为O,故A正确;
B.O核外2个电子层,S核外3个电子层,电子层数越多原子半径越大,则O原子半径小于S,故B错误;
C.由以上分析可知Y为S,元素名称为硫,故C正确;
D.S和Cl同周期,同周期元素从左到右非金属性增强,则Cl的非金属性大于S,故D正确;
故选:B。
14.C
【详解】A.碳酸氢钠的溶解度小于,A错误;
B.不是酸性氧化物,B错误;
C.与均为两性氢氧化物,C正确;
D.具有强氧化性,具有较强的还原性,两者反应生成,D错误;
故答案为:C。
15.(1)盐
(2)是
(3)
(4)金刚石或石墨
(5) 少量⑧的水溶液与足量的氢氧化钙溶液反应产物为CaCO 和NaOH,离子方程式为:
(6)
【详解】(1)是由酸根阴离子和二价铁离子组成的化合物,所以属于盐;
(2)电解质是在水溶液或者熔融状态下能导电的化合物,水是极弱的电解质;
(3)Al2 (SO4)3、是强电解质,所以电离方程式为:、;
(4)的同素异形体有金刚石或石墨等
(5)i.⑦与⑧反应的离子方程式是:;ii.③与⑥反应的离子方程式是:; iii.少量⑧的水溶液与足量的氢氧化钙溶液反应产物为CaCO 和NaOH,离子方程式为:。
(6)CaH 中的氢元素为负一价,H O中的氢元素为正一价,发生归中反应,所以用双线桥表示的电子转移情况为:
16.(1) 12C 14C
(2)O3
(3) NaCl NaCl=Na++Cl-
(4)
(5)CO2+2NaOH=Na2CO3+H2O
【分析】T失去一个电子后,形成与Ne相同的核外电子排布,则T为Na;X的最外层电子数是次外层电子数的2倍,则X含有2个电子层,最外层含有4个电子,为C元素;Y的某种单质是空气的主要成分,也是最常见的助燃剂,则Y为O;Z的原子核外有3个电子层,最外层比次外层少1个电子,则Z为Cl元素,以此分析解答。
【详解】(1)X为C,元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是12C,C的一种同位素可用来测定文物所属年代,该核素的质量数为14,这种同位素的原子符号是14C;
(2)Y为O,O形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质为臭氧,其化学式是O3;
(3)Z为Cl,元素Z在海水中含量非常高,海水中含Z元素的化合物主要NaCl,电离方程式为NaCl=Na++Cl-;
(4)T为Na,原子结构示意图为;
(5)X为C、Y为O,X的单质在Y的常见单质中充分燃烧,生成产物为CO2,二氧化碳通入足量氢氧化钠溶液中反应的方程式为CO2+2NaOH=Na2CO3+H2O。
17.(1)
(2)
(3) 升华
(4)
【详解】(1)砷(As)与磷位于同一主族相邻位置,原子序数为33,其电子层排布为2、8、18、5,即原子结构示意图为 ;
(2)H3AsO3(亚砷酸),是三元弱酸,第一步和第二步电离通过和水中的氢氧根结合实现的,第三步则直接电离出H+。第一步电离方程式为:H3AsO3+H2O[As(OH)4]-+H+,第二步的电离方程式为;
(3))“令砒烟上飞”指砒霜升华,“着覆器,遂凝结”指砒霜凝华,该提纯用的基本操作是升华;砷黄铁矿(FeAsS)煅烧可生成砒霜和红棕色固体,铁元素转化为红棕色固体氧化铁,硫元素转化为二氧化硫,砷元素转化为砒霜,该反应的化学方程式为;
(4)在含高浓度的酸性溶液中加入可将转化为而脱除,对应的化学额方程式为:。
18.(1)离子
(2)乙醇
(3)碳原子排列方式不同
(4)乳化
(5) t1℃时 a、c 的溶解度相等,都是 20g 蒸发结晶 BC
【详解】(1)氯化钠是由钠离子和氯离子构成的,故答案为:离子;
(2)碘酒是单质碘溶液乙醇形成的,故溶剂是乙醇;
(3)金刚石、石墨都是碳元素组成的单质互为同素异形体,其物理性质有很大的差异的原因是:碳原子排列方式不同;
(4)洗洁精具有乳化作用,能使油污与水形成相对稳定的乳浊液而洗去油污;
(5)①根据图中曲线可知,P点的含义是t1℃时 a、c 的溶解度相等,都是 20g;
②由图像可知,a物质的溶解度随温度的增加而增加,且变化趋势较大,b物质的溶解度随温度的增加变化较小,故b中混有少量的a时,可用蒸发结晶的方法提纯b;
③A.c的溶解度随着温度降低而增大,因此c变成不饱和溶液,A错误;
B.a、b析出固体后仍然是饱和溶液,b的溶解度大于a,因此b的质量分数大于a,由于a在t1℃时的溶解度大于c在坦t2℃时的溶解度,因此a的质量分数大于c,溶质质量分数大小关系是bac,B正确;
C.析出晶体质量最多的是a,是因为该温度范围内a的溶解度差最大,C正确;
故答案为:BC
一、单选题
1.日本将福岛核废水排海,引起全世界强烈谴责。核废水中含有放射性的氚、碘-131、铯-134、铯-137、碳-14、钴-60和锶-90等。下列叙述正确的是
A.原子所含中子数与质子数之差为25 B.铯-134和铯-137是两种不同元素
C.氕、氘、氚三种核素都含有中子 D.和的核外电子数之差为1
2.某矿石的主要成分由原子序数依次增大的前20号主族元素X、Y、Z、W组成。已知:X、Y、Z、W的原子序数之和为52,Y元素形成的单质在黑暗处遇氢气会发生爆炸,Z元素原子内层电子数是最外层电子数的2倍,W元素原子最外层电子数和最内层电子数相等。下列叙述正确的是
A.原子半径:W>Z>Y>X
B.中含有非极性共价键
C.Z元素最高价氧化物对应的水化物为强酸
D.最简单氢化物的沸点:X>Y>Z
3.是五种原子序数依次增大的短周期主族元素,其原子序数之和为31;其中Y的最外层电子数等于X的核外电子总数;五种主族元素组成的化合物Q的结构如图所示。下列说法正确的是
A.原子半径:
B.X的氧化物一定属于酸性氧化物
C.在Q的结构中,所有原子最外层均满足8电子稳定结构
D.Y元素组成的最常见单质和M的单质,在加热条件下生成的化合物中只含离子键
4.化合物常应用于各种调味香精中,其结构式如图所示。已知X、Y、Z、W为原子序数依次增大的短周期元素且分属三个不同周期,Z、W的基态原子价层电子都有2个未成对电子,下列有关叙述错误的是
A.原子半径: B.氢化物键角:
C.W的氧化物对应的水化物均为强酸 D.的电子式为:
5.反应可用于制备含氯消毒剂。下列说法正确的是
A.是共价化合物
B.的电子式为
C.既含离子键又含共价键
D.与具有相同的电子层结构
6.污水处理厂处理含废水的过程分两步进行:①向含的废水中加入过量将转化为;②调节①所得溶液为酸性,使继续被转化为两种无污染的气体。下列关于上述过程的叙述错误的是
A.的电子式为
B.过程①中,生成的反应中氧化剂与还原剂的物质的量之比为
C.过程②中,生成的两种无污染的气体为和
D.氧化性:
7.由下列实验现象一定能得出相应结论的是
装置 A B
现象 ①中无明显现象;②中产生浑浊 左边棉球变黄,右边棉球变蓝
结论 热稳定性:Na2CO3>NaHCO3 氧化性:Cl2>Br2>I2
装置 C D
现象 a中产生灰白色固体;b中溶液褪色 锥形瓶中产生大量气泡,试管出现浑浊
结论 在此条件下铜与浓硫酸发生氧化还原反应,但未生成硫酸铜 元素的非金属性Cl>C>Si
A.A B.B C.C D.D
8.近期意大利罗马大学的 FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是
A.N4属于一种新型的化合物
B.N4与N2的性质相同
C.N4转化为 N2属于物理变化
D.N4与 N2都是由氮元素的同素异形体
9.化学与生活、生产、科技密切相关。下列说法不正确的是
A.和是酸性氧化物,都能与NaOH溶液反应
B.“曾青得铁则化为铜”不包含化学变化
C.激光法蒸发石墨得发生的是化学变化
D.白磷和红磷互为同素异形体
10.短周期元素X、Y、Z、W的原子序数依次增大它们分别位于不同的主族,X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于,下列说法正确的是
A.原子半径大小顺序:W>Z>Y>X B.沸点:XW2>Y2W
C.简单氢化物的热稳定性:Z
11.黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑。下列说法正确的是
A.黑火药是纯净物 B.硝酸钾的电离方程式:KNO3=K++NO
C.硫的原子结构示意图: D.该反应为非氧化还原反应
12.我国在可控核聚变研究上处于世界领先水平。核聚变原料的制备与核聚变的产物如图。
已知:氚()是氢元素的一种放射性核素。下列说法不正确的是
A.、互为同位素 B.具有放射性
C.核聚变属于化学变化 D.、的化学性质基本相同
13.X、Y和Z为原子序数依次递增的3种短周期元素,已知X与Y同主族,Y与Z同周期且相邻,Z的核外电子数为17。下列说法错误的是
A.X的元素符号为O B.X的原子半径大于Y
C.Y的元素名称为硫 D.Z的非金属性强于Y
14.下列关于元素及化合物的性质的“类比”结果正确的是
A.的溶解度比的大,的溶解度也比的大
B.和均属于酸性氧化物,也是酸性氧化物
C.与NaOH溶液反应生成和,则和NaOH溶液反应生成和
D.与反应生成与,与反应生成与
二、非选择题
15.科学的分类能够反映事物的本质特征,有利于人们分门别类地进行深入探究。
①②晶体③固体 ④ ⑤熔融⑥ ⑦溶液⑧固体
(1)已知是一种酸根离子,则②属于 (填“酸”“碱”“盐”或“氧化物”)。
(2)以上物质中⑥ 电解质(填“是”、“不是”)。
(3)写出⑤⑦中溶质的电离方程式:
⑤ ;⑦ 。
(4)请写出与互为同素异形体的物质的名称: 。
(5)从以上物质中,选出适当的物质,按以下要求写出反应的离子方程式:
i.⑦与⑧反应: ;
ii.③与⑥反应: ;
iii.少量⑧的水溶液与足量的氢氧化钙溶液反应 。
(6)用双线桥表示反应电子转移情况: 。
16.已知几种元素的性质或原子结构的相关叙述如表所示,回答下列问题。
元素编号 元素性质或原子结构的相关叙述
T 失去一个电子后形成与Ne相同的核外电子排布
X 最外层电子数是次外层电子数的2倍
Y 其某种单质是空气的主要成分,也是最常见的助燃剂
Z 原子核外有3个电子层,最外层比次外层少1个电子
(1)元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是 。X的另一种同位素可用来测定文物所属年代,这种同位素的原子符号是 。
(2)Y形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是 。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是 (填化学式),电离方程式为 。
(4)画出T的原子结构示意图: 。
(5)由X元素组成的单质在Y元素组成的常见单质中完全燃烧,生成的产物用足量的氢氧化钠溶液吸收,反应的化学方程式为 。
17.砷及其化合物用途非常广泛。回答下列问题:
(1)已知:砷(As)与磷位于同一主族相邻位置。画出砷的原子结构示意图: 。
(2)(亚砷酸)是三元弱酸,第一步和第二步电离是通过和水中的氢氧根结合实现的,第三步则直接电离出。第一步电离方程式为,第二步的电离方程式为 。
(3)古代《本草衍义》提纯砒霜作如下叙述:“将生砒就置火上,以器覆之,令砒烟上飞,着覆器,遂凝结,累然下垂如乳尖……”,该提纯用的基本操作是 。砷黄铁矿(FeAsS)制烧可生成砒霜和红棕色固体,该反应的化学方程式为 。
(4)处理含砷废水的方法很多,在含高浓度的酸性溶液中加入可将转化为而脱除,该脱除砷的离子方程式为 。
18.化学物质与人类的生产、生活密切相关。
(1)食盐的主要成分是氯化钠,氯化钠是由 (填“分子”、“原子”或“离子”)构成的。
(2)碘酒的主要作用是用来抑制和杀灭细菌、病毒等。碘酒的溶剂是 。
(3)金刚石、石墨都是碳元素组成的单质,但它们的物理性质有很大的差异,其根本原因是 。
(4)洗涤剂可以清洗掉盘子上的油污,洗涤剂起到 作用。
(5)如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据下图回答下列问题。
①P点的含义是 。
②大量的b中混有少量的a,提纯b的方法为 。
③t2℃时,将a、b、c三种物质的等质量的饱和溶液降温至t1℃。下列说法正确的是 。
A.都是饱和溶液
B.溶质质量分数大小关系是:bac
C.析出晶体质量最多的是a
试卷第1页,共3页
参考答案:
1.A
【详解】A.原子所含中子数为131-53=78,中子数与质子数之差为78-53=25,A正确;
B.铯-134和铯-137是同种元素,B错误;
C.氕不含中子,C错误;
D.和的核外电子数相等,D错误;
故选A。
2.D
【分析】X、Y、Z、W原子序数依次增大;由Y元素形成的单质在黑暗处遇氢气会发生爆炸,可知Y元素为F;Z元素原子内层电子数是最外层电子数的2倍,则Z元素为P;W元素原子最外层电子数和最内层电子数相等,则W元素为Mg或Ca,因Z元素原子序数大于P元素,故W元素为Ca;根据四种元素原子序数之和为52,可推出X元素为O。
【详解】A.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,原子半径:Ca>P>O>F,故A错误;
B.CaF2是离子化合物,只含离子键,故B错误;
C.P元素最高价氧化物对应的水化物为H3PO4,H3PO4为弱酸,故C错误;
D.最简单氢化物的沸点:H2O>HF>PH3,故D正确;
选D。
3.D
【分析】M、W、X、Y、Z是五种原子序数依次增大的短周期主族元素,Y的最外层电子数等于 X 的核外电子总数,Y形成两对共用电子对,X形成4对共用电子对,则X为C,Y为O;Z形成1对共用电子对,W形成4对共用电子对,但Q中阴离子带1个单位负电荷,则Z为F,W为B,五种原子的原子序数之和为31,M的原子序数为31-5-6-8-9=3,则M为Li。
【详解】A.同周期元素原子,从左往右半径减小;同主族元素原子,从上到下半径增大,原子半径C>O>F,故A错误;
B.X的氧化物CO不是酸性氧化物,故B错误;
C.Q中的Li+最外层2个电子,不满足8e-稳定结构,故C错误;
D.Y元素的单质是O2,M的单质是Li,加热条件下只能生成一种氧化物Li2O,只含离子键,故D正确;
故选D。
4.C
【详解】X共价键为1,则X可能为H、F、Cl,Y存在4个共价键,Y可能为Si、C,Z存在2个共价键,Z可能为O、S,W存在2个共价键,Z可能为O、S,X、Y、Z、W为原子序数依次增大,且属于三个周期,则X为H、Y为C、Z为O、W为S,以此分析;
【分析】A.电子层越多,半径越大,当电子层越多,核电荷数越大,半径越小,则半径,S>C>O>H,A正确;
B.O的电负性比S大,而原子半径小于S, 所以键角HOH要大于HSH,B正确;
C.S的氧化物对应水化物H2SO4为强酸,H2SO3为弱酸,C错误;
D.CS2的电子数为 ,D正确;
故答案为:C。
5.C
【详解】A.为单质,不属于化合物,故A错误;
B.NaOH为离子化合物,电子式为,故B错误
C.NaClO是由钠离子和次氯酸根离子构成的离子化合物,既含离子键又含共价键,故C正确;
D.Na+核外电子排布为2、8,共有2个电子层,Cl-核外电子排布为2、8、8,共有3个电子层,所以二者电子层结构不同,故D错误;
故选C。
6.B
【分析】①向含CN-的废水中加入过量NaClO将CN-转化为CNO-,发生反应的离子方程式为CN-+ClO-=CNO-+Cl-;②调节①所得溶液为酸性,使CNO-继续被NaClO转化为两种无污染的气体CO2和N2,反应的离子方程式为2CNO-+3ClO-+2H+=2CO2↑+N2↑+3Cl-+H2O;据此作答。
【详解】A.CN-中C与N之间形成碳氮三键,电子式为,A项正确;
B.过程①中发生的反应为CN-+ClO-=CNO-+Cl-,该反应中Cl元素的化合价由+1价降至-1价,ClO-为氧化剂,C元素的化合价由+2价升至+4价,CN-为还原剂,根据得失电子守恒,该反应中氧化剂与还原剂物质的量之比为1∶1,B项错误;
C.根据分析,过程②中生成的两种无污染的气体为CO2和N2,C项正确;
D.过程①中发生的反应为CN-+ClO-=CNO-+Cl-,该反应中ClO-是氧化剂,CN-是还原剂、CNO-是氧化产物,根据同一氧化还原反应中,氧化剂的氧化性强于氧化产物,则氧化性:ClO->CNO-,D项正确;
答案选B。
7.A
【详解】A.澄清石灰水变浑浊,说明物质分解产生了CO2,直接加热的Na2CO3没有分解,反而间接加热的NaHCO3分解,说明了热稳定性:Na2CO3 >NaHCO3,故A正确;
B.右侧棉球变蓝说明生成了I2,既可能是Br2氧化了I-,也可能是Cl2氧化了I-,所以无法比较Br2和I2的氧化性强弱,故B错误;
C.b试管中品红褪色说明铜与浓硫酸反应生成发生氧化还原反应生成SO2,生成灰白色固体是硫酸铜失去结晶水所生成的,故C错误;
D.元素非金属性越强,最高价氧化物对应水化物酸性越强;该实验可证明盐酸酸性强于碳酸,碳酸酸性强于硅酸,但盐酸不是Cl元素最高价氧化物的水化物,所以不能比较Cl与C的非金属性,故D错误;
答案选A。
8.D
【详解】A.N4只含一种元素,属于一种新型的单质,A不正确;
B.N4与N2互为同素异形体,物理性质不同,B不正确;
C.N4转化为 N2属于同素异形体之间的转化,属于化学变化,C不正确;
D.N4与 N2的结构不同,物理性质不同,二者都是由氮元素组成的同素异形体,D正确;
故选D。
9.B
【详解】A.和都能与NaOH溶液反应生成盐和水,都是酸性氧化物,故A正确;
B.“曾青得铁则化为铜”描述的是铁置换铜的过程,有新物质产生,包含化学变化,故B错误;
C.激光法蒸发石墨得过程中产生新物质,该过程属于化学变化,故C正确;
D.白磷和红磷是由同种元素组成的性质不同的单质,互为同素异形体,故D正确;
答案选B。
10.C
【分析】根据题意可知:短周期元素X、Y、Z、W的原子序数依次增大,它们分别位于不同的主族,X的最高正价与最低负价代数和为0,X为C元素,X与W所在族序数之和等于,确定W是S元素,Y与Z最外层电子数之和与W的最外层电子数相等,Y为金属元素, Y、Z分别为Na、P元素。
【详解】A.电子层数越多原子半径越大,同周期元素自左向右原子半径逐渐减小,故原子半径Y(Na)>Z(P)>W(S)>X(C),A项错误;
B.W分别与X、Y形成的化合物为CS2、Na2S,前者为共价化合物,后者为离子化合物,则硫化钠的沸点高于二硫化碳,B项错误;
C.非金属性Z(P)
答案选C。
11.B
【详解】A.黑火药是由硫磺、碳单质和组成的混合物,A错误;
B.硝酸钾为强电解质,电离方程式为:,B正确;
C.是的结构示意图,C错误;
D.该反应为中S元素、C元素、N元素的化合价都发生变化,为氧化还原反应,D错误;
故选B。
12.C
【详解】A.、质子数相同,中子数不同,互为同位素,A正确;
B.中的氚()是放射性核素,因此具有放射性,B正确;
C.核聚变为原子核的变化,属于物理变化,化学变化的最小粒子是原子,C错误;
D.、的相对分子质量不同,二者的沸点不同,但二者同属于氢气,化学性质基本相同,D正确;
故选C。
13.B
【分析】Z的核外电子数为17,可知Z为Cl,Y与Z同周期且相邻,则Y为S,X与Y同主族,则X为O,据此分析解答;
【详解】A.由以上分析可知X为O,故A正确;
B.O核外2个电子层,S核外3个电子层,电子层数越多原子半径越大,则O原子半径小于S,故B错误;
C.由以上分析可知Y为S,元素名称为硫,故C正确;
D.S和Cl同周期,同周期元素从左到右非金属性增强,则Cl的非金属性大于S,故D正确;
故选:B。
14.C
【详解】A.碳酸氢钠的溶解度小于,A错误;
B.不是酸性氧化物,B错误;
C.与均为两性氢氧化物,C正确;
D.具有强氧化性,具有较强的还原性,两者反应生成,D错误;
故答案为:C。
15.(1)盐
(2)是
(3)
(4)金刚石或石墨
(5) 少量⑧的水溶液与足量的氢氧化钙溶液反应产物为CaCO 和NaOH,离子方程式为:
(6)
【详解】(1)是由酸根阴离子和二价铁离子组成的化合物,所以属于盐;
(2)电解质是在水溶液或者熔融状态下能导电的化合物,水是极弱的电解质;
(3)Al2 (SO4)3、是强电解质,所以电离方程式为:、;
(4)的同素异形体有金刚石或石墨等
(5)i.⑦与⑧反应的离子方程式是:;ii.③与⑥反应的离子方程式是:; iii.少量⑧的水溶液与足量的氢氧化钙溶液反应产物为CaCO 和NaOH,离子方程式为:。
(6)CaH 中的氢元素为负一价,H O中的氢元素为正一价,发生归中反应,所以用双线桥表示的电子转移情况为:
16.(1) 12C 14C
(2)O3
(3) NaCl NaCl=Na++Cl-
(4)
(5)CO2+2NaOH=Na2CO3+H2O
【分析】T失去一个电子后,形成与Ne相同的核外电子排布,则T为Na;X的最外层电子数是次外层电子数的2倍,则X含有2个电子层,最外层含有4个电子,为C元素;Y的某种单质是空气的主要成分,也是最常见的助燃剂,则Y为O;Z的原子核外有3个电子层,最外层比次外层少1个电子,则Z为Cl元素,以此分析解答。
【详解】(1)X为C,元素X的一种同位素用作相对原子质量的标准,这种同位素的原子符号是12C,C的一种同位素可用来测定文物所属年代,该核素的质量数为14,这种同位素的原子符号是14C;
(2)Y为O,O形成的另一种单质,主要存在于地球的平流层中,被称作地球生物的保护伞,该单质为臭氧,其化学式是O3;
(3)Z为Cl,元素Z在海水中含量非常高,海水中含Z元素的化合物主要NaCl,电离方程式为NaCl=Na++Cl-;
(4)T为Na,原子结构示意图为;
(5)X为C、Y为O,X的单质在Y的常见单质中充分燃烧,生成产物为CO2,二氧化碳通入足量氢氧化钠溶液中反应的方程式为CO2+2NaOH=Na2CO3+H2O。
17.(1)
(2)
(3) 升华
(4)
【详解】(1)砷(As)与磷位于同一主族相邻位置,原子序数为33,其电子层排布为2、8、18、5,即原子结构示意图为 ;
(2)H3AsO3(亚砷酸),是三元弱酸,第一步和第二步电离通过和水中的氢氧根结合实现的,第三步则直接电离出H+。第一步电离方程式为:H3AsO3+H2O[As(OH)4]-+H+,第二步的电离方程式为;
(3))“令砒烟上飞”指砒霜升华,“着覆器,遂凝结”指砒霜凝华,该提纯用的基本操作是升华;砷黄铁矿(FeAsS)煅烧可生成砒霜和红棕色固体,铁元素转化为红棕色固体氧化铁,硫元素转化为二氧化硫,砷元素转化为砒霜,该反应的化学方程式为;
(4)在含高浓度的酸性溶液中加入可将转化为而脱除,对应的化学额方程式为:。
18.(1)离子
(2)乙醇
(3)碳原子排列方式不同
(4)乳化
(5) t1℃时 a、c 的溶解度相等,都是 20g 蒸发结晶 BC
【详解】(1)氯化钠是由钠离子和氯离子构成的,故答案为:离子;
(2)碘酒是单质碘溶液乙醇形成的,故溶剂是乙醇;
(3)金刚石、石墨都是碳元素组成的单质互为同素异形体,其物理性质有很大的差异的原因是:碳原子排列方式不同;
(4)洗洁精具有乳化作用,能使油污与水形成相对稳定的乳浊液而洗去油污;
(5)①根据图中曲线可知,P点的含义是t1℃时 a、c 的溶解度相等,都是 20g;
②由图像可知,a物质的溶解度随温度的增加而增加,且变化趋势较大,b物质的溶解度随温度的增加变化较小,故b中混有少量的a时,可用蒸发结晶的方法提纯b;
③A.c的溶解度随着温度降低而增大,因此c变成不饱和溶液,A错误;
B.a、b析出固体后仍然是饱和溶液,b的溶解度大于a,因此b的质量分数大于a,由于a在t1℃时的溶解度大于c在坦t2℃时的溶解度,因此a的质量分数大于c,溶质质量分数大小关系是bac,B正确;
C.析出晶体质量最多的是a,是因为该温度范围内a的溶解度差最大,C正确;
故答案为:BC
