4.2 元素周期律 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2 元素周期律 同步练习题(含解析) 2023-2024学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 349.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-09 23:27:11 | ||
图片预览



文档简介
4.2 元素周期律 同步练习题
一、选择题
1.X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Y、W也同主族,且Y的原子序数比X大1,Z的原子序数是X的3倍。下列说法错误的是
A.最高价氧化物对应水化物的碱性:
B.W的单质既能与盐酸反应,又能溶于溶液
C.原子半径:
D.常温下,Z、W的单质均能在空气中形成氧化膜
2.下列事实不能用元素周期律解释的是
A.F2 在暗处遇H2 爆炸, I2 在暗处遇H2几乎不反应
B.Br2 和NaI 溶液发生置换反应,和 NaCl 溶液不发生置换反应
C.金属 Na 和熔融 KCl 反应置换出金属 K
D.常温下,Na能够与水反应,Al不行
3.元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
元素 X Y Z
最高化合价 +7 +6 +5
最低化合价 -1 -2 -3
A.原子半径:X<Y<Z
B.离子半径:X-<Y2-<Z3-
C.稳定性:HX<H2Y<ZH3
D.酸性由强到弱:HXO4>H2YO4>H3ZO4
4.下列有关说法错误的是
A.酸性:H2CO3>HClO B.原子半径:r(Al)<r(Cl)
C.碱性:NaOH>Al(OH)3 D.氧化性:S<Cl2
5.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E是由上述四种元素中的一种或几种组成的物质。已知A、B分子中分别含有18、10个电子,E为黄绿色单质,D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是
A.Y、Z的氢化物的热稳定性比较:Y>Z
B.X和Z可以形成18电子的化合物X2Z2
C.四种元素简单离子半径比较:W>Y>Z>X
D.X、Y、W组成的化合物中可能既有离子键又有极性键
6.下列元素的原子半径最大的是
A.Si B.P C.S D.Cl
7.已知1-18号元素的离子aW3+、bX+、cY2-和dZ- 都具有相同的电子结构,下列关系正确的是
A.原子序数:c>d>b>a B.离子的还原性:Y2- > Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X < W
8.下列关系正确的是
A.原子半径:NaAl
C.酸性: D.稳定性:HBr>HCl
二、非选择题
9.Ⅰ.请参考题中图表,已知E1=134kJ/mol,E2=368kJ/mol,根据要求回答问题:
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,△H的变化是 (填“增大”、“减小”或“不变”)。写出NO2和CO反应的热化学方程式: 。
(2)如表所示是部分化学键的键能参数:
化学键 P-P P-O O=O P=O
键能/kJ/mol a b c x
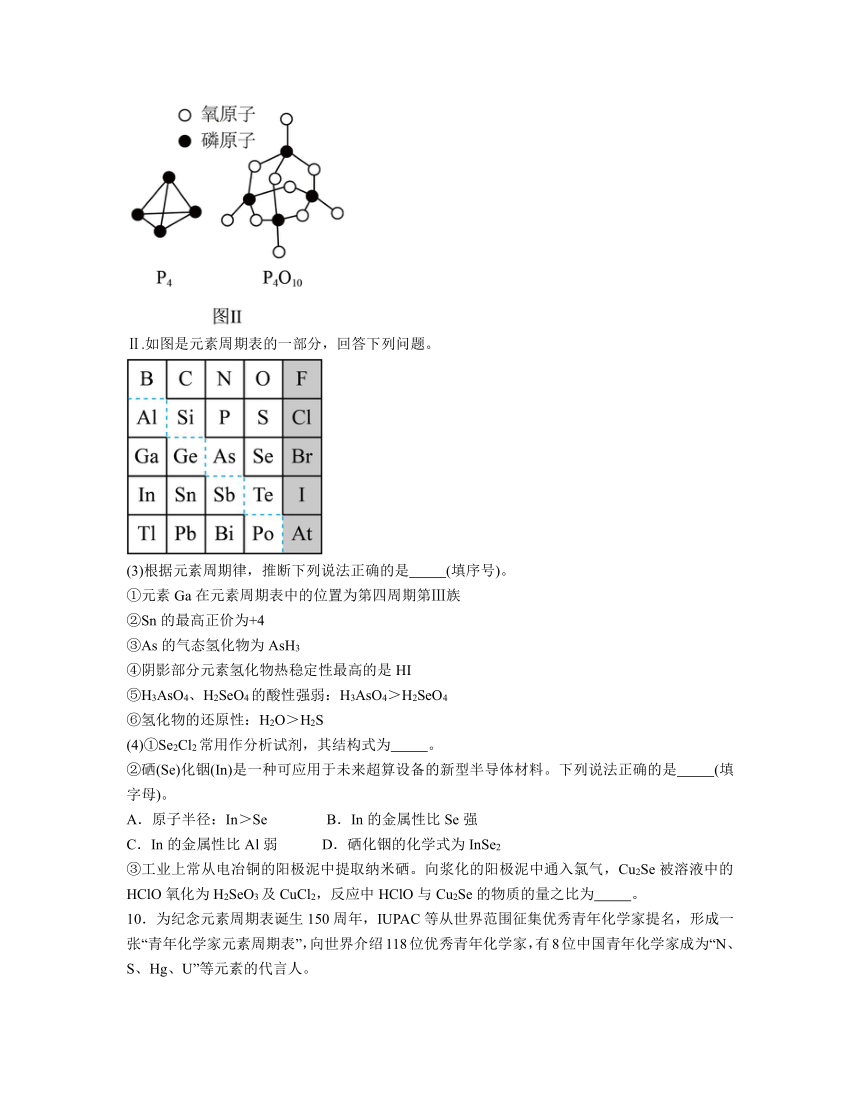
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图Ⅱ所示。根据所给信息可求出表中x= kJ/mol(用含a、b、c、d的代表数式表示)
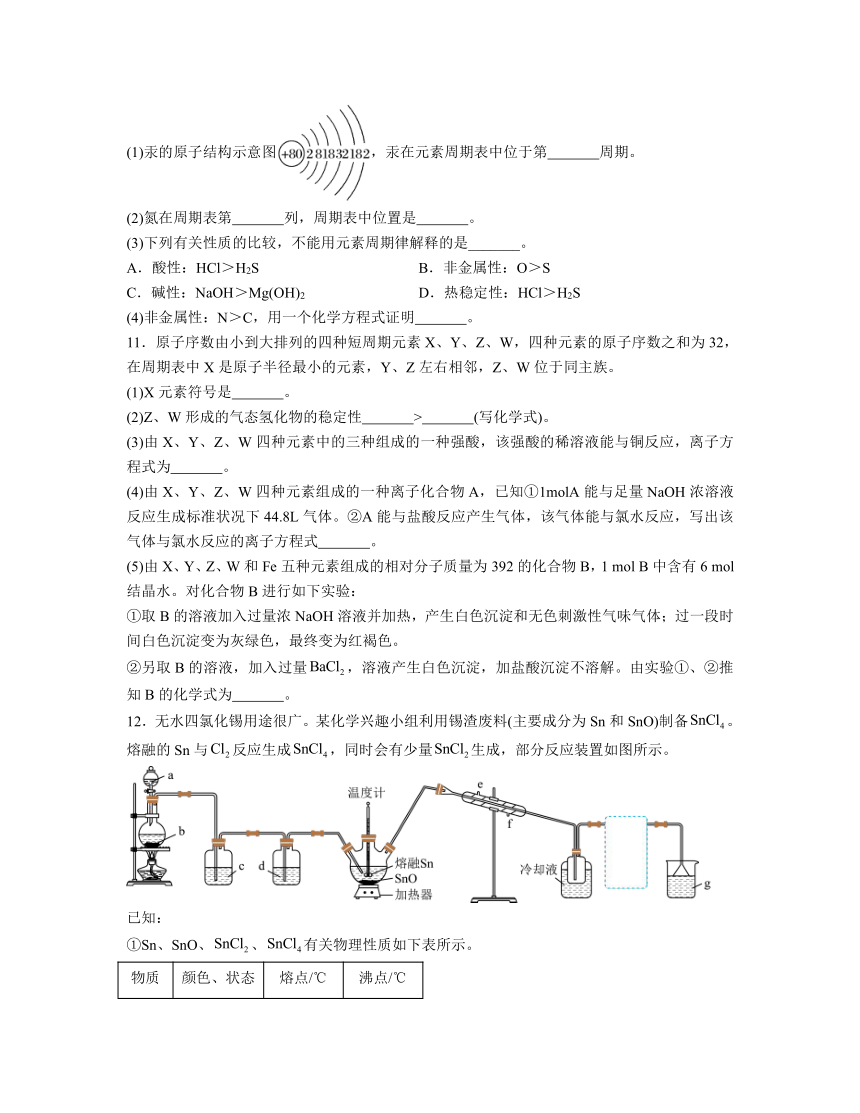
Ⅱ.如图是元素周期表的一部分,回答下列问题。
(3)根据元素周期律,推断下列说法正确的是 (填序号)。
①元素Ga在元素周期表中的位置为第四周期第Ⅲ族
②Sn的最高正价为+4
③As的气态氢化物为AsH3
④阴影部分元素氢化物热稳定性最高的是HI
⑤H3AsO4、H2SeO4的酸性强弱:H3AsO4>H2SeO4
⑥氢化物的还原性:H2O>H2S
(4)①Se2Cl2常用作分析试剂,其结构式为 。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是 (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为 。
10.为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、S、Hg、U”等元素的代言人。
(1)汞的原子结构示意图,汞在元素周期表中位于第 周期。
(2)氮在周期表第 列,周期表中位置是 。
(3)下列有关性质的比较,不能用元素周期律解释的是_______。
A.酸性:HCl>H2S B.非金属性:O>S
C.碱性:NaOH>Mg(OH)2 D.热稳定性:HCl>H2S
(4)非金属性:N>C,用一个化学方程式证明 。
11.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是 。
(2)Z、W形成的气态氢化物的稳定性 > (写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式 。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,1 mol B中含有6 mol结晶水。对化合物B进行如下实验:
①取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
②另取B的溶液,加入过量,溶液产生白色沉淀,加盐酸沉淀不溶解。由实验①、②推知B的化学式为 。
12.无水四氯化锡用途很广。某化学兴趣小组利用锡渣废料(主要成分为Sn和SnO)制备。熔融的Sn与反应生成,同时会有少量生成,部分反应装置如图所示。
已知:
①Sn、SnO、、有关物理性质如下表所示。
物质 颜色、状态 熔点/℃ 沸点/℃
Sn 银白色固体 232 2260
SnO 蓝黑色粉末 1080分解 1080分解
无色晶体 246 652
无色液体 -33 114
②极易水解生成。
③当时,Sn存在形式为沉淀;当时,Sn存在形式为。回答下列问题:
(1)盛放试剂b的仪器名称是 ,该装置中发生反应的离子方程式为 。
(2)制备的相关试剂和操作正确的是 (填字母)。
A.试剂a为稀盐酸 B.试剂b为固体
C.试剂c为浓硫酸 D.试剂d为饱和食盐水
E.f口为出水口 F.试剂g可选用NaOH溶液
(3)温度计控制温度t的范围为 。
(4)根据实验要求,若要完成该实验,需在上图虚线框中画出装置所缺少的仪器和所需试剂(即冷却装置与尾气处理装置之间的仪器);若没有该装置,可能会发生的副反应的化学方程式为 。
(5)因氯化亚锡()用途广泛,在无机工业中用作还原剂(易被氧化为)。该兴趣小组又用三颈烧瓶内的剩余物质制备,向三颈烧瓶中加入适量的浓盐酸并充分搅拌,加热到一定温度,一段时间后,冷却至室温,过滤,向滤液中加入少许单质锡,调节,在气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体。
①在制备时,向三颈烧瓶中通入的目的是 。
②调节的原因是 。
【参考答案】
一、选择题
1.C
【分析】由题干信息可知,X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Z的原子序数是X的3倍,则 X为1、Z为3、则Y为He不是主族元素(舍去),X为Be、Z为Mg,且Y的原子序数比X大1,故Y为B,Y、W也同主族,W为Al,据此分析解题。
解析:A.由分析可知,X为Be、Z为Mg,则金属性Be<Mg,故最高价氧化物对应水化物的碱性Mg(OH)2>Be(OH)2,即,A正确;
B.由分析可知,W为Al,故W的单质既能与盐酸反应,又能溶于溶液,反应方程式分别为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,B正确;
C.由分析可知,X、Y、Z、W分别为Be、B、Mg、Al,则原子半径相对大小为:Mg>Al>Be>B即,C错误;
D.由分析可知,Z为Mg,W为Al,故常温下,Z、W的单质均能在空气中形成氧化膜,D正确;
故答案为:C。
2.C
解析:A.非金属性F>I,故氟气与氢气化合较容易,可以利用元素周期律解释,选项A正确;
B.溴的非金属性强于碘但弱于氯, Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应,可以利用元素周期律解释,选项B正确;
C.钾金属性强于钠,金属Na和熔融KCl反应置换出金属K是因为钾的沸点较低,不可以利用元素周期律解释,选项C不正确;
D.钠的金属性强于铝,钠更活泼,能够与水反应,但Al的活泼性较弱,不能与水反应,能用元素周期律解释,选项D正确;
答案选C。
3.C
【分析】元素X、Y、Z位于相同短周期,X有-1、+7价,X为Cl,X、Y、Z位于相同短周期,Y的最高价为+6价,Y为S;Z的最高价为+5价,Z为P。
解析:A.同周期从左向右原子半径逐渐减小,因此原子半径:P>S>Cl,即Z>Y>X,故A正确;
B. X-、Y2-、Z3-的电子层数相同,原子序数越大,离子半径越小,则离子半径X-<Y2-<Z3-,故B正确;
C.非金属性越强,对应简单氢化物越稳定,非金属性:Cl>S>P,则稳定性:HX>H2Y>ZH3,故C错误;
D.非金属性越强,对应最高价含氧酸的酸性越强,非金属性:Cl>S>P,则酸性由强到弱:HXO4>H2YO4>H3ZO4,故D正确;
答案选C。
4.B
解析:A.CO2可以和NaClO溶液发生反应生成HClO,由此可知,酸性:H2CO3>HClO,A正确;
B.同一周期,从左到右,元素的原子半径依次减小,故原子半径:r(Al)>r(Cl),B错误;
C.同一周期,从左到右,元素的金属性依次减弱;元素的金属性越强,其最高价氧化物对应的水化物的碱性越强;金属性:Na>Al,故碱性:NaOH>Al(OH)3,C正确;
D.同一周期,从左到右,元素的非金属性依次增强;元素的非金属性越强,其单质的氧化性越强;非金属性:S<Cl,故氧化性:S<Cl2,D正确;
故选B。
5.A
【分析】E为黄绿色单质,E为Cl2;A含有18电子,D有漂白性,且A与D反应生成氯气,则A为HCl,D为HClO,B既能与HCl反应又能与氯气反应,且含10个电子,则B为NH3;生成的C为NH4Cl,所以X为H、Y为N、Z为O、W为Cl。
解析:A.非金属性:O>N,非金属越强氢化物稳定性越强,则稳定性:H2O>NH3,故A错误;
B.H和O可形成18电子的H2O2,故B正确;
C.电子层数越多离子半径越大,层数相同时,核电荷数越多离子半径越小,则离子半径:,故C正确;
D.H、N、Cl可形成NH4Cl,既有离子键又有极性键,故D正确;
故选:A。
6.A
解析:同周期随核电荷数增大,原子核对核外电子吸引增强,原子半径减小,Si、P、S、Cl同周期,核电荷数依次增大,原子半径依次减小,故Si原子半径最大;
故选A。
7.B
【分析】1-18号元素的离子aW3+、bX+、cY2-和dZ- 都具有相同的电子结构;X、W是阳离子,Y、Z是阴离子,所以X、W位于Y、Z的下一周期;再根据所带电荷数,则W的原子序数大于X,Z的原子序数大于Y。
解析:A.由分析可知,原子序数:a>b >d>c,A错误;
B. Z在Y元素的右侧,Z元素的非金属性比Y强,所以阴离子的还原性Y2->Z-,B正确;
C. Z元素的非金属性比Y强,所以Z的氢化物比Y的氢化物稳定,C错误;
D. X与W是同周期元素,X的原子序数小于W,所以X的原子半径大于W,D错误。
故选B。
8.B
解析:A.同周期元素原子从左到右半径依次减小,所以原子半径:Na>Cl,A错误;
B.同周期元素从左到右金属性依次减弱,所以金属性:Mg>Al,B正确;
C.同周期元素从左到右非金属性依次增强,其最高价氧化物对应水化物的酸性也依次增强,所以酸性:,C错误;
D.同主族元素从上到下非金属性依次减弱,所以气态氢化物的稳定性也依次减弱,即稳定性:HBr<HCl,D错误;
故选B。
二、非选择题
9.(1) 不变 NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ mol-1
(2)(d+6a+5c-12b)
(3)②③
(4) Cl-Se-Se-Cl AB 4:1
解析:(1)加入催化剂能降低反应所需的活化能,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ mol-1;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,所以12mol×bkJ/mol+4mol×xkJ/mol-(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,x=(d+6a+5c-12b);
(3)①根据Ga和Al同一主族,Ga在Al的下一周期,则Ga在周期表的位置位于第四周期第ⅢA族,故错误;
②Sn和碳同一主族,最高正价为+4价,故正确;
③As最外层有5个电子,与3个H原子形成3个共价键,使分子中每个原子都达到稳定结构,所以As的气态氢化物为AsH3,故正确;
④同一主族元素从上到下,元素的非金属性逐渐减弱,则相应的氢化物的稳定性逐渐减弱,因此氢化物热稳定性最高的是HF,故错误;
⑤同一周期从左向右,元素的非金属性逐渐增强,则其最高价含氧酸的酸性逐渐增强,所以酸性:H3AsO4<H2SeO4;
⑥同一主族元素的非金属性越强,其相应的简单的氢化物的还原性就越弱,由于元素的非金属性O>S,所以氢化物的还原性:H2O<H2S;
故选:②③;
(4)①Se2Cl2均满足8电子的稳定结构,电子式为 ;
②A.同周期原子半径由左向右逐渐减小,所以原子半径In>Se;故A正确;
B.同周期由左向右金属性逐渐减弱,则In的金属性比Se强;故B正确;
C.由上述B分析得出In的金属性比Se强:故C错误;
D.根据In和Al同族,最高正化合价为+3;Se和S同族最低负价为-2;硒化铟的化学式为In2Se3,不是InSe2;故D错误;
故选:AB;
③Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2写出反应方程式为:Cu2S+4HClO=H2SeO3+2CuCl2+H2O;则反应中HClO与Cu2Se的物质的量之比为4:1;故答案为:4:1。
10.(1)六
(2) 第15列 第二周期第ⅤA族
(3)A
(4)CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
解析:(1)汞的原子结构示意图为,最外层电子数是2,有6个电子层,所以汞在元素周期表中位于第六周期。
(2)氮元素的原子序数是7,氮在周期表第15列,周期表中位置是第二周期第ⅤA族。
(3)A. 氢化物的酸性与非金属性强弱没有关系,不能用元素周期律解释,A符合;
B. 同主族从上到下非金属性逐渐增强,即非金属性:O>S,能用元素周期律解释,B不符合;
C. 金属性越强,最高价氧化物对应水化物的碱性越强,金属性Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,C不符合;
D. 非金属性越强,简单氢化物的稳定性越强,非金属性Cl>S,所以热稳定性:HCl>H2S,能用元素周期律解释,D不符合;
答案选A。
(4)硝酸能制备碳酸,说明硝酸的酸性强于碳酸,所以非金属性:N>C,反应的化学方程式为CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑。
11.(1)H
(2)
(3)
(4)
(5)
解析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x 1,由四种元素的原子序数之和为32,则,解得x=8,即Y为N元素,Z为O元素,W为S元素,M元素与X同主族,与W同周期,则M为Na。
(1)分析可知X为H元素,
故答案为H;
(2)非金属性越强,氢化物越稳定,非金属性O>S,故氢化物越稳定H2O>H2S;
故答案为H2O,H2S;
(3)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为;
故答案为;
(4)由H、N、O、S四种元素组成的一种离子化合物A,则A为铵盐;1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为(NH4)2SO3,B为SO2;SO2与氯水反应的离子方程式为;
故答案为;
(5)由H、N、O、S和Fe五种元素组成的相对分子质量为392的化合物B,1mol B中含有6mol结晶水。向B的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明B中含有Fe2+和,另取少量B的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明B中含有;结合B的相对分子质量和结晶水个数可知B的化学式为;故答案为。
12.(1) 圆底烧瓶 4H++2Cl-+MnO2Mn2++Cl2↑+2H2O
(2)BF
(3)232~652℃
(4)SnCl4+(x+2)H2O=SnO2 xH2O+4HCl
(5) 排尽装置内空气,防止Sn2+被氧化 防止Sn2+转化为Sn(OH)2沉淀
解析:某化学兴趣小组利用锡渣废料(主要成分为Sn和SnO)制备SnCl4。熔融的Sn与Cl2反应生成SnCl4,同时会有少量SnCl2生成。结合装置图可知,三颈烧瓶左侧的装置用来制取和提纯Cl2,三颈烧瓶中Sn和Cl2反应制备SnCl4,三颈烧瓶右侧的装置用来收集SnCl4,由于SnCl4的沸点相对较低,可以通过蒸馏收集,又因为SnCl4极易水解生成SnO2 xH2O,收集到的SnCl4需要注意“防水”。
(1)盛放试剂b的仪器名称是圆底烧瓶,该装置中,浓盐酸和MnO2反应产生Cl2,该反应的离子方程式为4H++2Cl-+MnO2Mn2++Cl2↑+2H2O。
(2)由分析可知,三颈烧瓶左侧的装置用来制取和提纯Cl2,三颈烧瓶中Sn和Cl2反应制备SnCl4,三颈烧瓶右侧的装置用来收集SnCl4,则试剂a为浓盐酸,试剂b为MnO2,试剂c为饱和食盐水(除去Cl2中混有的HCl气体),试剂d为浓硫酸(干燥Cl2),e为出水口,f为进水口,试剂g可选用NaOH溶液(用来吸收挥发出的SnCl4),故制备SnCl4的相关试剂和操作正确的是BF。
(3)熔融的Sn与Cl2反应生成SnCl4,同时会有少量SnCl2生成,为了使Sn处于熔融状态,同时防止产品中带入SnCl2,温度计控制温度t的范围为232~652℃。
(4)SnCl4极易水解生成SnO2 xH2O,需在上图虚线框中(即冷却装置与尾气处理装置之间的仪器)添加干燥装置,吸收从尾气装置中挥发出的水蒸气,试剂可以选用浓硫酸,若没有该装置,SnCl4可能会和水蒸气反应生成SnO2 xH2O,反应的化学方程式为SnCl4+(x+2)H2O=SnO2 xH2O+4HCl。
(5)①在制备SnCl2时,由于Sn2+易被氧化为Sn4+,故需要向三颈烧瓶中通入N2,排尽装置内空气,防止Sn2+被氧化。②当2
一、选择题
1.X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Y、W也同主族,且Y的原子序数比X大1,Z的原子序数是X的3倍。下列说法错误的是
A.最高价氧化物对应水化物的碱性:
B.W的单质既能与盐酸反应,又能溶于溶液
C.原子半径:
D.常温下,Z、W的单质均能在空气中形成氧化膜
2.下列事实不能用元素周期律解释的是
A.F2 在暗处遇H2 爆炸, I2 在暗处遇H2几乎不反应
B.Br2 和NaI 溶液发生置换反应,和 NaCl 溶液不发生置换反应
C.金属 Na 和熔融 KCl 反应置换出金属 K
D.常温下,Na能够与水反应,Al不行
3.元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
元素 X Y Z
最高化合价 +7 +6 +5
最低化合价 -1 -2 -3
A.原子半径:X<Y<Z
B.离子半径:X-<Y2-<Z3-
C.稳定性:HX<H2Y<ZH3
D.酸性由强到弱:HXO4>H2YO4>H3ZO4
4.下列有关说法错误的是
A.酸性:H2CO3>HClO B.原子半径:r(Al)<r(Cl)
C.碱性:NaOH>Al(OH)3 D.氧化性:S<Cl2
5.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E是由上述四种元素中的一种或几种组成的物质。已知A、B分子中分别含有18、10个电子,E为黄绿色单质,D有漂白性。五种物质间的转化关系如图所示。下列说法错误的是
A.Y、Z的氢化物的热稳定性比较:Y>Z
B.X和Z可以形成18电子的化合物X2Z2
C.四种元素简单离子半径比较:W>Y>Z>X
D.X、Y、W组成的化合物中可能既有离子键又有极性键
6.下列元素的原子半径最大的是
A.Si B.P C.S D.Cl
7.已知1-18号元素的离子aW3+、bX+、cY2-和dZ- 都具有相同的电子结构,下列关系正确的是
A.原子序数:c>d>b>a B.离子的还原性:Y2- > Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X < W
8.下列关系正确的是
A.原子半径:Na
C.酸性: D.稳定性:HBr>HCl
二、非选择题
9.Ⅰ.请参考题中图表,已知E1=134kJ/mol,E2=368kJ/mol,根据要求回答问题:
(1)图I是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中的能最变化示意图,若在反应体系中加入催化剂,△H的变化是 (填“增大”、“减小”或“不变”)。写出NO2和CO反应的热化学方程式: 。
(2)如表所示是部分化学键的键能参数:
化学键 P-P P-O O=O P=O
键能/kJ/mol a b c x
已知白磷的燃烧热为dkJ/mol,白磷及其完全燃烧的产物的结构如图Ⅱ所示。根据所给信息可求出表中x= kJ/mol(用含a、b、c、d的代表数式表示)
Ⅱ.如图是元素周期表的一部分,回答下列问题。
(3)根据元素周期律,推断下列说法正确的是 (填序号)。
①元素Ga在元素周期表中的位置为第四周期第Ⅲ族
②Sn的最高正价为+4
③As的气态氢化物为AsH3
④阴影部分元素氢化物热稳定性最高的是HI
⑤H3AsO4、H2SeO4的酸性强弱:H3AsO4>H2SeO4
⑥氢化物的还原性:H2O>H2S
(4)①Se2Cl2常用作分析试剂,其结构式为 。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是 (填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为 。
10.为纪念元素周期表诞生150周年,IUPAC等从世界范围征集优秀青年化学家提名,形成一张“青年化学家元素周期表”,向世界介绍118位优秀青年化学家,有8位中国青年化学家成为“N、S、Hg、U”等元素的代言人。
(1)汞的原子结构示意图,汞在元素周期表中位于第 周期。
(2)氮在周期表第 列,周期表中位置是 。
(3)下列有关性质的比较,不能用元素周期律解释的是_______。
A.酸性:HCl>H2S B.非金属性:O>S
C.碱性:NaOH>Mg(OH)2 D.热稳定性:HCl>H2S
(4)非金属性:N>C,用一个化学方程式证明 。
11.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是 。
(2)Z、W形成的气态氢化物的稳定性 > (写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式 。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,1 mol B中含有6 mol结晶水。对化合物B进行如下实验:
①取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
②另取B的溶液,加入过量,溶液产生白色沉淀,加盐酸沉淀不溶解。由实验①、②推知B的化学式为 。
12.无水四氯化锡用途很广。某化学兴趣小组利用锡渣废料(主要成分为Sn和SnO)制备。熔融的Sn与反应生成,同时会有少量生成,部分反应装置如图所示。
已知:
①Sn、SnO、、有关物理性质如下表所示。
物质 颜色、状态 熔点/℃ 沸点/℃
Sn 银白色固体 232 2260
SnO 蓝黑色粉末 1080分解 1080分解
无色晶体 246 652
无色液体 -33 114
②极易水解生成。
③当时,Sn存在形式为沉淀;当时,Sn存在形式为。回答下列问题:
(1)盛放试剂b的仪器名称是 ,该装置中发生反应的离子方程式为 。
(2)制备的相关试剂和操作正确的是 (填字母)。
A.试剂a为稀盐酸 B.试剂b为固体
C.试剂c为浓硫酸 D.试剂d为饱和食盐水
E.f口为出水口 F.试剂g可选用NaOH溶液
(3)温度计控制温度t的范围为 。
(4)根据实验要求,若要完成该实验,需在上图虚线框中画出装置所缺少的仪器和所需试剂(即冷却装置与尾气处理装置之间的仪器);若没有该装置,可能会发生的副反应的化学方程式为 。
(5)因氯化亚锡()用途广泛,在无机工业中用作还原剂(易被氧化为)。该兴趣小组又用三颈烧瓶内的剩余物质制备,向三颈烧瓶中加入适量的浓盐酸并充分搅拌,加热到一定温度,一段时间后,冷却至室温,过滤,向滤液中加入少许单质锡,调节,在气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体。
①在制备时,向三颈烧瓶中通入的目的是 。
②调节的原因是 。
【参考答案】
一、选择题
1.C
【分析】由题干信息可知,X、Y、Z、W四种短周期主族元素的原子序数依次增大,其中X、Z同主族,Z的原子序数是X的3倍,则 X为1、Z为3、则Y为He不是主族元素(舍去),X为Be、Z为Mg,且Y的原子序数比X大1,故Y为B,Y、W也同主族,W为Al,据此分析解题。
解析:A.由分析可知,X为Be、Z为Mg,则金属性Be<Mg,故最高价氧化物对应水化物的碱性Mg(OH)2>Be(OH)2,即,A正确;
B.由分析可知,W为Al,故W的单质既能与盐酸反应,又能溶于溶液,反应方程式分别为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,B正确;
C.由分析可知,X、Y、Z、W分别为Be、B、Mg、Al,则原子半径相对大小为:Mg>Al>Be>B即,C错误;
D.由分析可知,Z为Mg,W为Al,故常温下,Z、W的单质均能在空气中形成氧化膜,D正确;
故答案为:C。
2.C
解析:A.非金属性F>I,故氟气与氢气化合较容易,可以利用元素周期律解释,选项A正确;
B.溴的非金属性强于碘但弱于氯, Br2和NaI溶液发生置换反应,和NaCl溶液不发生置换反应,可以利用元素周期律解释,选项B正确;
C.钾金属性强于钠,金属Na和熔融KCl反应置换出金属K是因为钾的沸点较低,不可以利用元素周期律解释,选项C不正确;
D.钠的金属性强于铝,钠更活泼,能够与水反应,但Al的活泼性较弱,不能与水反应,能用元素周期律解释,选项D正确;
答案选C。
3.C
【分析】元素X、Y、Z位于相同短周期,X有-1、+7价,X为Cl,X、Y、Z位于相同短周期,Y的最高价为+6价,Y为S;Z的最高价为+5价,Z为P。
解析:A.同周期从左向右原子半径逐渐减小,因此原子半径:P>S>Cl,即Z>Y>X,故A正确;
B. X-、Y2-、Z3-的电子层数相同,原子序数越大,离子半径越小,则离子半径X-<Y2-<Z3-,故B正确;
C.非金属性越强,对应简单氢化物越稳定,非金属性:Cl>S>P,则稳定性:HX>H2Y>ZH3,故C错误;
D.非金属性越强,对应最高价含氧酸的酸性越强,非金属性:Cl>S>P,则酸性由强到弱:HXO4>H2YO4>H3ZO4,故D正确;
答案选C。
4.B
解析:A.CO2可以和NaClO溶液发生反应生成HClO,由此可知,酸性:H2CO3>HClO,A正确;
B.同一周期,从左到右,元素的原子半径依次减小,故原子半径:r(Al)>r(Cl),B错误;
C.同一周期,从左到右,元素的金属性依次减弱;元素的金属性越强,其最高价氧化物对应的水化物的碱性越强;金属性:Na>Al,故碱性:NaOH>Al(OH)3,C正确;
D.同一周期,从左到右,元素的非金属性依次增强;元素的非金属性越强,其单质的氧化性越强;非金属性:S<Cl,故氧化性:S<Cl2,D正确;
故选B。
5.A
【分析】E为黄绿色单质,E为Cl2;A含有18电子,D有漂白性,且A与D反应生成氯气,则A为HCl,D为HClO,B既能与HCl反应又能与氯气反应,且含10个电子,则B为NH3;生成的C为NH4Cl,所以X为H、Y为N、Z为O、W为Cl。
解析:A.非金属性:O>N,非金属越强氢化物稳定性越强,则稳定性:H2O>NH3,故A错误;
B.H和O可形成18电子的H2O2,故B正确;
C.电子层数越多离子半径越大,层数相同时,核电荷数越多离子半径越小,则离子半径:,故C正确;
D.H、N、Cl可形成NH4Cl,既有离子键又有极性键,故D正确;
故选:A。
6.A
解析:同周期随核电荷数增大,原子核对核外电子吸引增强,原子半径减小,Si、P、S、Cl同周期,核电荷数依次增大,原子半径依次减小,故Si原子半径最大;
故选A。
7.B
【分析】1-18号元素的离子aW3+、bX+、cY2-和dZ- 都具有相同的电子结构;X、W是阳离子,Y、Z是阴离子,所以X、W位于Y、Z的下一周期;再根据所带电荷数,则W的原子序数大于X,Z的原子序数大于Y。
解析:A.由分析可知,原子序数:a>b >d>c,A错误;
B. Z在Y元素的右侧,Z元素的非金属性比Y强,所以阴离子的还原性Y2->Z-,B正确;
C. Z元素的非金属性比Y强,所以Z的氢化物比Y的氢化物稳定,C错误;
D. X与W是同周期元素,X的原子序数小于W,所以X的原子半径大于W,D错误。
故选B。
8.B
解析:A.同周期元素原子从左到右半径依次减小,所以原子半径:Na>Cl,A错误;
B.同周期元素从左到右金属性依次减弱,所以金属性:Mg>Al,B正确;
C.同周期元素从左到右非金属性依次增强,其最高价氧化物对应水化物的酸性也依次增强,所以酸性:,C错误;
D.同主族元素从上到下非金属性依次减弱,所以气态氢化物的稳定性也依次减弱,即稳定性:HBr<HCl,D错误;
故选B。
二、非选择题
9.(1) 不变 NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ mol-1
(2)(d+6a+5c-12b)
(3)②③
(4) Cl-Se-Se-Cl AB 4:1
解析:(1)加入催化剂能降低反应所需的活化能,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ mol-1;
(2)白磷燃烧的方程式为P4+5O2=P4O10,1mol白磷完全燃烧需拆开6mol P-P、5mol O=O,形成12molP-O、4mol P=O,所以12mol×bkJ/mol+4mol×xkJ/mol-(6mol×a kJ/mol+5 mol×c kJ/mol)=dkJ/mol,x=(d+6a+5c-12b);
(3)①根据Ga和Al同一主族,Ga在Al的下一周期,则Ga在周期表的位置位于第四周期第ⅢA族,故错误;
②Sn和碳同一主族,最高正价为+4价,故正确;
③As最外层有5个电子,与3个H原子形成3个共价键,使分子中每个原子都达到稳定结构,所以As的气态氢化物为AsH3,故正确;
④同一主族元素从上到下,元素的非金属性逐渐减弱,则相应的氢化物的稳定性逐渐减弱,因此氢化物热稳定性最高的是HF,故错误;
⑤同一周期从左向右,元素的非金属性逐渐增强,则其最高价含氧酸的酸性逐渐增强,所以酸性:H3AsO4<H2SeO4;
⑥同一主族元素的非金属性越强,其相应的简单的氢化物的还原性就越弱,由于元素的非金属性O>S,所以氢化物的还原性:H2O<H2S;
故选:②③;
(4)①Se2Cl2均满足8电子的稳定结构,电子式为 ;
②A.同周期原子半径由左向右逐渐减小,所以原子半径In>Se;故A正确;
B.同周期由左向右金属性逐渐减弱,则In的金属性比Se强;故B正确;
C.由上述B分析得出In的金属性比Se强:故C错误;
D.根据In和Al同族,最高正化合价为+3;Se和S同族最低负价为-2;硒化铟的化学式为In2Se3,不是InSe2;故D错误;
故选:AB;
③Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2写出反应方程式为:Cu2S+4HClO=H2SeO3+2CuCl2+H2O;则反应中HClO与Cu2Se的物质的量之比为4:1;故答案为:4:1。
10.(1)六
(2) 第15列 第二周期第ⅤA族
(3)A
(4)CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑
解析:(1)汞的原子结构示意图为,最外层电子数是2,有6个电子层,所以汞在元素周期表中位于第六周期。
(2)氮元素的原子序数是7,氮在周期表第15列,周期表中位置是第二周期第ⅤA族。
(3)A. 氢化物的酸性与非金属性强弱没有关系,不能用元素周期律解释,A符合;
B. 同主族从上到下非金属性逐渐增强,即非金属性:O>S,能用元素周期律解释,B不符合;
C. 金属性越强,最高价氧化物对应水化物的碱性越强,金属性Na>Mg,则碱性:NaOH>Mg(OH)2,能用元素周期律解释,C不符合;
D. 非金属性越强,简单氢化物的稳定性越强,非金属性Cl>S,所以热稳定性:HCl>H2S,能用元素周期律解释,D不符合;
答案选A。
(4)硝酸能制备碳酸,说明硝酸的酸性强于碳酸,所以非金属性:N>C,反应的化学方程式为CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑。
11.(1)H
(2)
(3)
(4)
(5)
解析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x 1,由四种元素的原子序数之和为32,则,解得x=8,即Y为N元素,Z为O元素,W为S元素,M元素与X同主族,与W同周期,则M为Na。
(1)分析可知X为H元素,
故答案为H;
(2)非金属性越强,氢化物越稳定,非金属性O>S,故氢化物越稳定H2O>H2S;
故答案为H2O,H2S;
(3)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为;
故答案为;
(4)由H、N、O、S四种元素组成的一种离子化合物A,则A为铵盐;1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为(NH4)2SO3,B为SO2;SO2与氯水反应的离子方程式为;
故答案为;
(5)由H、N、O、S和Fe五种元素组成的相对分子质量为392的化合物B,1mol B中含有6mol结晶水。向B的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明B中含有Fe2+和,另取少量B的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明B中含有;结合B的相对分子质量和结晶水个数可知B的化学式为;故答案为。
12.(1) 圆底烧瓶 4H++2Cl-+MnO2Mn2++Cl2↑+2H2O
(2)BF
(3)232~652℃
(4)SnCl4+(x+2)H2O=SnO2 xH2O+4HCl
(5) 排尽装置内空气,防止Sn2+被氧化 防止Sn2+转化为Sn(OH)2沉淀
解析:某化学兴趣小组利用锡渣废料(主要成分为Sn和SnO)制备SnCl4。熔融的Sn与Cl2反应生成SnCl4,同时会有少量SnCl2生成。结合装置图可知,三颈烧瓶左侧的装置用来制取和提纯Cl2,三颈烧瓶中Sn和Cl2反应制备SnCl4,三颈烧瓶右侧的装置用来收集SnCl4,由于SnCl4的沸点相对较低,可以通过蒸馏收集,又因为SnCl4极易水解生成SnO2 xH2O,收集到的SnCl4需要注意“防水”。
(1)盛放试剂b的仪器名称是圆底烧瓶,该装置中,浓盐酸和MnO2反应产生Cl2,该反应的离子方程式为4H++2Cl-+MnO2Mn2++Cl2↑+2H2O。
(2)由分析可知,三颈烧瓶左侧的装置用来制取和提纯Cl2,三颈烧瓶中Sn和Cl2反应制备SnCl4,三颈烧瓶右侧的装置用来收集SnCl4,则试剂a为浓盐酸,试剂b为MnO2,试剂c为饱和食盐水(除去Cl2中混有的HCl气体),试剂d为浓硫酸(干燥Cl2),e为出水口,f为进水口,试剂g可选用NaOH溶液(用来吸收挥发出的SnCl4),故制备SnCl4的相关试剂和操作正确的是BF。
(3)熔融的Sn与Cl2反应生成SnCl4,同时会有少量SnCl2生成,为了使Sn处于熔融状态,同时防止产品中带入SnCl2,温度计控制温度t的范围为232~652℃。
(4)SnCl4极易水解生成SnO2 xH2O,需在上图虚线框中(即冷却装置与尾气处理装置之间的仪器)添加干燥装置,吸收从尾气装置中挥发出的水蒸气,试剂可以选用浓硫酸,若没有该装置,SnCl4可能会和水蒸气反应生成SnO2 xH2O,反应的化学方程式为SnCl4+(x+2)H2O=SnO2 xH2O+4HCl。
(5)①在制备SnCl2时,由于Sn2+易被氧化为Sn4+,故需要向三颈烧瓶中通入N2,排尽装置内空气,防止Sn2+被氧化。②当2
