2.4化学反应的调控(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.4化学反应的调控(含解析) 同步练习题 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |
|
|
| 格式 | docx | ||
| 文件大小 | 450.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 00:00:00 | ||
图片预览


文档简介
2.4化学反应的调控同步练习题
一、选择题
1.在恒容密闭容器中充入一定量的和,发生反应N2O4(g) 2NO2(g) ,体系中各物质的百分含量与温度的变化关系如图所示,
下列说法错误的是
A.曲线①表示的百分含量
B.的键能总和大于的键能总和
C.若点为反应平衡点,此时平衡常数
D.反应达到平衡后,往该容器中充入少量N2O4,N2O4转化率减小
2.下图是光气在不同温度下的分解图象。光气,又称碳酰氯,化学式为,是一种重要的有机中间体,在农药、当今医药、工程塑料、聚氨酯材料以及军事上都有许多用途。制备光气的反应,下列各项措施中,能提高光气的产率是
A.增大容器容积 B.适当降低反应温度
C.分离出部分CO D.等容下通入惰性气体
3.在容积可变的密闭容器中,2 mol N2 和 8 mol H2 在一定条件下反应,达到平衡时,H2 的转化率为 25%,则平衡时氨气的体积分数接近于
A.5% B.10% C.15% D.20%
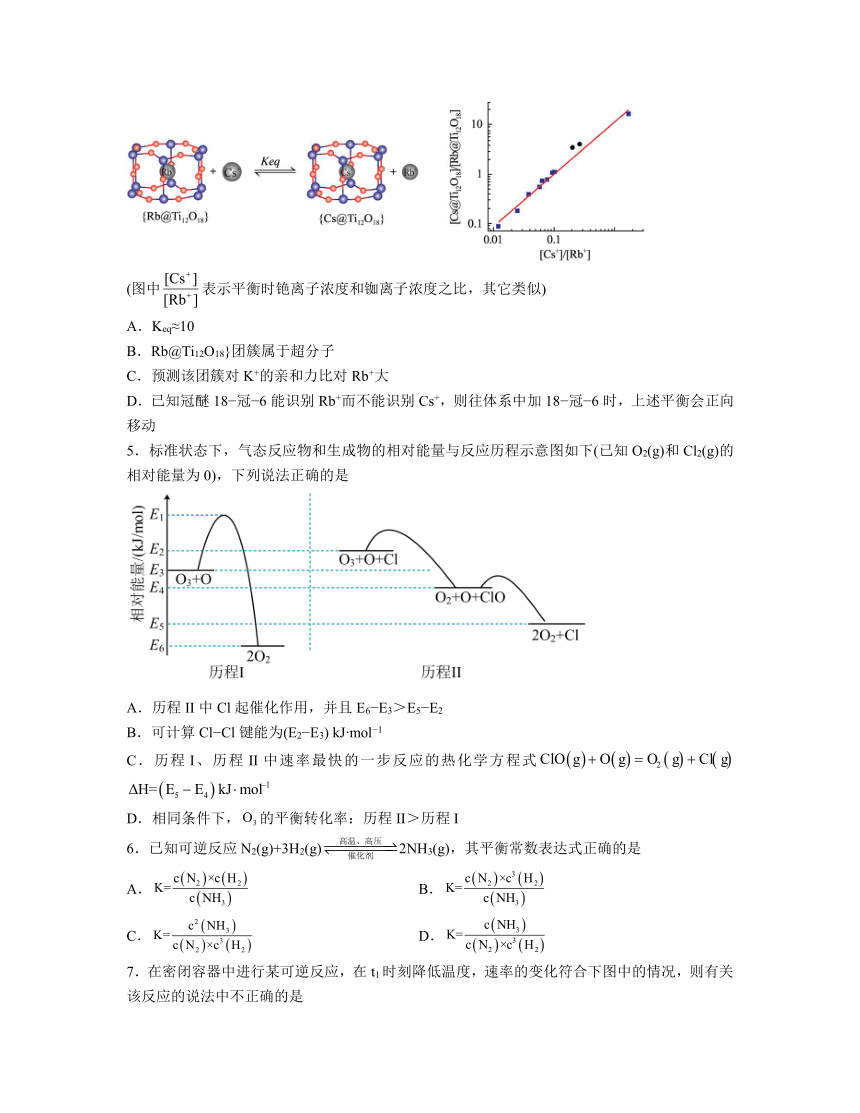
4.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将Rb@Ti12O18}和Cs+反应,测定笼内Cs+的浓度,计算Cs+取代Rb+反应的平衡常数(Keq),反应示意图和所测数据如图。有关说法不正确的是
(图中表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
A.Keq≈10
B.Rb@Ti12O18}团簇属于超分子
C.预测该团簇对K+的亲和力比对Rb+大
D.已知冠醚18 冠 6能识别Rb+而不能识别Cs+,则往体系中加18 冠 6时,上述平衡会正向移动
5.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2(g)和Cl2(g)的相对能量为0),下列说法正确的是
A.历程II中Cl起催化作用,并且E6 E3>E5 E2
B.可计算Cl Cl键能为(E2 E3) kJ mol 1
C.历程I、历程II中速率最快的一步反应的热化学方程式
D.相同条件下,的平衡转化率:历程II>历程I
6.已知可逆反应N2(g)+3H2(g)2NH3(g),其平衡常数表达式正确的是
A. B.
C. D.
7.在密闭容器中进行某可逆反应,在t1时刻降低温度,速率的变化符合下图中的情况,则有关该反应的说法中不正确的是
A.无法判断 S大于0还是小于0 B. H<0
C.平衡向逆反应方向移动 D.达到新平衡后平衡常数减小
8.某已平衡的化学可逆反应,下列有关叙述正确的是
A.使用合适的催化剂可以使平衡正向移动
B.升高温度,平衡一定正向移动
C.增加生成物的质量,平衡一定逆向移动
D.有气体参加的可逆反应,减小体积增大压强能够加快反应速率
二、非选择题
9.3A 3B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是_______热反应;
(2)若温度固定,扩大容器的体积,平衡向逆反应方向移动,则A一定呈_______态;
(3)若A是气态时,加压时,平衡不移动,则B为_______态。
10.在化学的学习中,我们会学到很多理论,这些理论对化学中千变万化的现象的规律性总结,指导我们认识化学世界的变化规律和本质。
(1)化学家盖斯根据一系列事实于1840年提出了盖斯定律:不管化学过程是____步完成或分几步完成,其反应热是____(填“相同”或“不同”)的。换句话说,化学反应的反应热只与反应体系的____和____有关,而与反应的途径无关。
(2)法国化学家勒夏特列总结出一条经验规律:如果改变影响平衡的条件之一(如温度、______、以及参加及应的化学物质的______),平衡将向着能够这种改变的方向移动,这就是著名的勒夏特列原理。
(3)已知NaSO4·10H2ONaSO4·nH2O+(10 n) H2O,将装有芒硝的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将______能转化为______能,晚上将______能转化为______能。
【参考答案】
一、选择题
1.C
解析:A.反应N2O4(g) 2NO2(g) ,反应吸热,所以升高温度,平衡向正反应方向移动,二氧化氮的百分含量增大,四氧化二氮的百分含量减小,对应图像可分析可出,曲线①表示的百分含量,曲线②表示的百分含量,A正确;
B.反应N2O4(g) 2NO2(g) ,反应吸热,又=反应物的键能之和-生成物的键能之和,所以的键能总和大于的键能总和,B正确;
C.若点为反应平衡点,则和的百分含量均为50%,又平衡常数表达式为,但因为没有具体的物质的量,所以无法准确计算平衡常数,C错误;
D.反应达到平衡后,往该容器中充入少量N2O4,相当于增大压强,平衡会向逆反应方向移动,致使N2O4转化率减小,D正确;
故选C。
2.B
解析:A.该反应是气体体积减小,增大容器的容积,压强减小,平衡向逆反应方向进行,COCl2产率降低,故A不符合题意;
B.根据图象,制备光气的反应属于放热反应,降低温度,平衡向正反应方向进行,COCl2产率增大,故B符合题意;
C.分离出CO,减少反应物的浓度,平衡逆向进行,COCl2产率降低,故C不符合题意;
D.等容下,通入惰性气体,组分浓度不变,反应速率不变,平衡不移动,故D不符合题意;
答案为B。
3.C
解析:在容积可变的密闭容器中,2molN2和8molH2在一定条件下反应,达到平衡时,H2的转化率为25%,消耗的氢气为2mol,则:
平衡时氨气的体积分数= ,故选:C。
4.C
解析:A.,根据右边图像的意义看,Keq=直线的斜率,故A正确;
B.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,说明Rb@Ti12O18}团簇属于超分子,故B正确;
C.根据Cs+取代Rb+反应的平衡常数Keq≈10,Ti12O18}团簇对Cs+的亲和力比对Rb+大,则Ti12O18}团簇对K+的亲和力比对Rb+小,故C错误;
D.已知冠醚18-冠-6能识别Rb+而不能识别Cs+,则往体系中加18-冠-6时,则识别出Rb+,平衡正向移动,故D正确。
综上所述,答案为C。
5.C
解析:A.历程II中Cl起催化作用,催化剂降低反应活化能,但焓变不变即E6 E3=E5 E2,故A错误;
B.Cl2(g)的相对能量为0,由图可知Cl(g)的相对能量为(E2 E3) kJ mol 1,断裂化学键吸收热量,Cl2(g)→2Cl(g)吸收能量为2(E2 E3) kJ mol 1,则Cl Cl键能为2(E2 E3) kJ mol 1,故B错误;
C.历程I、历程II中速率最快的一步是活化能最小的一步即,其反应的热化学方程式 ,故C正确;
D.相同条件下,催化剂不改变平衡移动,因此的平衡转化率:历程II=历程I,故D错误。
综上所述,答案为C。
6.C
【解析】化学平衡常数表达式是利用化学平衡状态下的平衡浓度计算,K=。
解析:可逆反应N2(g)+3H2(g)2NH3(g),其平衡常数表达式,C符合题意。
答案选C。
7.B
解析:A.未改变压强,则无法判断该反应大于0还是小于0,A正确;
B.t1时刻,正逆反应速率都减小,且,说明降温时反应向逆反应方向进行,则逆反应为放热反应,正反应为吸热反应, H>0,B错误;
C.由图可知平衡向逆反应方向移动,C正确;
D.对于吸热反应,降低温度,平衡左移、达到新平衡时化学平衡常数减小,D正确;
答案选B。
8.D
解析:A.催化剂只改变反应速率,不能使平衡发生移动,A错误;
B.升高温度平衡向吸热方向移动,但不一定是正向移动,B错误;
C.若该生成物为固体,增加其质量,平衡不移动,C错误;
D.有气体参加的可逆反应,减小体积增大压强,气体物质的浓度变大,反应速率加快,D正确;
综上所述答案为D。
二、非选择题
9. (1)吸(2)气(3)气
解析:(1)因为温度升高,平衡向吸热反应方向移动,根据3A 3B+C,平衡向正反应方向移动,所以正反应是吸热反应;故答案为:吸。
(2)若温度固定,扩大容器的体积,相当于减小压强,减小压强平衡向气体体积增大的方向移动,向逆反应方向移动,则A一定呈气态;故答案为:气。
(3)若A是气态时,加压时,平衡不移动,说明两边气体计量数相等,则B为气态物质,C为非气态物质。故答案为:气。
10. 一 相同 始态 终态 压强 浓度 太阳 化学 化学 热
解析:(1)盖斯定律的内容是:不管化学过程是一步完成或分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,故答案为:一;相同;始态;终态;
(2)勒夏特列原理的内容是:如果改变影响平衡的条件之一(如温度、压强、以及参加及应的化学物质的浓度),平衡将向着能够这种改变的方向移动,故答案为: 压强;浓度;
(3白天发生的反应是NaSO4·10H2ONaSO4·nH2O+(10 n) H2O,将太阳能转化为化学能,晚上发生的反应是NaSO4·nH2O+(10 n) H2ONaSO4·10H2O,将化学能转化为热能,故答案为:太阳;化学;化学;热
一、选择题
1.在恒容密闭容器中充入一定量的和,发生反应N2O4(g) 2NO2(g) ,体系中各物质的百分含量与温度的变化关系如图所示,
下列说法错误的是
A.曲线①表示的百分含量
B.的键能总和大于的键能总和
C.若点为反应平衡点,此时平衡常数
D.反应达到平衡后,往该容器中充入少量N2O4,N2O4转化率减小
2.下图是光气在不同温度下的分解图象。光气,又称碳酰氯,化学式为,是一种重要的有机中间体,在农药、当今医药、工程塑料、聚氨酯材料以及军事上都有许多用途。制备光气的反应,下列各项措施中,能提高光气的产率是
A.增大容器容积 B.适当降低反应温度
C.分离出部分CO D.等容下通入惰性气体
3.在容积可变的密闭容器中,2 mol N2 和 8 mol H2 在一定条件下反应,达到平衡时,H2 的转化率为 25%,则平衡时氨气的体积分数接近于
A.5% B.10% C.15% D.20%
4.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,我国科学家通过将Rb@Ti12O18}和Cs+反应,测定笼内Cs+的浓度,计算Cs+取代Rb+反应的平衡常数(Keq),反应示意图和所测数据如图。有关说法不正确的是
(图中表示平衡时铯离子浓度和铷离子浓度之比,其它类似)
A.Keq≈10
B.Rb@Ti12O18}团簇属于超分子
C.预测该团簇对K+的亲和力比对Rb+大
D.已知冠醚18 冠 6能识别Rb+而不能识别Cs+,则往体系中加18 冠 6时,上述平衡会正向移动
5.标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下(已知O2(g)和Cl2(g)的相对能量为0),下列说法正确的是
A.历程II中Cl起催化作用,并且E6 E3>E5 E2
B.可计算Cl Cl键能为(E2 E3) kJ mol 1
C.历程I、历程II中速率最快的一步反应的热化学方程式
D.相同条件下,的平衡转化率:历程II>历程I
6.已知可逆反应N2(g)+3H2(g)2NH3(g),其平衡常数表达式正确的是
A. B.
C. D.
7.在密闭容器中进行某可逆反应,在t1时刻降低温度,速率的变化符合下图中的情况,则有关该反应的说法中不正确的是
A.无法判断 S大于0还是小于0 B. H<0
C.平衡向逆反应方向移动 D.达到新平衡后平衡常数减小
8.某已平衡的化学可逆反应,下列有关叙述正确的是
A.使用合适的催化剂可以使平衡正向移动
B.升高温度,平衡一定正向移动
C.增加生成物的质量,平衡一定逆向移动
D.有气体参加的可逆反应,减小体积增大压强能够加快反应速率
二、非选择题
9.3A 3B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是_______热反应;
(2)若温度固定,扩大容器的体积,平衡向逆反应方向移动,则A一定呈_______态;
(3)若A是气态时,加压时,平衡不移动,则B为_______态。
10.在化学的学习中,我们会学到很多理论,这些理论对化学中千变万化的现象的规律性总结,指导我们认识化学世界的变化规律和本质。
(1)化学家盖斯根据一系列事实于1840年提出了盖斯定律:不管化学过程是____步完成或分几步完成,其反应热是____(填“相同”或“不同”)的。换句话说,化学反应的反应热只与反应体系的____和____有关,而与反应的途径无关。
(2)法国化学家勒夏特列总结出一条经验规律:如果改变影响平衡的条件之一(如温度、______、以及参加及应的化学物质的______),平衡将向着能够这种改变的方向移动,这就是著名的勒夏特列原理。
(3)已知NaSO4·10H2ONaSO4·nH2O+(10 n) H2O,将装有芒硝的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将______能转化为______能,晚上将______能转化为______能。
【参考答案】
一、选择题
1.C
解析:A.反应N2O4(g) 2NO2(g) ,反应吸热,所以升高温度,平衡向正反应方向移动,二氧化氮的百分含量增大,四氧化二氮的百分含量减小,对应图像可分析可出,曲线①表示的百分含量,曲线②表示的百分含量,A正确;
B.反应N2O4(g) 2NO2(g) ,反应吸热,又=反应物的键能之和-生成物的键能之和,所以的键能总和大于的键能总和,B正确;
C.若点为反应平衡点,则和的百分含量均为50%,又平衡常数表达式为,但因为没有具体的物质的量,所以无法准确计算平衡常数,C错误;
D.反应达到平衡后,往该容器中充入少量N2O4,相当于增大压强,平衡会向逆反应方向移动,致使N2O4转化率减小,D正确;
故选C。
2.B
解析:A.该反应是气体体积减小,增大容器的容积,压强减小,平衡向逆反应方向进行,COCl2产率降低,故A不符合题意;
B.根据图象,制备光气的反应属于放热反应,降低温度,平衡向正反应方向进行,COCl2产率增大,故B符合题意;
C.分离出CO,减少反应物的浓度,平衡逆向进行,COCl2产率降低,故C不符合题意;
D.等容下,通入惰性气体,组分浓度不变,反应速率不变,平衡不移动,故D不符合题意;
答案为B。
3.C
解析:在容积可变的密闭容器中,2molN2和8molH2在一定条件下反应,达到平衡时,H2的转化率为25%,消耗的氢气为2mol,则:
平衡时氨气的体积分数= ,故选:C。
4.C
解析:A.,根据右边图像的意义看,Keq=直线的斜率,故A正确;
B.Ti12O18}团簇是比较罕见的一个穴醚无机类似物,说明Rb@Ti12O18}团簇属于超分子,故B正确;
C.根据Cs+取代Rb+反应的平衡常数Keq≈10,Ti12O18}团簇对Cs+的亲和力比对Rb+大,则Ti12O18}团簇对K+的亲和力比对Rb+小,故C错误;
D.已知冠醚18-冠-6能识别Rb+而不能识别Cs+,则往体系中加18-冠-6时,则识别出Rb+,平衡正向移动,故D正确。
综上所述,答案为C。
5.C
解析:A.历程II中Cl起催化作用,催化剂降低反应活化能,但焓变不变即E6 E3=E5 E2,故A错误;
B.Cl2(g)的相对能量为0,由图可知Cl(g)的相对能量为(E2 E3) kJ mol 1,断裂化学键吸收热量,Cl2(g)→2Cl(g)吸收能量为2(E2 E3) kJ mol 1,则Cl Cl键能为2(E2 E3) kJ mol 1,故B错误;
C.历程I、历程II中速率最快的一步是活化能最小的一步即,其反应的热化学方程式 ,故C正确;
D.相同条件下,催化剂不改变平衡移动,因此的平衡转化率:历程II=历程I,故D错误。
综上所述,答案为C。
6.C
【解析】化学平衡常数表达式是利用化学平衡状态下的平衡浓度计算,K=。
解析:可逆反应N2(g)+3H2(g)2NH3(g),其平衡常数表达式,C符合题意。
答案选C。
7.B
解析:A.未改变压强,则无法判断该反应大于0还是小于0,A正确;
B.t1时刻,正逆反应速率都减小,且,说明降温时反应向逆反应方向进行,则逆反应为放热反应,正反应为吸热反应, H>0,B错误;
C.由图可知平衡向逆反应方向移动,C正确;
D.对于吸热反应,降低温度,平衡左移、达到新平衡时化学平衡常数减小,D正确;
答案选B。
8.D
解析:A.催化剂只改变反应速率,不能使平衡发生移动,A错误;
B.升高温度平衡向吸热方向移动,但不一定是正向移动,B错误;
C.若该生成物为固体,增加其质量,平衡不移动,C错误;
D.有气体参加的可逆反应,减小体积增大压强,气体物质的浓度变大,反应速率加快,D正确;
综上所述答案为D。
二、非选择题
9. (1)吸(2)气(3)气
解析:(1)因为温度升高,平衡向吸热反应方向移动,根据3A 3B+C,平衡向正反应方向移动,所以正反应是吸热反应;故答案为:吸。
(2)若温度固定,扩大容器的体积,相当于减小压强,减小压强平衡向气体体积增大的方向移动,向逆反应方向移动,则A一定呈气态;故答案为:气。
(3)若A是气态时,加压时,平衡不移动,说明两边气体计量数相等,则B为气态物质,C为非气态物质。故答案为:气。
10. 一 相同 始态 终态 压强 浓度 太阳 化学 化学 热
解析:(1)盖斯定律的内容是:不管化学过程是一步完成或分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,故答案为:一;相同;始态;终态;
(2)勒夏特列原理的内容是:如果改变影响平衡的条件之一(如温度、压强、以及参加及应的化学物质的浓度),平衡将向着能够这种改变的方向移动,故答案为: 压强;浓度;
(3白天发生的反应是NaSO4·10H2ONaSO4·nH2O+(10 n) H2O,将太阳能转化为化学能,晚上发生的反应是NaSO4·nH2O+(10 n) H2ONaSO4·10H2O,将化学能转化为热能,故答案为:太阳;化学;化学;热
