广东省2023-2024学年高二上学期12月学业水平监测化学试题(含答案)
文档属性
| 名称 | 广东省2023-2024学年高二上学期12月学业水平监测化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 629.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 10:39:21 | ||
图片预览


文档简介
广东省2023-2024学年高二上学期12月学业水平监测
化学试卷
(试卷共6页,考试时间为75分钟,满分100分)
可能用到的相对原子质量:H1
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.杭州第19届亚运会采用零碳甲醇()作为主火炬燃料,碳循环过程如图所示。下列说法不正确的是( )
A.甲醇充分燃烧排放清洁产物 B.过程①存在C=O的断裂
C.过程②发生了吸热反应 D.该循环有利于实现碳中和
2.可作火箭推进剂,已知: 。下列说法正确的是( )
A.该反应常温下为自发反应 B.的燃烧热是
C.该反应生成物比反应物总能量高 D.若生成液态水释放的能量减少
3.溶液中存在平衡: 。下列措施能使平衡正向移动的是( )
A.溶液降温 B.加入少量KCl固体
C.加水稀释 D.加入几滴溶液
4.下列劳动项目所涉及的化学原理与水解无关的是( )
A.焊接技术员用溶液除铁锈 B.环保工人用明矾净水
C.环保工程师用溶液吸收 D.厨师用热的纯碱除油污
5.下列物质溶于水,因水解而呈碱性的是( )
A. B. C. D.
6.密闭容器中通入CO和NO,发生反应: ,达到平衡。下列说法正确的是( )
A.升高温度,减慢
B.分离,加快
C.使用催化剂,NO的平衡转化率增大
D.增大容器体积,CO的平衡转化率减小
7.0.1mol/L的氨水中,关于电离平衡的说法不正确的是( )
A.电离方程式:
B.加入NaOH固体,电离平衡逆向移动
C.加水稀释,电离平衡正向移动
D.加热溶液,减小
8.HR为一种弱酸,常温下,用0.10mol/LNaOH标准溶液滴定一定体积未知浓度的HR酸溶液。下列说法正确的是( )
A.装NaOH标准液时,用右图所示方法排除滴定管内的气泡
B.滴定过程中,眼睛一直注视滴定管内液面变化
C.若用酚酞做指示剂,终点时溶液红色恰好褪去
D.滴定终点时混合溶液的pH=7
9.下列实验设计不能达到目的的是( )
实验设计
实验目的 A.探究压强对化学平衡的影响 B.测定中和反应的反应热 C.测定稀硫酸与铁屑反应速率 D.探究温度对化学反应速率的影响
10.下列方程式书写不正确的是( )
A.燃烧的热化学方程式:
B.的电离:
C.的水解:
D.稀与稀NaOH溶液反应的热化学方程式:
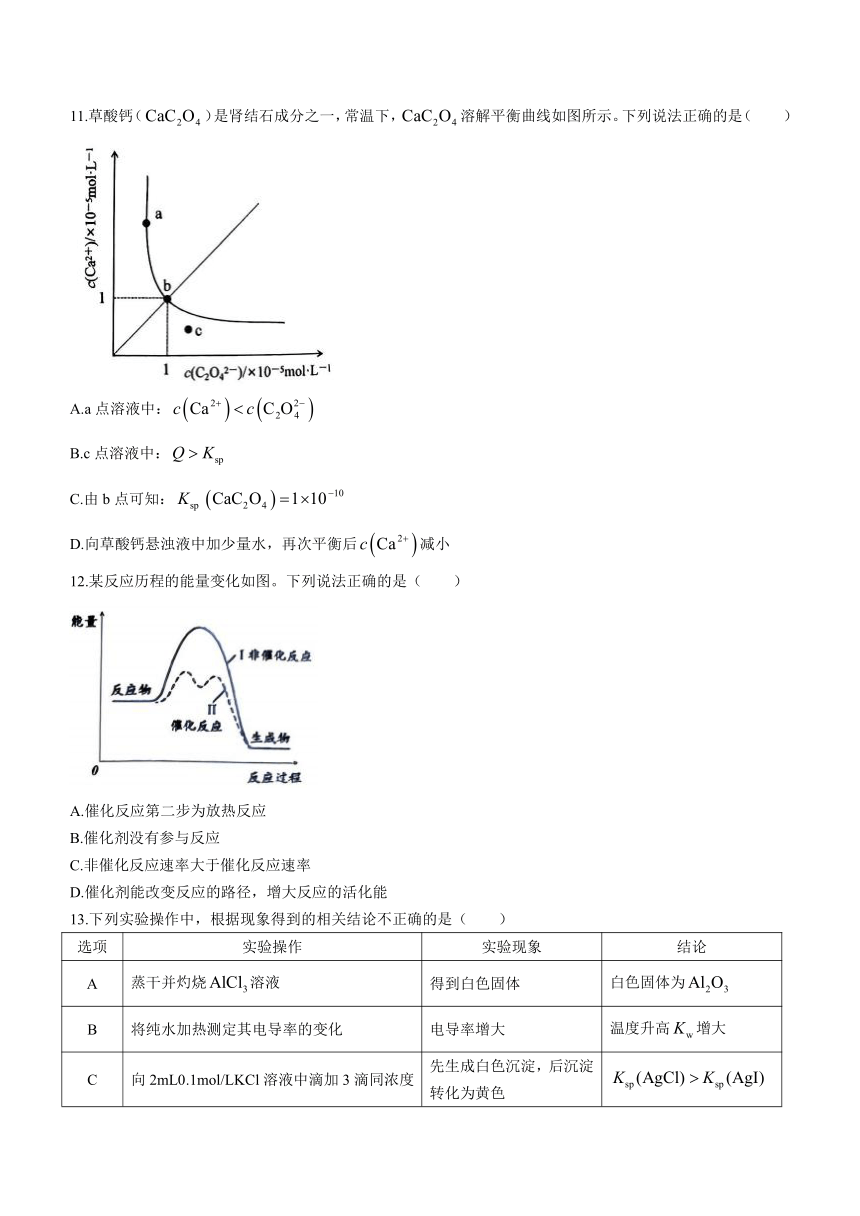
11.草酸钙()是肾结石成分之一,常温下,溶解平衡曲线如图所示。下列说法正确的是( )
A.a点溶液中:
B.c点溶液中:
C.由b点可知:
D.向草酸钙悬浊液中加少量水,再次平衡后减小
12.某反应历程的能量变化如图。下列说法正确的是( )
A.催化反应第二步为放热反应
B.催化剂没有参与反应
C.非催化反应速率大于催化反应速率
D.催化剂能改变反应的路径,增大反应的活化能
13.下列实验操作中,根据现象得到的相关结论不正确的是( )
选项 实验操作 实验现象 结论
A 蒸干并灼烧溶液 得到白色固体 白色固体为
B 将纯水加热测定其电导率的变化 电导率增大 温度升高增大
C 向2mL0.1mol/LKCl溶液中滴加3滴同浓度的溶液,然后再加入3滴同浓度的KI溶液。 先生成白色沉淀,后沉淀转化为黄色
D 分别将1mLpH=3的HA和HB溶液加水稀释至100mL,测溶液pH 酸性:HA<HB
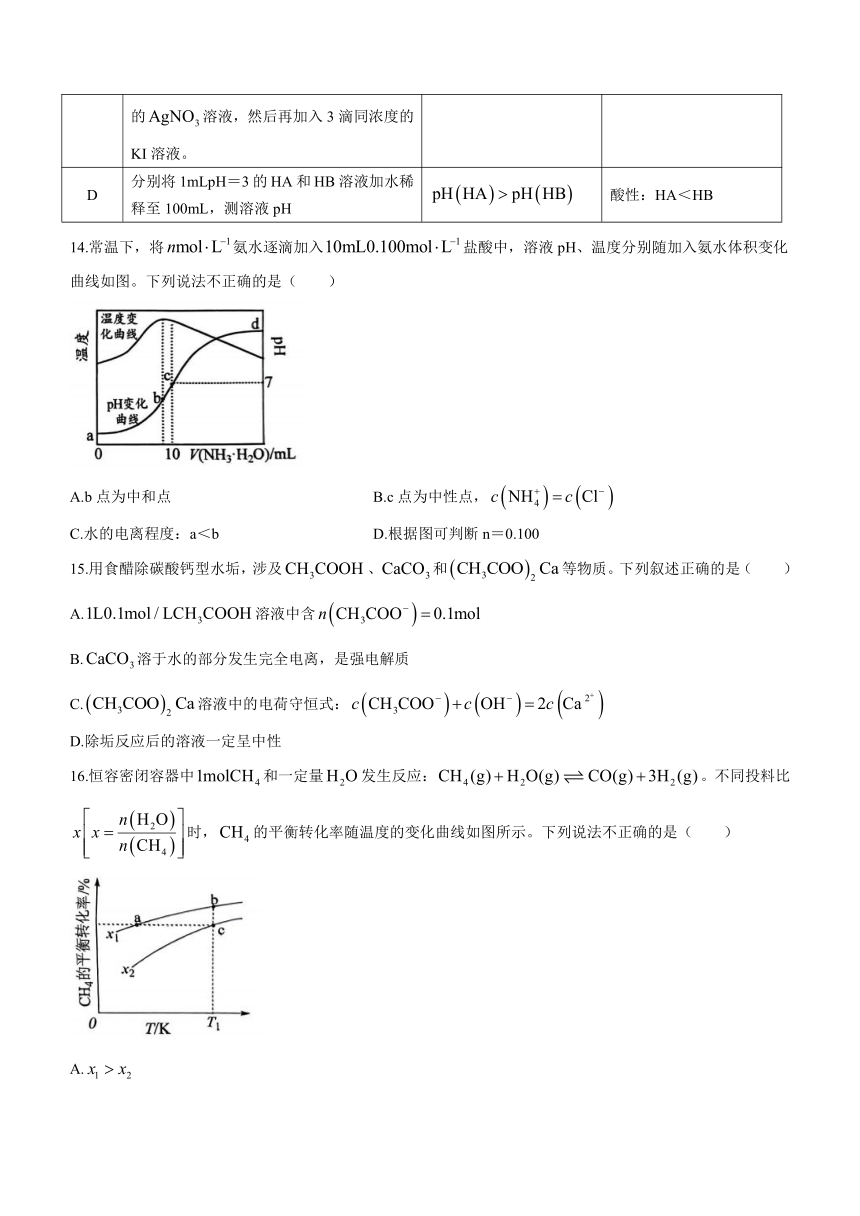
14.常温下,将氨水逐滴加入盐酸中,溶液pH、温度分别随加入氨水体积变化曲线如图。下列说法不正确的是( )
A.b点为中和点 B.c点为中性点,
C.水的电离程度:a<b D.根据图可判断n=0.100
15.用食醋除碳酸钙型水垢,涉及、和等物质。下列叙述正确的是( )
A.溶液中含
B.溶于水的部分发生完全电离,是强电解质
C.溶液中的电荷守恒式:
D.除垢反应后的溶液一定呈中性
16.恒容密闭容器中和一定量发生反应:。不同投料比时,的平衡转化率随温度的变化曲线如图所示。下列说法不正确的是( )
A.
B.反应速率:
C.b、c对应的平衡常数:
D.温度为,容器内压强不变时,反应达到平衡状态
二、非选择题:本题共4题,共56分。
17.(14分)过氧化氢()是一种用途广泛的工业原料。回答下列问题:
(1)已知:反应①
反应②
则的________kJ/mol;不同温度下分解反应的平衡常数_________(填“>”、“<”或“=”)。
(2)是一种极弱的酸,在水中电离的示意图如下:
编号 温度/℃
i 25 10.0 0 10.0
ii 25 15.0 a b
iii 25 10.0 2.0 c
iv 60 d 0 10.0
①实验i和ii探究浓度对反应速率的影响,则a=_________,b=_________。
②实验_________(填编号)探究催化剂对速率的影响,能说明催化剂加快反应速率的实验记录是_________。
③温度越高反应速率越快,用碰撞理论解释正确的是_________。
A.单位体积内活化分子数增多 B.活化分子百分数不变
C.单位体积内有效碰撞的次数增大 D.改变了反应的路径
④实验i中几乎没有收集到气体,可能原因是_________。
(4)写出在生活中的一种用途_________。
18.(14分)锂是一种重要的战略性金属,从废旧磷酸铁锂正极材料(含石墨、Al、等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
已知:①;②。
(1)粉碎研磨废旧电池正极材料的目的是_________。
(2)完全浸出时发生主要反应的化学方程式:
___________________________;
浸出时Al与酸作用的离子方程式为_________。
(3)滤泥中主要成分为_________(填化学式)。
(4)当恰好完全沉淀(浓度等于)时,净化液中_________,此时溶液pH=_________。
(5)沉锂后母液中可回收利用的主要物质为_________(填名称)。
(6)已知磷酸()为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因_________。
19.(14分)工业合成氨对提高农业生产意义重大。回答下列问题:
(1)“哈伯—博施法”合成氨反应的能量变化如图1,合成氨的热化学方程式为_________(用含和的代数式表示)。
(2)10L密闭容器中充入和,一定条件下反应,10min末,的浓度为,则0~10min时间内的平均反应速率为_________。此时,将容器体积压缩为5L,则达到平衡后,_________(填“>”“<”或“=”),平衡常数K_________(填“增大”“减小”或“不变”)。
(3)工业合成氨控制压强范围为10~30MPa,压强太低则_________(结合速率平衡作答),压强太高对设备要求高
图1 图2
(4)反应物在铁催化剂表面上合成氨的反应历程可简化为图2所示,吸附在铁催化剂表面上的物种用*标注。
①该历程中能垒________eV(用含a和b的代数式表示),写出该历程的化学方程式________。
②铁催化合成氨时,铁表面吸附的速率比快得多,则________(填“”或“”)的吸附速率决定了合成氨的整体反应速率。
③下列关于合成氨实际生产的说法正确的是________。
A.选择400-500℃是因该温度下氨的平衡产率最高
B.将含和的原料气循环使用可以提高原料的转化率
C.常采用1:2.8而不是1:3,原因是适度过量可加快吸附速率
D.催化剂活性位点若被杂质气体占据,会导致和的反应速率变快
20.(14分)R是一种亲氯有机物,属于非电解质,易溶于水,在含的溶液中能发生反应:
反应Ⅰ:;反应Ⅱ:
回答下列问题:
(1)写出反应Ⅰ平衡常数的表达式________。
(2)常温下,向R溶液中加入适量NaCl,下列情况能说明反应Ⅰ和反应Ⅱ已达到平衡状态的是________(填序号)
A.溶液中
B.容器中生成一个R分子的同时产生一个
C.溶液中不再发生变化
D.R的消耗速率等于生成速率
(3)某学习小组想研究氯水与R的反应。向水中通入得到1L氯水(设无逸出)。
①写出与反应的离子方程式________。
②用pH计连续监测发现,新制氯水pH缓慢变小,原因是________。
③实验测得该氯水的pH=4,计算溶液中为多少?(注:写出计算过程,忽略水和HClO的电离,忽略HClO的分解)
(4)①向氯水中加入R,会________(填“变大”或“变小”)
②室温下,向初始浓度的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种随的数据记录如下表(b和d代表数字,忽略溶液体积变化):
0 0.25 0.50 0.75 1.00
1.00 0.79 0.64 0.54 0.46
0 0.09 0.16 0.22 0.28
0 0.06 b d 0.13
根据表中数据分析d=________。
广东省2023-2024学年高二上学期12月学业水平监测
化学参考答案评分细则
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分:第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8
C A B C A D D A
9 10 11 12 13 14 15 16
B B C A D D B C
二、非选择题:本题共4小题,共56分。
17.(14分)
题号 参考答案 评分标准 备注
(1) -196 1分 唯一答案
< 1分 唯一答案
(2) 或 2分 “=、→”给1分 “、”给1分
(3) ①0 5.0 各1分,共2分 5给1分
②i和iii 1分 唯一答案
在相同的反应时间内收集到气体的体积 2分 提及给2分
③AC 2分 ABC、ACD、A、C等答案给1分
④常温下分解速率很慢;装置漏气或其它合理答案均可得分 2分 活化能高;氧气溶于水;浓度低、温度低,速率慢等均可给2分
(4) 伤口消毒 1分 其他参考作用:杀菌抗菌、漂白剂、除臭剂、面膜、防腐剂、清洁剂等
18.(14分)
题号 参考答案 评分标准 备注
(1) 增大固液接触面积,加快浸出反应速率,提高浸出率。 1分 答到任意一点给1分。
(2) 2 各1分,共3分 物质与系数均正确,给1分。 系数不对不得分。 三个物质都写对,给1分。
物质正确给1分; 配平、条件合计给1分; 写成化学方程式全对给1分。
(3) 2分 写氢氧化铝得1分; 只写给2分; 填写和给1分。
(4) 1分 也给1分,单位不作扣分点。
4.7 1分 、等合理答案也给1分。
(5) 氧化钠 2分 写出NaCl给1分。
(6) 随着盐酸用量的增多,浸出液中增大,发生反应,从而导致平衡:右移,溶液中Fe、P元素含量增加。 2分 提到“反应”等类似表达给1分, 提到“反应减少,平衡:右移”等类似表达给1分。
19.(14分)
题号 参考答案 评分标准 备注
(1) 2分 方程式1分,1分。 ①、也给分 ②写单位不做扣分点。
(2) 0.0225 2分 唯一答案。
<(1分),不变(1分) 2 唯一答案。
(3) 反应速率太慢, 平衡转化率太小(或产率低) 2分 速率1分,平衡1分。
(4) ① 1分 、给1分。
2分 也得分;没写“*”扣1分。“→”表达不做扣分点。
② 1分 唯一答案。
③ BC 2分 ABC、BCD、B、C给1分。
20.(14分)
题号 参考答案 评分标准 备注
(1) 2分 唯一答案
(2) CD 2分 ACD、BCD、C、D给1分。
(3) 2分 全对2分,可逆符号写成等号扣1分,其他0分
HClO不稳定,分解为HCl,促进平衡正向移动 2分 分开给分,提到HClO不稳定,分解为HCl给2分 答到HClO分解使平衡正向移动相似表达给2分
根据题意,过程1 溶液中 过程2 mol/L 始 0.0010 0 转 0.00010 0.00010 终 0.00090 0.00010 过程3 即 3分 提到给1分,计算出的给2分(含计算过程),不写过程直接给给1分。其他解题过程酌情给分,不要求有效数字,单位不作扣分点。
(4) 变小 1分 唯一答案
0.12 2分 唯一答案
化学试卷
(试卷共6页,考试时间为75分钟,满分100分)
可能用到的相对原子质量:H1
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.杭州第19届亚运会采用零碳甲醇()作为主火炬燃料,碳循环过程如图所示。下列说法不正确的是( )
A.甲醇充分燃烧排放清洁产物 B.过程①存在C=O的断裂
C.过程②发生了吸热反应 D.该循环有利于实现碳中和
2.可作火箭推进剂,已知: 。下列说法正确的是( )
A.该反应常温下为自发反应 B.的燃烧热是
C.该反应生成物比反应物总能量高 D.若生成液态水释放的能量减少
3.溶液中存在平衡: 。下列措施能使平衡正向移动的是( )
A.溶液降温 B.加入少量KCl固体
C.加水稀释 D.加入几滴溶液
4.下列劳动项目所涉及的化学原理与水解无关的是( )
A.焊接技术员用溶液除铁锈 B.环保工人用明矾净水
C.环保工程师用溶液吸收 D.厨师用热的纯碱除油污
5.下列物质溶于水,因水解而呈碱性的是( )
A. B. C. D.
6.密闭容器中通入CO和NO,发生反应: ,达到平衡。下列说法正确的是( )
A.升高温度,减慢
B.分离,加快
C.使用催化剂,NO的平衡转化率增大
D.增大容器体积,CO的平衡转化率减小
7.0.1mol/L的氨水中,关于电离平衡的说法不正确的是( )
A.电离方程式:
B.加入NaOH固体,电离平衡逆向移动
C.加水稀释,电离平衡正向移动
D.加热溶液,减小
8.HR为一种弱酸,常温下,用0.10mol/LNaOH标准溶液滴定一定体积未知浓度的HR酸溶液。下列说法正确的是( )
A.装NaOH标准液时,用右图所示方法排除滴定管内的气泡
B.滴定过程中,眼睛一直注视滴定管内液面变化
C.若用酚酞做指示剂,终点时溶液红色恰好褪去
D.滴定终点时混合溶液的pH=7
9.下列实验设计不能达到目的的是( )
实验设计
实验目的 A.探究压强对化学平衡的影响 B.测定中和反应的反应热 C.测定稀硫酸与铁屑反应速率 D.探究温度对化学反应速率的影响
10.下列方程式书写不正确的是( )
A.燃烧的热化学方程式:
B.的电离:
C.的水解:
D.稀与稀NaOH溶液反应的热化学方程式:
11.草酸钙()是肾结石成分之一,常温下,溶解平衡曲线如图所示。下列说法正确的是( )
A.a点溶液中:
B.c点溶液中:
C.由b点可知:
D.向草酸钙悬浊液中加少量水,再次平衡后减小
12.某反应历程的能量变化如图。下列说法正确的是( )
A.催化反应第二步为放热反应
B.催化剂没有参与反应
C.非催化反应速率大于催化反应速率
D.催化剂能改变反应的路径,增大反应的活化能
13.下列实验操作中,根据现象得到的相关结论不正确的是( )
选项 实验操作 实验现象 结论
A 蒸干并灼烧溶液 得到白色固体 白色固体为
B 将纯水加热测定其电导率的变化 电导率增大 温度升高增大
C 向2mL0.1mol/LKCl溶液中滴加3滴同浓度的溶液,然后再加入3滴同浓度的KI溶液。 先生成白色沉淀,后沉淀转化为黄色
D 分别将1mLpH=3的HA和HB溶液加水稀释至100mL,测溶液pH 酸性:HA<HB
14.常温下,将氨水逐滴加入盐酸中,溶液pH、温度分别随加入氨水体积变化曲线如图。下列说法不正确的是( )
A.b点为中和点 B.c点为中性点,
C.水的电离程度:a<b D.根据图可判断n=0.100
15.用食醋除碳酸钙型水垢,涉及、和等物质。下列叙述正确的是( )
A.溶液中含
B.溶于水的部分发生完全电离,是强电解质
C.溶液中的电荷守恒式:
D.除垢反应后的溶液一定呈中性
16.恒容密闭容器中和一定量发生反应:。不同投料比时,的平衡转化率随温度的变化曲线如图所示。下列说法不正确的是( )
A.
B.反应速率:
C.b、c对应的平衡常数:
D.温度为,容器内压强不变时,反应达到平衡状态
二、非选择题:本题共4题,共56分。
17.(14分)过氧化氢()是一种用途广泛的工业原料。回答下列问题:
(1)已知:反应①
反应②
则的________kJ/mol;不同温度下分解反应的平衡常数_________(填“>”、“<”或“=”)。
(2)是一种极弱的酸,在水中电离的示意图如下:
编号 温度/℃
i 25 10.0 0 10.0
ii 25 15.0 a b
iii 25 10.0 2.0 c
iv 60 d 0 10.0
①实验i和ii探究浓度对反应速率的影响,则a=_________,b=_________。
②实验_________(填编号)探究催化剂对速率的影响,能说明催化剂加快反应速率的实验记录是_________。
③温度越高反应速率越快,用碰撞理论解释正确的是_________。
A.单位体积内活化分子数增多 B.活化分子百分数不变
C.单位体积内有效碰撞的次数增大 D.改变了反应的路径
④实验i中几乎没有收集到气体,可能原因是_________。
(4)写出在生活中的一种用途_________。
18.(14分)锂是一种重要的战略性金属,从废旧磷酸铁锂正极材料(含石墨、Al、等,还有少量不溶性杂质)中浸取锂的工艺流程如下:
已知:①;②。
(1)粉碎研磨废旧电池正极材料的目的是_________。
(2)完全浸出时发生主要反应的化学方程式:
___________________________;
浸出时Al与酸作用的离子方程式为_________。
(3)滤泥中主要成分为_________(填化学式)。
(4)当恰好完全沉淀(浓度等于)时,净化液中_________,此时溶液pH=_________。
(5)沉锂后母液中可回收利用的主要物质为_________(填名称)。
(6)已知磷酸()为三元弱酸,“浸出”时,盐酸用量对各元素的浸出率影响如图,当盐酸用量超过1.0倍后,Fe、P元素浸出率随盐酸用量增多而增大,用平衡移动原理解释可能的原因_________。
19.(14分)工业合成氨对提高农业生产意义重大。回答下列问题:
(1)“哈伯—博施法”合成氨反应的能量变化如图1,合成氨的热化学方程式为_________(用含和的代数式表示)。
(2)10L密闭容器中充入和,一定条件下反应,10min末,的浓度为,则0~10min时间内的平均反应速率为_________。此时,将容器体积压缩为5L,则达到平衡后,_________(填“>”“<”或“=”),平衡常数K_________(填“增大”“减小”或“不变”)。
(3)工业合成氨控制压强范围为10~30MPa,压强太低则_________(结合速率平衡作答),压强太高对设备要求高
图1 图2
(4)反应物在铁催化剂表面上合成氨的反应历程可简化为图2所示,吸附在铁催化剂表面上的物种用*标注。
①该历程中能垒________eV(用含a和b的代数式表示),写出该历程的化学方程式________。
②铁催化合成氨时,铁表面吸附的速率比快得多,则________(填“”或“”)的吸附速率决定了合成氨的整体反应速率。
③下列关于合成氨实际生产的说法正确的是________。
A.选择400-500℃是因该温度下氨的平衡产率最高
B.将含和的原料气循环使用可以提高原料的转化率
C.常采用1:2.8而不是1:3,原因是适度过量可加快吸附速率
D.催化剂活性位点若被杂质气体占据,会导致和的反应速率变快
20.(14分)R是一种亲氯有机物,属于非电解质,易溶于水,在含的溶液中能发生反应:
反应Ⅰ:;反应Ⅱ:
回答下列问题:
(1)写出反应Ⅰ平衡常数的表达式________。
(2)常温下,向R溶液中加入适量NaCl,下列情况能说明反应Ⅰ和反应Ⅱ已达到平衡状态的是________(填序号)
A.溶液中
B.容器中生成一个R分子的同时产生一个
C.溶液中不再发生变化
D.R的消耗速率等于生成速率
(3)某学习小组想研究氯水与R的反应。向水中通入得到1L氯水(设无逸出)。
①写出与反应的离子方程式________。
②用pH计连续监测发现,新制氯水pH缓慢变小,原因是________。
③实验测得该氯水的pH=4,计算溶液中为多少?(注:写出计算过程,忽略水和HClO的电离,忽略HClO的分解)
(4)①向氯水中加入R,会________(填“变大”或“变小”)
②室温下,向初始浓度的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种随的数据记录如下表(b和d代表数字,忽略溶液体积变化):
0 0.25 0.50 0.75 1.00
1.00 0.79 0.64 0.54 0.46
0 0.09 0.16 0.22 0.28
0 0.06 b d 0.13
根据表中数据分析d=________。
广东省2023-2024学年高二上学期12月学业水平监测
化学参考答案评分细则
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分:第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8
C A B C A D D A
9 10 11 12 13 14 15 16
B B C A D D B C
二、非选择题:本题共4小题,共56分。
17.(14分)
题号 参考答案 评分标准 备注
(1) -196 1分 唯一答案
< 1分 唯一答案
(2) 或 2分 “=、→”给1分 “、”给1分
(3) ①0 5.0 各1分,共2分 5给1分
②i和iii 1分 唯一答案
在相同的反应时间内收集到气体的体积 2分 提及给2分
③AC 2分 ABC、ACD、A、C等答案给1分
④常温下分解速率很慢;装置漏气或其它合理答案均可得分 2分 活化能高;氧气溶于水;浓度低、温度低,速率慢等均可给2分
(4) 伤口消毒 1分 其他参考作用:杀菌抗菌、漂白剂、除臭剂、面膜、防腐剂、清洁剂等
18.(14分)
题号 参考答案 评分标准 备注
(1) 增大固液接触面积,加快浸出反应速率,提高浸出率。 1分 答到任意一点给1分。
(2) 2 各1分,共3分 物质与系数均正确,给1分。 系数不对不得分。 三个物质都写对,给1分。
物质正确给1分; 配平、条件合计给1分; 写成化学方程式全对给1分。
(3) 2分 写氢氧化铝得1分; 只写给2分; 填写和给1分。
(4) 1分 也给1分,单位不作扣分点。
4.7 1分 、等合理答案也给1分。
(5) 氧化钠 2分 写出NaCl给1分。
(6) 随着盐酸用量的增多,浸出液中增大,发生反应,从而导致平衡:右移,溶液中Fe、P元素含量增加。 2分 提到“反应”等类似表达给1分, 提到“反应减少,平衡:右移”等类似表达给1分。
19.(14分)
题号 参考答案 评分标准 备注
(1) 2分 方程式1分,1分。 ①、也给分 ②写单位不做扣分点。
(2) 0.0225 2分 唯一答案。
<(1分),不变(1分) 2 唯一答案。
(3) 反应速率太慢, 平衡转化率太小(或产率低) 2分 速率1分,平衡1分。
(4) ① 1分 、给1分。
2分 也得分;没写“*”扣1分。“→”表达不做扣分点。
② 1分 唯一答案。
③ BC 2分 ABC、BCD、B、C给1分。
20.(14分)
题号 参考答案 评分标准 备注
(1) 2分 唯一答案
(2) CD 2分 ACD、BCD、C、D给1分。
(3) 2分 全对2分,可逆符号写成等号扣1分,其他0分
HClO不稳定,分解为HCl,促进平衡正向移动 2分 分开给分,提到HClO不稳定,分解为HCl给2分 答到HClO分解使平衡正向移动相似表达给2分
根据题意,过程1 溶液中 过程2 mol/L 始 0.0010 0 转 0.00010 0.00010 终 0.00090 0.00010 过程3 即 3分 提到给1分,计算出的给2分(含计算过程),不写过程直接给给1分。其他解题过程酌情给分,不要求有效数字,单位不作扣分点。
(4) 变小 1分 唯一答案
0.12 2分 唯一答案
同课章节目录
