4.2.1电解池 课件 (共24张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.1电解池 课件 (共24张PPT)2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 12:11:12 | ||
图片预览






文档简介
(共24张PPT)
电解池(第一课时)
学 科:化 学
年 级:高 二
【问题1】我们可以通过什么方法实现水的分解呢?
ΔH =+285.8 kJ·mol-1
生成物 H2(g)+1/2O2(g)
【资料】水常温下很难分解。即使在2 500 K 高温下,分解率也不足25%。
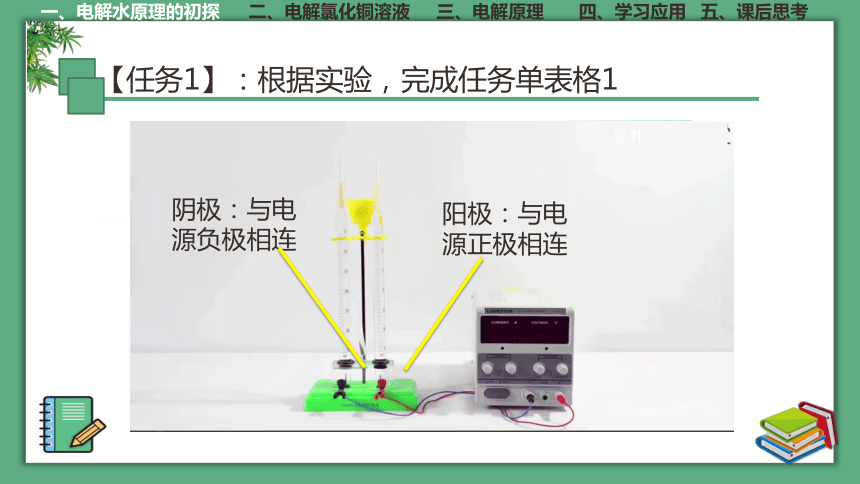
【任务1】:根据实验,完成任务单表格1
资料
阴极:与电源负极相连
阳极:与电源正极相连
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
表格1
实验现象 实验结论
阴极上生成气体体积 20 mL 阳极上生成气体体积为10 mL 阴阳两极气体体积比为 2:1
阳极上生成的气体能使带火星的木条复燃 阳极产生了氧气
阴极上生成的气体能点燃 阴极产生了氢气
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
【问题2】水是如何电解的?它的微观过程是什么?
【方法引导】
1.纯水中有哪些微粒?这些微粒是怎样产生的?
2.纯水中的微粒如何运动?
3.接通电源后,微粒又是怎样运动的?
4.接通电源后,微粒如何发生变化?
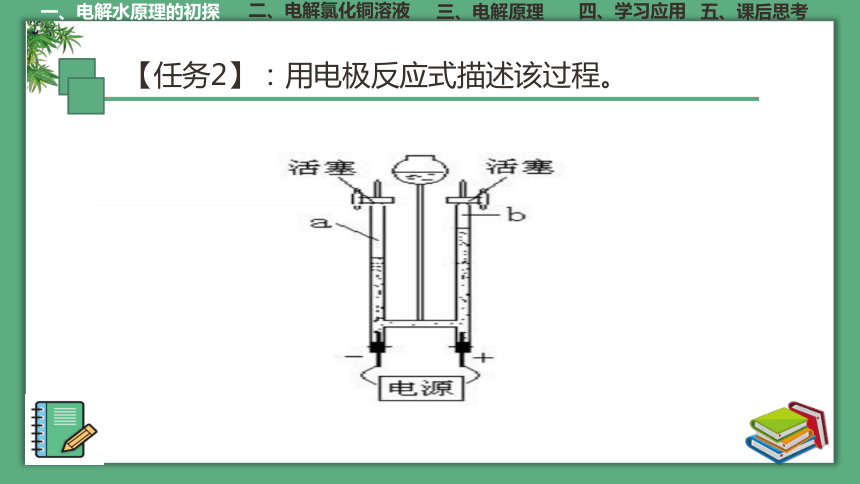
H2O H++OH-
自由移动
定向移动,阳离子移向阴极;阴离子移向阳极
H+得电子,发生还原反应;OH-失电子,发生氧化反应
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
【任务2】:用电极反应式描述该过程。
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
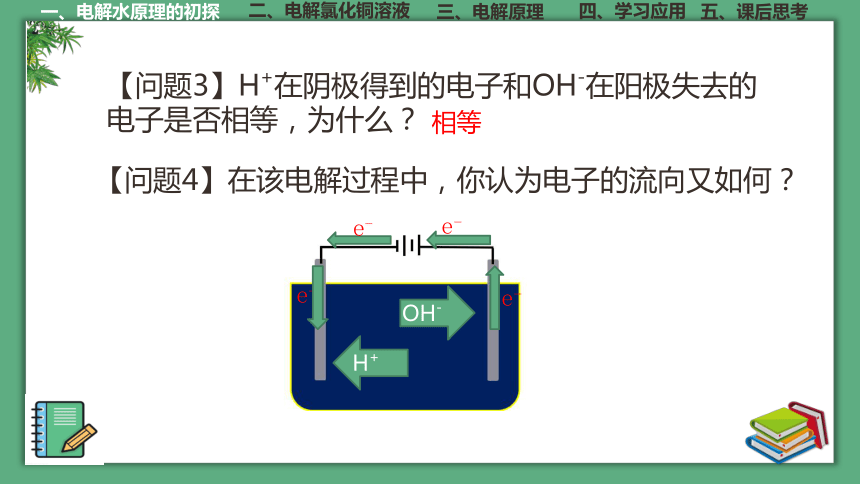
【问题3】H+在阴极得到的电子和OH-在阳极失去的电子是否相等,为什么?
【问题4】在该电解过程中,你认为电子的流向又如何?
e-
e-
H+
OH-
e-
e-
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
相等
五、课后思考
【科学史话】
电解水的成功,使人们意识到电可以用于化学研究。
英国化学家戴维在思考:电可以分解水,那么对于盐溶液又将产生什么作用呢?
戴维(英国1778-1829)
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
1.电解CuCl2溶液的实验探究
【方法引导】
2.CuCl2溶液中的微粒如何运动?
3.接通电源后,微粒又是怎样运动的?
4.接通电源后,微粒如何发生变化?
1.CuCl2溶液中有哪些微粒?这些微粒是怎样产生的?
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务3】大胆猜想,完成任务单表格2
在阴阳两极上可能会出现什么现象?
两极上析出或逸出的产物可能是什么?
阴极 阳极
电极现象
电极产物
表格2
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
1.电解CuCl2溶液的实验探究
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
1.电解CuCl2溶液的实验探究
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务4】实验探究,完成表格3
表格3
阴极 阳极
电极现象
电极产物
电极反应
反应类型
有红色物质析出,无气泡产生。
有气泡产生,该气体可使湿润的淀粉碘化钾试纸变蓝。
Cu
Cl2
Cu2++2e-=Cu
2Cl--2e-=Cl2↑
还原反应
氧化反应
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【问题5】在阴极为什么不是H+被还原,在阳极为什么不是OH-被氧化呢?
放电:阴离子得电子发生还原反应或阳离子失电子发生氧化反应的过程。
阴极:氧化性强的先放电。
阳极:还原性强的先放电。
Cl- > OH-
> 含氧酸根
Cu2+ > H+
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务4】实验探究,完成表格3
阴极 阳极
电极现象
电极产物
电极反应
反应类型
总反应 表格3
有红色物质析出,无气泡产生。
有气泡产生,该气体可使湿润的淀粉碘化钾试纸变蓝。
Cu
Cl2
Cu2++2e-=Cu
2Cl--2e-=Cl2↑
还原反应
氧化反应
CuCl2 Cu + Cl2↑
电解
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【归纳整理】
电解:使电流通过电解质溶液(或熔融电解质)而在 阳极、阴极引起氧化还原反应的过程。
【形成电解池的条件】
1.电源
2.电解质溶液
3.两个电极
4.形成闭合的回路
电解池:将电能转化为化学能的装置。
(作用:提供电能)
(作用:做离子导体)
(作用:得失电子的场所)
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【 思考与讨论】
请结合图4-10Ⅱ绘制反映电解池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明电解池的组成;
(2)表明氧化反应和还原反应发生的区域;
(3)表明电子的运动方向和阴离子、阳离子的迁移方向。
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【思维拔高】
原理维度
现象
过程
电极反应物
电极产物
失电子场所(阳极材料)
电子导体(导线)
离子导体(电解质)
得电子场所(阴极材料)
还原剂
失e-
氧化产物
氧化剂
得e-
还原产物
装置维度
阴离子
阳离子
-
+
e-
e-
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务5】结合上述分析过程,总结分析电解池问题的一般思路
电解池分析思路
确定微粒种类及移动方向
根据放电顺序确定放电微粒
写出电极反应式和总反应
2-
4
阴极:阳离子的放电顺序:Ag+ > Cu2+ > H+ > Na+
阳极:阴离子的放电顺序:Cl-> OH-> SO
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【学习应用】
五、课后思考
1.下列有关电解的叙述中错误的是( )
A.与电源正极相连的是阳极
B.与电源负极相连的是阴极
C.在阴极上发生氧化反应
D.阴离子向阳极方向迁移
C
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【学习应用】
五、课后思考
2.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变
C
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【课后思考】
某同学在做电解水的实验时发现两极产生气泡的速率特别缓慢,你能否在不改变两电极产物的情况下,加入某种物质使其加快电解速率?
五、课后思考
感谢聆听
谢谢
电解池(第一课时)
学 科:化 学
年 级:高 二
【问题1】我们可以通过什么方法实现水的分解呢?
ΔH =+285.8 kJ·mol-1
生成物 H2(g)+1/2O2(g)
【资料】水常温下很难分解。即使在2 500 K 高温下,分解率也不足25%。
【任务1】:根据实验,完成任务单表格1
资料
阴极:与电源负极相连
阳极:与电源正极相连
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
表格1
实验现象 实验结论
阴极上生成气体体积 20 mL 阳极上生成气体体积为10 mL 阴阳两极气体体积比为 2:1
阳极上生成的气体能使带火星的木条复燃 阳极产生了氧气
阴极上生成的气体能点燃 阴极产生了氢气
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
【问题2】水是如何电解的?它的微观过程是什么?
【方法引导】
1.纯水中有哪些微粒?这些微粒是怎样产生的?
2.纯水中的微粒如何运动?
3.接通电源后,微粒又是怎样运动的?
4.接通电源后,微粒如何发生变化?
H2O H++OH-
自由移动
定向移动,阳离子移向阴极;阴离子移向阳极
H+得电子,发生还原反应;OH-失电子,发生氧化反应
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
【任务2】:用电极反应式描述该过程。
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
【问题3】H+在阴极得到的电子和OH-在阳极失去的电子是否相等,为什么?
【问题4】在该电解过程中,你认为电子的流向又如何?
e-
e-
H+
OH-
e-
e-
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
相等
五、课后思考
【科学史话】
电解水的成功,使人们意识到电可以用于化学研究。
英国化学家戴维在思考:电可以分解水,那么对于盐溶液又将产生什么作用呢?
戴维(英国1778-1829)
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
1.电解CuCl2溶液的实验探究
【方法引导】
2.CuCl2溶液中的微粒如何运动?
3.接通电源后,微粒又是怎样运动的?
4.接通电源后,微粒如何发生变化?
1.CuCl2溶液中有哪些微粒?这些微粒是怎样产生的?
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务3】大胆猜想,完成任务单表格2
在阴阳两极上可能会出现什么现象?
两极上析出或逸出的产物可能是什么?
阴极 阳极
电极现象
电极产物
表格2
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
1.电解CuCl2溶液的实验探究
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
五、课后思考
1.电解CuCl2溶液的实验探究
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务4】实验探究,完成表格3
表格3
阴极 阳极
电极现象
电极产物
电极反应
反应类型
有红色物质析出,无气泡产生。
有气泡产生,该气体可使湿润的淀粉碘化钾试纸变蓝。
Cu
Cl2
Cu2++2e-=Cu
2Cl--2e-=Cl2↑
还原反应
氧化反应
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【问题5】在阴极为什么不是H+被还原,在阳极为什么不是OH-被氧化呢?
放电:阴离子得电子发生还原反应或阳离子失电子发生氧化反应的过程。
阴极:氧化性强的先放电。
阳极:还原性强的先放电。
Cl- > OH-
> 含氧酸根
Cu2+ > H+
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务4】实验探究,完成表格3
阴极 阳极
电极现象
电极产物
电极反应
反应类型
总反应 表格3
有红色物质析出,无气泡产生。
有气泡产生,该气体可使湿润的淀粉碘化钾试纸变蓝。
Cu
Cl2
Cu2++2e-=Cu
2Cl--2e-=Cl2↑
还原反应
氧化反应
CuCl2 Cu + Cl2↑
电解
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【归纳整理】
电解:使电流通过电解质溶液(或熔融电解质)而在 阳极、阴极引起氧化还原反应的过程。
【形成电解池的条件】
1.电源
2.电解质溶液
3.两个电极
4.形成闭合的回路
电解池:将电能转化为化学能的装置。
(作用:提供电能)
(作用:做离子导体)
(作用:得失电子的场所)
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【 思考与讨论】
请结合图4-10Ⅱ绘制反映电解池工作原理的示意图,并与同学交流。示意图要求包括以下内容:
(1)注明电解池的组成;
(2)表明氧化反应和还原反应发生的区域;
(3)表明电子的运动方向和阴离子、阳离子的迁移方向。
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【思维拔高】
原理维度
现象
过程
电极反应物
电极产物
失电子场所(阳极材料)
电子导体(导线)
离子导体(电解质)
得电子场所(阴极材料)
还原剂
失e-
氧化产物
氧化剂
得e-
还原产物
装置维度
阴离子
阳离子
-
+
e-
e-
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【任务5】结合上述分析过程,总结分析电解池问题的一般思路
电解池分析思路
确定微粒种类及移动方向
根据放电顺序确定放电微粒
写出电极反应式和总反应
2-
4
阴极:阳离子的放电顺序:Ag+ > Cu2+ > H+ > Na+
阳极:阴离子的放电顺序:Cl-> OH-> SO
五、课后思考
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【学习应用】
五、课后思考
1.下列有关电解的叙述中错误的是( )
A.与电源正极相连的是阳极
B.与电源负极相连的是阴极
C.在阴极上发生氧化反应
D.阴离子向阳极方向迁移
C
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【学习应用】
五、课后思考
2.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
A.a为负极,b为正极B.a为阳极,b为阴极C.电解过程中,d电极质量增加D.电解过程中,氯离子浓度不变
C
一、电解水原理的初探
二、电解氯化铜溶液
三、电解原理
四、学习应用
【课后思考】
某同学在做电解水的实验时发现两极产生气泡的速率特别缓慢,你能否在不改变两电极产物的情况下,加入某种物质使其加快电解速率?
五、课后思考
感谢聆听
谢谢
