3.1水与水溶液 同步练习题(含解析) 2023-2024学年高二上学期鲁科版(2019)化学选择性必修1
文档属性
| 名称 | 3.1水与水溶液 同步练习题(含解析) 2023-2024学年高二上学期鲁科版(2019)化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 604.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-10 12:43:39 | ||
图片预览



文档简介
3.1水与水溶液 同步练习题
一、选择题
1.某温度下,向c(OH-)=10-6 mol/L的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=0.001 mol/L。已知:NaHSO4在水中的电离方程式为。下列对该溶液的叙述,不正确的是
A.该温度下的Kw=1×10-12
B.由水电离出来的H+的浓度为1×10-9 mol/L
C.取该溶液加水稀释10倍,溶液中c(OH-)减小
D.该温度高于25℃
2.设为阿伏加德罗常数的值。下列说法正确的是
A.常温下,的醋酸钠溶液中,水电离出的数目为
B.的溶液中数目为
C.通入水中,含氯微粒的数目之和为
D.30.8 g乙酸乙酯在碱性条件下完全水解,生成乙酸的分子数为
3.25℃时,0.01mol/L的NaOH溶液的pH为
A.0.1 B.1 C.12 D.13
4.下列溶液一定呈碱性的是
A.由水电离出的为的溶液
B.的溶液
C.使石蕊试液呈紫色的溶液
D.常温下,的氨水与的盐酸等体积混合后的溶液
5.常温下,关于溶液的稀释下列说法正确的是
A.pH=6的盐酸酸溶液稀释100倍,pH=8
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
6.规范的操作是实验成功的保证。下列实验操作正确的是
A. CO2验满 B.收集O2 C.滴加液体 D.测溶液的pH
A.A B.B C.C D.D
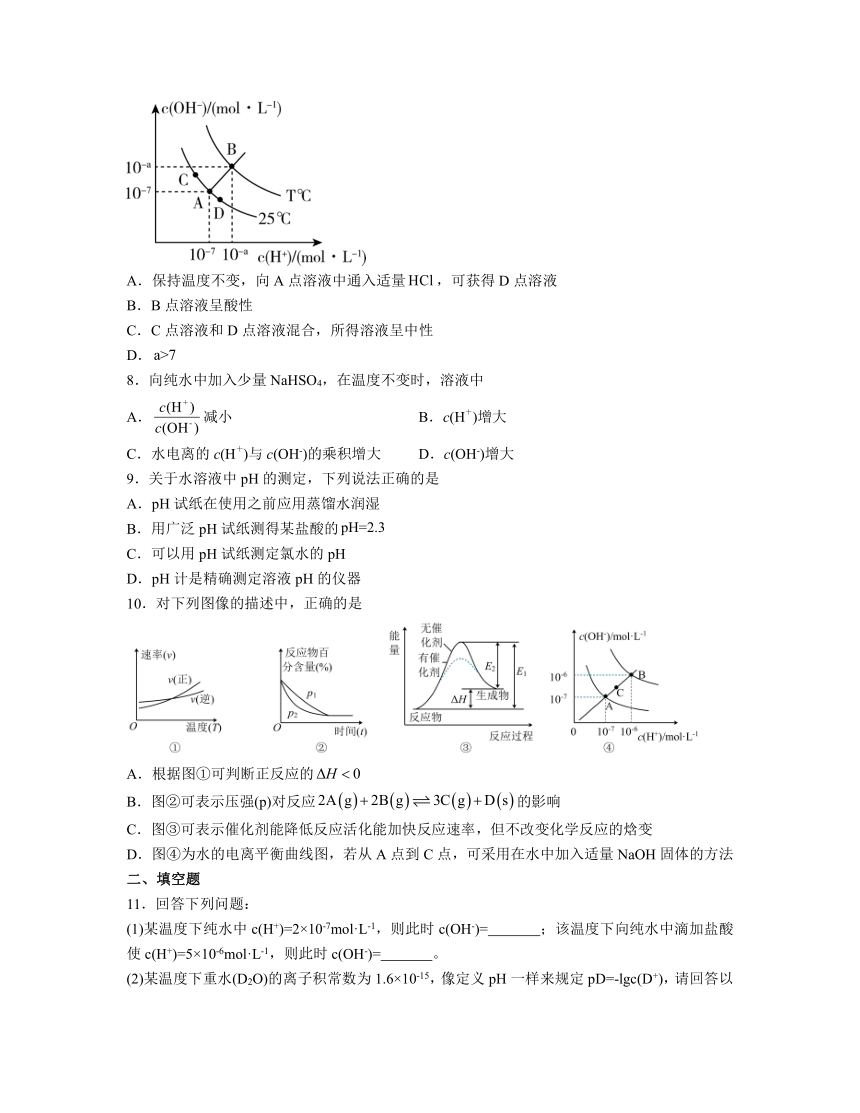
7.水的电离平衡曲线如下图所示,已知,下列说法正确的是
A.保持温度不变,向A点溶液中通入适量,可获得D点溶液
B.B点溶液呈酸性
C.C点溶液和D点溶液混合,所得溶液呈中性
D.
8.向纯水中加入少量NaHSO4,在温度不变时,溶液中
A.减小 B.c(H+)增大
C.水电离的c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
9.关于水溶液中pH的测定,下列说法正确的是
A.pH试纸在使用之前应用蒸馏水润湿
B.用广泛pH试纸测得某盐酸的
C.可以用pH试纸测定氯水的pH
D.pH计是精确测定溶液pH的仪器
10.对下列图像的描述中,正确的是
A.根据图①可判断正反应的
B.图②可表示压强(p)对反应的影响
C.图③可表示催化剂能降低反应活化能加快反应速率,但不改变化学反应的焓变
D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
二、填空题
11.回答下列问题:
(1)某温度下纯水中c(H+)=2×10-7mol·L-1,则此时c(OH-)= ;该温度下向纯水中滴加盐酸使c(H+)=5×10-6mol·L-1,则此时c(OH-)= 。
(2)某温度下重水(D2O)的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
①写出重水的电离方程式: 。
②该温度下,重水中的c(D+)= ,pD= 。(已知lg2=0.3)
③0.01mol·L-1的NaOD溶液中pD= 。
12.水的电离平衡曲线如图所示,回答下列问题。
(1)图中A、B、C、D、E五点间的关系: 。
(2)在水中加少量酸,可实现A点向 点移动。
(3)形成的区域中的点都呈现 性。
(4)若在B点温度下,的硫酸溶液中, 。
13.I.现有①硫酸铜晶体、②稀硫酸、③醋酸、④硫化氢、⑤三氧化硫、⑥石墨、⑦固态苛性钠、⑧氨水。
(1)属于弱电解质的是 。(填序号,下同)。
(2)能导电的是 。
II.如表是不同温度下水的离子积数据:
温度/℃ 25 t1 t2
水的离子积Kw 1×10-14 a 1×10-12
试回答以下问题:
(3)若25<t1<t2,则a 1×10-14(填“>”“<”或“=”),作此判断的理由是 。
(4)25℃时,某Na2SO4溶液中c(SO)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(5)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水= 。
(6)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= 。
14.(1)25℃时,0.05 mol/L H2SO4溶液的c(H+)= ,pH= ,0.01 mol/L NaOH溶液的c(H+)= ,pH= ;
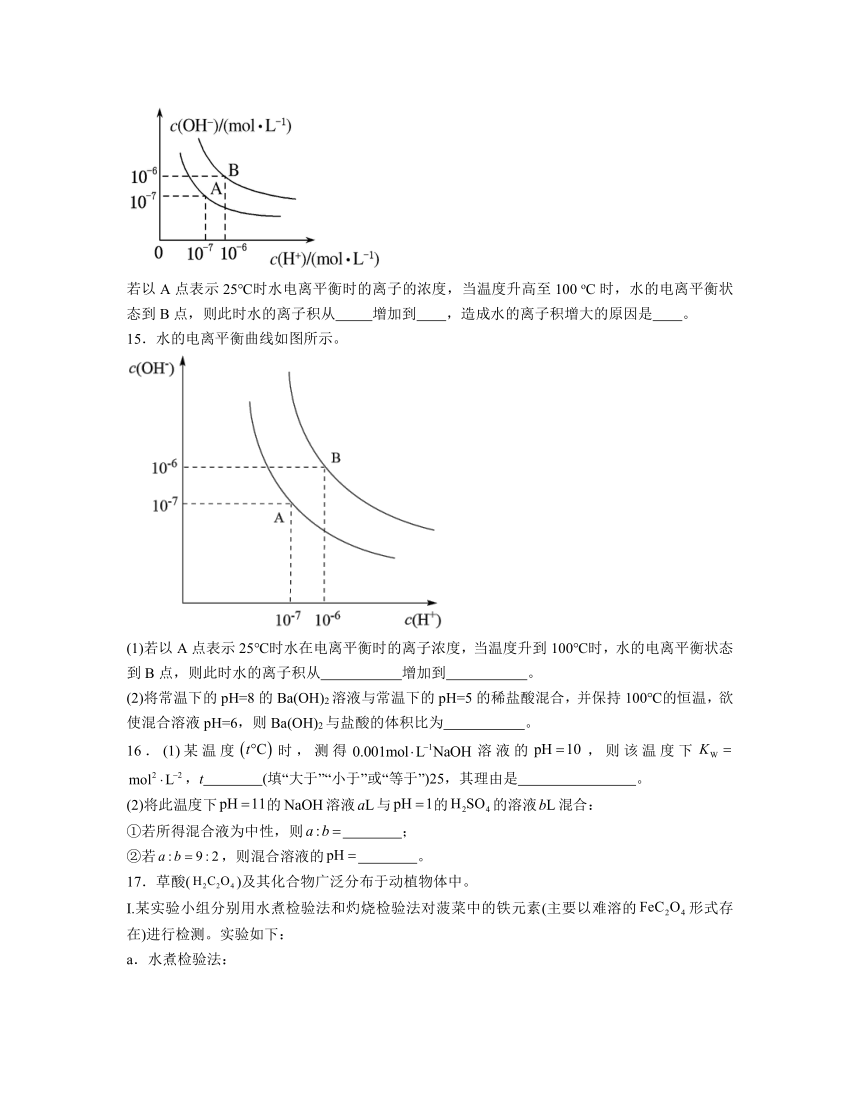
(2)水的电离平衡曲线如图所示。
若以A点表示25℃时水电离平衡时的离子的浓度,当温度升高至100 oC时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。
15.水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=6,则Ba(OH)2与盐酸的体积比为 。
16.(1)某温度时,测得溶液的,则该温度下 ,t (填“大于”“小于”或“等于”)25,其理由是 。
(2)将此温度下的溶液与的的溶液混合:
①若所得混合液为中性,则 ;
②若,则混合溶液的 。
17.草酸()及其化合物广泛分布于动植物体中。
Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的形式存在)进行检测。实验如下:
a.水煮检验法:
b.灼烧检验法:
(1)灼烧菠菜时应将其放在 (填仪器名称)中加热。
(2)溶液A中未能检测出的可能原因是 ;
(3)取溶液B,先滴加溶液、再滴加溶液。溶液呈红色;用离子方程式表示的作用: 。
(4)甲同学取少量溶液B,滴加酸性溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有。乙同学认为甲同学的实验方法不严谨,理由是 。
Ⅱ.利用草酸制备草酸亚铁晶体()的流程及组分测定方法如下:
已知:几种物质的溶解度()如下:
20℃ 48 75 37
60℃ 101 88 38
(5)趁热过滤的原因是: 。
(6)氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M),称取ag草酸亚铁晶体置于锥形瓶中,用稀硫酸将其溶解,再用的高锰酸钾标准液滴定,滴定时,眼睛应注视 。到达滴定终点时,消耗高锰酸钾,则 。(已知:)
【参考答案】
一、选择题
1.C
解析:A.该温度下蒸馏水中c(OH-)=10-6 mol/L,则此时水的离子积Kw=1×10-12,A正确;
B.Kw=c(H+)·c(OH-),公式中c(OH-)的只能来自水,盐不可能提供OH-,溶液中c(H+)=0.001 mol/L,Kw=1×10-12,代入公式计算出c(OH-)水=1×10-9 mol/L,则水电离出来的H+的浓度为c(H+)水= c(OH-)水=1×10-9 mol/L,B正确;
C.该溶液c(H+)=0.001 mol/L,溶液显酸性,稀释该溶液时,c(H+)减小,由于Kw不变,则溶液中OH-的浓度c(OH-)增大,C错误;
D.Kw仅适用酸、碱、盐的稀溶液,且水的离子积常数Kw随温度升高而增大,由于该温度下的水的离子积Kw=1×10-12>1×10-14,所以该温度高于25℃,D正确;
故合理选项是C。
2.A
解析:A.醋酸钠是强碱弱酸盐,醋酸根离子在溶液中水解促进水的电离,的醋酸钠溶液中,,由电离的数目为,A正确;
B.没有给出溶液的体积,无法计算,B错误;
C.氯水中的含氯微粒有、、、,根据守恒可知,含氯微粒数目之和小于,C错误;
D.乙酸乙酯在碱性条件下发生水解反应生成的是乙酸钠,而不是乙酸,D错误;
故选A。
3.C
解析:25℃时,Kw=10-14,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,所以c(H+)=mol/L,则pH=-lgc(H+)=-lg10-12=12,答案选C。
4.D
解析:A. 溶液中水的电离被抑制,该溶液可能为酸溶液,故A错误;
B. 未指明温度,如100℃时的溶液呈中性,故B错误;
C. 石蕊试液呈紫色时,pH为5~8,此时溶液可能呈酸性、中性或碱性,故C错误;
D. ,等体积混合后氨水过量,溶液呈碱性,故D正确;
故选D。
5.C
解析:A.pH=6冲稀后,溶液不可能呈碱性,A错误;
B.pH=4的H2SO4溶液稀释100倍时,溶液中的c(H+)=10-6 mol·L-1,溶液中的c(OH-)==mol·L-1,水电离的c(OH-)=10-8 mol·L-1,而水电离的c(H+)=水电离的c(OH-)=mol/L,故B错误;
C.将1 L 0.1 mol·L-1的溶液稀释到2 L时,c(OH-)= mol·L-1=mol/L,c(H+)=10-13 mol·L-1,pH=13,故C正确;
D.NaOH是碱溶液,无论怎么稀释,pH在常温下都不可能为6,只能无限接近于7,故D错误;
故选C。
6.B
解析:A.二氧化碳验满,燃着的木条应放在瓶口,A错误;
B.氧气从短口进入将水排出,从而收集氧气,B正确;
C.滴加液体时,胶头滴管不应该伸入到仪器内部,C错误;
D.测溶液的pH时,pH试纸不能深入到液体中,以免污染试剂,D错误;
故选B。
7.A
解析:A.保持温度不变,水的离子积不变,向A点溶液中通入适量,则溶液中的H+浓度增大,c(OH-)减小,但c(H+)c(OH-)不变,即还在曲线CAD上,即可获得D点溶液,A正确;
B.由题干图示信息可知,B点溶液中c(H+)=c(OH-),故溶液呈中性,B错误;
C.由于未告知混合时C点溶液和D点溶液的体积,则无法判断C点溶液和D点溶液混合所得溶液的酸碱性,C错误;
D.已知水的电离是一个吸热过程,升高温度促进水的电离,且,故,D错误;
故答案为:A。
8.B
解析:A.纯水中加入NaHSO4,溶液中氢离子浓度增大,氢氧根离子浓度减小,氢离子与氢氧根离子的浓度比值增大,故A错误;
B.加入NaHSO4后,溶液由中性变成酸性,溶液中的氢离子浓度增大,故B正确;
C.加入NaHSO4后,溶液中的氢离子浓度增大,抑制水的电离,导致水电离的c(H+)与c(OH-)的乘积减小,故C错误;
D.加入NaHSO4后,溶液中的氢离子浓度增大,在温度不变时,溶液中的c(H+)与c(OH-)的乘积是常数,所以c(OH-)减小,故D错误;
故选B。
9.D
解析:A.pH试纸使用之前不能润洗,否则可能会导致所测溶液的pH值有偏差,A错误;
B.广泛pH试纸只能测出整数值,B错误;
C.氯水具有强氧化性, pH试纸会被其漂白,不能利用pH试纸测定,C错误;
D.pH计是测定溶液pH的精密仪器,D正确;
故选D。
10.C
解析:A.根据图①可知,升高温度,平衡正向移动,可判断正反应的,故A错误;
B.根据图②,增大压强,反应物百分含量不变,可知反应前后气体系数和不变,所以图②不能表示压强(p)对反应的影响,故B错误;
C.催化剂能降低反应活化能,图③可表示催化剂能降低反应活化能加快反应速率,但不改变化学反应的焓变,故C正确;
D.图④为水的电离平衡曲线图,从A点到C点,Kw增大,可采用加热的方法,故D错误;
选C。
二、填空题
11.(1) 2×10-7mol·L-1 8×10-9mol·L-1
(2)D2OD++OD- 4×10-8mol/L 7.4 12.8
解析:(1)纯水中c(H+)=c(OH-),某温度下纯水中c(H+)=2×10-7mol·L-1,则此时c(OH-)=2×10-7mol·L-1,该温度下水的离子积为:Kw=c(H+)c(OH-)=2×10-7mol·L-1×2×10-7mol·L-1=4×10-14,则
向纯水中滴加盐酸使c(H+)=5×10-6mol·L-1,则此时c(OH-)==8×10-9mol/L,故答案为:2×10-7mol·L-1;8×10-9mol·L-1;
(2)①根据水的电离方程式可知重水的电离方程式为:D2OD++OD-,故答案为:D2OD++OD-;
②该温度下,重水中的c(D+)=c(OD-)==4×10-8mol/L,pD=-lgc(D+)=-lg(4×10-8)=8-2lg2=8-2×0.3=7.4,故答案为:4×10-8mol/L;7.4;
③0.01mol·L-1的NaOD溶液中c(OD-)=0.01mol/L,则c(D+)===1.6×10-13,pD=-lgc(D+)=-lg(1.6×10-13)=12.8,故答案为:12.8。
12.(1)
(2)D
(3)碱
(4)
解析:(1)水的电离常数受温度影响,温度越高电离程度越大,故A、B、C、D、E五点间的关系:;
(2)在水中加少量酸,电离常数不变,溶液中氢离子浓度变大、氢氧根离子浓度减小,可实现A点向D点移动。
(3)形成的区域中的点都是氢氧根离子浓度大于氢离子浓度,呈现碱性。
(4)若在B点温度下,水的电离常数为10-12,,的硫酸溶液中,。
13.(1)③④
(2)②⑥⑧
(3)> 水的电离为吸热反应,升高温度水的电离程度增大,离子积变大
(4)1000:1
(5)1×10-10
(6)9:11
解析:(1)①硫酸铜是盐,其晶体中没有自由移动的离子,是强电解质,不能导电;
②稀硫酸,有自由移动的离子,可以导电,是混合物,不是电解质,也不是非电解质;
③醋酸,是弱酸,属于弱电解质,没有自由移动的离子,不能导电;
④硫化氢,是弱酸,属于弱电解质,没有自由移动的离子,不能导电;
⑤三氧化硫,溶于水生成的硫酸是电解质,但其本身不能电离,不是电解质,不能导电;
⑥石墨可以导电,但是属于单质,既不是电解质,也不是非电解质;
⑦固态苛性钠是氢氧化钠,是强碱,属于强电解质,但没有自由移动的离子,不能导电;
⑧氨水,其中有自由移动的离子,可以导电,但属于混合物,既不是电解质,也不是非电解质;
故属于弱电解质的是:③④;
(2)由第一问的分析可知,能导电的是②⑥⑧;
(3)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大;因此,本题正确答案是:>;水的电离为吸热反应,升高温度水的电离程度增大,离子积变大;
(4)根据硫酸钠的化学式,则溶液中一定满足c(Na+):c(SO)=2:1,硫酸钠溶液中c(Na+)=2×5×10-4mol/L=10-3mol/L,稀释后c(Na+)==10-4mol/L,溶液呈中性,c(OH-)=10-7mol/L,则稀释后溶液中c(Na+) :c(OH-)= 10-4:10-7=1000︰1;综上所述,本题答案是:1000︰1;
(5)pH=10的NaOH溶液中c(H+)=10 10mol L 1,NaOH溶液中H+来自于水的电离,水电离出H+的同时也电离出等量的OH ,所以水电离产生的OH 的浓度为c(OH-)=1×10-10mol/L;
(6))t2℃时,所得混合溶液的pH=2,说明溶液为酸性,酸过量,t2℃时,pH=11的NaOH溶液,c(OH )=0.1mol·L 1,则,解得V1∶V2=9∶11。
14.1mol/L 1 1×10-12mol/L 12 1×10-14 1×10-12 温度升高,水的电离程度增大,Kw增大
解析:(1)0.05 mol/L H2SO4溶液的c(H+)=2c(H2SO4)=2×0.05 mol/L=0.1 mol/L,pH=-lgc(H+)=-lg0.1=1,0.01 mol/L NaOH溶液的c(OH-)=c(NaOH)=0.01 mol/L,c(H+)==,pH=12,故答案为:0.1 mol/L;1;1×10-12mol/L;12;
(2)A点对应的水的离子积常数,B点对应的水的离子积常数,水的电离是吸热过程,温度升高水的电离平衡正向移动,电离程度增大,Kw增大,故答案为:1×10-14;1×10-12;温度升高,水的电离程度增大,Kw增大。
15.(1) 10-14 10-12
(2)10:1
解析:(1)
25℃时纯水中c(H+)=c(OH-)=10-7mol/L,Kw=c(H+)。c(OH-)=10-14,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,则Kw=c(H+)。c(OH-)=10-12,从A点到B点,水的离子积从10-14增加到10-12;故答案为10-14;10-12;
(2)
100℃时,pH=8的Ba(OH)2溶液中:c(OH-)=10-6mol/L,pH=5的稀盐酸中:c(H+)=10-5mol/L,设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,混合溶液pH=6,溶液呈中性,则溶液中氢氧根离子的物质的量等于氢离子的物质的量:即10-6x= 10-5y解得x:y=10:1;故答案为10:1。
16. 大于 常温下,水的电离是吸热的,升高温度时水的电离平衡正向移动,增大,则温度高于 2
【分析】氢氧化钠的电离抑制了水的电离,测得溶液的,则水电离出的氢离子和氢氧根离子的浓度为10-10mol/L,常温下,水的离子积常数为。
解析:(1)时,测得溶液的,则该温度下,电离吸热,升高温度促进水的电离,所以高于。
(2)将此温度下的溶液与的的溶液混合:
①若所得混合液为中性,则,解得;
②若,则硫酸过量,因此混合溶液中,因此混合溶液的。
17.坩埚 在加热水煮过程中二价铁被氧化为三价铁(或在水中的溶解度小,合理答案即可) 酸性条件下,能将还原(或能将还原,合理答案即可) 由溶解度表数据可知,趁热过滤的原因是防止低温时和析出,影响的纯度。 锥形瓶溶液颜色的变化
解析:(1)灼烧用的仪器是坩埚;
(2)Fe2+具有较强的还原性,在水煮加热过程中很容易被氧气氧化为Fe3+;
(3)溶液B能生成蓝色沉淀,说明其中有Fe2+,具有较强的还原性,加入的H2O2具有氧化性,二者发生氧化还原反应:;
(4)溶液B是菠菜灰中加入过量稀盐酸得来,其中含有氯离子,具有还原性,酸性高锰酸钾溶液具有强氧化性,二者也可以发生氧化还原反应,使酸性高锰酸钾溶液褪色;
(5) 该步骤的目的是制备,由溶解度表数据可知,和的溶解度在60℃时较高,在20℃时较低,低温下容易析出,而的溶解度受温度影响较小,所以趁热过滤的原因是防止低温时和析出,影响的纯度;
(6)滴定时应时刻关注滴定终点,所以眼睛应当注视锥形瓶溶液颜色的变化;根据比例关系:10FeC2O4-6KMnO4,,。
一、选择题
1.某温度下,向c(OH-)=10-6 mol/L的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=0.001 mol/L。已知:NaHSO4在水中的电离方程式为。下列对该溶液的叙述,不正确的是
A.该温度下的Kw=1×10-12
B.由水电离出来的H+的浓度为1×10-9 mol/L
C.取该溶液加水稀释10倍,溶液中c(OH-)减小
D.该温度高于25℃
2.设为阿伏加德罗常数的值。下列说法正确的是
A.常温下,的醋酸钠溶液中,水电离出的数目为
B.的溶液中数目为
C.通入水中,含氯微粒的数目之和为
D.30.8 g乙酸乙酯在碱性条件下完全水解,生成乙酸的分子数为
3.25℃时,0.01mol/L的NaOH溶液的pH为
A.0.1 B.1 C.12 D.13
4.下列溶液一定呈碱性的是
A.由水电离出的为的溶液
B.的溶液
C.使石蕊试液呈紫色的溶液
D.常温下,的氨水与的盐酸等体积混合后的溶液
5.常温下,关于溶液的稀释下列说法正确的是
A.pH=6的盐酸酸溶液稀释100倍,pH=8
B.pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C.将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D.pH=8的NaOH溶液稀释100倍,其pH=6
6.规范的操作是实验成功的保证。下列实验操作正确的是
A. CO2验满 B.收集O2 C.滴加液体 D.测溶液的pH
A.A B.B C.C D.D
7.水的电离平衡曲线如下图所示,已知,下列说法正确的是
A.保持温度不变,向A点溶液中通入适量,可获得D点溶液
B.B点溶液呈酸性
C.C点溶液和D点溶液混合,所得溶液呈中性
D.
8.向纯水中加入少量NaHSO4,在温度不变时,溶液中
A.减小 B.c(H+)增大
C.水电离的c(H+)与c(OH-)的乘积增大 D.c(OH-)增大
9.关于水溶液中pH的测定,下列说法正确的是
A.pH试纸在使用之前应用蒸馏水润湿
B.用广泛pH试纸测得某盐酸的
C.可以用pH试纸测定氯水的pH
D.pH计是精确测定溶液pH的仪器
10.对下列图像的描述中,正确的是
A.根据图①可判断正反应的
B.图②可表示压强(p)对反应的影响
C.图③可表示催化剂能降低反应活化能加快反应速率,但不改变化学反应的焓变
D.图④为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法
二、填空题
11.回答下列问题:
(1)某温度下纯水中c(H+)=2×10-7mol·L-1,则此时c(OH-)= ;该温度下向纯水中滴加盐酸使c(H+)=5×10-6mol·L-1,则此时c(OH-)= 。
(2)某温度下重水(D2O)的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
①写出重水的电离方程式: 。
②该温度下,重水中的c(D+)= ,pD= 。(已知lg2=0.3)
③0.01mol·L-1的NaOD溶液中pD= 。
12.水的电离平衡曲线如图所示,回答下列问题。
(1)图中A、B、C、D、E五点间的关系: 。
(2)在水中加少量酸,可实现A点向 点移动。
(3)形成的区域中的点都呈现 性。
(4)若在B点温度下,的硫酸溶液中, 。
13.I.现有①硫酸铜晶体、②稀硫酸、③醋酸、④硫化氢、⑤三氧化硫、⑥石墨、⑦固态苛性钠、⑧氨水。
(1)属于弱电解质的是 。(填序号,下同)。
(2)能导电的是 。
II.如表是不同温度下水的离子积数据:
温度/℃ 25 t1 t2
水的离子积Kw 1×10-14 a 1×10-12
试回答以下问题:
(3)若25<t1<t2,则a 1×10-14(填“>”“<”或“=”),作此判断的理由是 。
(4)25℃时,某Na2SO4溶液中c(SO)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(5)在t2℃下pH=10的NaOH溶液中,水电离产生的OH-浓度c(OH-)水= 。
(6)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2= 。
14.(1)25℃时,0.05 mol/L H2SO4溶液的c(H+)= ,pH= ,0.01 mol/L NaOH溶液的c(H+)= ,pH= ;
(2)水的电离平衡曲线如图所示。
若以A点表示25℃时水电离平衡时的离子的浓度,当温度升高至100 oC时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 。
15.水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 。
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=6,则Ba(OH)2与盐酸的体积比为 。
16.(1)某温度时,测得溶液的,则该温度下 ,t (填“大于”“小于”或“等于”)25,其理由是 。
(2)将此温度下的溶液与的的溶液混合:
①若所得混合液为中性,则 ;
②若,则混合溶液的 。
17.草酸()及其化合物广泛分布于动植物体中。
Ⅰ.某实验小组分别用水煮检验法和灼烧检验法对菠菜中的铁元素(主要以难溶的形式存在)进行检测。实验如下:
a.水煮检验法:
b.灼烧检验法:
(1)灼烧菠菜时应将其放在 (填仪器名称)中加热。
(2)溶液A中未能检测出的可能原因是 ;
(3)取溶液B,先滴加溶液、再滴加溶液。溶液呈红色;用离子方程式表示的作用: 。
(4)甲同学取少量溶液B,滴加酸性溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有。乙同学认为甲同学的实验方法不严谨,理由是 。
Ⅱ.利用草酸制备草酸亚铁晶体()的流程及组分测定方法如下:
已知:几种物质的溶解度()如下:
20℃ 48 75 37
60℃ 101 88 38
(5)趁热过滤的原因是: 。
(6)氧化还原滴定法常用于测定草酸亚铁晶体的摩尔质量(M),称取ag草酸亚铁晶体置于锥形瓶中,用稀硫酸将其溶解,再用的高锰酸钾标准液滴定,滴定时,眼睛应注视 。到达滴定终点时,消耗高锰酸钾,则 。(已知:)
【参考答案】
一、选择题
1.C
解析:A.该温度下蒸馏水中c(OH-)=10-6 mol/L,则此时水的离子积Kw=1×10-12,A正确;
B.Kw=c(H+)·c(OH-),公式中c(OH-)的只能来自水,盐不可能提供OH-,溶液中c(H+)=0.001 mol/L,Kw=1×10-12,代入公式计算出c(OH-)水=1×10-9 mol/L,则水电离出来的H+的浓度为c(H+)水= c(OH-)水=1×10-9 mol/L,B正确;
C.该溶液c(H+)=0.001 mol/L,溶液显酸性,稀释该溶液时,c(H+)减小,由于Kw不变,则溶液中OH-的浓度c(OH-)增大,C错误;
D.Kw仅适用酸、碱、盐的稀溶液,且水的离子积常数Kw随温度升高而增大,由于该温度下的水的离子积Kw=1×10-12>1×10-14,所以该温度高于25℃,D正确;
故合理选项是C。
2.A
解析:A.醋酸钠是强碱弱酸盐,醋酸根离子在溶液中水解促进水的电离,的醋酸钠溶液中,,由电离的数目为,A正确;
B.没有给出溶液的体积,无法计算,B错误;
C.氯水中的含氯微粒有、、、,根据守恒可知,含氯微粒数目之和小于,C错误;
D.乙酸乙酯在碱性条件下发生水解反应生成的是乙酸钠,而不是乙酸,D错误;
故选A。
3.C
解析:25℃时,Kw=10-14,0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,所以c(H+)=mol/L,则pH=-lgc(H+)=-lg10-12=12,答案选C。
4.D
解析:A. 溶液中水的电离被抑制,该溶液可能为酸溶液,故A错误;
B. 未指明温度,如100℃时的溶液呈中性,故B错误;
C. 石蕊试液呈紫色时,pH为5~8,此时溶液可能呈酸性、中性或碱性,故C错误;
D. ,等体积混合后氨水过量,溶液呈碱性,故D正确;
故选D。
5.C
解析:A.pH=6冲稀后,溶液不可能呈碱性,A错误;
B.pH=4的H2SO4溶液稀释100倍时,溶液中的c(H+)=10-6 mol·L-1,溶液中的c(OH-)==mol·L-1,水电离的c(OH-)=10-8 mol·L-1,而水电离的c(H+)=水电离的c(OH-)=mol/L,故B错误;
C.将1 L 0.1 mol·L-1的溶液稀释到2 L时,c(OH-)= mol·L-1=mol/L,c(H+)=10-13 mol·L-1,pH=13,故C正确;
D.NaOH是碱溶液,无论怎么稀释,pH在常温下都不可能为6,只能无限接近于7,故D错误;
故选C。
6.B
解析:A.二氧化碳验满,燃着的木条应放在瓶口,A错误;
B.氧气从短口进入将水排出,从而收集氧气,B正确;
C.滴加液体时,胶头滴管不应该伸入到仪器内部,C错误;
D.测溶液的pH时,pH试纸不能深入到液体中,以免污染试剂,D错误;
故选B。
7.A
解析:A.保持温度不变,水的离子积不变,向A点溶液中通入适量,则溶液中的H+浓度增大,c(OH-)减小,但c(H+)c(OH-)不变,即还在曲线CAD上,即可获得D点溶液,A正确;
B.由题干图示信息可知,B点溶液中c(H+)=c(OH-),故溶液呈中性,B错误;
C.由于未告知混合时C点溶液和D点溶液的体积,则无法判断C点溶液和D点溶液混合所得溶液的酸碱性,C错误;
D.已知水的电离是一个吸热过程,升高温度促进水的电离,且,故,D错误;
故答案为:A。
8.B
解析:A.纯水中加入NaHSO4,溶液中氢离子浓度增大,氢氧根离子浓度减小,氢离子与氢氧根离子的浓度比值增大,故A错误;
B.加入NaHSO4后,溶液由中性变成酸性,溶液中的氢离子浓度增大,故B正确;
C.加入NaHSO4后,溶液中的氢离子浓度增大,抑制水的电离,导致水电离的c(H+)与c(OH-)的乘积减小,故C错误;
D.加入NaHSO4后,溶液中的氢离子浓度增大,在温度不变时,溶液中的c(H+)与c(OH-)的乘积是常数,所以c(OH-)减小,故D错误;
故选B。
9.D
解析:A.pH试纸使用之前不能润洗,否则可能会导致所测溶液的pH值有偏差,A错误;
B.广泛pH试纸只能测出整数值,B错误;
C.氯水具有强氧化性, pH试纸会被其漂白,不能利用pH试纸测定,C错误;
D.pH计是测定溶液pH的精密仪器,D正确;
故选D。
10.C
解析:A.根据图①可知,升高温度,平衡正向移动,可判断正反应的,故A错误;
B.根据图②,增大压强,反应物百分含量不变,可知反应前后气体系数和不变,所以图②不能表示压强(p)对反应的影响,故B错误;
C.催化剂能降低反应活化能,图③可表示催化剂能降低反应活化能加快反应速率,但不改变化学反应的焓变,故C正确;
D.图④为水的电离平衡曲线图,从A点到C点,Kw增大,可采用加热的方法,故D错误;
选C。
二、填空题
11.(1) 2×10-7mol·L-1 8×10-9mol·L-1
(2)D2OD++OD- 4×10-8mol/L 7.4 12.8
解析:(1)纯水中c(H+)=c(OH-),某温度下纯水中c(H+)=2×10-7mol·L-1,则此时c(OH-)=2×10-7mol·L-1,该温度下水的离子积为:Kw=c(H+)c(OH-)=2×10-7mol·L-1×2×10-7mol·L-1=4×10-14,则
向纯水中滴加盐酸使c(H+)=5×10-6mol·L-1,则此时c(OH-)==8×10-9mol/L,故答案为:2×10-7mol·L-1;8×10-9mol·L-1;
(2)①根据水的电离方程式可知重水的电离方程式为:D2OD++OD-,故答案为:D2OD++OD-;
②该温度下,重水中的c(D+)=c(OD-)==4×10-8mol/L,pD=-lgc(D+)=-lg(4×10-8)=8-2lg2=8-2×0.3=7.4,故答案为:4×10-8mol/L;7.4;
③0.01mol·L-1的NaOD溶液中c(OD-)=0.01mol/L,则c(D+)===1.6×10-13,pD=-lgc(D+)=-lg(1.6×10-13)=12.8,故答案为:12.8。
12.(1)
(2)D
(3)碱
(4)
解析:(1)水的电离常数受温度影响,温度越高电离程度越大,故A、B、C、D、E五点间的关系:;
(2)在水中加少量酸,电离常数不变,溶液中氢离子浓度变大、氢氧根离子浓度减小,可实现A点向D点移动。
(3)形成的区域中的点都是氢氧根离子浓度大于氢离子浓度,呈现碱性。
(4)若在B点温度下,水的电离常数为10-12,,的硫酸溶液中,。
13.(1)③④
(2)②⑥⑧
(3)> 水的电离为吸热反应,升高温度水的电离程度增大,离子积变大
(4)1000:1
(5)1×10-10
(6)9:11
解析:(1)①硫酸铜是盐,其晶体中没有自由移动的离子,是强电解质,不能导电;
②稀硫酸,有自由移动的离子,可以导电,是混合物,不是电解质,也不是非电解质;
③醋酸,是弱酸,属于弱电解质,没有自由移动的离子,不能导电;
④硫化氢,是弱酸,属于弱电解质,没有自由移动的离子,不能导电;
⑤三氧化硫,溶于水生成的硫酸是电解质,但其本身不能电离,不是电解质,不能导电;
⑥石墨可以导电,但是属于单质,既不是电解质,也不是非电解质;
⑦固态苛性钠是氢氧化钠,是强碱,属于强电解质,但没有自由移动的离子,不能导电;
⑧氨水,其中有自由移动的离子,可以导电,但属于混合物,既不是电解质,也不是非电解质;
故属于弱电解质的是:③④;
(2)由第一问的分析可知,能导电的是②⑥⑧;
(3)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大;因此,本题正确答案是:>;水的电离为吸热反应,升高温度水的电离程度增大,离子积变大;
(4)根据硫酸钠的化学式,则溶液中一定满足c(Na+):c(SO)=2:1,硫酸钠溶液中c(Na+)=2×5×10-4mol/L=10-3mol/L,稀释后c(Na+)==10-4mol/L,溶液呈中性,c(OH-)=10-7mol/L,则稀释后溶液中c(Na+) :c(OH-)= 10-4:10-7=1000︰1;综上所述,本题答案是:1000︰1;
(5)pH=10的NaOH溶液中c(H+)=10 10mol L 1,NaOH溶液中H+来自于水的电离,水电离出H+的同时也电离出等量的OH ,所以水电离产生的OH 的浓度为c(OH-)=1×10-10mol/L;
(6))t2℃时,所得混合溶液的pH=2,说明溶液为酸性,酸过量,t2℃时,pH=11的NaOH溶液,c(OH )=0.1mol·L 1,则,解得V1∶V2=9∶11。
14.1mol/L 1 1×10-12mol/L 12 1×10-14 1×10-12 温度升高,水的电离程度增大,Kw增大
解析:(1)0.05 mol/L H2SO4溶液的c(H+)=2c(H2SO4)=2×0.05 mol/L=0.1 mol/L,pH=-lgc(H+)=-lg0.1=1,0.01 mol/L NaOH溶液的c(OH-)=c(NaOH)=0.01 mol/L,c(H+)==,pH=12,故答案为:0.1 mol/L;1;1×10-12mol/L;12;
(2)A点对应的水的离子积常数,B点对应的水的离子积常数,水的电离是吸热过程,温度升高水的电离平衡正向移动,电离程度增大,Kw增大,故答案为:1×10-14;1×10-12;温度升高,水的电离程度增大,Kw增大。
15.(1) 10-14 10-12
(2)10:1
解析:(1)
25℃时纯水中c(H+)=c(OH-)=10-7mol/L,Kw=c(H+)。c(OH-)=10-14,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,则Kw=c(H+)。c(OH-)=10-12,从A点到B点,水的离子积从10-14增加到10-12;故答案为10-14;10-12;
(2)
100℃时,pH=8的Ba(OH)2溶液中:c(OH-)=10-6mol/L,pH=5的稀盐酸中:c(H+)=10-5mol/L,设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,混合溶液pH=6,溶液呈中性,则溶液中氢氧根离子的物质的量等于氢离子的物质的量:即10-6x= 10-5y解得x:y=10:1;故答案为10:1。
16. 大于 常温下,水的电离是吸热的,升高温度时水的电离平衡正向移动,增大,则温度高于 2
【分析】氢氧化钠的电离抑制了水的电离,测得溶液的,则水电离出的氢离子和氢氧根离子的浓度为10-10mol/L,常温下,水的离子积常数为。
解析:(1)时,测得溶液的,则该温度下,电离吸热,升高温度促进水的电离,所以高于。
(2)将此温度下的溶液与的的溶液混合:
①若所得混合液为中性,则,解得;
②若,则硫酸过量,因此混合溶液中,因此混合溶液的。
17.坩埚 在加热水煮过程中二价铁被氧化为三价铁(或在水中的溶解度小,合理答案即可) 酸性条件下,能将还原(或能将还原,合理答案即可) 由溶解度表数据可知,趁热过滤的原因是防止低温时和析出,影响的纯度。 锥形瓶溶液颜色的变化
解析:(1)灼烧用的仪器是坩埚;
(2)Fe2+具有较强的还原性,在水煮加热过程中很容易被氧气氧化为Fe3+;
(3)溶液B能生成蓝色沉淀,说明其中有Fe2+,具有较强的还原性,加入的H2O2具有氧化性,二者发生氧化还原反应:;
(4)溶液B是菠菜灰中加入过量稀盐酸得来,其中含有氯离子,具有还原性,酸性高锰酸钾溶液具有强氧化性,二者也可以发生氧化还原反应,使酸性高锰酸钾溶液褪色;
(5) 该步骤的目的是制备,由溶解度表数据可知,和的溶解度在60℃时较高,在20℃时较低,低温下容易析出,而的溶解度受温度影响较小,所以趁热过滤的原因是防止低温时和析出,影响的纯度;
(6)滴定时应时刻关注滴定终点,所以眼睛应当注视锥形瓶溶液颜色的变化;根据比例关系:10FeC2O4-6KMnO4,,。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
